El margen positivo en cirugía conservadora del cáncer de mama es un importante factor pronóstico. El objetivo de este estudio fue evaluar cómo influye nuestro protocolo de evaluación intraoperatoria del margen del espécimen en la frecuencia de márgenes afectos (MA). Además, estudiamos la precisión de nuestro protocolo como prueba diagnóstica de MA.
MétodosSe incluyeron pacientes tratadas mediante cirugía conservadora de la mama por carcinoma invasivo en un centro de referencia de cáncer de mama entre 2004 y 2015. El análisis intraoperatorio del margen consistió en una inspección macroscópica del espécimen por parte del patólogo. Se empleó ink on tumor como definición de MA.
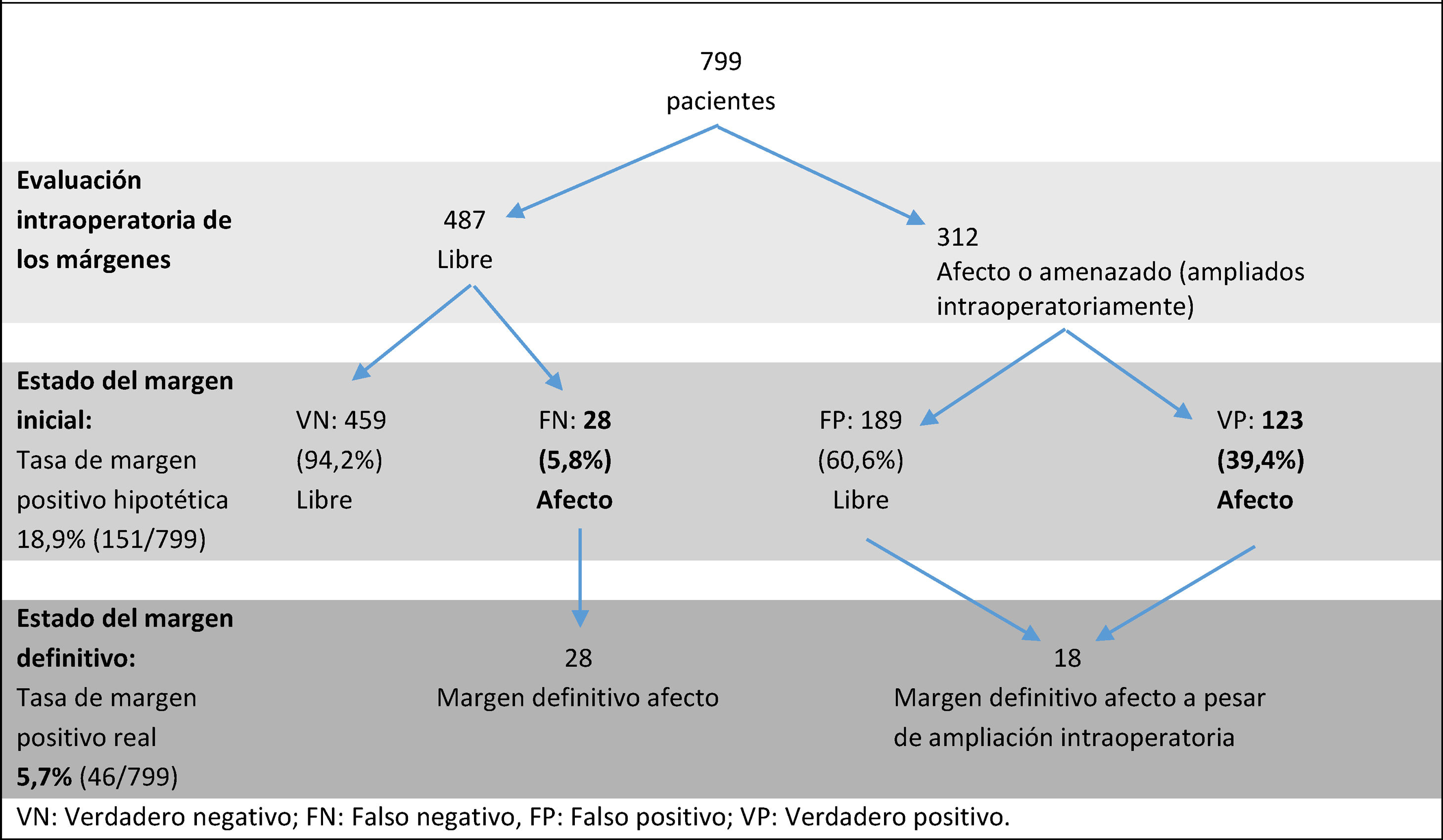
ResultadosSe incluyeron 799 pacientes. En 312 pacientes (39%) el margen se consideró afectado o amenazado, y se realizó una ampliación intraoperatoria. En la evaluación definitiva se confirmó que 123 de ellas tenían un margen afecto, y en 189 estaba libre. Por otro lado, se consideró que 487 muestras tenían el margen inicial libre y no se realizó ampliación intraoperatoria. Posteriormente se confirmó un margen final libre en 459 de estas pacientes (94,2%). Veintiocho pacientes tuvieron margen libre intraoperatoriamente, pero margen final afecto. Si no se hubiera realizado el análisis intraoperatorio del margen, la tasa de MA definitivo hubiera sido del 18,9% (151 pacientes de 799). Gracias a las ampliaciones intraoperatorias, la tasa de MA definitivo en tumores infiltrantes se redujo de 18,9 a 5,7%: hubo 46 pacientes con margen final afecto, 28 del grupo de margen intraoperatorio libre y 18 del grupo de márgenes intraoperatorios comprometidos. La sensibilidad del procedimiento fue de 0,81, mientras que la especificidad fue de 0,71. El valor predictivo positivo fue de 0,39 y el valor predictivo negativo fue de 0,94.
ConclusiónLa aplicación de nuestro protocolo de evaluación intraoperatoria del margen en tumores infiltrantes obtuvo una tasa de afectación de márgenes del 5,7%. Además, como prueba diagnóstica, presenta un elevado valor predictivo negativo, permitiendo seleccionar las pacientes que no van a necesitar ampliación de los márgenes en una segunda intervención.
A positive margin in breast-conserving surgery is an important prognostic factor. The aim of this study was to determine the influence of our protocol for the intraoperative assessment of the surgical specimen on the frequency of margin involvement (MI). We also studied the accuracy of our protocol as a diagnostic test of MI.
MethodsWe included patients treated with breast-conserving surgery for infiltrating ductal carcinoma in a breast cancer referral centre between 2004 and 2015. Intraoperative assessment consisted of macroscopic inspection of the specimen by a pathologist. MI was defined by ink on tumor.
ResultsA total of 799 patients were included. In 312 patients (39%), the margin was considered involved or in danger of involvement and intraoperative widening was performed. MI was confirmed by definitive assessment in 123 of these patients and clear margins were confirmed in 189 patients. In 487 patients, the initial margin was considered disease-free and margin enlargement was not performed. In 459 of these patients (94.2%) subsequent analysis confirmed disease-free margins. In 28 patients, intraoperative assessment suggested disease-free margins but subsequent analysis revealed MI. Without intraoperative margin assessment, the rate of definitive MI would have been 18.9% (151 patients out of 799). Due to intraoperative widening, the rate of definitive MI in infiltrating tumours was decreased from 18.9 to 5.7%. Definitive MI was found in 46 patients, 28 in the group with disease-free margins at the intraoperative assessment and 18 in the group with MI at the intraoperative assessment. The sensitivity of the procedure was 0.81 and specificity was 0.71. The positive predictive value was 0.39 and the negative predictive value was 0.94.
ConclusionThe application of our protocol for the intraoperative assessment of infiltrating tumors revealed an MI rate of 5.7%. Moreover, as a diagnostic test, the procedure showed high negative predictive value, allowing selection of patients not requiring margin enlargement in a second intervention.
La recurrencia local del cáncer de mama tras una cirugía conservadora de la mama (CCM) en tumores infiltrantes es variable, con cifras descritas que oscilan entre un 5 y un 22%1–3. Uno de los factores pronósticos más importantes es el estado del margen quirúrgico, ya que cuando este es positivo el riesgo de recurrencia local del cáncer de mama es mayor4. Las pacientes con margen afecto (MA) son sometidas a una reintervención quirúrgica para obtener un margen libre, lo que conlleva un aumento de la morbilidad, un retraso en el comienzo del tratamiento adyuvante, un incremento de la ansiedad para las pacientes y un elevado coste sanitario5,6.
La actitud para el estudio de los márgenes quirúrgicos es controvertida, y a pesar de existir un consenso claro de lo que constituye un margen quirúrgico negativo en CCM7, la tasa de afección de márgenes publicada en la literatura es muy variable1,8–10. Para reducir la tasa de MA es importante mejorar el diagnóstico de la enfermedad, la localización de la lesión y la planificación quirúrgica desde un enfoque multidisciplinar.
El objetivo de este estudio fue evaluar cómo influye nuestro protocolo de evaluación intraoperatoria del margen del espécimen en la tasa de MA. Además, estudiamos la precisión de nuestro protocolo como prueba diagnóstica de MA.
Material y métodosSe llevó a cabo un estudio retrospectivo que incluyó pacientes diagnosticadas de cáncer de mama que fueron sometidas a CCM entre 2004 y 2015 en un hospital terciario. Las pacientes que recibieron neoadyuvancia y las recidivas ipsilaterales de tumores diagnosticados antes de 2004 fueron excluidas. El estudio fue valorado de forma favorable por el Comité Ético del hospital.
El proceso de evaluación de los márgenes comenzaba tras la extracción del espécimen quirúrgico con una cuidadosa palpación del mismo por parte del cirujano. Previamente había sido marcado mediante clips para orientarlo adecuadamente. En caso de ser una lesión no palpable era remitido al servicio de radiología para comprobar la inclusión de la lesión. El espécimen se pincelaba en todos los casos con tinta china. El protocolo de evaluación intraoperatoria del margen solo se aplicaba a las lesiones infiltrantes, y consistía en una evaluación patológica macroscópica de los márgenes durante el tiempo operatorio. Si en alguno de los procedimientos postextracción se consideraba que el margen estaba próximo o afectado por el tumor, se procedía a la ampliación intraoperatoria del margen correspondiente. En casos de duda por lesiones inesperadas, se hacía un corte histológico por congelación de la zona dudosa. En las pacientes sometidas a ampliación intraoperatoria, el espécimen de la ampliación también era orientado con clips y puntos, y el margen definitivo era pincelado con tinta china, para ser evaluado de manera similar al margen quirúrgico inicial.
Se consideró que el margen estaba afecto si se localizaba enfermedad (invasiva o in situ) en contacto con el margen teñido (ink on tumor)11. Primero se recogió el estado del margen en el espécimen quirúrgico tal como salía del quirófano (margen quirúrgico inicial). En las pacientes no sometidas a ampliación intraoperatoria, este fue considerado también como el margen quirúrgico definitivo; y en las sometidas a ampliación, el margen definitivo se consideró el de la ampliación. En aquellas pacientes con margen quirúrgico definitivo afecto, se realizó una reescisión quirúrgica en un segundo tiempo.
Los datos fueron recogidos en una base de datos Microsoft® Access®, y se analizaron con el paquete estadístico SPSS® versión 25. La sensibilidad se definió como resultados verdaderos positivos/(verdaderos positivos+falsos negativos), mientras que la especificidad se definió como resultados verdaderos negativos/(verdaderos negativos+falsos positivos). El valor predictivo positivo (VPP) se definió como resultados verdaderos positivos/(verdaderos positivos+falsos positivos), mientras que el valor predictivo negativo (VPN) se definió como resultados verdaderos negativos/(verdaderos negativos+falsos negativos).
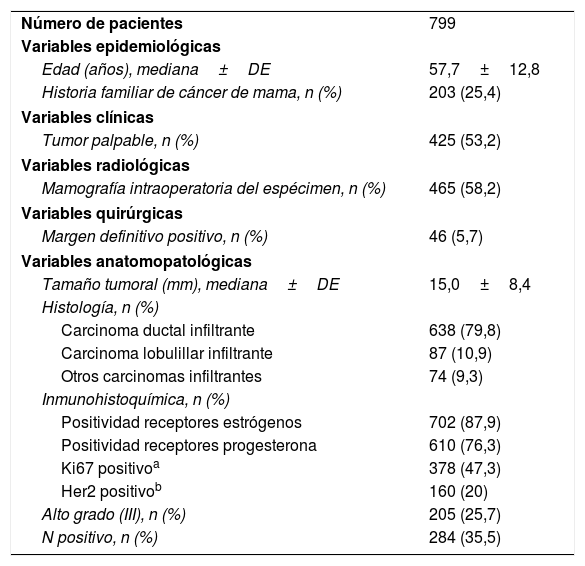
ResultadosSe incluyeron inicialmente 1.054 pacientes sometidas a CCM. Se excluyeron 154 pacientes con diagnóstico definitivo de carcinoma ductal in situ (CDIS). Como la mayoría de los CDIS no forman una masa y la inspección macroscópica por el patólogo resulta poco útil, a estas pacientes no se les realizó ningún estudio intraoperatorio del margen. Además, se excluyeron 101 pacientes por no haberse cumplido el protocolo de análisis intraoperatorio. La razón para no cumplirse fue en ocasiones decisión del cirujano; en otras, no disponer de patólogo o la ausencia de información acerca del estado del margen en el informe patológico. Los detalles clínico-patológicos de las 799 pacientes incluidas se muestran en la tabla 1.
Detalles clínicos y patológicos del grupo de estudio
| Número de pacientes | 799 |
| Variables epidemiológicas | |
| Edad (años), mediana±DE | 57,7±12,8 |
| Historia familiar de cáncer de mama, n (%) | 203 (25,4) |
| Variables clínicas | |
| Tumor palpable, n (%) | 425 (53,2) |
| Variables radiológicas | |
| Mamografía intraoperatoria del espécimen, n (%) | 465 (58,2) |
| Variables quirúrgicas | |
| Margen definitivo positivo, n (%) | 46 (5,7) |
| Variables anatomopatológicas | |
| Tamaño tumoral (mm), mediana±DE | 15,0±8,4 |
| Histología, n (%) | |
| Carcinoma ductal infiltrante | 638 (79,8) |
| Carcinoma lobulillar infiltrante | 87 (10,9) |
| Otros carcinomas infiltrantes | 74 (9,3) |
| Inmunohistoquímica, n (%) | |
| Positividad receptores estrógenos | 702 (87,9) |
| Positividad receptores progesterona | 610 (76,3) |
| Ki67 positivoa | 378 (47,3) |
| Her2 positivob | 160 (20) |
| Alto grado (III), n (%) | 205 (25,7) |
| N positivo, n (%) | 284 (35,5) |
DE: desviación estándar.
Al llevar a cabo la evaluación intraoperatoria, en 312 pacientes (39% de la muestra total) el margen se consideró afectado o amenazado, y se realizó una ampliación del mismo durante el acto quirúrgico. En la evaluación definitiva se confirmó que 123 de ellas (39,4% de las muestras ampliadas) tenían un MA y 189, no. Por otro lado, se consideró que 487 muestras tenían el margen inicial libre y no se realizó ninguna ampliación intraoperatoria. De estas 487, 28 pacientes tuvieron margen final afecto (5,8%), precisando una segunda intervención quirúrgica para ampliar el borde correspondiente. En las 459 restantes (94,2%) se confirmó un margen final libre (tabla 2). En 81 de las 312 muestras ampliadas se encontró tumor (26% del total de las ampliaciones). En 63 de estas, el tumor residual no afectaba al borde definitivo, pero en 18 casos sí que lo afectaba: en 6 pacientes el margen definitivo estaba afecto por carcinoma ductal infiltrante, en 5 por CDIS, y en 7 casos por carcinoma ductal infiltrante y CDIS.
La sensibilidad del procedimiento fue de 0,81, mientras que la especificidad fue de 0,71. El VPP fue de 0,39 y el VPN fue de 0,94. La tasa de verdaderos positivos fue del 39,4%; en cambio, la tasa de verdaderos negativos fue del 94,2%.
Si no se hubiera realizado el análisis intraoperatorio del margen (es decir, si el margen se hubiera considerado como definitivo tal y como sale de quirófano, sin tener en cuenta la ampliación realizada), la tasa de MA definitivo hubiera sido del 18,9% (151 pacientes de 799). Gracias a las ampliaciones intraoperatorias, la tasa de MA definitivo en tumores infiltrantes fue del 5,7%: hubo 46 pacientes con margen final afecto, 28 del grupo de margen intraoperatorio libre y 18 del grupo de márgenes intraoperatorios comprometidos.
Treinta y ocho de las 46 pacientes con margen definitivo afecto fueron intervenidas por segunda vez para la ampliación de los bordes. En las 8 restantes se desestimó la reintervención por ser pacientes de edad avanzada o tener una afectación puntual del margen y de bajo grado. A 28 de estas 38 pacientes se les realizó una nueva CCM, y a 10, una mastectomía. Tres pacientes requirieron una tercera intervención por persistencia de MA (0,4% del total de la muestra).
DiscusiónLa recurrencia local del cáncer de mama tras una CCM en tumores infiltrantes es variable, con cifras descritas que oscilan entre un 5 y un 22%1–3. Dado que la afectación de márgenes es un factor de riesgo de recurrencia local conocido3,12,13, es importante mejorar la tasa de MA y reducir la cifra de reintervenciones quirúrgicas. Por ello, nuestro objetivo fue valorar cómo influye nuestro protocolo de evaluación intraoperatoria del margen en la tasa de MA. Además, estudiamos la validez y seguridad de dicho protocolo como prueba diagnóstica de MA.
Gracias a la evaluación macroscópica intraoperatoria de los bordes, se obtuvo una tasa de MA del 5,7%, de forma que solo 46 pacientes tuvieron un margen definitivo afecto.
En cuanto a la evaluación macroscópica como prueba diagnóstica de MA, su sensibilidad fue de 0,81 y su especificidad, de 0,71. El VPP fue de 0,39 y el VPN, de 0,94. La tasa de verdaderos positivos fue del 39,4%; en cambio, la tasa de verdaderos negativos fue del 94,2%. La verdadera utilidad de la prueba es su elevado VPN, de forma que cuando el patólogo indica que el margen macroscópico se encuentra libre, con un 94% de probabilidad será cierto. El hecho de que el VPP sea bajo (39%) es comprensible, ya que la prueba predice la probabilidad de que el margen sea positivo, pero también amenazado. Esto provoca que se realicen un elevado número de ampliaciones (39%), con ausencia de tumor residual en el 74% de ellas. A pesar de esto, disminuye de manera considerable la necesidad de una segunda operación.
Nuestros resultados coinciden con varios estudios en los que se empleaba un protocolo similar para evaluar los márgenes1,8–10,14–16. Fleming et al., en su estudio retrospectivo, encontraron una frecuencia de MA del 21,4% en las pacientes en las que no se hacía examen macroscópico intraoperatorio y del 9,1% en las que sí se realizaba. De manera similar a la nuestra, solo llevaban a cabo una evaluación intraoperatoria macroscópica en las pacientes con carcinomas infiltrantes, ya que los márgenes de los carcinomas intraductales son peor definidos8. Nuestra frecuencia de MA ha sido menor a la publicada por Fleming et al., aunque esta diferencia probablemente se explique porque usaron otro criterio para definir la positividad (distancia margen/tumor<10mm). La sensibilidad de su procedimiento fue de 0,73, y la especificidad fue de 0,88.
Otros grupos que realizan evaluación macroscópica intraoperatoria, como Balch et al., publican una frecuencia de MA del 25%, con una sensibilidad de 0,72, una especificidad de 0,50, un VPP de 0,33 y un VPN de 0,84. Ellos concluyen que la evaluación macroscópica del espécimen no refleja el estado del margen en el 25% de las mujeres intervenidas, e insisten en la búsqueda de otras técnicas para reducir la tasa de MA17. En cambio, en nuestro caso, la evaluación intraoperatoria nos ha permitido reducir la tasa de MA de forma significativa, de la misma forma que Cabioglu et al., quienes afirman que la ampliación intraoperatoria del margen convierte uno de cada 4 casos en márgenes negativos16. Estos últimos también emplean en la evaluación intraoperatoria el examen macroscópico y la radiografía del espécimen, con cortes por congelación en casos dudosos. Un grupo español que realiza ecografía intraoperatoria junto con la evaluación macroscópica publica una sensibilidad de 0,8, una especificidad de 0,87, un VPP de 0,23 y un VPN de 0,95 para ambas técnicas18. Su frecuencia de MA fue del 13,3%. Singh et al. plantean que se puede mejorar la precisión de las ampliaciones y reducir las cifras de reescisión realizando la tinción del espécimen en el quirófano por parte del cirujano19.
Existen otros métodos de evaluación intraoperatoria de los márgenes que han sido valorados en la literatura. Además, en muchos de estos trabajos no se evalúa directamente la frecuencia de MA, sino que la estudian de manera indirecta, comunicando la frecuencia de reoperaciones o reescisiones realizadas para conseguir un margen libre. Se han empleado el corte por congelación o la citología, y ambos se asocian significativamente a una menor tasa de reescisión, al permitir ampliar intraoperatoriamente el margen9,20,21. Para el corte por congelación se han obtenido cifras de un 10% de reescisión y del 11% con la citología, comparado con un 35% en el grupo sin análisis intraoperatorio. En una revisión sistemática se describe una sensibilidad del 72% y una especificidad del 97% de la impronta citológica, con una sensibilidad del 83% y una especificidad del 95% para cortes por congelación9. La proporción de pacientes en las que la ampliación intraoperatoria es necesaria es similar a la nuestra (33%). Otros métodos empleados son la ecografía intraoperatoria o la radiografía del espécimen. En un metaanálisis reciente se han comparado estos métodos de análisis intraoperatorio del espécimen para la valoración de los márgenes. Sus resultados indican que el corte por congelación y la citología tienen mayor precisión diagnóstica respecto a la ecografía intraoperatoria o la radiografía del espécimen. Los autores manifiestan que estas técnicas requieren más tiempo y consumo de recursos, y esto ha impedido su empleo generalizado10.
Varios estudios recientes han propuesto la ampliación sistemática de toda la cavidad quirúrgica (ACQ)22–24. Esta técnica consigue una disminución significativa de la frecuencia de MA tras CCM. Sin embargo, puede deteriorar el resultado estético, al requerir la escisión de un mayor volumen de tejido mamario, e incrementa el tiempo quirúrgico. La frecuencia de MA es algo más alta que la que hemos obtenido con la evaluación macroscópia de los márgenes (6,1% en nuestro estudio y 9,7% con la ACQ)23. Al realizar una ampliación intraoperatoria dirigida por los resultados del estudio macroscópico de los márgenes realizamos una «ampliación dirigida». De esta forma, la cantidad de volumen mamario perdido es menor y se preserva la estética de la mama. Además, a diferencia de otros métodos, nuestra evaluación intraoperatoria apenas influye en el tiempo quirúrgico, ya que el patólogo la realiza mientras en quirófano se continúa con la biopsia del ganglio centinela o la reconstrucción mamaria, empleándose para ello 20-30min. Bolger et al. no encontraron diferencias significativas en el tiempo quirúrgico entre los grupos ACQ versus examen macroscópico25, para unas cifras de MA similares (24% con ACQ y 26% con análisis macroscópico).
Se debe reconocer que la evaluación macroscópica no es accesible para todos, ya que precisa recursos técnicos y la implicación de distintos especialistas. A pesar de ello, se recomienda como prueba diagnóstica principal de MA. Se trata de una prueba eficaz, con un VPN elevado, que permite seleccionar con seguridad a las pacientes que van a tener un margen negativo. Consigue reducir de forma significativa la frecuencia de MA y, por lo tanto, de reintervenciones, consumiendo poco tiempo quirúrgico.
ConclusiónLa aplicación de nuestro protocolo de evaluación intraoperatoria del margen en tumores infiltrantes obtuvo una tasa de afectación de márgenes del 5,7%. Además, como prueba diagnóstica, presenta un elevado VPN, permitiendo seleccionar a las pacientes que no van a necesitar ampliación de los márgenes en una segunda intervención.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes y han obtenido los permisos correspondientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.