Analizar la incidencia de cáncer de mama y de ovario, y las características de dichos tumores en pacientes portadoras de mutaciones BRCA1-2.
Pacientes y métodosEstudio observacional retrospectivo que incluye un total de 111 pacientes con diagnóstico molecular de mutación en genes BRCA1 (56) o BRCA2 (55).
ResultadosEn el 69,4% de los casos el test genético se realizó tras el diagnóstico oncológico. La incidencia objetivada de cáncer de mama y ovario fue, respectivamente, del 62,2 y el 20,7%. El tipo histológico más frecuente de cáncer de mama fue el ductal infiltrante (89,7%). El 67,7% de los tumores mamarios BRCA1 presentaron un fenotipo triple negativo y el 80% de los BRCA2 mostraron un fenotipo luminal, siendo la diferencia estadísticamente significativa. El 87% de los cánceres de ovario fueron carcinomas serosos de alto grado. El 41,4% de las pacientes se realizó mastectomía profiláctica encontrándose de forma casual lesiones patológicas en el 19,5% de las piezas quirúrgicas. El 41,4% se realizó salpingooforectomía bilateral profiláctica, en cuyas piezas quirúrgicas objetivaron un 6,5% de lesiones patológicas.
ConclusionesLa incidencia de cáncer de mama/ovario en las pacientes portadoras de BRCA 1-2 estudiadas es superior a la descrita en la población general, desarrollándose a edades más tempranas. No obstante, el diagnóstico genético de la mutación es, en la mayoría de los casos, secundario al del evento oncológico. Se debe incidir en el diagnóstico precoz de la mutación basado en los antecedentes familiares para instaurar precozmente medidas de cribado y de reducción de riesgo.
To analyse the incidence of breast and ovarian cancer, and the characteristics of these tumours, in patients with BRCA1-2 mutations.
Patients and methodsRetrospective observational study that included a total of 111 patients with a molecular diagnosis of mutation in BRCA1 (56) and / or BRCA2 (55) genes.
ResultsIn 69.4% of the cases, genetic testing was performed after oncological diagnosis. The incidence of breast and ovarian cancer was 62.2% and 20.7%, respectively. The most frequent histological type of breast cancer was infiltrating ductal (89.7%). A total of 67.7% of breast tumours in BRCA1 patients had a triple negative phenotype and 80% of BRCA2 patients showed a luminal phenotype. Most (87%) ovarian cancers were high grade serous carcinomas. In 41.4% of the patients, prophylactic mastectomy was performed, with a coincidental pathological finding in 19.5% of the surgical specimens. In 41.4% of the patients, prophylactic bilateral salpingo-oophorectomy was performed, with 6.5% of surgical specimens showing pathological lesions.
ConclusionsThe incidence of breast/ovarian cancer in patients harbouring BRCA 1-2 mutations is higher than in the general population, and the cancer develops in younger patients. However, the genetic diagnosis of the mutation is usually secondary to that of the oncological event. The early diagnosis of the mutation based on family history should be emphasised in order to initiate early screening and risk-reduction measures.
El 5-10% de los cánceres de mama y de ovario son hereditarios, la mayoría de los mismos relacionados con mutaciones en los genes BRCA1 y BRCA21-5. En el caso de los pacientes portadores de mutaciones en BRCA1, el riesgo a lo largo de la vida de desarrollar un cáncer de mama es del 52% (IC del 95%, 26-69%) y para el cáncer de ovario del 22% (IC del 95%, 0-40%). Para las portadoras de mutaciones en BRCA2, estos riesgos son, respectivamente, del 47% (IC del 95%, 29-60%) y del 18% (IC del 95%, 0-35%)6. Este incremento de riesgo implica que esta población sea subsidiaria tanto de un cribado más estricto, como de la realización de cirugías profilácticas o de reducción de riesgo, como la mastectomía subcutánea bilateral o la salpingooforectomía bilateral (RRSO)6.
El objetivo principal de este trabajo es analizar la incidencia de cáncer de mama y ovario, y las características de dichos tumores, en pacientes diagnosticadas de mutaciones en BRCA1 o BRCA2 en el Hospital Universitario 12 de Octubre. Como objetivo secundario se plantea analizar las cirugías reductoras de riesgo (mastectomía y salpingooforectomía bilateral) realizadas, así como las características histopatológicas de las piezas quirúrgicas obtenidas.
MétodosSe llevó a cabo un estudio observacional retrospectivo. El estudio fue aprobado por el comité ético de nuestro centro, no siendo necesario un consentimiento informado firmado específico, dada la naturaleza retrospectiva del mismo y el uso de historias clínicas anónimas.
Se incluyó a un total de 111 pacientes con diagnóstico de mutación en los genes BRCA1 o BRCA2 en el Servicio de Genética del Hospital Universitario 12 de Octubre durante el periodo comprendido entre enero del año 2002 y junio del año 2017. Se excluyó del estudio a aquellas pacientes diagnosticadas de la mutación que no mantenían seguimiento en nuestro centro.
La información fue recogida en una base de datos diseñada para el proyecto. En el estudio descriptivo de la muestra las variables categóricas se describen mediante sus frecuencias absolutas y relativas, y las variables numéricas, a través de la media y la desviación estándar, mediana y rango intercuartílico.
Se realizaron contrastes de hipótesis para evaluar la asociación estadística entre el tipo de mutación genética y las variables explicativas. Para las variables categóricas se utilizó el test de la chi al cuadrado o el estadístico exacto de Fisher si la frecuencia esperada en alguna de las casillas era inferior a 5. En el caso de las variables numéricas, cuando se asumió normalidad, se realizó un contraste mediante una t de Student para muestras independientes. Cuando la normalidad no pudo ser asumida, el contraste fue el test no paramétrico U de Mann-Whitney. Se consideró diferencia estadísticamente significativa una p<0,05. Los análisis se realizaron con el software estadístico Stata/IC 13.0 de Windows (Statacorp).
ResultadosEl 50,5% (56) de los casos correspondió con una mutación BRCA1 y el 49,5% (55) con mutación BRCA2. No se objetivó ningún caso de mutación simultánea en ambos genes. La edad media al diagnóstico molecular de la mutación fue 46 años. En el 69,4% de los casos el test genético se realizó a raíz del diagnóstico de cáncer de mama u ovario en la propia paciente (caso índice), mientras que en el 30,6% este se indicó por los antecedentes familiares y en ausencia de proceso oncológico propio.
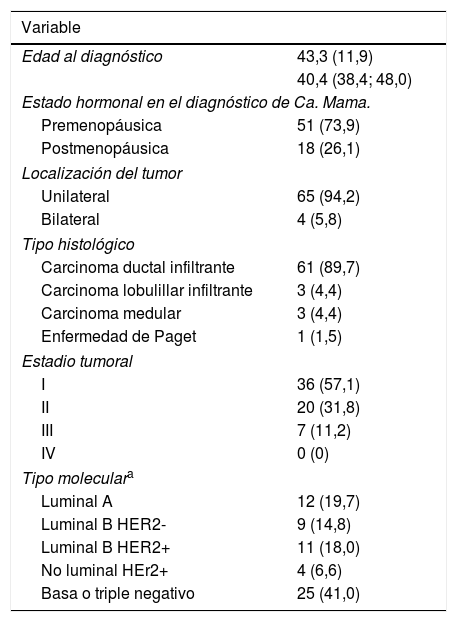
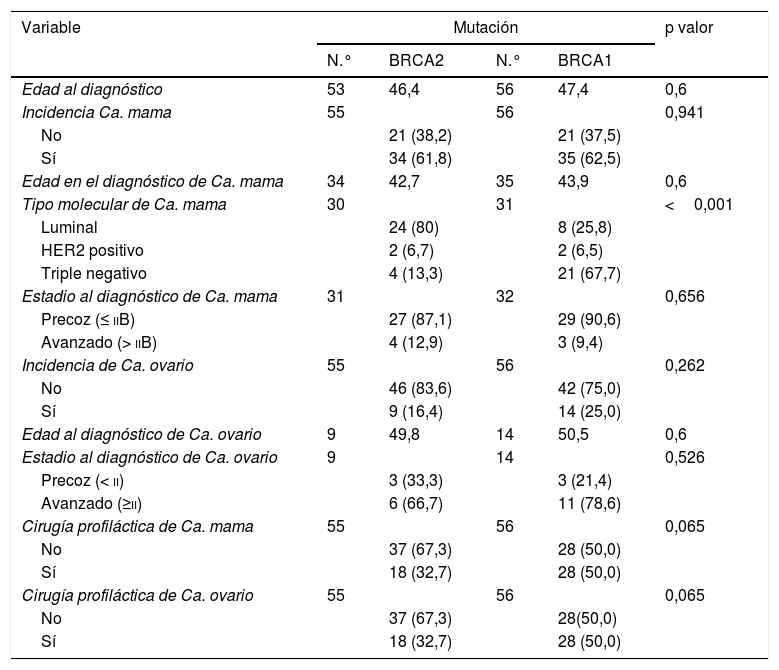
El 62,2% de las pacientes incluidas en el estudio fueron diagnosticadas de un cáncer de mama, con una incidencia de segundos tumores primarios del 18,8%. La edad media al diagnóstico fue 43,3 años. El tipo histológico más frecuente fue el carcinoma ductal infiltrante (89,7%). Todos los casos de carcinoma medular diagnosticados se correspondieron con mutaciones BRCA1, mientras que todos los casos de carcinoma lobulillar infiltrante con mutaciones de tipo BRCA2. En el global de la muestra, el tipo molecular más frecuente fue el triple negativo (41%); no obstante, en el análisis de subgrupos esta tendencia solo se mantuvo para los casos con mutación en BRCA1, con una prevalencia de tumores triple negativo del 67,7% frente al 13,3% de los tumores en casos con mutación BRCA2 (p≤0,001) (tablas 1 y 2).
Características epidemiológicas, histopatológicas y moleculares de las pacientes con antecedente personal de Ca. Mama (N=69)
| Variable | |
|---|---|
| Edad al diagnóstico | 43,3 (11,9) |
| 40,4 (38,4; 48,0) | |
| Estado hormonal en el diagnóstico de Ca. Mama. | |
| Premenopáusica | 51 (73,9) |
| Postmenopáusica | 18 (26,1) |
| Localización del tumor | |
| Unilateral | 65 (94,2) |
| Bilateral | 4 (5,8) |
| Tipo histológico | |
| Carcinoma ductal infiltrante | 61 (89,7) |
| Carcinoma lobulillar infiltrante | 3 (4,4) |
| Carcinoma medular | 3 (4,4) |
| Enfermedad de Paget | 1 (1,5) |
| Estadio tumoral | |
| I | 36 (57,1) |
| II | 20 (31,8) |
| III | 7 (11,2) |
| IV | 0 (0) |
| Tipo moleculara | |
| Luminal A | 12 (19,7) |
| Luminal B HER2- | 9 (14,8) |
| Luminal B HER2+ | 11 (18,0) |
| No luminal HEr2+ | 4 (6,6) |
| Basa o triple negativo | 25 (41,0) |
Variables expresadas en N(%) o en Media (desviación estándar) y p50 (p25; p75)
Análisis comparativo según tipo de mutación BRCA
| Variable | Mutación | p valor | |||
|---|---|---|---|---|---|
| N.° | BRCA2 | N.° | BRCA1 | ||
| Edad al diagnóstico | 53 | 46,4 | 56 | 47,4 | 0,6 |
| Incidencia Ca. mama | 55 | 56 | 0,941 | ||
| No | 21 (38,2) | 21 (37,5) | |||
| Sí | 34 (61,8) | 35 (62,5) | |||
| Edad en el diagnóstico de Ca. mama | 34 | 42,7 | 35 | 43,9 | 0,6 |
| Tipo molecular de Ca. mama | 30 | 31 | <0,001 | ||
| Luminal | 24 (80) | 8 (25,8) | |||
| HER2 positivo | 2 (6,7) | 2 (6,5) | |||
| Triple negativo | 4 (13,3) | 21 (67,7) | |||
| Estadio al diagnóstico de Ca. mama | 31 | 32 | 0,656 | ||
| Precoz (≤ iiB) | 27 (87,1) | 29 (90,6) | |||
| Avanzado (> iiB) | 4 (12,9) | 3 (9,4) | |||
| Incidencia de Ca. ovario | 55 | 56 | 0,262 | ||
| No | 46 (83,6) | 42 (75,0) | |||
| Sí | 9 (16,4) | 14 (25,0) | |||
| Edad al diagnóstico de Ca. ovario | 9 | 49,8 | 14 | 50,5 | 0,6 |
| Estadio al diagnóstico de Ca. ovario | 9 | 14 | 0,526 | ||
| Precoz (< ii) | 3 (33,3) | 3 (21,4) | |||
| Avanzado (≥ii) | 6 (66,7) | 11 (78,6) | |||
| Cirugía profiláctica de Ca. mama | 55 | 56 | 0,065 | ||
| No | 37 (67,3) | 28 (50,0) | |||
| Sí | 18 (32,7) | 28 (50,0) | |||
| Cirugía profiláctica de Ca. ovario | 55 | 56 | 0,065 | ||
| No | 37 (67,3) | 28(50,0) | |||
| Sí | 18 (32,7) | 28 (50,0) | |||
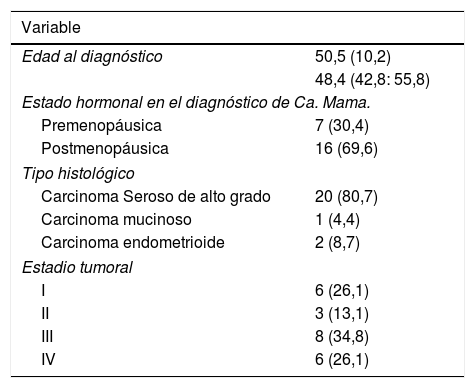
El 20,7% de las pacientes estudiadas fueron diagnosticadas de un carcinoma de ovario, con una edad media al diagnóstico de 50,5 años. El tipo histológico más frecuente fue el carcinoma epitelial seroso de alto grado (87%), seguido del carcinoma endometrioide (8,7%). En el 74% de los casos presentaban enfermedad extendida en el momento del diagnóstico (estadio tumoral ≥ ii según FIGO) (tabla 3).
Características epidemiológicas, histopatológicas y moleculares de las pacientes con antecedente personal de Ca. Ovario (N=23)
| Variable | |
|---|---|
| Edad al diagnóstico | 50,5 (10,2) |
| 48,4 (42,8: 55,8) | |
| Estado hormonal en el diagnóstico de Ca. Mama. | |
| Premenopáusica | 7 (30,4) |
| Postmenopáusica | 16 (69,6) |
| Tipo histológico | |
| Carcinoma Seroso de alto grado | 20 (80,7) |
| Carcinoma mucinoso | 1 (4,4) |
| Carcinoma endometrioide | 2 (8,7) |
| Estadio tumoral | |
| I | 6 (26,1) |
| II | 3 (13,1) |
| III | 8 (34,8) |
| IV | 6 (26,1) |
Variables expresadas en N(%) o en Media (desviación estándar) y p50 (p25; p75)
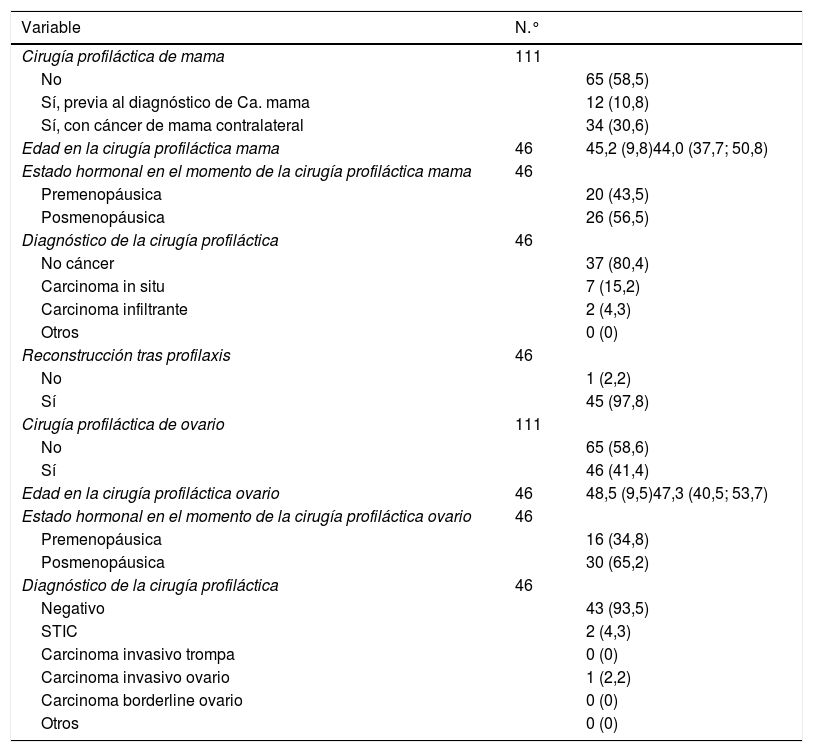
Se realizó cirugía de reducción de riesgo mamaria (mastectomía bilateral o unilateral si antecedente de mastectomía previa) en el 41,4% de las pacientes, con una edad media de 45,2 años en el momento de la cirugía. El 73,9% presentaban antecedente de cáncer de mama contralateral. En el 4,3% de las cirugías profilácticas realizadas se evidenció un carcinoma infiltrante en la pieza quirúrgica y en el 15,2% carcinoma in situ (tabla 4).
Cirugía de reducción de riesgo de mama y ovario
| Variable | N.° | |
|---|---|---|
| Cirugía profiláctica de mama | 111 | |
| No | 65 (58,5) | |
| Sí, previa al diagnóstico de Ca. mama | 12 (10,8) | |
| Sí, con cáncer de mama contralateral | 34 (30,6) | |
| Edad en la cirugía profiláctica mama | 46 | 45,2 (9,8)44,0 (37,7; 50,8) |
| Estado hormonal en el momento de la cirugía profiláctica mama | 46 | |
| Premenopáusica | 20 (43,5) | |
| Posmenopáusica | 26 (56,5) | |
| Diagnóstico de la cirugía profiláctica | 46 | |
| No cáncer | 37 (80,4) | |
| Carcinoma in situ | 7 (15,2) | |
| Carcinoma infiltrante | 2 (4,3) | |
| Otros | 0 (0) | |
| Reconstrucción tras profilaxis | 46 | |
| No | 1 (2,2) | |
| Sí | 45 (97,8) | |
| Cirugía profiláctica de ovario | 111 | |
| No | 65 (58,6) | |
| Sí | 46 (41,4) | |
| Edad en la cirugía profiláctica ovario | 46 | 48,5 (9,5)47,3 (40,5; 53,7) |
| Estado hormonal en el momento de la cirugía profiláctica ovario | 46 | |
| Premenopáusica | 16 (34,8) | |
| Posmenopáusica | 30 (65,2) | |
| Diagnóstico de la cirugía profiláctica | 46 | |
| Negativo | 43 (93,5) | |
| STIC | 2 (4,3) | |
| Carcinoma invasivo trompa | 0 (0) | |
| Carcinoma invasivo ovario | 1 (2,2) | |
| Carcinoma borderline ovario | 0 (0) | |
| Otros | 0 (0) |
Variables expresadas en N.° (%), media (desviación estándar) y P50 (p25; p75).
Así mismo, se realizó salpingooforectomía bilateral (o unilateral si antecedente de salpingooforectomía previa) profiláctica en el 41,4% de los casos, con una edad media en el momento de la realización de 48,5 años, siendo el 65,2% de las pacientes posmenopáusicas. El análisis anatomopatológico de la pieza quirúrgica fue negativo en el 93,5% de los casos, diagnosticándose carcinoma seroso intraepitelial de trompa (STIC) en el 4,3% de los casos y carcinoma infiltrante en el 2,2% (tabla 4).
No se encontraron diferencias estadísticamente significativas en la incidencia de cáncer de mama ni en la incidencia de carcinoma de ovario entre las pacientes portadoras de mutación BRCA1 y BRCA2 (61,8% vs. 65,2%, p=0,941; 25% vs. 16,4%, p=0,262). Tampoco se encontraron diferencias estadísticamente significativas en relación con la cirugía profiláctica de reducción de riesgo entre ambos grupos de estudio, habiendo sido realizadas un 32,7% de mastectomías profilácticas y RSSO en pacientes BRCA1 frente a un 50% en pacientes con mutación BRCA 2 (tabla 2).
DiscusiónEl cáncer de mama es el tumor más frecuente en la población femenina y el segundo más frecuente a nivel global. Su incidencia en la población general se sitúa en un 11,9%7, con una incidencia acumulada a lo largo de la vida del 8,9%8. En pacientes portadoras de mutaciones en los genes BRCA, este riesgo se incrementa, mostrando un riesgo acumulado a lo largo de la vida del 52% (IC del 95%, 26-69%) para BRCA1 y del 47% (IC del 95%, 29-60%) para BRCA26. En la serie de pacientes analizada, la incidencia de carcinoma de mama objetivada fue del 62,2%, dato sustancialmente superior al descrito en la población general, lo que concuerda con el riesgo incrementado de esta patología en este subgrupo de pacientes.
Al igual que en la población general, el tipo histológico de cáncer de mama más frecuente en pacientes portadoras de mutación BRCA1 y BRCA2 es el carcinoma ductal infiltrante, con una incidencia descrita en la literatura en torno al 80%8,9. Acorde con ello, este tipo histológico ha supuesto el 89,7% del total de los carcinomas de mama diagnosticados en nuestra serie de pacientes. Así mismo, histologías menos prevalentes se han asociado con mutaciones concretas de BRCA, de manera que el tipo histológico medular es 5 veces más frecuente en los casos de mutación BRCA1 y el tipo lobulillar infiltrante cuatro veces más frecuente en los casos de mutación BRCA210. Esta tendencia también se objetiva en la serie de pacientes analizada en la que todos los carcinomas medulares diagnosticados se correspondieron con una mutación de tipo BRCA1 y todos los lobulillares con una mutación BRCA2.
Respecto a los tipos moleculares, los tumores asociados a mutaciones BRCA1 y BRCA2 presentan de forma significativa mayor prevalencia de fenotipos triple negativo. Mavaddat et al. describen un porcentaje 47,9%9 de tumores triples negativos frente al 15-20%10 de la población general. Acorde con ello, en nuestra serie el 40% de los casos diagnosticados correspondieron con fenotipos triples negativos. No obstante, para algunos autores esta tendencia es exclusiva de los casos de mutación en BRCA1. Tun et al. obtienen 5,6 veces más riesgo de presentar una mutación BRCA1 tras un diagnóstico de carcinoma de mama triple negativo frente al resto de la población (mutación BRCA2 o BRCA no mutado)11. En nuestra serie de pacientes, también se objetiva esta tendencia, de manera que la prevalencia de tumores triples negativos ha sido estadísticamente superior en pacientes portadoras de mutación BRCA1 (67,7% vs. 13,3%; p=<0,001).
Por su parte, la incidencia de carcinoma de ovario en la población general es del 3,6%7, con un riesgo acumulado a lo largo de la vida de 1,24%8. De nuevo, en pacientes con mutación BRCA este riesgo se incrementa, con una incidencia acumulada a lo largo de la vida del 22% (IC del 95%, 0-40%) para los casos de mutación BRCA1 y del 18% (IC del 95%, 0-35%) para BRCA26. Acorde con ello, la incidencia de carcinoma de ovario objetivada en nuestra serie fue del 20,7%, superior a la descrita en la población general. El tipo histológico más frecuente descrito en las pacientes portadoras de mutación BRCA1-2, al igual que en la población general, es el carcinoma epitelial seroso de alto grado9. Conforme a esto, este tipo histológico ha supuesto el 87% del total de los carcinomas de ovario diagnosticados en nuestra serie.
Como ya ha sido comentado, el riesgo incrementado para el carcinoma de mama y ovario condiciona que este subgrupo de pacientes sea subsidiario de cirugías profilácticas o de reducción de riesgo. Estudios previos estipulan que la realización de una mastectomía subcutánea bilateral profiláctica reduce el riesgo del cáncer de mama en un 90-95%6,12,13. La mastectomía subcutánea contralateral profiláctica tras el diagnóstico de un carcinoma de mama parece también reducir el riesgo de presentar cáncer de mama, aunque no existen actualmente estudios a largo plazo que evalúen la recurrencia de la enfermedad y la supervivencia de las pacientes sometidas a esta intervención, estimándose que su beneficio es ligeramente inferior que la mastectomía bilateral profiláctica14. Por su parte, la RRSO reduce el riesgo de cáncer de ovario en un 72-80% y podría reducir el riesgo de cáncer de mama en torno a un 40-60%15 si se realiza antes de la menopausia. Por ello, actualmente se recomiendan ambos tipos de cirugías profilácticas, siendo recomendable la realización de la RRSO entre 35 y 40 años de edad para las pacientes portadoras de mutación BRCA1 y hasta los 45 años en pacientes con mutación en BRCA2.
No obstante, la decisión de realizar alguna de estas cirugías de reducción de riesgo es multifactorial, habiéndose asociado tanto con la historia familiar de cáncer mama y ovario, el deseo genésico y los propios antecedentes personales oncológicos16. Además, uno de los aspectos que retrasa la edad de la realización de una RRSO es la generación de una menopausia precoz iatrogénica17. Es importante señalar que, en ausencia de antecedente personal de cáncer de mama, la terapia hormonal sustitutiva no está contraindicada en pacientes portadoras de BRCA1-2, pudiendo ser una alternativa eficaz para mejorar tanto los síntomas vasomotores como sexuales derivados de la deprivación estrogénica, especialmente cuando se inicia en el primer año tras la cirugía18-20. En la literatura ha sido descrito entre un 8% y un 50% de cirugías profilácticas en pacientes conocedoras de mutación BRCA1-2, dato que concuerda con el obtenido en nuestra serie, con en torno a un 40% de mastectomías y RRSO profilácticas realizadas.
Por último, se ha descrito en la literatura que en el 0,4-3% de las mastectomías y en el 0,5-4% de las RRSO profilácticas realizadas se objetivan lesiones preneoplásicas o carcinomas ocultos, subsidiarios de seguimiento o tratamiento que de otra forma habrían sido diagnosticados en estadios más avanzados16,21-24.
Domchek et al. describen una incidencia de lesiones malignas ocultas del 0,4%21 en su serie 2.482 pacientes sometidas a mastectomía profiláctica. Gilbert et al. objetivan una incidencia de carcinoma infiltrante del 0,7% y de carcinoma in situ del 2,8% en su serie de 142 pacientes16. En nuestra serie, la incidencia tanto de carcinomas infiltrantes como de carcinoma in situ han sido superiores, respectivamente, del 4,3 y el 15,2%, probablemente debido al uso de técnicas de laboratorio y análisis más exhaustivas.
En cuanto a los hallazgos anatomopatológicos de las RRSO, recientemente Minig et al. han reportado los resultados de un estudio español multicéntrico retrospectivo, con un total de 359 pacientes, en la que se objetiva una incidencia del 0,8% para STIC y del 1,7% para los carcinomas invasivos de ovario o trompa23. En el presente estudio, el 93,5% de las piezas quirúrgicas resultaron negativas para malignidad, objetivándose STICS en el 4,3% y carcinoma invasivo de ovario en el 2,2%. Estos datos, aunque concuerdan con la literatura, son ligeramente superiores a los reportados por otros autores, pudiéndose explicar estas diferencias por el análisis anatomopatológico exhaustivo realizado en nuestro centro, denominado «Sectioning and extensively examining of the fimbirated end protocol» (SEE-FIM). Dicho análisis puede aumentar la tasa de detección de STIC hasta en un 17%23,24.
Para concluir, la incidencia de cáncer de mama y ovario en las pacientes portadoras de BRCA1-2 estudiadas es superior a la descrita en la población general, desarrollándose así mismo a edades más tempranas. En consecuencia, consideramos fundamental para el control oncológico de este subgrupo de pacientes instaurar un cribado estricto, así como ofrecer cirugías de reducción de riesgo a edades tempranas, siendo, por tanto, imprescindible el diagnóstico precoz de la mutación genética. No obstante, dicho diagnóstico es, en la mayoría de los casos, secundario al diagnóstico del tumor mamario/ovario. Por ello, debemos incidir en los indicadores clínicos de sospecha de mutación genética centrado en un estudio exhaustivo de los antecedentes oncológicos familiares que nos permita detectar precozmente a estas pacientes y, en consecuencia, disminuir los eventos oncológicos en las mismas o, en su defecto, detectarlos más precozmente.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.