revisar la eficacia del tratamiento percutáneo del cáncer infiltrante de mama (CM) mediante crioablación guiada con ecografía en pacientes con estadio clínico I/II en las que se desestima la cirugía axilar.
Métodosse recogieron de nuestros archivos las pacientes con CM en estadio clínico I/II que fueron tratadas mediante crioablación guiada con ecografía en las que se desestimó la cirugía axilar. Se seleccionaron las pacientes que tuvieron un seguimiento mínimo de 12 meses. Las revisiones fueron ecográficas: la primera entre 1 y 2 meses (para valorar lesiones residuales por tratamiento incompleto) y posteriormente semestrales (para valorar las recidivas). Las lesiones residuales y las recidivas se confirmaron con BAG y en todos los casos se valoró el tratamiento con nueva crioablación (de rescate). Se analizó la eficacia del procedimiento en función del control local en la mama.
Resultadosdesde marzo de 2019 hasta septiembre de 2022 fueron tratadas mediante crioablación guiada con ecografía 84 pacientes con 92 CM en estadio clínico I/II en las que la cirugía axilar fue desestimada. Se estudiaron retrospectivamente las 43 pacientes (58-96 años, media 83, DE ±7,64) con 48 CM (entre 5 y 60 mm, media 17, DE ±13,75) que tuvieron un seguimiento mínimo de 12 meses (entre 12 y 40 meses, media 20). Hubo 2 pacientes con tratamiento incompleto en la primera ecografía y 5 pacientes recidivaron (entre 9 y 27 meses, media 17). Todas se trataron con crioablaciones de rescate. El control local a los 12 meses fue del 90,5% (probabilidad 0,905 error estándar 0,045) y en el 95% de las pacientes (41/43) se consiguió controlar localmente el CM. Fallecieron 6 pacientes, 3 por evolución del CM y 3 por otras causas. Todos los procedimientos fueron bien tolerados y no hubo complicaciones graves.
Conclusiónla crioablación guiada con ecografía es un tratamiento percutáneo efectivo en el control local del CM en pacientes en estadio clínico I/II en las que se desestima la cirugía axilar.
To review the efficacy of percutaneous treatment of infiltrating breast cancer (BC) by ultrasound-guided cryoablation in patients with clinical stage I/II without indication for axillary surgery
MethodsPatients with clinical stage I/II BC who were treated by ultrasound-guided cryoablation in whom axillary surgery was ruled out were collected from our files. Patients who had a minimum follow-up of 12 months were selected. The ultrasound follow up were: the first between 1-2 months (to assess residual lesions due to incomplete treatment) and subsequently every six months (to assess recurrences). Residual lesions and recurrences were confirmed with CNB and in all cases treatment with new (salvage) cryoablation was considered. The efficacy of the procedure was assessed on local control in the breast.
ResultsBetween March 2019 and September 2022, 84 patients with 92 BC in clinical stage I/II were treated with ultrasound-guided cryoablation without indication for axillary surgery. The inclusion criteria of the retrospective study were met by 43 patients (58-96 years, mean 83, SD ±7,64) with 48 BC (between 5-60mm, mean 17, SD ±13,75) who were reviewed during a mean period of 20 months (between 12-40 months). There were two patients with incomplete treatment at the first ultrasound and five patients relapsed (between 9-27 months, mean 17). All were treated with salvage cryoablation. Local control at 12 months was 90.5% (probability 0.905 standard error 0.045) and in 95% of patients (41/43) the BC was locally controlled. Six patients died, three due to progression of the BC and three due to other causes. All procedures were well tolerated and there were no serious complications.
ConclusionUltrasound-guided cryoablation is an effective percutaneous treatment for the local control of BC in patients with clinical stage I/II without indication for axillary surgery.
La cirugía del cáncer infiltrante de mama (CM) ha ido evolucionando hacia un manejo más conservador. La mayor efectividad del tratamiento sistémico primario (TSP) y el desarrollo de la oncoplastía han permitido disminuir el número de mastectomías. Paralelamente, la cirugía axilar ha presentado una desescalada constante en las 2 últimas décadas1. Actualmente la biopsia selectiva del ganglio centinela y la disección axilar dirigida son las técnicas de estadificación predominantes frente a la linfadenectomía. En las pacientes sin evidencia de afectación axilar clínico-ecográfica y en las que la estadificación axilar no cambia la actitud, ni el pronóstico (mayores de 70 años o con comorbilidades y expectativa de vida corta) es razonable obviar la biopsia selectiva del ganglio centinela2. En este grupo de pacientes, el tratamiento de elección sigue siendo la extirpación quirúrgica del CM3,4. En las mujeres no candidatas a la cirugía por comorbilidad el tratamiento hormonal (TH) es el de elección ya que la mayoría de los CM expresan los receptores de estrógenos (RE+)5. Es menos efectivo que la cirugía ya que alrededor del 40% de las pacientes se hacen resistentes6. Se logra mejor control local si se combina la cirugía con el TH e incluso algunos estudios apuntan a una mayor supervivencia a partir de los 5 años de seguimiento3,4.
En las 2 últimas décadas se han desarrollado técnicas de ablación percutánea que permiten tratar tumores en diferentes localizaciones7. Las técnicas ablativas con mayor experiencia clínica en el tratamiento del CM son la radiofrecuencia (RF), la crioablación (CR) y los microondas. La RF y la CR acumulan mayor evidencia científica8. La RF y los microondas emplean el calor para destruir el tumor, son muy dolorosas y por ello requieren sedación profunda. La CR destruye el tumor generando un frío extremo alrededor de la criosonda. El frío se tolera muy bien y por ello el procedimiento se realiza con anestesia local. Además, es la técnica con menos complicaciones9,10. Estas características han determinado que la CR sea el método ablativo más empleado en el tratamiento del cáncer de mama en la última década. El reflejo de esto son los 2 ensayos clínicos FROST (NCT01992250) y Ice3 (NCT02200705) que están estudiando su efectividad en el tratamiento del CM de bajo grado, inferior a 15 mm, los más ambiciosos hasta el momento con un método de ablación percutánea8. El resultado preliminar del ensayo Ice 3 después de 3 años de seguimiento mostró una tasa de recidiva del 1,4%, similar a la cirugía y apunta a que la CR podría ser una alternativa de tratamiento11. En las pacientes sin indicación de cirugía axilar, esto cobra gran relevancia ya que abre la posibilidad del manejo percutáneo del CM, cambiando el paradigma del tratamiento quirúrgico.
El objetivo principal de este estudio retrospectivo fue valorar la eficacia de la CR guiada con ecografía en el control local del CM en una serie consecutiva de pacientes en estadio clínico I/II en las que se desestimó la cirugía axilar.
Pacientes y métodosLa CR del CM guiada con ecografía es un procedimiento percutáneo ambulatorio que se realiza en la Sección de Radiología de la Mama y está incluido en la cartera de servicios de la Unidad Multidisciplinar de Mama de nuestro hospital desde marzo del 2019. Se recomienda como tratamiento de primera elección en las mujeres no candidatas a la cirugía que son resistentes al TH o a otros tratamientos sistémicos y se ofrece a las pacientes en las que se desestima la estadificación axilar (generalmente ancianas mayores de 75 años) como alternativa al tratamiento quirúrgico. El protocolo de nuestro centro incluye el TH neoadyuvante en los carcinomas Luminal A y B con RE+ antes de la cirugía o la CR12.
Criterios de inclusiónPara nuestro estudio retrospectivo se incluyeron las pacientes con CM en estadio I/II en las que se desestimó la cirugía axilar, que fueron tratadas con CR guiada con ecografía y que fueron revisadas con un intervalo mínimo de 12 meses. La indicación del tratamiento fue adoptada de forma colegiada en el comité de la Unidad Multidisciplinar de Mama de nuestro hospital. No fue excluida ninguna paciente por los criterios de tamaño de la lesión o de su cercanía a la piel o al músculo pectoral. Las pacientes fueron informadas de las ventajas e inconvenientes del procedimiento y obtuvimos su consentimiento por escrito.
Radiólogos y equipamientoLas CR y el seguimiento ecográfico fueron realizados por los autores José Maria Oliver Goldaracena, Vicenta Cordoba Chicote, Maria Jose Roca Navarro, Diego Garrido Alonso, Ylenia Navarro Monforte, Fernando Garcia Martinez, Teresa Diaz De Bustamante, radiólogos con dedicación exclusiva a la mama y con 21, 23, 18, 6, 5, 3 y 17 años de experiencia en diagnóstico por imagen e intervencionismo de mama, respectivamente. El ecógrafo empleado fue el ACUSON 2000 (Siemens, Berlin, Germany) con el transductor de 18 MHz. El sistema de CR usado fue ICEfx Galil Boston Scientific (EE. UU.) que utiliza gas argón y criosondas de calibre 17 G o 14 G.
ProcedimientoEl procedimiento fue ambulatorio y con un tiempo por exploración de 60 minutos, similar a otras técnicas intervencionistas como la BAV (biopsia asistida por vacío) guiada con estereoataxia o por ecografía. Las pacientes acudieron a su cita y después del tratamiento se les dio de alta. Se seleccionaron el tipo y número de criosondas necesarias para alcanzar un volumen de congelación que superase al menos 10 mm el margen del tumor, siguiendo las recomendaciones de la literatura13. La paciente se colocó en una posición confortable con los brazos extendidos hacia abajo. La técnica de punción fue «manos libres». En el punto elegido de la piel se instilaron 10 cc de anestesia local (lidocaína 2%). Posteriormente la criosonda se introdujo a lo largo del eje mayor de la lesión, sobrepasándola 10 mm para obtener el margen de tratamiento deseado. Cuando fueron necesarias varias criosondas, se insertaron siguiendo la dirección más adecuada y un eje paralelo entre ellas (con una separación entre 10 y 15 mm). Posteriormente se aplicó el protocolo habitual para esta técnica que es la triple fase: la primera de congelación, la segunda de calentamiento pasivo y la tercera de congelación. La duración de cada fase fue de 10 minutos. En las lesiones menores de 10 mm el tiempo de las fases fue reducido, según el protocolo de ACOSOG Z-107214. Si en las 3 fases iniciales hubo algún margen no cubierto, la criosonda fue recolocada sobre la zona no tratada y el procedimiento fue repetido con las 3 fases. Cuando el volumen de congelación se situó a menos de 5 mm de distancia a la piel o contacto con la misma se colocó una bolsa de suero caliente durante las fases de congelación. Después de finalizar el procedimiento la criosonda fue retirada y se mantuvo una compresión localizada en el lecho de la punción hasta alcanzar la hemostasia. Posteriormente las pacientes fueron dadas de alta.
Recogida de datos y seguimientoTodas las pacientes fueron revisadas con ecografía. El primer control se realizó entre 1 y 2 meses para valorar lesiones residuales por tratamiento incompleto. Los controles posteriores fueron semestrales para descartar recidivas. En los controles semestrales se estudiaron ambas mamas y la axila ipsilateral. Las recidivas se clasificaron como recidivas en la cicatriz o alejadas de la cicatriz. Las recidivas en la cicatriz y las lesiones residuales se consideraron como fallo de la técnica y las recidivas alejadas de la cicatriz fueron consideradas como progresión local de la enfermedad ya que aparecieron en zonas no tratadas previamente. Los hallazgos sospechosos de lesión residual o recidiva fueron caracterizados mediante biopsia con aguja gruesa (BAG). En todas las lesiones residuales y recidivas se planteó otra CRR (de rescate). El seguimiento posterior a las CRR fue el mismo que con la primera CR. Consideramos control local cuando en la última revisión ecográfica a los 6 meses no fueron identificados signos de recidiva tumoral en la mama. La tolerancia y sus complicaciones se recogieron en todos los procedimientos.
Se estimaron las curvas de control local con el método semi paramétrico Kaplan-Meier. Se consideraron todas las pruebas bilaterales y los resultados estadísticamente significativos cuando p < 0,05. Los datos se analizaron con el programa estadístico SAS 9.3 (SAS Institute Inc., Cary, NC, EE. UU.).
ResultadosPacientesDesde marzo de 2019 hasta septiembre de 2022 fueron tratadas mediante crioablación guiada con ecografía 84 pacientes con 92 CM en estadio clínico I/II en las que la cirugía axilar fue desestimada. Se estudiaron retrospectivamente las 43 pacientes (58-96 años, media 83, DE ±7,64) con 48 CM (entre 5 y 60 mm, media 17, DE ±13,75) que tuvieron un seguimiento mínimo de 12 meses (entre 12 y 40 meses, media 20) (tabla 1). La CR se realizó en 17 pacientes que no eran candidatas a la cirugía por comorbilidades: 11 resistentes al TH primario (entre 12 y 96 meses, media 34), 3 con buena respuesta al TH primario (entre 23 y 14 meses, media 17) y 3 con otras neoplasias estabilizadas en estadio IV. Estas últimas se trataron inicialmente con CR, 2 de ellas recibieron TH posterior. A 25 mujeres ancianas mayores de 75 años candidatas a cirugía se les ofreció la opción de cirugía o CR después de TH neoadyuvante (entre 6 y 14 meses, media 8,5) y optaron por la segunda. Cuatro fueron tratadas primero con CR, 3 por CM de pequeño tamaño (entre 5 y 7 mm), en las que posteriormente se pautó TH y una por CM RE negativos. Una paciente de 58 años se negó a la cirugía y se le propuso la CR que aceptó a los 12 meses de TH neoadyuvante.
Características de las pacientes y carcinomas que han sido tratadas con crioablación (n = 43)
| Edad (años) | |
| Media (rango) | 83 (entre 58 – 96 años) |
| Mediana (desviación estándar) | 82,1 (+/- 5,4) |
| Tipo de cirugía axilar no realizada | |
| BSGCa | 41 (94%) |
| Disección axilar dirigidab | 2 (6%) |
| Indicaciones crioablación | |
| No candidatas a cirugía | 17 (40%) |
| Ancianas con comorbilidades | 14 (35%) |
| Otra neoplasia en estadio IVc | 3 (5%) |
| Mujeres candidatas a cirugía que optan por la crioablación | 26 (60%) |
| ≥75 años | 25 (58%) |
| <75 años | 1 (2%) |
| Extensión local | |
| Focal | 38 (88%) |
| Multifocald | 3 (7%) |
| Bilaterale | 2 (5%) |
| Estadio clínico | |
| I | 31 (72%) |
| II | 12 (28%) |
| Características de los carcinomas (n = 48) | |
| Tipo Histológico | |
| Carcinoma ductal infiltrante | 30 (62,5%) |
| Carcinoma lobulillar infiltrante | 12 (25%) |
| Carcinoma coloide | 4 (8,3%) |
| Carcinoma papilar | 2 (4,2%) |
| Grado tumoralf | |
| G1 | 9 (18,8%) |
| G2 | 36 (75%) |
| G3 | 3 (6,2%) |
| Perfil inmunohistoquímico | |
| RE+/Her2-g | 44 (92%) |
| RE+/Her2- | 4 (8%) |
| Tamaño de la lesión (mm) | |
| Media (rango) | 17 (3-60) |
| Mediana (desviación estándar) | 17 (+/- 7) |
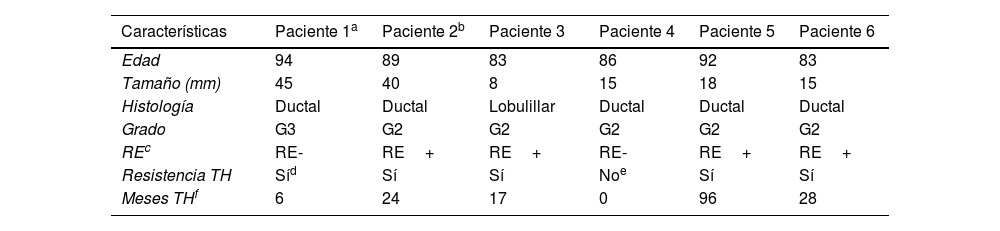
Dos pacientes (4,6%) presentaron lesiones residuales por tratamiento incompleto y 5 recidivaron (11,6%) (tabla 2). Una de las pacientes que presentó lesión residual también desarrolló posteriormente recidiva. El tamaño medio de los CM que presentaron lesiones residuales fue de 42,5 mm (40 y 45 mm) y de los que recidivaron fue de 23,5 mm (osciló entre 8 y 40 mm). Las 4 pacientes con CM que expresaban RE+ desarrollaron resistencia al TH después de una media de 41 meses (osciló entre 17 y 96 meses).
Características de las pacientes con lesiones residuales y recidiva
| Características | Paciente 1a | Paciente 2b | Paciente 3 | Paciente 4 | Paciente 5 | Paciente 6 |
|---|---|---|---|---|---|---|
| Edad | 94 | 89 | 83 | 86 | 92 | 83 |
| Tamaño (mm) | 45 | 40 | 8 | 15 | 18 | 15 |
| Histología | Ductal | Ductal | Lobulillar | Ductal | Ductal | Ductal |
| Grado | G3 | G2 | G2 | G2 | G2 | G2 |
| REc | RE- | RE+ | RE+ | RE- | RE+ | RE+ |
| Resistencia TH | Síd | Sí | Sí | Noe | Sí | Sí |
| Meses THf | 6 | 24 | 17 | 0 | 96 | 28 |
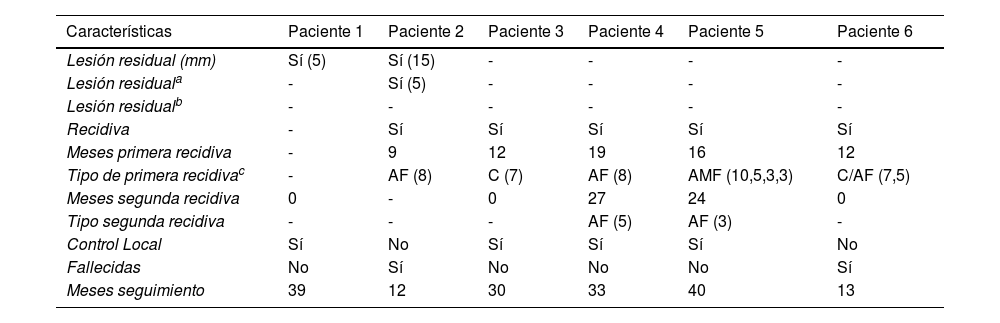
Se diagnosticaron 3 lesiones residuales en 3 tratamientos incompletos en 2 pacientes y 7 recidivas en 5 pacientes a los 17 meses de media (9-27 meses) (tabla 3). Dos de las recidivas fueron en la cicatriz y 5 alejadas de la cicatriz. Las pacientes con tratamiento incompleto fueron la 1 y la 2, aunque esta última también presentó una recaída. En la paciente 1 la lesión residual de 5 mm se localizó en la periferia de la cicatriz, fue tratada con CRR y los controles posteriores hasta los 39 meses fueron normales (fig. 1A-N). La paciente 2 presentó una lesión de 15 mm que fue tratada con CRR y en el control posterior se demostró todavía una lesión residual periférica a la cicatriz de 5 mm por lo que fue necesario tratarla con nueva CRR. Posteriormente se confirmó el tratamiento completo de la lesión, pero presentó una recurrencia de 8 mm alejada de la cicatriz a los 9 meses con múltiples metástasis axilares y se desestimó para otras CRR. La paciente falleció a los 13 meses por metástasis cerebrales. La paciente 3 presentó una recidiva en la cicatriz de 8 mm a los 12 meses y tras la CRR permanece libre de enfermedad después de 30 meses de seguimiento. Las pacientes 4 y 5 desarrollaron 2 recidivas consecutivas. La paciente 4 presentó una recidiva de 7 mm alejada de la cicatriz a los 19 meses, después de la CRR se detectó otra recidiva de 5 mm, a los 8 meses, separada de las 2 cicatrices y se volvió a tratar. La paciente 5 presentó una recidiva múltiple de 4 lesiones (entre 3 y 8 mm), alejadas de la cicatriz, a los 16 meses. Se trataron las 4 lesiones en la misma sesión y a los 8 meses se detectó otra recidiva de 3 mm, situada en la piel, separada de las 5 cicatrices que se trataron. Ambas pacientes se encuentran libres de enfermedad a los 33 y 40 meses de seguimiento, respectivamente. La paciente 6 presentó 2 recidivas a los 12 meses, en la cicatriz (7 mm) y alejada de la cicatriz (5 mm). Se trataron las 2 lesiones en la misma sesión. La paciente falleció por un ictus al mes del segundo tratamiento, por tanto, no cumplió el criterio del último control en 6 meses libre de enfermedad en la mama y no se consiguió el control local.
Características de las lesiones residuales, de las recidivas, tipos de recidiva y evolución de las pacientes
| Características | Paciente 1 | Paciente 2 | Paciente 3 | Paciente 4 | Paciente 5 | Paciente 6 |
|---|---|---|---|---|---|---|
| Lesión residual (mm) | Sí (5) | Sí (15) | - | - | - | - |
| Lesión residuala | - | Sí (5) | - | - | - | - |
| Lesión residualb | - | - | - | - | - | - |
| Recidiva | - | Sí | Sí | Sí | Sí | Sí |
| Meses primera recidiva | - | 9 | 12 | 19 | 16 | 12 |
| Tipo de primera recidivac | - | AF (8) | C (7) | AF (8) | AMF (10,5,3,3) | C/AF (7,5) |
| Meses segunda recidiva | 0 | - | 0 | 27 | 24 | 0 |
| Tipo segunda recidiva | - | - | - | AF (5) | AF (3) | - |
| Control Local | Sí | No | Sí | Sí | Sí | No |
| Fallecidas | No | Sí | No | No | No | Sí |
| Meses seguimiento | 39 | 12 | 30 | 33 | 40 | 13 |
C: en la cicatriz. AF: alejada de la cicatriz focal. AMF: alejada de la cicatriz multifocal, varias lesiones (tamaño en mm de cada lesión).
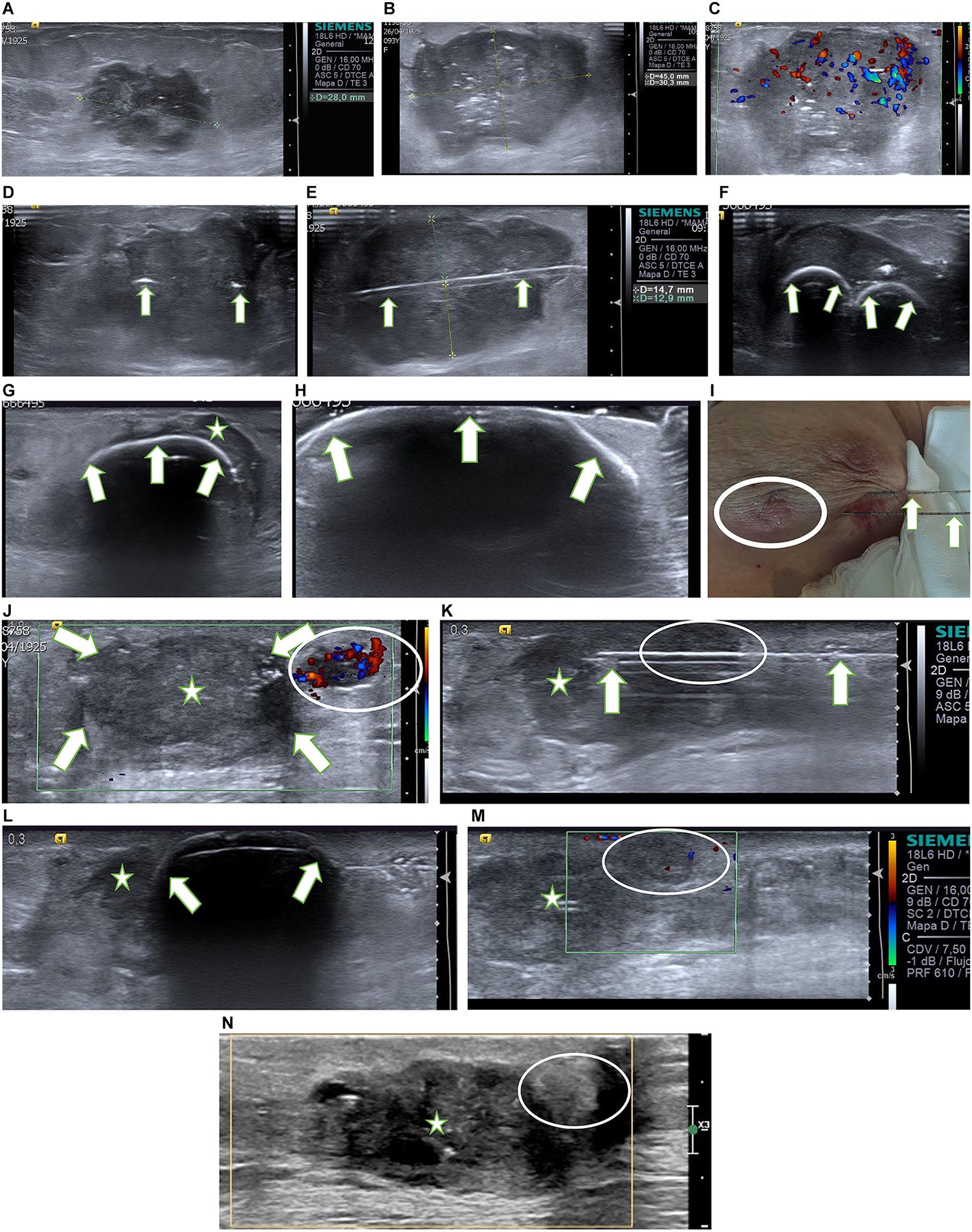
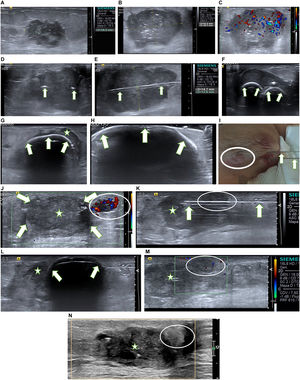
Una paciente de 93 años. Carcinoma ductal infiltrante (G3, receptores estrógenos y progesterona negativos, receptores de andrógenos 90%, Her2 negativo, Ki67 70%). A) Ecografía en el diagnóstico. Lesión hipoecogénica irregular de 28 mm en el cuadrante ínfero-interno de la mama izquierda. La axila izquierda no mostraba hallazgos. La paciente presentaba una cardiopatía severa por lo que no fue candidata a cirugía. Se instauró tratamiento con hormonoterapia primaria (antiandrógenos). B-C) Control ecográfico a los 6 meses. B) Se demuestra un crecimiento muy significativo de la lesión (45mm), C) con marcada señal doppler color. En el Comité Multidisciplinar de Mama se decide el manejo con crioablación. D-I) Imágenes ecográficas durante la crioablación . Se colocaron 2 agujas Ice Pearl paralelas en el eje mayor de la lesión para conseguir el volumen adecuado. D) La ecografía en el plano transversal (eje corto de la lesión) muestra las 2 agujas separadas unos 10 mm en el centro de la masa (flechas). E) La ecografía en el plano longitudinal (eje largo de la lesión) muestra una de las agujas (flechas), en el centro de la masa. F-H) Durante el primer ciclo de congelación se pueden apreciar 2 semicírculos hiperecogénicos relacionados con el contorno de las bolas de hielo (flechas) creciendo progresivamente F) hasta que se fusionan en una H) que al final del ciclo se expande hasta abarcar completamente la lesión (estrella). I) Nótese que la bola de hielo está en íntimo contacto con la piel, lo que produjo quemadura leve por congelación (círculo). J) Control ecográfico a los 2 meses. Se comprobó la presencia de una lesión de pequeño tamaño con marcada señal doppler color (círculo) en la periferia del carcinoma tratado que aparece como una lesión hipoecogénica sin señal doppler color (flechas). La BAG de la lesión con señal doppler color confirmó el diagnóstico de carcinoma residual y la BAG del carcinoma tratado (estrella) fue negativa para maliginidad. K-M) Crioablación de rescate de la lesión residual a los 4 meses. K) La imagen ecográfica en el plano longitudinal muestra la aguja de crioablación Ice Sphere (flechas) a lo largo del eje mayor de la lesión (círculo). Carcinoma tratado (estrella). L) La imagen ecográfica al final del segundo ciclo de congelación muestra la bola de hielo (flechas) que ha envuelto la lesión, en contacto con la piel. La colocación de la bolsa de suero caliente durante las fases de congelación y el pequeño tamaño de la bola de hielo, posiblemente contribuyeron a que no se produjera quemadura en la piel. M) Ecografía doppler color de la lesión residual (círculo) inmediatamente después del procedimiento. Se puede apreciar la falta de señal doppler color lo que indica buena respuesta inmediata al tratamiento. N) Control ecográfico a los 39 meses. Se comprueba la buena respuesta a las 2 crioablaciones. Se aprecia una lesión hipoecogénica que se corresponde con la masa tratada inicialmente (estrella) y una lesión hiperecogénica (círculo) que se corresponde con la lesión residual, ambas sin señal doppler color.
El tamaño medio de las 3 lesiones residuales fue de 8 mm (5-15 mm) y el de las 11 lesiones diagnosticadas en las 7 recidivas fue de 6 mm (3-10 mm). Las lesiones residuales y las recidivas fueron caracterizadas con BAG, aunque en la paciente con la recidiva de 4 lesiones, solo se biopsió la de mayor tamaño.
Procedimiento, tolerancia y complicacionesTodas las CR fueron realizadas con anestesia local, aunque una paciente con enfermedad de Alzheimer necesitó sedación. Se trataron inicialmente 48 lesiones en 43 pacientes y en las CRR se trataron 14 lesiones en 6 pacientes. El número medio de criosondas por procedimiento en el tratamiento inicial fue de 1,2. En todas las CRR se utilizó una criosonda por lesión. La duración media de los procedimientos fue de 50 minutos (osciló entre 25 y 75 minutos). Los procedimientos fueron ambulatorios y las pacientes fueron dadas de alta después de finalizar el tratamiento, aunque la paciente que necesitó sedación fue dada de alta 3 horas después.
En 17 casos fueron objetivadas quemaduras leves por congelación, 16 lesiones situadas a menos de 5 mm de la piel y una en la piel. Dos pacientes refirieron dolor local después del tratamiento. Una paciente requirió tratamiento con metamizol recibiendo el alta una hora después y la otra paciente presentó dolor local leve a la semana del procedimiento persistiendo durante 2 meses. En 11 pacientes se originó un hematoma leve. El lecho tratado se manifestó como un nódulo palpable en todas las pacientes como consecuencia de la necrosis grasa generada por la CR. En 2 pacientes hubo secreción serosa a través del orificio de la piel durante las primeras 24-48 horas, que cedió espontáneamente.
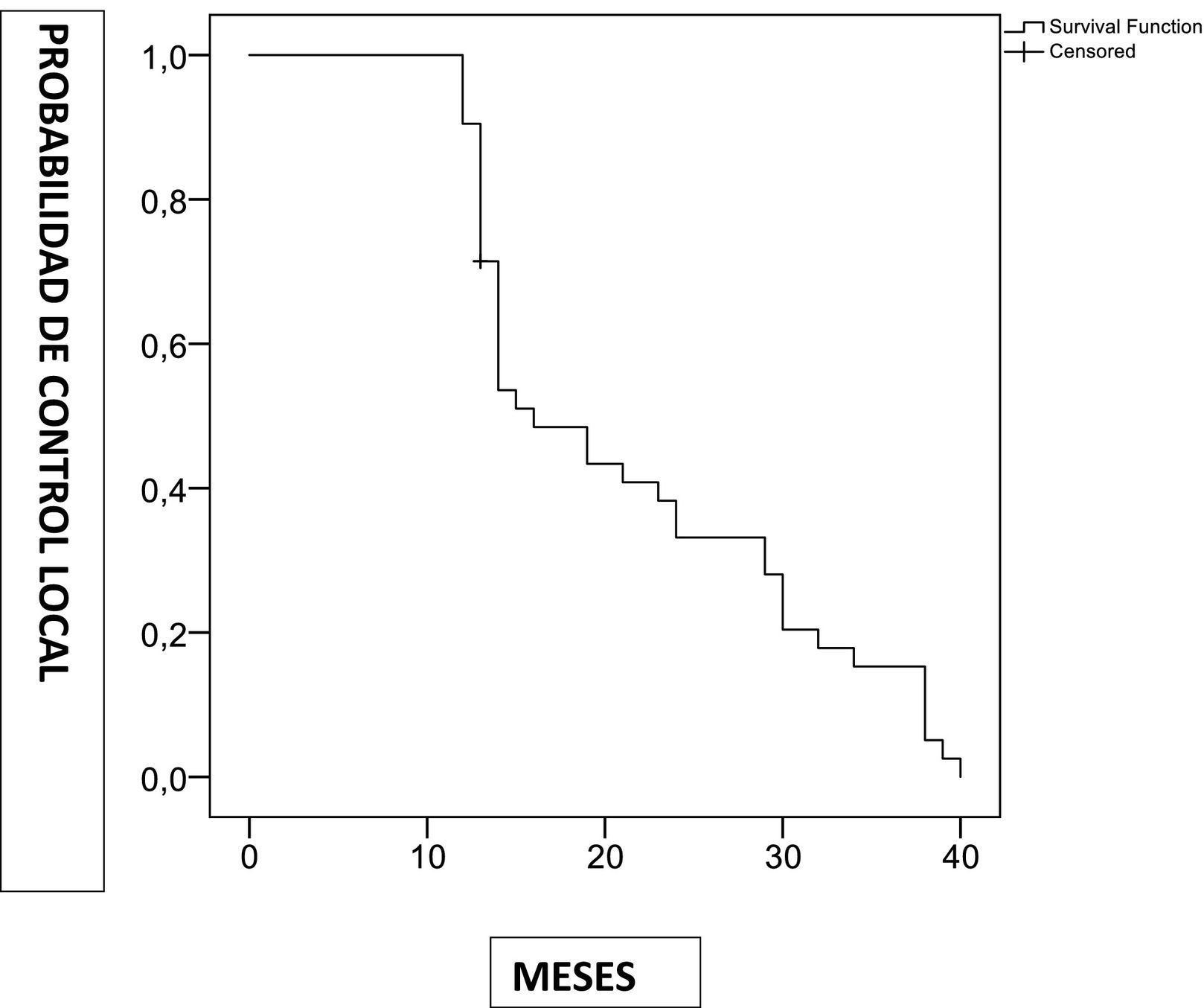
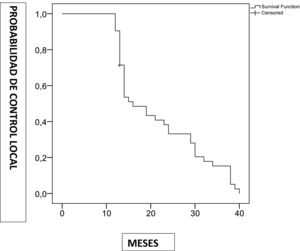
Efectividad de la técnica en el control localEn los primeros 12 meses de seguimiento el control local fue del 90,5% (probabilidad 0,905 error estándar 0,045) (fig. 2). Globalmente se consiguió en el 95% de las pacientes (41/43).
El CM evolucionó hacia la diseminación metastásica en 2 pacientes con control local. Una de ellas con carcinoma papilar y axila negativa desarrolló metástasis hepáticas a los 19 meses que fue tratada con quimioterapia y permaneció libre de enfermedad a los 38 meses de seguimiento. La otra paciente con un carcinoma ductal infiltrante desarrolló metástasis ganglionares, óseas y hepáticas falleciendo a los 12 meses de la crioablación. Tres pacientes con carcinomas ductales infiltrantes fallecieron a los 14, 18 y 32 meses por otras causas no relacionadas con el CM.
DiscusiónNuestro trabajo es el primero publicado hasta ahora que ha valorado y demostrado la efectividad de la CR en el tratamiento de pacientes con CM que no se van a someter a una estadificación axilar. La mayoría son mujeres ancianas en la década de los 80, en estadio precoz de la enfermedad (I/II) y candidatas a la cirugía de mama. La tendencia actual en las pacientes ancianas, sobre todo a partir de los 80 años, es ofrecer el TH primario (la mayoría de los CM son RE+) con la intención de evitar posibles complicaciones derivadas de la cirugía2,4. El inconveniente es que el CM puede hacerse resistente a los 2 o 3 años de iniciar el TH y progresar localmente5. En este punto es cuando se plantea la cirugía con la paradoja de que, después de varios años, la paciente suele presentar mayor fragilidad que en el momento del diagnóstico4,5. La CR junto con el TH podría ser el tratamiento más adecuado en este grupo de pacientes basándonos en la efectividad y baja morbilidad de la CR que hemos objetivado en este estudio.
El trabajo de Cazzato et al.15 es el único publicado hasta ahora similar al nuestro. Aunque, solo incluyeron pacientes que no eran candidatas a cirugía por comorbilidad y el número de la serie (23) y el seguimiento medio (14,6 meses) fueron menores. Demostraron la efectividad de la CR con un control local del 76,9% a los 12 meses en lesiones con tamaño medio de 14 mm. La presente serie obtuvo mejores resultados con un control local del 90,5% en lesiones con un tamaño medio de 17 mm. Aunque en la serie de Cazzato et al.15 no se especifica el estadio de la enfermedad, posiblemente sus resultados son peores por presentar pacientes en estadios más avanzados. De hecho, solo se volvieron a tratar 2 de las 5 pacientes con recidivas, lo que indica que posiblemente la enfermedad estaba en estadios avanzados en las 3 pacientes no tratadas.
La mayoría de los trabajos publicados hasta ahora han estudiado la efectividad de la CR en el carcinoma ductal infiltrante menor de 15-20 mm11,13,14. Solamente los estudios de Cazzato et al.15, Pusceddu et al.16 y Beji et al.17 añadieron el carcinoma lobulillar infiltrante. Los trabajos de Pusceddu et al. y Beji et al. siguen una metodología similar al de Cazzato et al.15 y al presente, aunque su población estudiada era diferente ya que se encontraba en el estadio IV de CM estabilizado, con una expectativa de vida superior a 12 meses16,17. En la presente serie tanto los carcinomas lobulillares como otros tipos histológicos menos frecuentes (coloide y papilar) respondieron bien a la CR y se trataron lesiones mayores de 20 mm (hasta 60 mm) de manera similar a Cazzato et al.15, Pusceddu et al.16 y Beji et al.17, que trataron lesiones hasta 54, 48 y 28 mm, respectivamente. En estas series y en la nuestra, la utilización de varias criosondas permitió aumentar el volumen de ablación en un solo procedimiento lo que facilitó el tratamiento de las lesiones mayores de 15-20 mm.
Aunque la población estudiada en nuestra serie y la de Cazzato et al.15 son diferentes a las de Pusceddu et al.16 y Beji et al.17 las recidivas fueron similares. Oscilaron entre el 28% de Pusceddu et al. (10/35) y el 12% de Beji et al. (2/17), frente al 21% de Cazzato et al. (5/23) y el 11,6% de la nuestra (5/43) con tamaño medio de las lesiones de 30,16 mm frente a 14 y 17 mm y seguimiento medio de 48,22 meses frente a 14,6 y 20 meses, respectivamente. En los 3 estudios publicados y en nuestra serie se trataron las recidivas con CRR15–17. Un concepto que únicamente se estudió en la serie de Pusceddu et al.16 y en la nuestra fue la posibilidad de que el tratamiento inicial fuera incompleto y que persistiera el carcinoma residual. En ambas series hubo 4 CM con tratamiento incompleto, todos mayores de 30 mm16. Discriminar entre recidiva y lesión residual por tratamiento incompleto ha sido útil ya que hemos comprobado las limitaciones de la CR en las lesiones de mayores de 30 mm. Esto nos ha permitido optimizar el manejo de las pacientes. De hecho, después de 2 años de experiencia, hemos cambiado el protocolo de seguimiento. En las mujeres con lesiones menores de 30 mm realizamos un control en 6 meses, mientras que en las lesiones mayores de 30 mm mantenemos el primer control entre 1 y 2 meses.
La mayoría de las lesiones residuales se localizaron en la periferia de la cicatriz de CR, esto se debe a que el efecto destructivo es menor en el margen externo del volumen de congelación, donde la temperatura oscila alrededor de los -20° (fig. 1J). En la región central, adyacente a la aguja, las temperaturas son mucho más extremas (pueden llegar hasta los -160°) provocando la necrosis colicuativa del tejido.
Nuestro trabajo es el único hasta ahora en clasificar los tipos de recidiva, en la cicatriz y alejada de la cicatriz. Conceptualmente son diferentes. La recidiva en la cicatriz es consecuencia del fallo de la técnica en la ablación completa del tumor. En un estudio reciente de nuestro grupo, Roca et al. demostraron que en las pacientes con CM de bajo grado, inferiores a 15 mm, en las que se trataron con CR antes de la cirugía, persistieron focos microscópicos de carcinoma infiltrante viable en el 6% de los casos18. En otros trabajos similares, la presencia de carcinoma residual en lesiones de bajo riesgo osciló entre el 4 y el 10% en las menores y mayores de 10 mm, respectivamente19,20. El carcinoma viable en el lecho de la CR probablemente fue el responsable de la recidiva en la cicatriz del 5% (2/43) de nuestras pacientes, cifra inferior a lo esperable dado el tamaño medio (17 mm) de las lesiones y de la disparidad de tipo y grado histológico de los CM tratados, la mayoría G2 y 3 casos G3. Lo razonable sería esperar una recidiva en la cicatriz mayor del 10%, basándonos en los resultados publicados hasta ahora19,20. La explicación de esta discordancia podría ser la respuesta del CM al TH. En nuestra serie solo han recidivado las pacientes resistentes al TH. En las respondedoras, el TH podría bloquear el crecimiento de las células residuales viables en el lecho de la CR. En las resistentes al TH, las células residuales progresarían hasta la recidiva. Si consideramos únicamente las pacientes resistentes al TH obtenemos un 15% (2/13) de recidiva en la cicatriz, más acorde con los datos publicados. Las recidivas alejadas de la cicatriz probablemente están relacionadas con progresión local de la enfermedad, focos multifocales o multicéntricos de CM alejados del lecho tratado. Deben ser consideradas como lesiones nuevas y no como fallo de la CR. En nuestra serie las 4 pacientes eran resistentes al TH y esto explicaría la progresión.
Las mujeres con comorbilidades que son tratadas únicamente con TH primario presentan una tasa de progresión local hasta el 40%6. En nuestra serie representaban el 30% (13/43) de las pacientes, en el 85% (11/13) el tratamiento con CR fue efectivo y en 2 de ellas fracasó. En el grupo de pacientes no resistentes al TH (neoadyuvante o primario) no se objetivó recidiva. Pensamos que la CR junto con el TH podría constituir el manejo más adecuado para las pacientes ancianas o con comorbilidades independientemente de que sean candidatas o no a la cirugía. La CR no añade morbilidad y como hemos demostrado en el trabajo consigue el control local en la mayoría de las pacientes.
Como en todos los estudios publicados hasta ahora hemos comprobado que el procedimiento se tolera muy bien con anestesia local7–11,13–20. El calibre de las criosondas (17G-14G) es similar al calibre de la BAG (16G-14G). Por otro lado, la congelación no provoca dolor por el efecto anestésico del frío. Las complicaciones no han sido importantes.
Este estudio es retrospectivo y sus resultados indican que la crioablación es una técnica prometedora para el manejo percutáneo de este grupo de pacientes, pero es necesario confirmarlo con estudios prospectivos y comparativos con la cirugía. El número de pacientes de la serie es pequeño, a pesar de ser la serie publicada más numerosa hasta ahora. Falta seguimiento a largo plazo, siendo esperable mayor número de recidivas. Hay que tener en cuenta que la primera recidiva se ha diagnosticado entre los 9 y 19 meses y hasta la fecha hay 23 pacientes con un seguimiento inferior a los 19 meses.
La crioablación guiada con ecografía es efectiva en el control local del carcinoma infiltrante de mama en las pacientes con estadio I/II no subsidiarias de cirugía axilar. Es una técnica muy bien tolerada (se realiza con anestesia local) y no presenta complicaciones importantes. Abre la posibilidad del manejo percutáneo del cáncer de mama en este grupo de pacientes cambiando el paradigma de la cirugía como tratamiento de elección.
FinanciaciónLa presente investigación no ha recibido ayudas específicas provenientes de agencias del sector público, sector comercial o entidades sin ánimo de lucro.
Responsabilidades éticasLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales, que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes y que en este artículo no aparecen datos de ellos. Los autores cuentan con el consentimiento informado de los pacientes. El Comité Etico del Hospital Universitario La Paz aprobó la investigación y el número de registro es HULP: PI-4841.
Conflicto de interesesLos autores declaran que no tienen conflicto de intereses.
AutoríaJosé Maria Oliver Goldaracena participó en la concepción y diseño del estudio, la obtención y análisis de los datos, el tratamiento estadístico, la búsqueda bibliográfica y la redacción del trabajo; Maria Jose Roca Navarro participó en la obtención de datos, la búsqueda bibliográfica y la redacción del trabajo; Covadonga Marti Alvarez participó en la búsqueda bibliográfica, la redacción y la revisión del manuscrito; Jose Ignacio Sanchez Mendez participó en la búsqueda de la bibliografía y en la revisión del manuscrito; Vicenta Cordoba Chicote, Diego Garrido Alonso, Ylenia Navarro Monforte, Teresa Diaz De Bustamante y Fernando Garcia Martinez participaron en la obtención de datos, Laura Yebenes, Virginia Martinez Marin, Pilar Zamora Auñon y Elisa York Pineda participaron en la revisión crítica del manuscrito haciendo aportaciones relevantes.