REV. SENOLOGÍA Y PATOL. MAM., 11, 1 (40-44), 1998
Carcinoma con metaplasia sarcomatoide de célula fusiforme
Metaplastic sarcomatoid carcinoma of spindle cell
A. Córdoba Iturriagagoitia*,
I. Querol Nasarre**,
M. L. Gómez Dorronsoro***,
F. J. Monzón Muñoz*
***.Unidad de Anatomía Patológica.
***.Servicio de Medicina Interna. Hospital Reina Sofía. Tudela (Pamplona).
***.Servicio de Anatomía Patológica. Hospital de Navarra. Pamplona.
Correspondencia:
Alicia Córdoba Iturriagagoitia.
Plaza Obispo Irurita, 5, 13.° D.
31008 Pamplona (Navarra).
SUMMARY
We present the case of a 66 years old woman, who had a metaplastic carcinoma of the breast. This tumor was clasiffied as a spindle cell form. There was not any ductal carcinoma component. The spindle cell metaplastic carcinoma had better prognosis than the other subgroups of metaplastic carcinoma. This type of spindle cell metaplastic carcinoma showed more similarities than differences with the new described myoepithelial carcinoma. We suggest that the inclusion of both tumors in the group of neoplasm derived from myoepithelial cell should be considered.
Palabras clave
Carcinoma metaplásico de células fusiformes, Carcinoma mioepitelial, Célula mioepitelial.
Key words
Metaplastic carcinoma of spindle, Myoepithelial carcinoma, Myoepithelial cell.
INTRODUCCIÓN
Los tumores de mama constituidos principalmente por células fusiformes han recibido diferentes denominaciones y múltiples consideraciones histogenéticas. Desde el desarrollo de la inmunohistoquímica en el ámbito de la anatomía patológica se han diferenciado dos grandes grupos: los sarcomas primarios de la mama y los carcinomas metaplásicos. En 1989, Wargotz et al reunieron todos los casos de carcinoma metaplásico del Registro Americano de Patología de las Fuerzas Armadas (AFIP), una vez rechazados los sarcomas, y los reclasificaron según los tipos histológicos. Se reconocieron cuatro subtipos: carcinoma
escamoso, carcinoma productor de matriz, carcinoma de célula fusiforme y carcinoma con metaplasia heteróloga..1 Esta división ha permitido además distinguir diferencias respecto al pronóstico..2
El carcinoma metaplásico de células fusiformes o carcinoma de células fusiformes (CCF) está constituido por una población de células mioepiteliales, en general monomorfa, semejante a un fibrosarcoma o histiocitoma fibroso maligno acompañado de un componente epitelial de carcinoma ductal infiltrante. Estos elementos epiteliales pueden ser escasos o inexistentes. Por ello, la mayor parte de estos casos eran considerados anteriormente como sarcomas..1 En 1991, Tavassoli describe las lesiones originadas de las células mioepiteliales de la mama incluyendo el carcinoma mioepitelial (CM)..3 Este nuevo tipo tumoral está también constituido por células fusiformes y no se contempla en la clasificación precedente. Ambos autores consideran que la célula mioepitelial es el origen de ambos tumores, el CCF y el CM. Esta célula muestra características ultraestructurales de célula epitelial y muscular, y parece ser también la responsable de un tercer tumor mamario, el cistosarcoma fillodes.
Presentamos un caso de carcinoma con metaplasia sarcomatoide de células fusiformes (CCF). Consideramos los tres tumores derivados de la célula mioepite-lial con sus semejanzas y diferencias.
DESCRIPCIÓN DEL CASO
Se trata de una mujer de 66 años sin antecedentes familiares de interés. Entre sus antecedentes personales hay que destacar hipertensión arterial y un síndrome depresivo. La paciente padecía un síndrome de Wolf-Parkinson-White con vía posterolateral izquierda que tras tres intentos de ablación por ra-diofrecuencia ineficaces tuvo que ser intervenida quirúrgicamente de este síndrome de preexcitación en otro centro. El postoperatorio resultó complicado por un neumotórax y una infección respiratoria que obligó a mantener la ventilación mecánica y traqueostomía durante 1 mes. La paciente sufría además de una insuficiencia mitral leve-moderada; todo ello producía una insuficiencia cardíaca moderada (II-III).
Un mes después del alta acude a consulta y refiere un nódulo sobre la cicatriz de un tubo de drenaje en cuadrante superointerno de la mama izquierda. El nódulo alcanza 3 cm de diámetro y la paciente refería una historia de 2 meses. La punción-aspiración con aguja fina muestra un tumor maligno de células fusiformes que se reseca. La intervención se reduce a una tumorectomía amplia por la delicada situación cardiovascular de la paciente.
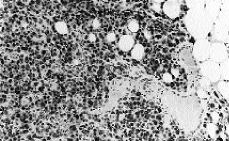
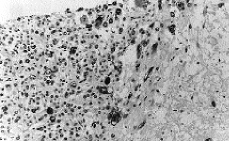
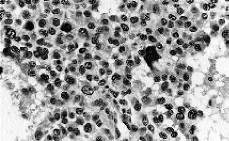
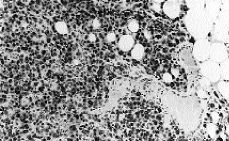
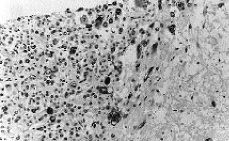
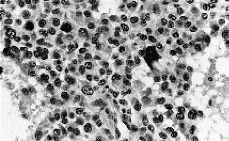
El tumor muestra límites redondeados, 3 cm de diámetro máximo y una coloración macroscópica blanquecina. Histológicamente se evidencia una neoplasia de células fusiformes de aspecto sarcomatoso que sustituye en su totalidad al parénquima mamario y en la cual no es posible identificar estucturas tubulares o glandulares (Fig. 1). Se trata, por tanto, de un tumor sin elementos epiteliales identificables. Se plantean los siguientes diagnósticos: un sarcoma primario, un carcinoma con metaplasia sarcomatoide (CCF) o carcinoma de célula mioepitelial (CM). Se excluye el cistosarcoma fillodes maligno por no presentar componente epitelial. Con una amplia batería de marcadores inmunohistoquímicos obtenemos positividad focal y en las mismas células para actina (Fig. 2) y keratina de bajo peso molecular (Cam 5,2) (Fig. 3). Este hecho sugiere la naturaleza epitelial o mioepitelial de estos elementos. La naturaleza dual de los elementos del tumor se reafirmó por la expresión de EMA (antígeno de membrana epitelial) y vimentina (filamento intermedio mesenquimal) (Fig. 4). Resultaron también positivos la S-100 y desmina marcadores neural y muscular, respectivamente.
Fig. 1. El tumor está constituido por células fusiformes en bandas entrecruzadas. Destaca el monomorfismo celular y el alto índice mitósico. (*100, hematoxilina-eosina.)
Fig. 2. Algunas células aisladas mostraban gran atipia. Estas células bizarras resultan positivas para actina, que es un marcador de diferenciación muscular lisa. (*100, estreptavidina-biotina para actina músculo liso específica.)
Fig. 3. Las mismas células atípicas que expresan actina expresan además citoqueratina de bajo peso molecular. (*100, estreptavidina-biotina para Cam 5,2.)
Fig. 4. La mayor parte de la células resultan marcadas con marcadores mesenquimales. (*100, estreptavidina biotina para vimentina.)
Por la expresión del tumor de marcadores epiteliales lo consideramos un carcinoma con metaplasia sarcomatoide con células fusiformes (CCF).
La paciente es enviada a otro centro a un Servicio de Oncología, donde se trata con radioterapia local y poliquimioterapia. Un año después de la tumorectomía se detecta una adenopatía axilar y la PAAF (punción-aspiración con aguja fina) confirma su naturaleza metastásica. La insuficiencia cardíaca de la paciente de nuevo limita el abordaje quirúrgico, que se reduce a la extirpación de la masa adenopática axilar. El estudio histológico correspondía a un tumor compuesto también exclusivamente de células de aspecto sarcomatoso con gran pleomorfismo y donde alternan extensas áreas de células fusiformes o fibroblásticas con otras de patrón angiomatoso o mioide. El fenotipo de la nueva muestra resultó similar al descrito previamente para el tumor primario.
Se aplican nuevo tratamiento poliquimioterápico. La paciente presenta un deterioro progresivo de su situación cardiovascular. Ingresa 1 año más tarde por agravamiento de su disnea y un cuadro sincopal. Se evidencia un derrame derecho que no se resuelve con toracocentesis y la paciente fallece por insuficiencia respiratoria.
COMENTARIO
Resulta un hecho clásico el desarrollo de tumores de células fusiformes en la mama..1-5, 7, 8 Desde el desarrollo de la inmunohistoquímica fue posible dividir estas lesiones en dos grandes grupos: los sarcomas, que incluyen aquellos que mostraban exclusivamente marcadores mesenquimales y ausencia de estructuras ductales tumorales;.7 el otro grupo se denominó carcinoma metaplásico, carcinosarcoma, carcinoma con metaplasia sarcomatoide.8 y correspondía a aquellas neoplasias con proporción variable de componente ductal y sarcomatoide donde se demuestra la expresión de marcadores epiteliales..8 En algunos casos el componente ductal es mínimo o ausente, de ahí la dificultad de diferenciarlos de los auténticos sarcomas primarios de la mama. Realizados estudios de revisión se comprobó que gran parte de los casos considerados como sarcomas debían considerarse carcinomas metaplásicos por expresar marcadores epiteliales (queratinas)..1, 7, 8
Dentro de los carcinomas metaplásicos se definen varios subtipos histológicos de características morfológicas, clínicas y evolutivas muy diferentes..1, 2, 8-10 Estas diferencias no fueron apreciables hasta que este grupo no fue dividido en carcinoma escamoso,.8 carcinoma de células fusiformes (CCF),.1, 2carcinoma productor de matriz.8, 9 y carcinoma con componente heterólogo..10
El carcinoma de células fusiformes (CCF) o carcinoma con metaplasia de células fusiformes se ha identificado a veces con las otras variedades de carcinoma metaplásico y consideramos esto un error, puesto que este subtipo se acompaña de mejor pronóstico que otras variedades (por ejemplo, el carcinoma escamoso)..1, 2, 8 Por ello debe restringirse su utilización para los tumores que exhiban los siguientes rasgos: el elemento celular predominante sea una célula fusiforme con moderada atipia, dispuestas en fascículos cortos y altenando con áreas estoriformes; se deben acompañar de un carcinoma ductal o lobulillar en sus formas in situ o infiltrante. Si la lesión carece de carcinoma evidente, la naturaleza epitelial se debe demostrar con inmunohistoquímica y ultraestructura..1, 2, 6, 7 El CCF se caracteriza además por unas cifras de supervivencia a los 5 años del 64% frente a valores de 44% del total de los carcinomas metaplásicos. Por ello se debe tratar de subclasificar según el tipo histológico.
Respecto al origen celular de esta neoplasia se preconiza la naturaleza mioepitelial de estas lesiones. Esta teoría está basada en el inmunofenotipo (positivo para S-100, actina, desmina y queratina) y por el aspecto ultaestructural de estas células fusiformes..1, 5 Las características que definen este tipo celular es una mezcla de célula epitelial y músculo liso. En la membrana celular se aprecian desmosomas en los que confluyen filamentos y en el citoplasma hay abundantes filamentos con áreas densas propias de una célula muscular lisa.
Prácticamente simultáneamente con la revisión de Wargotz,.1 la reclasificación de los carcinomas metaplásicos y definición del CCF, comienzan a publicarse en la literatura médica lesiones mioepiteliales de mama. Estas revisiones incluían menos de cinco casos..11-13 Tavassoli reúne una serie de 31 casos y propone una clasificación para las lesiones constituidas por células mioepiteliales. Se dividen en cuatro grupos: mioe-piteliosis y adenomioepitelioma son las formas benignas y carcinoma adenoide quístico y carcinoma mioepitelial son las formas malignas..3 Tavassoli no incluye en esta clasificación al CCF e incluso se plantea en este trabajo el diagnóstico diferencial entre el carcinoma de células fusiformes y el carcinoma mioepitelial..3, 4 El autor sugiere que la presencia de vesículas de pinocitosis en las células fusiformes sería el criterio principal para reconocer un CM y distinguirlo de un carcinoma de células fusiformes que carece de componente epitelial..3 Otros autores, sin embargo, describen estas vacuolas de pinocitosis en carcinoma de células fusiformes..5Todos coinciden en que se pueden establecer algunas diferencias cuantitativas en el patrón inmunohistoquímico, más expresión de queratina en el carcinoma de células fusiformes y más expresión de S-100 y actina en el carcinoma mioepitelial..1, 3, 5 Tavassoli incluso afirma que en algunos casos es imposible distinguirlos..3 En nuestra opinión, el CCF, donde no se aprecia el componente epitelial, es idéntico a un carcinoma mioepitelial y deberían incluirse en el grupo de lesiones mioepiteliales.
Otra lesión constituida por células mioepiteliales es el tumor fillodes, en el cual el componente epitelial está siempre presente, pero es también siempre benigno. El componente mesenquimal está constituido también por células mioepiteliales y puede ser benigno o mostrar una transformación maligna..6, 14 No entendemos la necesidad de separarlo en otro grupo, puesto que se incluyen en la clasificación de Tavassoli otras lesiones con componente epitelial tanto benigno (adenomioepitelioma) como maligno (carcinoma adenoide quístico)..3 Creemos que todo el grupo de carcinomas de células fusiformes debe contemplarse como un subtipo de lesión dentro de la patología de las células mioepiteliales de la mama.
En un intento de dilucidar si estas disquisiciones deben limitarse al terreno teórico o realmente tienen una significación respecto al tratamiento, hemos revisado los protocolos terapéuticos para las neoplasias derivadas de las células mioepiteliales. La revisión realizada por el grupo de Gutman.15 sobre los carcinomas metaplásicos, incluyendo el CCF, concluye que se comportan de manera diferente a los carcinomas habituales. Estas diferencias se centran en la menor proporción de afectación ganglionar y escasa expresión de receptores hormonales. Parece que el componente sarcomatoide es el que domina el curso clínico. Ellos proponen como tratamiento la mastectomía y un tratamiento adyuvante orientado hacia el componente sarcomatoide de radio y quimioterapia. El mismo grupo de trabajo realizan una revisión del tratamiento de los sarcomas en el cual propugnan una resección tumoral amplia sin resección axilar y un tratamiento oncológico adyuvante específico para cada subtipo de sarcoma. Este tratamiento debe dirigirse al tipo celular que constituya el sarcoma..16 Para el tumor fillodes maligno el tratamiento de elección parece ser la mastectomía amplia sin linfadenectomía..14 Las metástasis se producen por vía hematógena en el 22% de los casos. Se propone un tratamiento semejante al de los sarcomas..6 Tavassoli afirma que el tratamiento para el carcinoma mioepitelial debe ser similar al de un carcinoma ductal infiltrante, puesto que hay pocos casos descritos y no se pueden establecer diferencias por el momento..3Este autor considera que, aunque el diagnóstico diferencial es importante entre el carcinoma de células fusiformes y el carcinoma mioepitelial, si no es posible deben tratarse ambos con mastectomía radical. De todo lo anteriormente referido se desprende que no existe un acuerdo general respecto al tratamiento..1-4, 15, 16 Algunos consideran los carcinomas metaplásicos como sarcomas y otros consideran que tanto la variante de células fusiformes como el carcinoma mioepitelial deben considerarse como carcinomas habituales respecto al tratamiento..1, 3, 5, 14-16
Creemos que el CCF y el CM muestran más semejanzas que diferencias y dado que se originan de un mismo tipo celular debe de contemplarse la posibilidad de incluir el carcinoma de células fusiformes dentro del grupo de tumores de células mioepiteliales. Desde esta perspectiva se deben establecer semejanzas respecto al pronóstico y unificar los criterios de manejo clínico. Además, en nuestra opinión, el tumor fillodes podría incluirse en la clasificación de Tavassolli como un tumor mixto con una clara derivación de células mioepiteliales como el carcinoma adenoide quístico..3, 4
RESUMEN
Presentamos el caso de una paciente 66 años
que presenta un carcinoma con metaplasia sarcomatoide de células fusiformes o carcinoma de células fusiformes. Este subtipo de carcinoma metaplásico muestra un pronóstico relativamente mejor que el resto de carcinomas metaplásicos. Nuestro caso carecía de componente epitelial. En estos casos se plantea el diagnóstico diferencial con el carcinoma mioepitelial descrito recientemente. Ambas lesiones derivan de la célula epitelial y encontramos más semejanzas que diferencias entre ellas. Por ello, planteamos que ambas deben incluirse entre las neoplasias de células mioepiteliales.
REFERENCIAS
1. Wargotz ES, Deos PH, Norris HJ. Metaplastic carcinomas of the breast. II. Spindle cell carcinoma. Hum Pa-thol 1989;20:732-40.
2. Bauer TW, Rostock RA, Eggleston JC, Baral E. Spindle cell carcinoma of the breast: four cases and review of the literature. Hum Pathol 1984;15:147-52.
3. Tavassoli FA. Myoepithelial lesions of the breast. Mioepitheliosis, adenomyoepithelioma and myoepitelial carcinoma. Am J Surg Pathol 1991;15:554-68.
4. Tavassoli FA. Metaplastic carcinoma. En: Pathology of the breast. Nueva York: Elsevier; 1992. p. 349-53.
5. Harb JM, Komorowski RI, Vitali CM. Metaplastic breast carcinoma invading chest wall. Ultrastruct Pathol 1995; 19:439-43.
6. Moffat CJC, Pinder SE, Dixon AR, Elston CW, Blamey RW, Ellis LO. Phyllodes tumours of the breast: a clinicopathological review of thirty-two cases. Histopathol 1995;27:205-18.
7. Rosen PP, Oberman HA. Sarcomas of the breast. Atlas of tumor pathology. Tumors of the mammary gland. Washington DC: AFIP; 1992. p. 315-34.
8. Rosen PP, Oberman HA. Invasive carcinoma. Atlas
of tumor pathology. Tumors of the mammary gland. Washington DC: AFIP; 1992. p. 157-257.
9. Wargotz ES, Norris HJ. Metaplastic carcinomas of the breast. Matrix-producing carcinoma. Hum Pathol 1989;20:628-35.
10. Herrington CS, Tarin D, Buley L, Athanasou N. Osteosarcomatous differentiation in carcinoma of the breast: a case of «metaplastic» carcinoma with osteoclasts and osteoclast-like giant cells. Histopathol 1994;24: 282-5.
11. Bussolati G, Micca B, Eusebi V, Betts CM. Myoepithelial cells in lobular carcinoma in situ of the breast: a parallel immunocytochemical and ultraestructural study. Ultrastruct Pathol 1981;2:219-30.
12. Erlandson RA, Rosen PP. Infiltrating myoepithelioma of the breast. Am J Surg Pathol 1982;6:785-93.
13. Bigotti G, DiGiorgio G. Myoepithelioma of the breast: histologic, immunologic and electronmicroscopic
appearance. J Surg Oncol 1986;32:58-64.
14. Rosen PP, Oberman HA. Fibroepithelial neoplasms. Atlas of tumor pathology. Tumors of the mammary gland. Washington DC: AFIP; 1992. p. 101-7.
15. Gutman H, Pollock RE, Janjan NA, Johnston DA. Biologic distintions and therapeutic implications of sarcomatoid metaplasia of epithelial carcinoma of the breast. J Am Coll Surg 1995;180:193-9.
16. Gutman H, Pollock RE, et al. Sarcoma of the breast: implications for extent of therapy. The M. D. Anderson experience. Surg 1994;116:505-9.