La prescripción de fármacos antipsicóticos en niños y adolescentes se ha convertido en una práctica habitual.
MétodosEste artículo presenta el diseño de un estudio multicéntrico longitudinal a 12 meses con 266 niños y adolescentes a los que se les prescribió por primera vez un antipsicótico de primera o segunda generación y los resultados basales del estudio. El protocolo de seguimiento tuvo como finalidad detectar la posible aparición de cambios metabólicos, cardiológicos y motores.
ResultadosCuando se valoró la presencia de efectos secundarios a través de la UKU (Udvalg für Kliniske Undersogelser) se encontraron diferencias estadísticamente significativas entre pacientes naïve (pacientes incluidos que nunca habían tomado antipsicótico) y quasi-naïve (aquellos que habían tomado antipsicóticos durante un periodo inferior a 30 días), mostrando un mayor número de estos últimos síntomas de: ansiedad/laxitud/fatigabilidad (p=0,0049), somnolencia/sedación (p<0,001), aumento duración sueños (p<0,001), aumento de sueños (p=0,0199), indiferencia emocional (p=0,0194), hipocinesia/acinesia (p=0,0224), parestesias (p=0,0049), trastorno de acomodación (p=0,0254), aumento de la salivación (p<0,001), poliuria/polidipsia (p=0,0076), aumento de la sudoración (p=0,0076), aumento del deseo sexual (p=0,0117), disminución del deseo sexual (p=0,0053), cefaleas tensionales. (p=0,0405). Cuando se valoró la presencia de síntomas extrapiramidales con la MPRC-IMS (Maryland Psychiatry Research Center-Involuntary Movements Scale) se observó que los pacientes quasi-naïve presentaron un número estadísticamente superior de síntomas de discinesia (p=0,002), parkinsonismo (p=0,0004) y acatisia (p=0,0437) con respecto a los naïve.
ConclusionesEstos resultados ponen de manifiesto que en población infanto-juvenil, la presencia de efectos secundarios se comienza a observar ya desde el inicio de la toma de fármacos antipsicóticos.
The prescribing of anti-psychotic drugs has become a normal clinical practice.
MethodsThis article presents a longitudinal, multicentre study of 12 months conducted on 266 children and adolescents who were prescribed a first or second generation antipsychotic drug for the first time, and the baseline results of the study. The follow-up protocol had as its purpose to detect the possible appearance of metabolic, cardiological, and motor changes.
ResultsWhen the presence of side effects was evaluated using the UKU (clinical side-effects scale) statistically significant differences were found between naive (patients who had never taken an anti-psychotic drug) and quasi-naive patients (those who have taken anti-psychotic drugs for a period of less than 30 days), with a greater number of the latter showing symptoms of: anxiety/laxity/tiredness (P=.0049), drowsiness/sedation (P<.001), increase in dream duration (P<.001), increase in dreams (P=.0199), emotional indifference (P=.0194), hypokinesia/akinesia (P=.0224), paresthesias (P=.0049), accommodation disorder (P=.0254), increase in salivation (P<.001), polyuria/polydipsia (P=.0076), increase in sweating (P=.0076), increase in sexual desire (P=.0117), decrease in sexual desire (P=.0053), tension headaches (P=.0405). When the presence of extrapyramidal symptoms was assessed using the MPRC-IMS (Maryland Psychiatry Research Center-Involuntary Movements) Scale, it was observed that the quasi-naïve patients had a statistically higher number of dyskinesia (P=.002), Parkinsonism (P=.0004) and akathisia (P=.0437) symptoms compared to the naïve patients.
ConclusionsThese results show that, in the childhood-adolescent population, the presence of secondary effects begins to be observed from the first dose of the antipsychotic drug.
En los últimos años se ha incrementado la prescripción de fármacos antipsicóticos, tanto para los trastornos psicóticos como para otros trastornos mentales en niños y adolescentes1–5. Pese a las escasas indicaciones de estos tratamientos en este grupo de edad6,7, esta práctica se ha convertido en habitual en la clínica psiquiátrica, especialmente en el caso de los antipsicóticos de segunda generación (ASG)8–11.
Estudios sobre la prevalencia del uso de antipsicóticos en población pediátrica, han puesto de manifiesto un descenso progresivo del uso de antipsicóticos de primera generación (APG)12, acompañado de un incremento significativo de las prescripciones de ASG2,11. Un estudio realizado en Reino Unido halló un aumento en las prescripciones de ASG en población infanto-juvenil de casi 60 veces (pasando de 0,01 usuarios por 1.000 pacientes en 1994, frente a 0,61 usuarios por 1.000 pacientes en 2005)12. De igual modo, otro estudio llevado a cabo en Estados Unidos encontró un incremento del 160% en los años comprendidos entre 1990 y 20007. Este incremento se ha observado, no solo en las prescripciones, sino también en el periodo de exposición a estos fármacos (pasando de 0,8 meses en 1998-1999 a 1,6 meses en 2001)13.
Los datos obtenidos hasta la fecha han demostrado que los ASG en conjunto tienen menos efectos neurológicos motores adversos, que los APG en población infanto-juvenil4,5,14; por el contrario la mayor parte de ellos se asocian a un incremento en el riesgo de complicaciones metabólicas (obesidad, diabetes mellitus tipo ii, dislipemias y alteraciones cardiovasculares)4,5,14–17.
Un aspecto relevante que ha sido recogido en la literatura actual es la estabilidad temporal de los efectos secundarios metabólicos entre los diferentes fármacos antipsicóticos. En un estudio realizado con adolescentes y adultos, a los 3 meses de tratamiento con antipsicóticos (olanzapina, risperidona y haloperidol) se apreció un incremento de peso, mayor en el grupo de olanzapina (olanzapina>risperidona> haloperidol)18. En cambio, cuando se comparó el incremento de peso transcurridos 12 meses de tratamiento no se obtuvieron diferencias estadísticamente significativas entre los 3 grupos. En un estudio llevado a cabo con adolescentes con un primer episodio psicótico tratados con olanzapina o quetiapina, tras 6 meses de seguimiento, el grupo tratado con olanzapina tuvo un aumento mayor de peso que el grupo tratado con quetiapina (olanzapina Δ 15,5kg; quetiapina Δ 5,5kg); resultados similares se obtuvieron en el índice de masa corporal (IMC) (olanzapina Δ 5,4 puntos; quetiapina Δ1,8 puntos)19. Otro estudio realizado con niños y adolescentes tratados con olanzapina o quetiapina o risperidona, halló un incremento significativo de peso en el 50% de la muestra a los 6 meses de seguimiento e incrementos estadísticamente significativos en el IMC z-score, tanto en el grupo de olanzapina como en el de risperidona16. Datos similares se obtuvieron en otro estudio longitudinal a 12 meses realizado en población infanto-juvenil naïve. En este trabajo se observó el mismo efecto en el IMC z-score en los 3 grupos de tratamiento (olanzapina, quetiapina y risperidona) a los 12 meses de seguimiento, siendo este incremento significativamente mayor en los 6 primeros meses de tratamiento20.
Respecto a los efectos secundarios metabólicos en población pediátrica es importante tener en cuenta el hecho de que los trastornos psicóticos suponen un mayor riesgo per se asociado a la aparición de complicaciones metabólicas, según avalan estudios realizados en adultos21. En un estudio publicado recientemente con niños y adolescentes se observó una mayor incidencia de sobrepeso asociado a alguna complicación de la obesidad (hipertensión, dislipemia o hiperglicemia) asociado al tratamiento con ASG en adolescentes naïve con diagnóstico de trastorno bipolar, que en sujetos con cualquier otro diagnóstico22. No obstante, en este mismo estudio la media de aumento de peso tras 3 meses de tratamiento con ASG fue de 5,5 kg, no encontrándose diferencias por diagnóstico, lo que indica que los ASG influyen negativamente en los parámetros metabólicos de los menores independientemente de la patología que presenten.
Teniendo en cuenta que la población pediátrica es más vulnerable que la adulta a los efectos secundarios de los fármacos antipsicóticos, y además es más sensible al impacto negativo que dichos efectos ejercen sobre la imagen corporal o la autoestima8, se hace evidente incrementar los esfuerzos en investigación que aborden estos aspectos.
A pesar de los estudios realizados quedan importantes datos por conocer. La mayoría de las investigaciones están hechas con pacientes que han estado expuestos a antipsicóticos, durante periodos más o menos largos, antes de su inclusión en los estudios. Este hecho introduce factores de confusión en la interpretación de los datos. Además, los estudios recogidos hasta el momento en la literatura incluyen periodos de seguimiento cortos16,19,23; esto constituye una limitación para conocer si los efectos secundarios se estabilizan, si mejoran o desaparecen, o si por el contrario continúan aumentando a lo largo de todo el periodo de exposición.
A partir de los datos expuestos parece necesario ampliar y profundizar en el estudio de la relación causal entre la aparición de efectos adversos y la administración de los fármacos antipsicóticos en población pediátrica.
Este estudio pretende proporcionar el protocolo de seguimiento de un estudio cuya finalidad es medir la posible aparición de cambios metabólicos, cardiológicos y motores a lo largo de 12 meses de seguimiento, en niños y adolescentes a los que se les ha prescrito por primera vez fármacos antipsicóticos de primera y segunda generación. Así mismo se describen los resultados basales de dicho estudio.
Nuestra hipótesis de estudio fue que aquellos pacientes que en la visita basal ya estaban con tratamiento antipsicótico, presentarían un mayor número de efectos secundarios propios de la medicación antipsicótica que aquellos que en el momento de inclusión en el estudio eran pacientes naïve a tratamiento antipsicótico.
Material y métodosMuestraSe llevó a cabo un estudio observacional, longitudinal, naturalístico y multicéntrico en el que participaron 4 hospitales españoles: Hospital General Universitario Gregorio Marañón de Madrid (HGUGM), Hospital Clínic de Barcelona, Hospital Infantil Universitario Niño Jesús de Madrid y Hospital Sant Joan de Déu de Barcelona. Fueron incluidos pacientes tratados en consultas externas y pacientes en régimen de hospitalización. El reclutamiento se realizó entre mayo de 2005 y febrero de 2009.
Los criterios de inclusión en el estudio fueron: (1) niños y adolescentes con edades comprendidas entre los 4 los 17 años, (2) cualquier diagnóstico psiquiátrico de acuerdo a los criterios diagnósticos del Manual Estadístico de Trastornos Mentales en su cuarta edición (DSM-IV)24, (3) prescripción médica de tratamiento antipsicótico, tanto de primera como de segunda generación y (4) periodo de toma del antipsicótico inferior a 30 días en el momento de inclusión en el estudio.
Los pacientes incluidos en el estudio que nunca habían tomado antipsicóticos fueron clasificados como naïve, y aquellos que habían tomado antipsicóticos durante un periodo inferior a 30 días a la inclusión del estudio se clasificaron como quasi-naïve.
Consideraciones éticasEste estudio fue aprobado por el Comité de Ética e Investigación Clínica de cada uno de los hospitales que colaboraron en el reclutamiento. Se obtuvo consentimiento informado por escrito de los padres/tutores legales de los participantes y el asentimiento de los menores garantizando la confidencialidad de los datos. Se ofreció la posibilidad de plantear aquellas preguntas que los participantes y/o sus tutores juzgasen necesarias así como la libertad de abandonar el estudio en el momento que lo considerasen.
Seguimiento del estudioEl seguimiento del estudio de los pacientes se fijó a un año, con un total de 5 visitas (basal, un mes, 3 meses, 6 meses y 12 meses). Cada uno de los pacientes era citado a través de llamada telefónica. La cita para la visita correspondiente no podía sobrepasar la ventana establecida para el estudio (un tercio del periodo inter-visita). Concretamente las ventanas para las visitas 1, 3, 6 y 12 meses se fijaron en: ±10, ±20, ±30 y ±60 días respectivamente.
Los datos demográficos, antecedentes médicos personales del paciente, antecedentes médico-psiquiátricos familiares, hábitos tóxicos, así como la historia previa de distonías y síntomas extrapiramidales asociados a cualquier medicación, se recogieron en la visita basal por medio de una entrevista estructurada diseñada para el estudio, con los pacientes y sus padres o representantes legales. Todos estos datos exceptuando los antecedentes médico-psiquiátricos familiares fueron recogidos en el resto de visitas para controlar posibles cambios. Los diagnósticos fueron realizados por psiquiatras especializados en población infanto-juvenil de acuerdo a los criterios diagnósticos del DSM-IV24.
Los antecedentes médicos personales recogidos fueron: faringitis estreptocócica de repetición; fiebre reumática; traumatismo craneoencefálico (TCE) con pérdida de conciencia; transfusión sanguínea; encefalitis/meningitis; convulsiones/epilepsia; enfermedades cardiológicas; dislipemias; diabetes mellitus; sobrepeso/obesidad; alergias/asma; artritis; exposición fetal a drogas/alcohol; psicosis actual; psicosis pasada; terapia electroconvulsiva (TEC) previa; sin antecedentes médicos: siempre sano; tomografía axial computerizada (TAC)/resonancia magnética (RM) (hallazgos encontrados); otras enfermedades (especificando cuáles).
Los antecedentes médicos familiares recogidos fueron: faringitis estreptocócica de repetición; fiebre reumática; enfermedad de Huntington; enfermedad de Parkinson; síndrome de Gilles de la Tourette; diabetes mellitus; dislipemias; sobrepeso/obesidad; enfermedades cardiológicas; trastornos afectivos; trastornos psicóticos; otras enfermedades de la familia (especificando cuáles). En todos estos casos se registraba si estaba o no presente la patología y quién era el familiar afecto.
Al finalizar el estudio se cumplimentó una hoja de finalización en la que se registró la fecha en la que el paciente acabó su participación en el estudio. En el caso en que la interrupción fuera de forma anticipada se registró el motivo (pérdida de seguimiento; pérdida de seguimiento pero continuación con la medicación; remisión de los síntomas; falta de colaboración del paciente; mala cumplimentación persistente; intolerancia; ausencia de respuesta clínica/intolerancia; ingreso hospitalario psiquiátrico; fallecimiento (especificando la causa); otros (especificando la causa).
Medidas biológicasLa talla, peso, perímetro abdominal, extracción sanguínea (incluyendo hemograma, parámetros bioquímicos y hormonales), tensión arterial y electrocardiograma (ECG) de cada paciente fueron recogidos por el equipo de enfermería. Este protocolo se aplicó en todas las visitas de seguimiento del estudio, exceptuando la visita del mes en la que se realizaron todas las pruebas excepto el ECG y la extracción sanguínea.
Entre los parámetros bioquímicos se obtuvieron la glucosa en ayunas (ingesta previa 9 horas antes de la extracción), triglicéridos, colesterol total, lipoproteína de alta densidad (HDL), lipoproteína de baja densidad (LDL), hemoglobina glicosilada A1c (HbA1c), y homocisteína. La glucosa en sangre, el colesterol total, HDL, LDL, y los triglicéridos fueron determinados mediante procedimientos enzimáticos con el Analizador Químico Automático de Boehringer Mannheim/Hitachi 714 (Boehringer Mannheim Diagnostics, Inc., Indianapolis, Ind.): 1) test para la Glucosa (Roche Diagnostics, Mannheim, Alemania); 2) test para el colesterol (Boehringer Mannheim Diagnostics, Indianapolis, Ind.). La HbA1c fue analizada mediante cromatografía líquida de alta resolución (High Performance Liquid Chromatography, HPLC) Adams HA-8186, (Menarini, Zaventem, Bélgica). Además, el Hospital Clínic obtuvo los valores de homocisteina por inmunoensayo con fluorescencia (Abbot: AXSYM). El laboratorio de cada uno de los hospitales clasificó los datos obtenidos teniendo en cuenta los criterios de normalidad (máximo y mínimo) establecidos para cada uno de los parámetros.
Los parámetros hormonales medidos fueron tirotropina u hormona estimulante del tiroides (TSH), tiroxina libre (T4L), adiponectina, leptina y grelina. TSH y FT4 fueron medidas por radioinmunoensayo (Diagnostic Product Corporation, Los Ángeles, California). Los valores de adiponectina y leptina fueron realizados únicamente en el HGUGM y en el Clínic de Barcelona. En el HGUGM los valores de adiponectina fueron obtenidos en duplicados por Enzyme-Linked Immuno Sorbent Assay ELISA (BioVendor, ref: RD195023100), y los de leptina en duplicados por Enzyme-Linked Immuno Sorbent Assay ELISA (BioVendor, ref: RD191001100). En el Hospital Clínic de Barcelona los valores de leptina y adiponectina fueron obtenidos por radioinmunoensayo (Linco Research, St. Charles, MO). Además el Hospital Clínic obtuvo las medidas de grelina por radio-inmunoensayo (Ghrelin-Total RIA Kit; Linco Research).
El peso y la talla fueron medidos siempre con la misma báscula de escala Romana en cada hospital. Las básculas utilizadas por el HGUGM, Clínic, HNJ y HSJD fueron: Asimed S.A.; SosPanduri; Soehnle; Vogel & Halke Hamburg Model 701; SECA 220, respectivamente. El peso se registró en kilogramos (kg) y la altura en metros. A partir de estos datos se calculó el IMC, entendido como: peso en kilogramos/altura en metros al cuadrado [kg/m2]. Teniendo en cuenta que el rango de edad de inclusión en el estudio era muy amplio (4-17 años) y que los niños y adolescentes estaban en pleno desarrollo también calculamos el z-score del IMC de acuerdo a las tablas normativas españolas25.
El ECG se realizó con el paciente en reposo y en decúbito supino con el mismo electrocardiógrafo en cada hospital. Los electrocardiógrafos utilizados en el HGUGM, Clínic, HNJ y HSJD fueron: Delta 1Plus Digital Electrocardiogram; Siemens Scard 440; Delta 1Plus Digital Electrocardiogram y Bio-Tek (Lionheart-1), respectivamente. Los parámetros obtenidos con el ECG fueron: ritmo ventricular (latidos por minuto, lpm), PR (ms), QRS (ms), QTC (ms).
El perímetro abdominal se midió en todos los centros de acuerdo al protocolo que utiliza la Sociedad Española para el Estudio de la Obesidad (SEEDO). Se determina con una cinta métrica flexible, milimetrada, con el sujeto en bipedestación, sin ropa y relajado. Se localizó el borde superior de las crestas ilíacas y por encima de ese punto rodeó la cintura con la cinta métrica, de manera paralela al suelo, asegurando que la cinta esté ajustada pero sin comprimir la piel. La lectura se realizó al final de una espiración normal. Se hallaron los percentiles del perímetro abdominal de todos los pacientes siguiendo las tablas españolas elaboradas para niños y adolescentes26.
La tensión arterial fue tomada con el paciente en reposo con el mismo tensiómetro en cada hospital. Los tensiómetros utilizados en el HGUGM, Clínic, HNJ y HSJD fueron: tensiómetro digital OMRON M 6 (HEM-700-1E); OMRON M 6 (HEM-700-1E); Vital Signs Monitor 300 series (Welch Allyn) P/N 810-1707-00; HARTMANN TENSOVAL, respectivamente. La tensión arterial fue valorada en cada uno de los pacientes empleando los percentiles propuestos por The International Task Force for BP27.
TratamientoEn cada una de las visitas se registró de forma exhaustiva la medicación antipsicótica prescrita al paciente, anotándose, tanto los cambios de antipsicótico como los cambios de dosis. De igual modo se registró toda la medicación concomitante que estuviera recibiendo el paciente (antidepresivos, estimulantes, benzodiacepinas, estabilizantes, y anticolinérgicos). En cada una de las visitas se hicieron las conversiones de las dosis de los fármacos antipsicóticos a equivalentes de clorpromazina28. De todos los pacientes se registró la dosis diaria de ingesta de los antipsicóticos en cada visita y posteriormente se calcularon las dosis acumuladas durante el periodo transcurrido entre una visita y otra (dosis x días de exposición).
La adherencia al tratamiento antipsicótico se determinó utilizando la medición de los niveles plasmáticos del antipsicótico mediante HPLC (Alliance 2695) en el HGUGM y en el Hospital Clínic de Barcelona. El resto de centros se basaron en el criterio de los psiquiatras al no disponer de dicha técnica. Los criterios de continuación en el estudio fueron que los pacientes tuvieran una adecuada adherencia al tratamiento y que estuvieran tomando antipsicóticos durante un periodo de 12 meses.
Consumo de tóxicosEl registro del consumo de tóxicos se realizó a través de una entrevista diseñada para el estudio, en la que se preguntaba al paciente sus hábitos tóxicos con respecto al tabaco, alcohol, cannabis, cocaína, opiáceos, anfetaminas y derivados, dietilamida de ácido lisérgico (LSD), inhalantes y otros (especificando cuáles). En todos los casos se registró si había o no consumo y en caso de que lo hubiera el patrón de consumo del paciente (a diario, fin de semana, ocasional). En el caso del consumo de tabaco se registró también el número de cigarrillos diarios.
Escalas clínicasEn cada una de las visitas se evaluó el estado de desarrollo puberal de los pacientes, así como la presencia de efectos secundarios y de movimientos involuntarios provocados por los fármacos antipsicóticos.
Evaluación del desarrollo puberalPara la evaluación del desarrollo puberal se utilizaron las tablas diseñadas por Tanner29,30; que divide en 5 grados el desarrollo mamario, y el de vello púbico y genital. Estas tablas son usadas universalmente y permiten una evaluación objetiva de la progresión puberal. Durante la evaluación era el propio paciente el que señalaba el estadío en el cual se encontraba, exceptuando el caso de los niños más pequeños, en el que eran los padres o tutores/representantes legales que los acompañaban a la consulta quienes facilitaban la información.
Evaluación de efectos secundarios de la medicación antipsicóticaPara evaluar la presencia de efectos secundarios se empleó la escala UKU (Udvalg für Kliniske Undersogelser)31. Esta escala es una medida integral de los efectos adversos psicológicos y físicos que la ingesta de fármacos psicotrópicos produce; está constituida por 48 ítems agrupados en: efectos adversos psicológicos, neurológicos, autonómicos y otros síntomas (dermatológicos, fotosensibilidad, aumento/disminución de peso, hormonales, sexuales, cefaleas, dependencia física/psíquica al fármaco). Para determinar la gravedad del síntoma los ítems se puntúan de 0 a 3 puntos (0: indica ausencia o dudosa presencia del síntoma; 1: leve; 2: moderada y 3: grave; 9: no evaluado). La posible relación causal de la medicación con los síntomas se evalúa asignando a estos ítems de 0 a 2 puntos (0: indica improbable; 1: posible y 2: probable).
La UKU fue administrada mediante una entrevista semi-estructurada por psicólogos y psiquiatras entrenados.
Evaluación de movimientos involuntariosPara evaluar la presencia de movimientos involuntarios se utilizó la Maryland Psychiatry Research Center-Involuntary Movements Scale (MPRC-IMS)32. La escala está constituida por 28 ítems y estructurada topográficamente en las siguientes áreas corporales: lengua, región perioral, ojos y región periorbitaria, rostro y mandíbula, dedos y muñecas, brazos y codos, cuello, hombros y cabeza, muslos y rodillas, piernas y pies, movimiento y tensión de los brazos, marcha, cintura, y respiración.
Estos ítems miden la presencia de 2 síntomas extrapiramidales (discinesia y parkinsonismo) relacionados con la ingesta de fármacos antipsicóticos. Cada uno de los ítems se puntúa de 0 a 7 puntos (0-1: nada; 2-3: leve; 4-5: moderado; 6-7: severo).
La valoración global de discinesia y parkinsonismo se obtiene sumando las puntuaciones de los 14 ítems que constituyen cada una de las subescalas. La MPRC-IMS permite también evaluar de forma global la acatisia a través de la observación subjetiva efectuada por el psiquiatra/psicólogo a lo largo de la exploración.
Para la administración de la MPRC-IMS, una de las psiquiatras fue entrenada por los autores de la escala obteniendo coeficientes de correlación inter-clases (CCI) de 0,8 a 0,9 en los diferentes ítems que constituyen la escala. Posteriormente el resto de psicólogos y psiquiatras que participaron en la valoración pasaron por el mismo entrenamiento exigiéndoles un CCI mínimo de 0,8 en cada ítem para poder realizar la aplicación.
Análisis estadísticoSe realizaron análisis descriptivos o de frecuencias dependiendo de si las variables eran continuas o discretas respectivamente. Se analizó si existían diferencias estadísticamente significativas entre el grupo naïve y quasi-naïve a nivel basal en las variables de edad, sexo, raza y diagnóstico; para ello se realizó una t de student para la edad y una χ2 para el resto de variables (sexo, raza y diagnóstico). Se comparó la presencia de efectos secundarios entre los grupos naïve y quasi-naïve controlando por el diagnóstico, para ello se realizó un Cochran-Mantel-Haenszel. Para estos análisis se usó el paquete estadístico SPSS 18.0 para Windows. Los test estadísticos se realizaron a 2 colas, y con un valor de p < 0,05 de significación estadística.
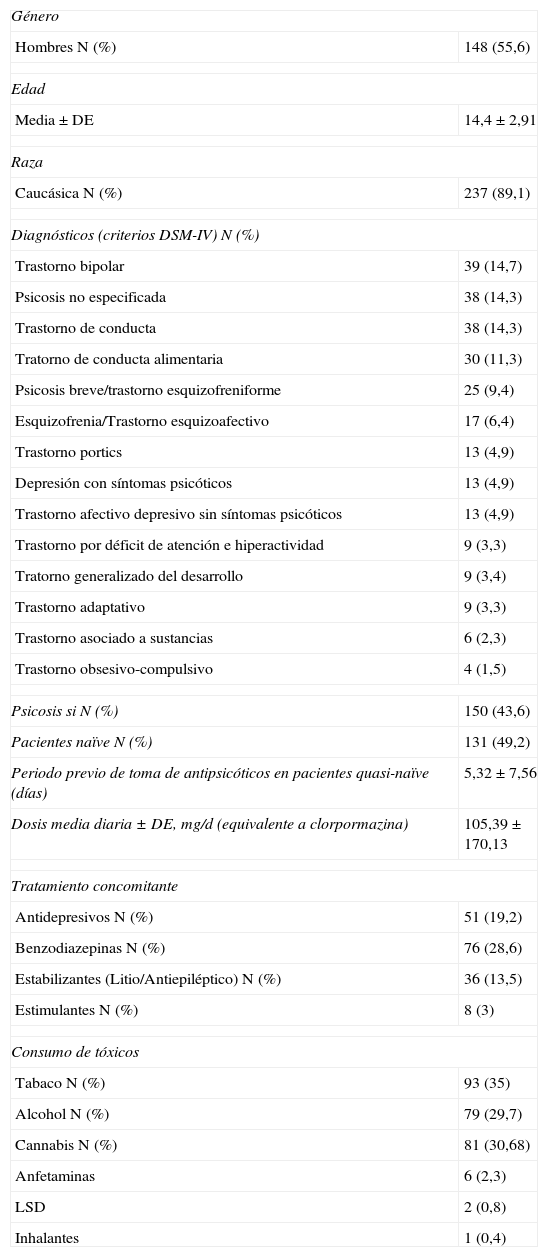
ResultadosEl número de pacientes incluidos en el estudio fue de 266 niños y adolescentes (tabla 1). Los análisis descriptivos de la muestra aparecen en la tabla 2.
Descriptivos basales de la muestra (N=266)
| Género | |
| Hombres N (%) | 148 (55,6) |
| Edad | |
| Media±DE | 14,4 ± 2,91 |
| Raza | |
| Caucásica N (%) | 237 (89,1) |
| Diagnósticos (criterios DSM-IV) N (%) | |
| Trastorno bipolar | 39 (14,7) |
| Psicosis no especificada | 38 (14,3) |
| Trastorno de conducta | 38 (14,3) |
| Tratorno de conducta alimentaria | 30 (11,3) |
| Psicosis breve/trastorno esquizofreniforme | 25 (9,4) |
| Esquizofrenia/Trastorno esquizoafectivo | 17 (6,4) |
| Trastorno portics | 13 (4,9) |
| Depresión con síntomas psicóticos | 13 (4,9) |
| Trastorno afectivo depresivo sin síntomas psicóticos | 13 (4,9) |
| Trastorno por déficit de atención e hiperactividad | 9 (3,3) |
| Tratorno generalizado del desarrollo | 9 (3,4) |
| Trastorno adaptativo | 9 (3,3) |
| Trastorno asociado a sustancias | 6 (2,3) |
| Trastorno obsesivo-compulsivo | 4 (1,5) |
| Psicosis si N (%) | 150 (43,6) |
| Pacientes naïve N (%) | 131 (49,2) |
| Periodo previo de toma de antipsicóticos en pacientes quasi-naïve (días) | 5,32 ± 7,56 |
| Dosis media diaria ± DE, mg/d (equivalente a clorpormazina) | 105,39 ± 170,13 |
| Tratamiento concomitante | |
| Antidepresivos N (%) | 51 (19,2) |
| Benzodiazepinas N (%) | 76 (28,6) |
| Estabilizantes (Litio/Antiepiléptico) N (%) | 36 (13,5) |
| Estimulantes N (%) | 8 (3) |
| Consumo de tóxicos | |
| Tabaco N (%) | 93 (35) |
| Alcohol N (%) | 79 (29,7) |
| Cannabis N (%) | 81 (30,68) |
| Anfetaminas | 6 (2,3) |
| LSD | 2 (0,8) |
| Inhalantes | 1 (0,4) |
DE: desviación estandar; Quasi-naïve: pacientes que habíantomado antipsicóticos durante un periodo inferior a 30 días previos a la inclusión en el estudio; LSD: dietilamidade ácido lisérgico; Naïve: pacientes que previamente a la inclusión en el estudio no habían tomado antipsicóticos.
Del total de la muestra analizada, el 72,9% (n=194) fueron reclutados durante su ingreso hospitalario. El resto provenía de las consultas externas de psiquiatría.
El análisis de los antecedentes médicos personales registrados en la visita basal de todos los pacientes proporcionó los siguientes resultados: 43,6% sin antecedentes médicos: siempre sano; 38% psicosis actual; 24,1% alergias/asma; al 19,5% se les había realizado alguna vez TAC/RM; 11,3% faringitis estreptocócica de repetición; 8,3% TCE con pérdida de conciencia; 7,9% sobrepeso/obesidad; 7,1% psicosis pasada; 4,5% convulsiones/epilepsia; 3% encefalitis/meningitis; 2,6% fiebre reumática; 2,6% enfermedades cardiológicas; 1,1% transfusión sanguínea; 0,8% dislipemias; 0,8% exposición fetal a drogas/alcohol; 0,4% diabetes mellitus; 0,4% artritis.
Los antecedentes médicos familiares registrados en la visita basal de todos los pacientes, expresados en porcentajes incluyen, al menos, un familiar con las siguientes patologías: 42,49% trastornos afectivos; 24,43% enfermedades cardíacas; 23,68% diabetes; 22,18% sobrepeso/obesidad; 15,41% trastornos psicóticos; 12,78% faringitis estreptocócica múltiple; 4,14% Parkinson; 3,53% dislipemias; 3,38% fiebre reumática; 1,5% síndrome de Tourette; 0,36% corea de Huntington.
Medidas biológicasLa media y desviación estándar (DE) del IMC basal de la muestra fue de 20,22 ±3,59kg/m2, y del perímetro abdominal fue de 74,61 ±10,71cm. En el caso de la tensión arterial la tensión arterial sistólica (TAS) media a nivel basal fue 113,43 ±16,31mm Hg y la tensión arterial diastólica (TAD) fue de 65,19 ±12,00mm Hg.
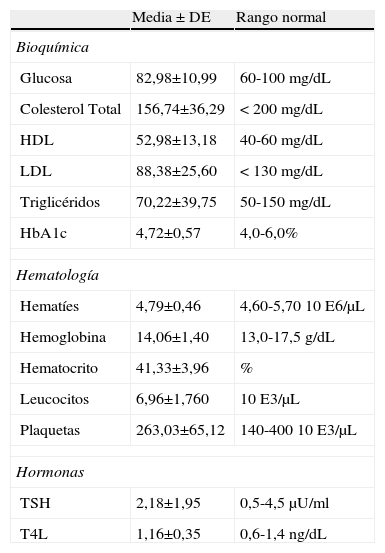
En la tabla 3 se presentan las medias y desviaciones estándar (DE) de los datos bioquímicos y hematológicos obtenidos en la extracción sanguínea.
Resultados bioquímicos y hematológicos basales
| Media ± DE | Rango normal | |
| Bioquímica | ||
| Glucosa | 82,98±10,99 | 60-100 mg/dL |
| Colesterol Total | 156,74±36,29 | < 200 mg/dL |
| HDL | 52,98±13,18 | 40-60 mg/dL |
| LDL | 88,38±25,60 | < 130 mg/dL |
| Triglicéridos | 70,22±39,75 | 50-150 mg/dL |
| HbA1c | 4,72±0,57 | 4,0-6,0% |
| Hematología | ||
| Hematíes | 4,79±0,46 | 4,60-5,70 10 E6/μL |
| Hemoglobina | 14,06±1,40 | 13,0-17,5 g/dL |
| Hematocrito | 41,33±3,96 | % |
| Leucocitos | 6,96±1,760 | 10 E3/μL |
| Plaquetas | 263,03±65,12 | 140-400 10 E3/μL |
| Hormonas | ||
| TSH | 2,18±1,95 | 0,5-4,5 μU/ml |
| T4L | 1,16±0,35 | 0,6-1,4 ng/dL |
DE: desviación estándar; HDL: lipoproteína de alta densidad; HbA1c: hemoglobina glicosilada; LDL:l ipoproteína de baja densidad; TSH: tirotropina hormona estimulante del tiroides; T4L: tiroxina libre.
La leptina basal fue recogida por el HGUGM y Hospital Clínic en 122 pacientes cuya media y DE fue de 9,91±12,92ng/mL y la adiponectina en 101 pacientes con una media y una DE de 11,43±4,64μg/mL. La grelina y homocisteína basal fueron recogidas por el Clínic en 35 y 61 pacientes respectivamente. Las medias y DE obtenidas en ambos parámetros fueron de 1.095,94±408,15pg/mL en el caso de la grelina y 9,7±5,68μmol/l en el caso de la homocisteina. Se eliminaron 6 visitas de 6 pacientes en los que se comprobó la ausencia de niveles plasmáticos de antipsicótico.
TratamientoAl inicio del estudio, el 49,2% (n=131) eran pacientes naïve para antipsicóticos. El resto de pacientes, denominados quasi-naive, (50,8%) recibieron tratamiento de antipsicóticos de primera generación (haloperidol=3, pimozida=1 y clorpromazina=3) o de segunda generación (risperidona=79, olanzapina=29, quetiapina=19 y aripiprazol=1). Se midieron los niveles plasmáticos de antipsicóticos en 87 niños y adolescentes (32,7%) para comprobar si tenían una buena adherencia al tratamiento antipsicótico prescrito. Todos los pacientes analizados presentaron una buena adherencia. En el grupo de pacientes quasi-naïve la media de días de exposición a antipsicóticos previa inclusión al estudio fue inferior a 6 días (tabla 2). El 2,3% de los pacientes recibieron tratamiento combinado de 2 antipsicóticos con una dosis media en equivalentes a clorpromazina del segundo antipsicótico prescrito de 361,59± 265,87mg.
A nivel basal no se encontraron diferencias estadísticamente significativas entre el grupo naïve y quasi-naïve en las variables de edad (t: 1,342; p= 0,181), sexo (χ2: 0,048; p=0,827) y raza (χ2: 5,157; p= 0,524), pero sí que se encontraron en diagnóstico (χ2: 24,845; p=0,036); existiendo un mayor número de pacientes con diagnóstico de psicosis en el grupo quasi-naïve. No se detectaron diferencias significativas entre ambos grupos en la tensión arterial sistólica ni en la tensión arterial diastólica, en el peso o el IMC. Con respecto a los parámetros analíticos únicamente se detectaron diferencias en la prolactina (grupo naïve 19,8, SD 13.1 frente a grupo quasi-naïve 37,7, SD 23.8; t=6,8, p<0,001).
Los psicofármacos administrados como tratamiento concomitante fueron: antidepresivos, estabilizantes del ánimo (litio y antiepilépticos), benzodiacepinas y estimulantes (tabla 2).
Consumo de tóxicosEn cuanto al consumo de tóxicos el 35% (n=93) consumía tabaco en el momento de la visita basal, con una media de 4,46 cigarrillos/día, siendo el patrón más común de consumo en fin de semana (n=44; 16,5%). El tiempo medio de consumo previo a la visita basal fue de 6,48±12,6 meses.
El consumo del resto de tóxicos registrados fue: cannabis el 30,68%, el patrón de consumo más frecuente fue a diario (16,66%); cocaína el 6,8%, el patrón de consumo más frecuente fue ocasional (4,1%); anfetaminas el 2,3%, LSD el 0,8%, inhalantes el 0,4%. Estos 3 últimos tóxicos (anfetaminas, LSD e inhalantes) presentaban un patrón de consumo ocasional. Ningún paciente comunicó consumo de opiáceos.
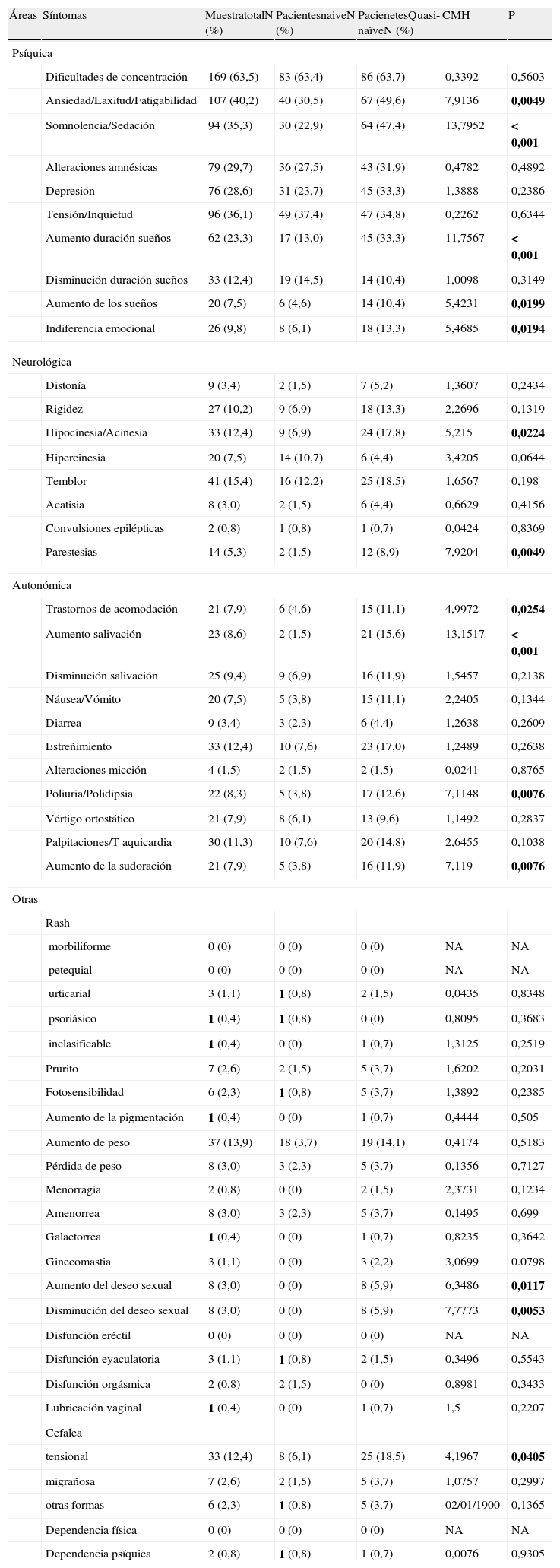
Escalas clínicasEvaluación de efectos secundarios de la medicación antipsicóticaEn la tabla 4 aparecen los resultados basales obtenidos en la escala UKU de todos aquellos pacientes que obtuvieron al menos una puntuación de leve en los síntomas evaluados. Para un análisis más exhaustivo se analizó por un lado la muestra completa y por otra diferenciando entre pacientes naïve y quasi-naïve controlando por diagnóstico basal.
Puntuaciones basales de la escala UKU (Udvalg für Kliniske Undersogelser)
| Áreas | Síntomas | MuestratotalN (%) | PacientesnaiveN (%) | PacienetesQuasi-naïveN (%) | CMH | P |
| Psíquica | ||||||
| Dificultades de concentración | 169 (63,5) | 83 (63,4) | 86 (63,7) | 0,3392 | 0,5603 | |
| Ansiedad/Laxitud/Fatigabilidad | 107 (40,2) | 40 (30,5) | 67 (49,6) | 7,9136 | 0,0049 | |
| Somnolencia/Sedación | 94 (35,3) | 30 (22,9) | 64 (47,4) | 13,7952 | <0,001 | |
| Alteraciones amnésicas | 79 (29,7) | 36 (27,5) | 43 (31,9) | 0,4782 | 0,4892 | |
| Depresión | 76 (28,6) | 31 (23,7) | 45 (33,3) | 1,3888 | 0,2386 | |
| Tensión/Inquietud | 96 (36,1) | 49 (37,4) | 47 (34,8) | 0,2262 | 0,6344 | |
| Aumento duración sueños | 62 (23,3) | 17 (13,0) | 45 (33,3) | 11,7567 | <0,001 | |
| Disminución duración sueños | 33 (12,4) | 19 (14,5) | 14 (10,4) | 1,0098 | 0,3149 | |
| Aumento de los sueños | 20 (7,5) | 6 (4,6) | 14 (10,4) | 5,4231 | 0,0199 | |
| Indiferencia emocional | 26 (9,8) | 8 (6,1) | 18 (13,3) | 5,4685 | 0,0194 | |
| Neurológica | ||||||
| Distonía | 9 (3,4) | 2 (1,5) | 7 (5,2) | 1,3607 | 0,2434 | |
| Rigidez | 27 (10,2) | 9 (6,9) | 18 (13,3) | 2,2696 | 0,1319 | |
| Hipocinesia/Acinesia | 33 (12,4) | 9 (6,9) | 24 (17,8) | 5,215 | 0,0224 | |
| Hipercinesia | 20 (7,5) | 14 (10,7) | 6 (4,4) | 3,4205 | 0,0644 | |
| Temblor | 41 (15,4) | 16 (12,2) | 25 (18,5) | 1,6567 | 0,198 | |
| Acatisia | 8 (3,0) | 2 (1,5) | 6 (4,4) | 0,6629 | 0,4156 | |
| Convulsiones epilépticas | 2 (0,8) | 1 (0,8) | 1 (0,7) | 0,0424 | 0,8369 | |
| Parestesias | 14 (5,3) | 2 (1,5) | 12 (8,9) | 7,9204 | 0,0049 | |
| Autonómica | ||||||
| Trastornos de acomodación | 21 (7,9) | 6 (4,6) | 15 (11,1) | 4,9972 | 0,0254 | |
| Aumento salivación | 23 (8,6) | 2 (1,5) | 21 (15,6) | 13,1517 | <0,001 | |
| Disminución salivación | 25 (9,4) | 9 (6,9) | 16 (11,9) | 1,5457 | 0,2138 | |
| Náusea/Vómito | 20 (7,5) | 5 (3,8) | 15 (11,1) | 2,2405 | 0,1344 | |
| Diarrea | 9 (3,4) | 3 (2,3) | 6 (4,4) | 1,2638 | 0,2609 | |
| Estreñimiento | 33 (12,4) | 10 (7,6) | 23 (17,0) | 1,2489 | 0,2638 | |
| Alteraciones micción | 4 (1,5) | 2 (1,5) | 2 (1,5) | 0,0241 | 0,8765 | |
| Poliuria/Polidipsia | 22 (8,3) | 5 (3,8) | 17 (12,6) | 7,1148 | 0,0076 | |
| Vértigo ortostático | 21 (7,9) | 8 (6,1) | 13 (9,6) | 1,1492 | 0,2837 | |
| Palpitaciones/T aquicardia | 30 (11,3) | 10 (7,6) | 20 (14,8) | 2,6455 | 0,1038 | |
| Aumento de la sudoración | 21 (7,9) | 5 (3,8) | 16 (11,9) | 7,119 | 0,0076 | |
| Otras | ||||||
| Rash | ||||||
| morbiliforme | 0 (0) | 0 (0) | 0 (0) | NA | NA | |
| petequial | 0 (0) | 0 (0) | 0 (0) | NA | NA | |
| urticarial | 3 (1,1) | 1 (0,8) | 2 (1,5) | 0,0435 | 0,8348 | |
| psoriásico | 1 (0,4) | 1 (0,8) | 0 (0) | 0,8095 | 0,3683 | |
| inclasificable | 1 (0,4) | 0 (0) | 1 (0,7) | 1,3125 | 0,2519 | |
| Prurito | 7 (2,6) | 2 (1,5) | 5 (3,7) | 1,6202 | 0,2031 | |
| Fotosensibilidad | 6 (2,3) | 1 (0,8) | 5 (3,7) | 1,3892 | 0,2385 | |
| Aumento de la pigmentación | 1 (0,4) | 0 (0) | 1 (0,7) | 0,4444 | 0,505 | |
| Aumento de peso | 37 (13,9) | 18 (3,7) | 19 (14,1) | 0,4174 | 0,5183 | |
| Pérdida de peso | 8 (3,0) | 3 (2,3) | 5 (3,7) | 0,1356 | 0,7127 | |
| Menorragia | 2 (0,8) | 0 (0) | 2 (1,5) | 2,3731 | 0,1234 | |
| Amenorrea | 8 (3,0) | 3 (2,3) | 5 (3,7) | 0,1495 | 0,699 | |
| Galactorrea | 1 (0,4) | 0 (0) | 1 (0,7) | 0,8235 | 0,3642 | |
| Ginecomastia | 3 (1,1) | 0 (0) | 3 (2,2) | 3,0699 | 0.0798 | |
| Aumento del deseo sexual | 8 (3,0) | 0 (0) | 8 (5,9) | 6,3486 | 0,0117 | |
| Disminución del deseo sexual | 8 (3,0) | 0 (0) | 8 (5,9) | 7,7773 | 0,0053 | |
| Disfunción eréctil | 0 (0) | 0 (0) | 0 (0) | NA | NA | |
| Disfunción eyaculatoria | 3 (1,1) | 1 (0,8) | 2 (1,5) | 0,3496 | 0,5543 | |
| Disfunción orgásmica | 2 (0,8) | 2 (1,5) | 0 (0) | 0,8981 | 0,3433 | |
| Lubricación vaginal | 1 (0,4) | 0 (0) | 1 (0,7) | 1,5 | 0,2207 | |
| Cefalea | ||||||
| tensional | 33 (12,4) | 8 (6,1) | 25 (18,5) | 4,1967 | 0,0405 | |
| migrañosa | 7 (2,6) | 2 (1,5) | 5 (3,7) | 1,0757 | 0,2997 | |
| otras formas | 6 (2,3) | 1 (0,8) | 5 (3,7) | 02/01/1900 | 0,1365 | |
| Dependencia física | 0 (0) | 0 (0) | 0 (0) | NA | NA | |
| Dependencia psíquica | 2 (0,8) | 1 (0,8) | 1 (0,7) | 0,0076 | 0,9305 | |
CMH: Cochran-Mantel-Haenszel; NA: no aplica; Naïve: pacientes que previamente a la inclusión en el estudio no habían tomado antipsicóticos; p: significación < 0,05; Quasi-naïve: pacientes que habían tomado antipsicóticos durante un periodo inferior a 30 días previos a la inclusión en el estudio.
Las negritas indican que la diferencia es estadísticamente significativa.
En el área psíquica se encontraron diferencias estadísticamente significativas a favor de un mayor número de pacientes quasi-naïve en los siguientes síntomas: ansiedad/laxitud/fatigabilidad, somnolencia/sedación, aumento duración sueños, aumento de los sueños e indiferencia emocional; en el área neurológica: hipocinesia/acinesia y parestesias; en el área autonómica: trastornos de acomodación, aumento de la salivación, poliuria/polidipsia, y aumento de la sudoración; finalmente dentro del área otras: aumento del deseo sexual, disminución del deseo sexual y cefaleas tensionales.
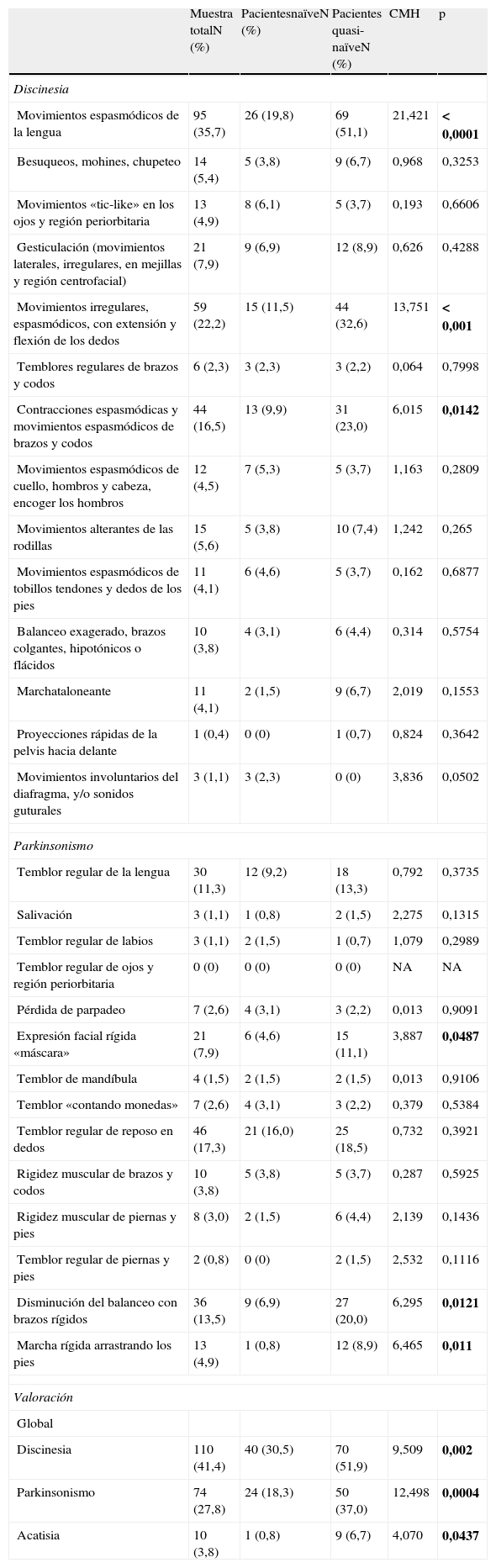
Evaluación de movimientos involuntariosLa tabla 5 muestra los resultados basales obtenidos en la escala MPRC-IMS de todos aquellos pacientes que obtuvieron al menos una puntuación de leve en los síntomas evaluados. Los resultados aparecen presentados tanto teniendo en cuenta el total de la muestra evaluada como las puntuaciones obtenidas por los 2 grupos que la constituían (pacientes naïve y quasi-naïve), controlando en este último caso por el diagnóstico basal.
Puntuaciones basales de la escala MPRC-IMS (Maryland Psychiatry Research Center- Involuntary Movements Scale)
| Muestra totalN (%) | PacientesnaïveN (%) | Pacientes quasi-naïveN (%) | CMH | p | |
| Discinesia | |||||
| Movimientos espasmódicos de la lengua | 95 (35,7) | 26 (19,8) | 69 (51,1) | 21,421 | < 0,0001 |
| Besuqueos, mohines, chupeteo | 14 (5,4) | 5 (3,8) | 9 (6,7) | 0,968 | 0,3253 |
| Movimientos «tic-like» en los ojos y región periorbitaria | 13 (4,9) | 8 (6,1) | 5 (3,7) | 0,193 | 0,6606 |
| Gesticulación (movimientos laterales, irregulares, en mejillas y región centrofacial) | 21 (7,9) | 9 (6,9) | 12 (8,9) | 0,626 | 0,4288 |
| Movimientos irregulares, espasmódicos, con extensión y flexión de los dedos | 59 (22,2) | 15 (11,5) | 44 (32,6) | 13,751 | < 0,001 |
| Temblores regulares de brazos y codos | 6 (2,3) | 3 (2,3) | 3 (2,2) | 0,064 | 0,7998 |
| Contracciones espasmódicas y movimientos espasmódicos de brazos y codos | 44 (16,5) | 13 (9,9) | 31 (23,0) | 6,015 | 0,0142 |
| Movimientos espasmódicos de cuello, hombros y cabeza, encoger los hombros | 12 (4,5) | 7 (5,3) | 5 (3,7) | 1,163 | 0,2809 |
| Movimientos alterantes de las rodillas | 15 (5,6) | 5 (3,8) | 10 (7,4) | 1,242 | 0,265 |
| Movimientos espasmódicos de tobillos tendones y dedos de los pies | 11 (4,1) | 6 (4,6) | 5 (3,7) | 0,162 | 0,6877 |
| Balanceo exagerado, brazos colgantes, hipotónicos o flácidos | 10 (3,8) | 4 (3,1) | 6 (4,4) | 0,314 | 0,5754 |
| Marchataloneante | 11 (4,1) | 2 (1,5) | 9 (6,7) | 2,019 | 0,1553 |
| Proyecciones rápidas de la pelvis hacia delante | 1 (0,4) | 0 (0) | 1 (0,7) | 0,824 | 0,3642 |
| Movimientos involuntarios del diafragma, y/o sonidos guturales | 3 (1,1) | 3 (2,3) | 0 (0) | 3,836 | 0,0502 |
| Parkinsonismo | |||||
| Temblor regular de la lengua | 30 (11,3) | 12 (9,2) | 18 (13,3) | 0,792 | 0,3735 |
| Salivación | 3 (1,1) | 1 (0,8) | 2 (1,5) | 2,275 | 0,1315 |
| Temblor regular de labios | 3 (1,1) | 2 (1,5) | 1 (0,7) | 1,079 | 0,2989 |
| Temblor regular de ojos y región periorbitaria | 0 (0) | 0 (0) | 0 (0) | NA | NA |
| Pérdida de parpadeo | 7 (2,6) | 4 (3,1) | 3 (2,2) | 0,013 | 0,9091 |
| Expresión facial rígida «máscara» | 21 (7,9) | 6 (4,6) | 15 (11,1) | 3,887 | 0,0487 |
| Temblor de mandíbula | 4 (1,5) | 2 (1,5) | 2 (1,5) | 0,013 | 0,9106 |
| Temblor «contando monedas» | 7 (2,6) | 4 (3,1) | 3 (2,2) | 0,379 | 0,5384 |
| Temblor regular de reposo en dedos | 46 (17,3) | 21 (16,0) | 25 (18,5) | 0,732 | 0,3921 |
| Rigidez muscular de brazos y codos | 10 (3,8) | 5 (3,8) | 5 (3,7) | 0,287 | 0,5925 |
| Rigidez muscular de piernas y pies | 8 (3,0) | 2 (1,5) | 6 (4,4) | 2,139 | 0,1436 |
| Temblor regular de piernas y pies | 2 (0,8) | 0 (0) | 2 (1,5) | 2,532 | 0,1116 |
| Disminución del balanceo con brazos rígidos | 36 (13,5) | 9 (6,9) | 27 (20,0) | 6,295 | 0,0121 |
| Marcha rígida arrastrando los pies | 13 (4,9) | 1 (0,8) | 12 (8,9) | 6,465 | 0,011 |
| Valoración | |||||
| Global | |||||
| Discinesia | 110 (41,4) | 40 (30,5) | 70 (51,9) | 9,509 | 0,002 |
| Parkinsonismo | 74 (27,8) | 24 (18,3) | 50 (37,0) | 12,498 | 0,0004 |
| Acatisia | 10 (3,8) | 1 (0,8) | 9 (6,7) | 4,070 | 0,0437 |
CMH: Cochran-Mantel-Haenszel; NA: No aplica; Naïve: pacientes que previamente a la inclusión en el estudio no habían tomado antipsicóticos; p: significación < 0,05; Quasi-naïve: pacientes que habían tomado antipsicóticos durante un periodo inferior a 30 días previos a la inclusión en el estudio.
Las negritas indican que la diferencia es estadísticamente significativa.
De las 3 áreas evaluadas, en el caso de la discinesia, se encontraron diferencias estadísticamente significativas a favor de un mayor número de pacientes quasi-naïve en los siguientes síntomas: movimientos espasmódicos de la lengua, movimientos irregulares, espasmódicos, con extensión y flexión de los dedos, y contracciones espasmódicas y movimientos espasmódicos de brazos y codos; en parkinsonismo: expresión facial rígida «máscara», disminución del balanceo con brazos rígidos y marcha rígida arrastrando los pies.
En las valoraciones globales de discinesia, parkinsonismo y acatisia, se observó de igual modo un número estadísticamente significativamente mayor de pacientes quasi-naïve con dichos síntomas.
DiscusiónEste artículo describe el diseño y resultados basales de un estudio realizado en 4 hospitales españoles con niños y adolescentes a los que se les ha prescrito por primera vez un antipsicótico de primera o segunda generación. Se ha presentado el protocolo de seguimiento a lo largo de 12 meses de tratamiento evaluando la seguridad y tolerabilidad del uso de estos fármacos en población infanto-juvenil; así como los instrumentos de evaluación empleados.
Del total de pacientes quasi-naïve al 98,4% se les prescribió ASG (risperidona, olanzapina, quetiapina o aripiprazol) y únicamente a 7 pacientes se les prescribió un APG (haloperidol, pimozida o clorpormazina). Estos datos van en consonancia con estudios de prevalencia del uso de antipsicóticos en niños y adolescentes, que describen el incremento significativo que se ha producido en las prescripciones de ASG en esta población en detrimento de las prescripciones de antipsicóticos de primera generación2. De los pacientes quasi-naïve únicamente el 1,9% estaba recibiendo tratamiento combinado de antipsicóticos, porcentaje muy bajo en comparación con lo que suele ocurrir en población adulta, en donde la polifarmacia es una práctica habitual, especialmente en Estados Unidos, pese a que lo que se recomiende sea la monoterapia de antipsicóticos33–35.
Numerosos estudios hacen mención de la relación existente entre la dosis de antipsicótico y la aparición de efectos secundarios, aspecto observado habitualmente en la práctica clínica. Pese a ello, los datos que existen hasta el momento proporcionan resultados contradictorios36–38. El registro exhaustivo de la medicación, así como el seguimiento prolongado durante 12 meses de los pacientes, nos permitirá analizar este aspecto tratando de arrojar datos aclaratorios.
Los pacientes incluidos en el estudio junto a los antipsicóticos tenían prescritos otros psicofármacos (benzodiacepinas, antidepresivos, estabilizantes del ánimo [litio y antiepilépticos], y estimulantes), lo que debe tenerse en cuenta a la hora de atribuir la aparición de efectos secundarios a la acción de los antipsicóticos o a terceros fármacos39. Un ejemplo de ello es un estudio previo de nuestro equipo que halló un posible efecto protector de los antidepresivos en el incremento de peso con ASG16.
Las áreas en las que mayor número de pacientes presentaron síntomas cuando se evaluaron los efectos secundarios con la UKU fueron la psíquica, neurológica y autonómica. Cuando se hizo un subanálisis diferenciando entre pacientes naïve y quasi-naïve se encontró un número significativamente mayor de los segundos con estos síntomas. En la valoración de síntomas extrapiramidales encontramos resultados similares siendo significativamente mayor el número de pacientes quasi-naïve que presentaban síntomas de discinesia, parkinsonismo y acatisia. La duración de los estudios realizados hasta el momento ha sido de no más de 12 semanas40 por lo que este estudio nos permitirá también ver posibles cambios así como la evolución de los síntomas extrapiramidales a lo largo de periodos más extensos de tiempo. Estos resultados obtenidos a nivel basal demuestran que en población infanto-juvenil tanto la aparición de efectos secundarios como de síntomas extrapiramidales ya se observan desde el inicio de la toma de los antipsicóticos.
Nuestros resultados deben ser interpretados teniendo en cuenta una serie de limitaciones. En primer lugar el estudio se llevó a cabo en centros hospitalarios, por lo que el 72,9% de la muestra estaba constituida por pacientes con ingreso hospitalario, lo que incluye un sesgo en la gravedad de la patología, así como a la hora de poder generalizar los resultados obtenidos con otras muestras de carácter ambulatorio. En segundo lugar, pese a que se midió la adherencia al tratamiento por medio de técnicas objetivas, este análisis no se pudo realizar en la totalidad de la muestra debido a que no todos los centros pudieron disponer de la técnica. En tercer lugar, no se incluyeron medidas de severidad de la enfermedad que hubiesen permitido evaluar el balance de eficiencia entre eficacia y efectos secundarios. Estas medidas deberían ser consideradas en futuros estudios.
Dentro de los puntos fuertes de nuestro estudio destacamos: en primer lugar, desde nuestro conocimiento es el primer estudio realizado con niños y adolescentes naïve o quasi-naïve, con un tamaño muestral tan elevado, a los que se les ha seguido exhaustivamente durante un periodo de 12 meses de tratamiento antipsicótico, valorando variables clínicas y biológicas con el fin de detectar precozmente la posible aparición de efectos secundarios. En segundo lugar, prácticamente el 50% de la muestra estaba constituida por niños y adolescentes que nunca habían recibido tratamiento antipsicótico y el resto tenían una exposición mínima. En tercer lugar, este estudio nos va a permitir valorar directamente en población infanto-juvenil la seguridad y tolerabilidad de estos fármacos. A partir de los resultados obtenidos en adultos no se puede inferir su seguridad y tolerabilidad en personas en desarrollo, un ejemplo de ello son los estudios que demuestran que los efectos secundarios de los ASG son más evidentes en los niños y adolescentes que en adultos41–43. En cuarto lugar, uno de los intereses de clínicos es establecer el perfil diferencial de los antipsicóticos. Atendiendo a los efectos secundarios, los antipsicóticos presentan perfiles muy heterogéneos, un ejemplo de ello es que el aumento de peso difiere de unos a otros ASG19. Este estudio permitirá aportar información sobre el comportamiento diferencial y longitudinal de los antipsicóticos, especialmente de los ASG. En último lugar, este estudio está en consonancia con las leyes de la FDA (Agencia Estadounidense del Medicamento) y la EMA (Agencia Europea del Medicamento) que exigen la realización de estudios diseñados para niños y adolescentes, que permitan confirmar el uso de estos fármacos aportando más información sobre su seguridad y tolerabilidad en esta población.
El objetivo principal de este artículo ha sido exponer un protocolo diseñado con la finalidad de permitir la detección precoz de efectos secundarios graves debidos al consumo de fármacos antipsicóticos en población infanto-juvenil. Tras los resultados que se obtengan y una vez demostrada su utilidad, esperamos que facilite el desarrollo e instauración en la práctica clínica habitual de protocolos de seguimiento específicos para niños y adolescentes con tratamiento antipsicótico.
Responsabilidades éticasProtección de personas y animales. Los autores declaran que los procedimientos seguidos se conformaron a las normas éticas del comité de experimentación humana responsable y de acuerdo con la Asociación Médica Mundial y la Declaración de Helsinki.
Confidencialidad de los datos. Los autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes y que todos los pacientes incluidos en el estudio han recibido información suficiente y han dado su consentimiento informado por escrito para participar en dicho estudio.
Derecho a la privacidad y consentimiento informado. Los autores han obtenido el consentimiento informado de los pacientes y/o sujetos referidos en el artículo. Este documento obra en poder del autor de correspondencia.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Centro de Investigación Biomédica en Red de Salud Mental (CIBERSAM), Madrid. España. Financiado en parte por el Ministerio Español de Salud, Instituto de Salud Carlos III «Fondo de Investigación Sanitaria» (F.I.S.-PI04/0455), «Asociación Madrileña de Salud Mental» («Miguel Angel Martín» Investigation Grant), «NARSAD 2005: Independent Investigator Award», Fundación Alicia Koplowitz y Fundación Mutua Madrileña. Con el apoyo del Ministerios de Ciencia e Innovación. Comunidad de Madrid, Ayudas I+D en Biomedicina S2010/BMD-2422 AGES, (Madrid).