En las últimas 2 décadas, las tasas de sobrevivencia de pacientes oncológicos han aumentado. El aumento de tasa de pacientes oncológicos menores de 20 años ha influenciado en adopción de prácticas de conservación seminal. Los tratamientos para cáncer, principalmente, la quimio y radioterapia pueden afectar la fertilidad. La quimioterapia afecta negativamente a la espermatogénesis, ya sea de forma transitoria o permanente, al igual que la radioterapia donde su daño es dirigido directamente al ADN. En la mayoría de los casos las terapias y el mismo cáncer disminuyen la calidad espermática, la utilización de protocolos que conlleven radiación y/o quimioterapia la disminuyen aún más. Las técnicas de criopreservación y los resultados de la utilización de estas células en reproducción asistida han sido reportadas de manera individual, mostrando diferencias y contradicciones entre ellos.
La criopreservación de semen es la principal opción para la preservación de la fertilidad. Es necesaria la gestión de centros de reproducción asistida para generar programas especiales para estos casos. La recomendación final es que se lleve a cabo de forma inmediata la criopreservación, incluso antes de empezar cualquier tratamiento. La recuperación de procesos fisiológicos normales como la espermatogénesis es lenta, casi toma años y a veces no se da, la prevención debe ser fomentada y la utilización de estos servicios también.
Over the last two decades, the survival rates of oncologic patients have risen. This rate increase in patients under 20 years of age has had an influence on adopting semen preservation practices. Cancer treatments, especially chemotherapy and radiotherapy can affect fertility. Chemotherapy has a negative effect on spermatogenesis that is either transitory or permanent and radiotherapy directly damages DNA. In the majority of cases, both the cancer and its treatments reduce sperm quality and protocols that include radiation and/or chemotherapy do so even more. Cryopreservation techniques and the use of these cells in assisted reproduction have been reported on an individual basis, with different and contradictory results.
Semen cryopreservation is the main option for fertility preservation. Assisted reproduction centers need to be created so that special programs can be developed for these cases. The final recommendation is to carry out cryopreservation immediately, even before beginning any treatment. The recovery of normal physiologic processes such as spermatogenesis is slow - often taking years - and sometimes is not achieved. Therefore prevention, along with these services, should be fomented.
En las últimas 2 décadas las tasas de sobrevivencia de pacientes oncológicos han aumentado, debido al avance sustancial de los tratamientos usando medicamentos más seguros, a la detección que ahora es más temprana y a los cuidados que se tienen en cuanto a la menor radiación en zonas que no son necesarias. El aumento de tasa de pacientes oncológicos menores de 20 años ha influenciado en adopción de prácticas de conservación, si bien el incremento de presentación de cáncer en jóvenes es notorio, las posibilidades de sobrevivir también; la preservación de material genético con alta probabilidad de dañarse, ya sea por el tipo de cáncer en sí o por la clase de tratamiento es alta, por esta razón los centros de reproducción asistida en México como en el mundo han redoblado las técnicas de conservación, para que estas muestras de extremo valor sean de mejor calidad y puedan usarse en el futuro, garantizando la preservación de la especie en los sobrevivientes del cáncer.
Muchos hombres y sus familiares tiene el deseo de conseguir una familia, el hecho de concientización de la enfermedad como tal hace que estas personas decidan realizar la preservación de sus células germinales (espermatozoides), la cual ha sido ampliamente reportada por la literatura por las consecuencias sobre la fertilidad en el uso de medicamentos antineoplásicos, la radiación y la quimioterapia. Este tipo de infertilidad en el hombre puede ser temporal o permanente variando individualmente y la predicción de ésta es casi imposible, por esta razón la criopreservación de semen es la principal medida preventiva para realizarse antes de empezar el tratamiento, práctica poco extendida en México por la falta de información de estos servicios por médicos generales y oncólogos; la guía de la American Society of Clinical Oncology (ASCO)1 señala de manera clara cuál es el diagrama de flujo a seguir en caso de tener un paciente con cáncer y darle a conocer las opciones que tiene para que pueda o no elegir la posibilidad de preservar antes de su tratamiento, la cual sería de carácter obligatorio en cualquier país civilizado.
Impacto del cáncer como “padecimiento” en la calidad seminalLa disminución de la calidad seminal de pacientes oncológicos es de origen multifactorial, la respuesta fisiológica ante la aparición “anormal” de un evento celular, llámese cáncer u otra enfermedad, es responder de una manera inmediata sobre ésta, disminuyendo funciones como la reproductiva con el propósito de detener la invasión a otros órganos y que el síndrome paraneoplásico no se dé, o sea menor. De aquí que muchos sistemas metabólicos se ajusten a los nuevos cambios o simplemente dejen de funcionar entre ellos los trastornos endocrinos, respuesta inmune y efectos físicos de tumores que generen la disfunción seminal, autores reportan que la primera función a sacrificar es la reproductiva.
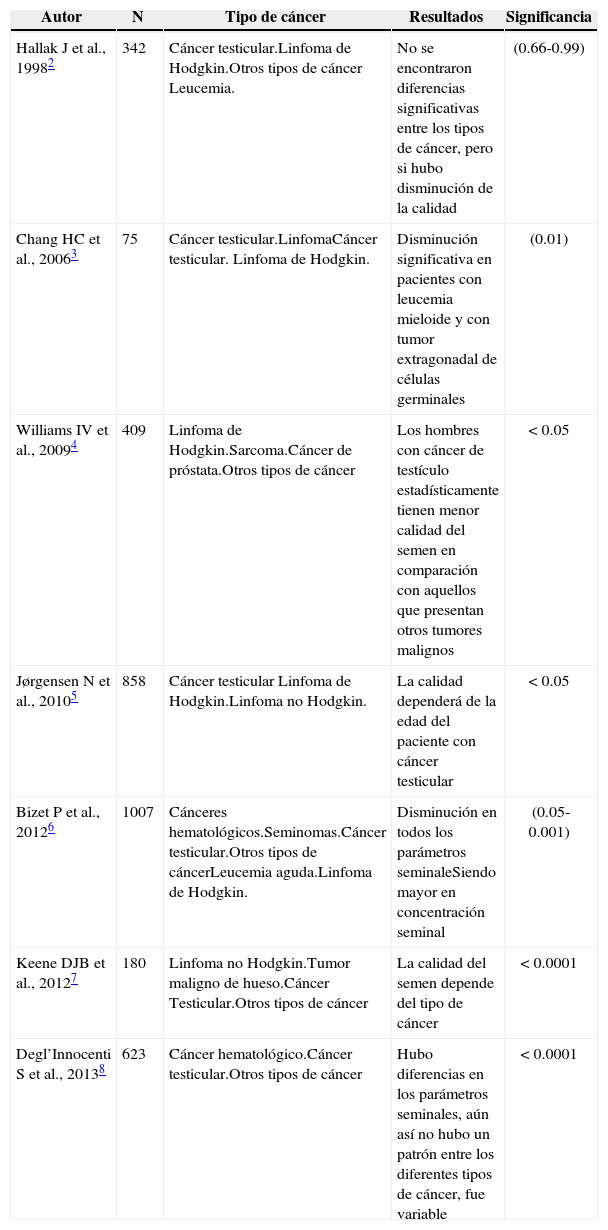
Los resultados donde el cáncer como enfermedad afecta negativamente la calidad del semen son contradictorios, como se presentan en la tabla 1. Allí se muestran diferentes conclusiones para el impacto sobre la función reproductiva, variables como el tipo de cáncer, el lugar donde está, son objeto de estudio de estas investigaciones.
Consecuencias del tipo de cáncer en la función reproductiva.
| Autor | N | Tipo de cáncer | Resultados | Significancia |
|---|---|---|---|---|
| Hallak J et al., 19982 | 342 | Cáncer testicular.Linfoma de Hodgkin.Otros tipos de cáncer Leucemia. | No se encontraron diferencias significativas entre los tipos de cáncer, pero si hubo disminución de la calidad | (0.66-0.99) |
| Chang HC et al., 20063 | 75 | Cáncer testicular.LinfomaCáncer testicular. Linfoma de Hodgkin. | Disminución significativa en pacientes con leucemia mieloide y con tumor extragonadal de células germinales | (0.01) |
| Williams IV et al., 20094 | 409 | Linfoma de Hodgkin.Sarcoma.Cáncer de próstata.Otros tipos de cáncer | Los hombres con cáncer de testículo estadísticamente tienen menor calidad del semen en comparación con aquellos que presentan otros tumores malignos | < 0.05 |
| Jørgensen N et al., 20105 | 858 | Cáncer testicular Linfoma de Hodgkin.Linfoma no Hodgkin. | La calidad dependerá de la edad del paciente con cáncer testicular | < 0.05 |
| Bizet P et al., 20126 | 1007 | Cánceres hematológicos.Seminomas.Cáncer testicular.Otros tipos de cáncerLeucemia aguda.Linfoma de Hodgkin. | Disminución en todos los parámetros seminaleSiendo mayor en concentración seminal | (0.05-0.001) |
| Keene DJB et al., 20127 | 180 | Linfoma no Hodgkin.Tumor maligno de hueso.Cáncer Testicular.Otros tipos de cáncer | La calidad del semen depende del tipo de cáncer | < 0.0001 |
| Degl’Innocenti S et al., 20138 | 623 | Cáncer hematológico.Cáncer testicular.Otros tipos de cáncer | Hubo diferencias en los parámetros seminales, aún así no hubo un patrón entre los diferentes tipos de cáncer, fue variable | < 0.0001 |
De acuerdo a distintos autores los resultados fueron variables, como el caso de Ragni et al., donde reporta que el 11.6 % de los hombres que deseaban criopreservar espermatozoides en su institución sufrieron de azoospermia9. En pacientes con linfoma hubo azoospermia en el 3.9 %, contrastando con pacientes con tumores testiculares quienes tuvieron un 15.3 % de aparición de azoospermia, además de disminuir sus otros parámetros8. Lass et al. informó que el 10.5 % de los hombres no tratados fueron azoospérmicos incluyendo 9.6 % de los tumores testiculares, el 13.3 % con leucemia o linfoma, y el 3.7 % de los hombres con otros tumores malignos10, reportando parámetros seminales normales según criterios de la Organización Mundial de la Salud (OMS) en sólo el 40 % de los hombres con linfoma, 37 % con cáncer testicular y el 37 % con otros tumores11. Los hombres con enfermedad de Hodgkin generalmente presentan parámetros de baja calidad12-15.
Un estudio de Bahadurt en 2005 realizado en 776 hombres con cáncer, mostró una significativa reducción en la concentración espermática en pacientes con cáncer testicular, pero no varió en otros pacientes con tumores malignos. En otro estudio se demostró que los pacientes con cáncer testicular tenían concentraciones espermáticas menores a los parámetros de la OMS antes de empezar el tratamiento16, en cuanto a la integridad del ADN se ha demostrado que es mayor en pacientes en tratamiento que antes de empezarlo, sin embargo hay evidencia para sugerir que el tipo de cáncer y su malignidad no afecta la calidad del ADN espermático17.
Efectos del tratamiento del cáncer en la calidad seminalLa quimioterapia afecta negativamente a la espermatogénesis, ya sea de forma transitoria o permanente. Estos fármacos dañan directamente la proliferación de las células, por lo que en estadios tempranos de la diferenciación de los espermatozoides son muy sensibles a estos agentes. Sin embargo, los precursores de la espermatogénesis pueden dañarse debido a los efectos acumulativos de múltiples dosis de quimioterapia18. Las células germinales en etapa avanzada, es decir, espermatocitos y espermátides, son menos sensibles a la quimioterapia, ya que no se están dividiendo, y esto explica el hallazgo de algunos espermatozoides inmediatamente después de la quimioterapia con una lenta disminución en los recuentos en los meses siguientes. La función de las células de Leydig parece estar menos afectada por la quimioterapia a menos que el factor endocrino disminuya la producción de testosterona y la falta de esta hormona sea la consecuencia de la disminución del tamaño testicular y el mal funcionamiento del estroma19-21.
La mejoría en los protocolos de quimioterapia se ha traducido en menores tasas de infertilidad, aunque la azoospermia después del tratamiento sigue siendo preocupante. Cuando los hombres se convierten en azoospérmicos después del tratamiento, algunos estudios reportan que sólo del 20 %-50 % de estos hombres tendrá una cierta recuperación de la espermatogénesis, mientras que otros informan que ésta puede ser de hasta el 80 % dependiendo del tipo de cáncer y el régimen de quimioterapia22.
Los agentes alquilantes que incluyen cisplatino son utilizados para el cáncer testicular y tienen un alto riesgo de azoospermia, particularmente cuando se combina con ifosfamida. El riesgo de azoospermia permanente parece ser dosis-dependiente23-25. Del mismo modo, la mayoría de los tratamientos para la enfermedad de Hodgkin también aumenta el riesgo de azoospermia15. El impacto de los agentes quimioterapéuticos más nuevos como taxanos y anticuerpos monoclonales aún están siendo estudiados26,27.
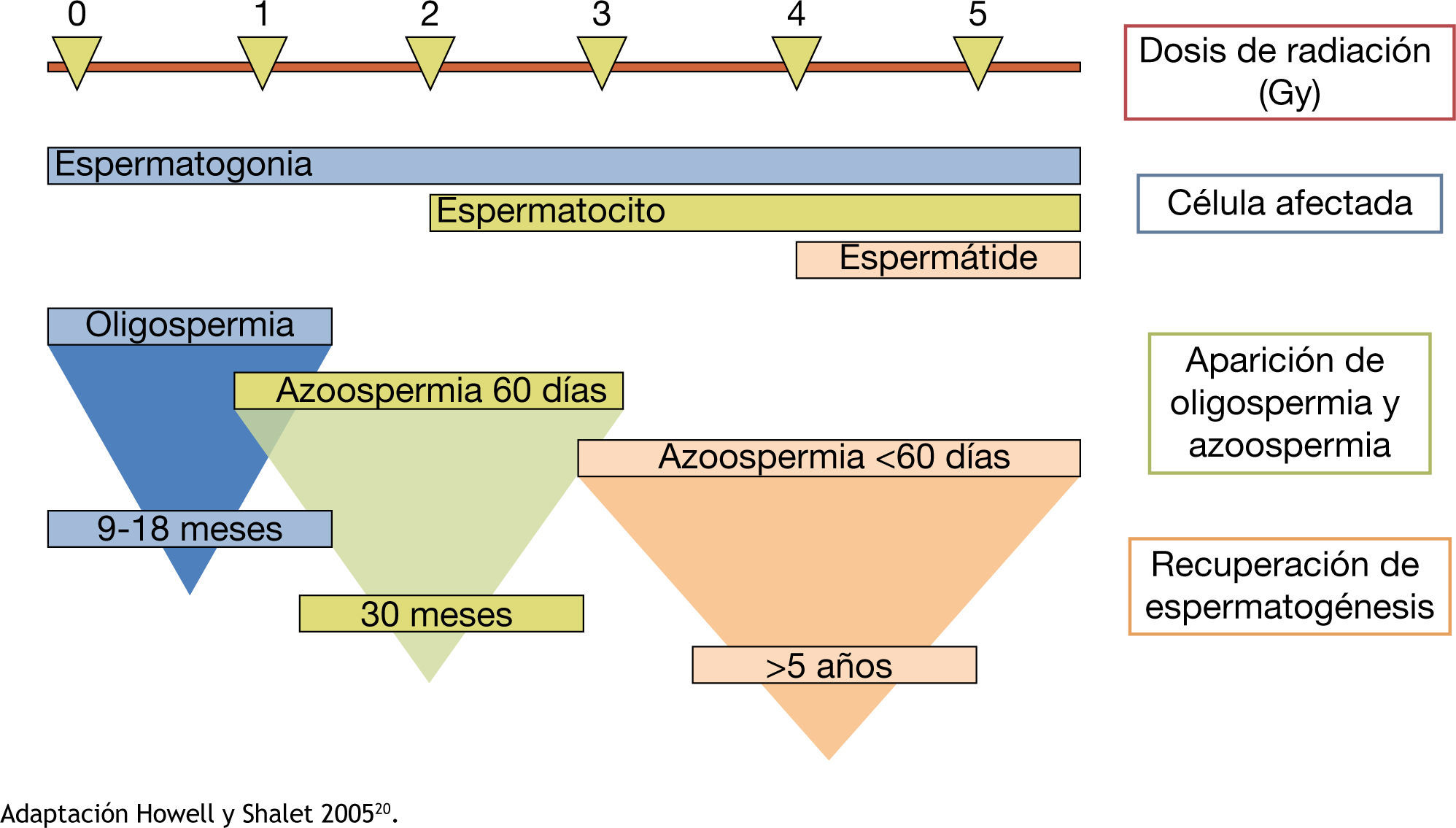
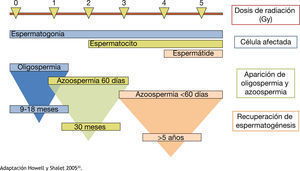
La radioterapia afecta negativamente a la espermatogénesis, ya sea de manera transitoria o permanente, por inducir directamente daño al ADN. El efecto nocivo de la radioterapia en la función gonadal dependerá de la dosis total, la fuente de la radiación, la protección gonadal, la cantidad de radiación dispersa y la susceptibilidad individual1. La dimensión de la parte a radiar debe ser definida para que la protección de los otros órganos este considerada al igual que el técnico que realice la radiación, ésta debe ser de forma obligatoria y rutinaria, sin embargo, una pequeña cantidad de radiación dispersa es inevitable. Tan sólo 0.15 Gy pueden resultar en la producción de espermatozoides deteriorados. Las dosis más alta de 0.5 Gy suelen dar lugar a azoospermia reversible. Los parámetros del semen a menudo llegan a su punto más bajo dentro de los 4 a 6 meses después del tratamiento. Dosis más altas de 2.5 Gy pueden producir azoospermia prolongada o permanente. La función de las células de Leydig se ve afectada cuando alcanzan dosis de mayor a 15 Gy28. Los tratamientos para tumores malignos tales como leucemia y cáncer testicular, la radiación total del cuerpo antes de trasplantes de médula ósea suelen dar lugar a un daño irreversible a las espermatogonias y puede producir esterilidad permanente15,20,21. Se explica brevemente en la figura 1
Deterioro de la espermatogénesis respecto a la dosis de radiación.
Otro tratamiento indicado es la resección parcial o total del órgano afectado, en este caso del testículo, próstata u otros órganos que afectan directamente el desempeño reproductivo como la vejiga y algunos ganglios -por ser la vía linfática la más común para la propagación de células cancerígenas-. Este procedimiento es conocido como disección de ganglios linfáticos retroperitoneales (LRP). En hombres con cáncer testicular puede causar infertilidad como resultado de la disfunción eyaculatoria debido al daño del plexo pélvico29, diverso estudios han demostrado sus ventajas y desventajas. Se ha reportado la influencia del cáncer en la parte baja de la cavidad abdominal con riesgos metastásicos que podrían ocasionar disfunción tanto testicular por diseminación, o daño físico por obliteración de flujo sanguíneo y alteraciones hormonales30.
Respecto a la fragmentación de ADN espermático también hay varios resultados, McDowell et al. (2013) no encontró diferencias entre el grupo control y los pacientes con cáncer testicular31; Meseguer tampoco encontró diferencias entre pacientes con cáncer testicular y otros tipos de cáncer17. Otros estudios señalan la actividad mutagénica de las radiaciones, particularmente las deleciones en el cromosoma Y que ha sido asociado con azoospermia 15 % y con oligospermia severa 5 %-10 %, debido a la incapacidad del genoma haploide de recombinarse y recuperar la información perdida, lo cual hace que la línea germinal sea defectuosa y no lleguen adquirir la maduración necesaria32.
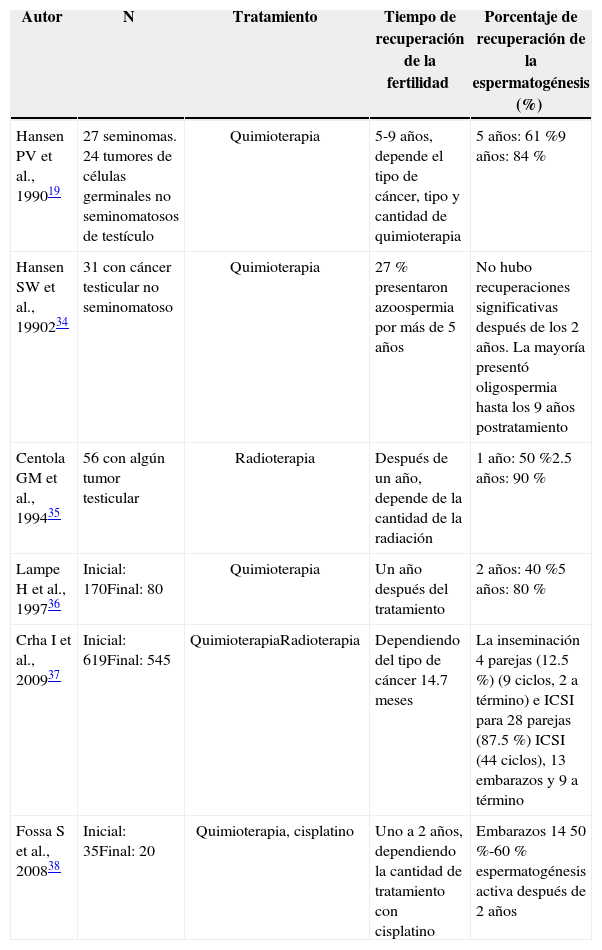
Fertilidad en pacientes sobrevivientesLa fertilidad en pacientes que tuvieron tratamiento contra el cáncer es difícil de recuperar, y están ampliamente reportados por la literatura como se muestra en la tabla 2. Esta recuperación es de lenta evolución, puede tardarse hasta años y su calidad es variable siendo indiscutible la necesidad de acudir a la reproducción asistida. Aproximadamente, el 15 %-30 % de los sobrevivientes de cáncer infantil tienen infertilidad permanente33.
Porcentaje de recuperación de la espermatogénesis después de tratamiento anticancerígeno.
| Autor | N | Tratamiento | Tiempo de recuperación de la fertilidad | Porcentaje de recuperación de la espermatogénesis (%) |
|---|---|---|---|---|
| Hansen PV et al., 199019 | 27 seminomas. 24 tumores de células germinales no seminomatosos de testículo | Quimioterapia | 5-9 años, depende el tipo de cáncer, tipo y cantidad de quimioterapia | 5 años: 61 %9 años: 84 % |
| Hansen SW et al., 1990234 | 31 con cáncer testicular no seminomatoso | Quimioterapia | 27 % presentaron azoospermia por más de 5 años | No hubo recuperaciones significativas después de los 2 años. La mayoría presentó oligospermia hasta los 9 años postratamiento |
| Centola GM et al., 199435 | 56 con algún tumor testicular | Radioterapia | Después de un año, depende de la cantidad de la radiación | 1 año: 50 %2.5 años: 90 % |
| Lampe H et al., 199736 | Inicial: 170Final: 80 | Quimioterapia | Un año después del tratamiento | 2 años: 40 %5 años: 80 % |
| Crha I et al., 200937 | Inicial: 619Final: 545 | QuimioterapiaRadioterapia | Dependiendo del tipo de cáncer 14.7 meses | La inseminación 4 parejas (12.5 %) (9 ciclos, 2 a término) e ICSI para 28 parejas (87.5 %) ICSI (44 ciclos), 13 embarazos y 9 a término |
| Fossa S et al., 200838 | Inicial: 35Final: 20 | Quimioterapia, cisplatino | Uno a 2 años, dependiendo la cantidad de tratamiento con cisplatino | Embarazos 14 50 %-60 % espermatogénesis activa después de 2 años |
ICSI: por sus siglas en inglés, Intra-Cytoplasmic Sperm Injection.
Muchos factores influyen en que la recuperación sea más lenta, la residualidad del medicamento antineoplásico, las cantidades de radiaciones y el tipo de cáncer parecen jugar un papel importante en la preservación de la fertilidad15. Cerca del 80 % de pacientes sobrevivientes a cáncer testicular obtuvieron embarazos, aunque pasaron varios años para que esto se diera y el 95 % de estos usaron algún método de reproducción asistida39. Contrario a los pacientes con seminomas, estos tienen una alta probabilidad de ser azoospérmicos de manera permanente por el daño ocasionado en las células epiteliales y por ende, en las células germinales, este daño es irreversible15.
Los sobrevivientes de linfoma de Hodgkin suelen experimentar azoospermia después del tratamiento. En función de los regímenes de quimioterapia y radioterapia, muchos pacientes recuperan un cierto grado de espermatogénesis, pero esto puede tomar de 5 a 10 años40. Protocolos de tratamientos de linfoma no Hodgkin parecen ser menos gonadotóxicos que los utilizados para tratar la enfermedad de Hodgkin20. Estrategias de trasplante de médula ósea para salvar la vida también pueden afectar a la fertilidad, con tasas de azoospermia van del 10 % al 70 % dependiendo de los agentes, dosis y radiación corporal empleados41,42.
Los pacientes con cáncer genitourinario tienen más problemas debido a que las barreras anatómicas y la consecuente pérdida de funcionalidad repercuten directamente en la función reproductiva del paciente, el aumento de casos de tumores prostáticos en la población joven es de atención ya que la prostatectomía total está indicada en el 96 % de los casos y las expectativas de tener una familia, en la mayoría de los casos, no se han cumplido; la criopreservación de espermatozoides es la alternativa inmediata para poder hacer uso de este, después de sobrevivir a un tratamiento y realizarse como padre. Nuevas terapias han sido estudiadas para los tumores de células uroteliales como el uso del bacilo de Calmette-Guerin (BCG) que ha resultado tener menos daño contraproducente que protocolos con mitomicina C43, otros como los tratamientos con yodo reactivo presentan muy altas tasas de disfunción testicular44-46.
Obtención de semenEl semen lo conforman 2 componentes, el paquete celular (espermatozoides) y el plasma seminal, el cual se encarga de la nutrición y el metabolismo de los espermatozoides, generalmente la obtención más frecuente es la masturbación. Para muchos hombres es un poco incómodo y aún más para los jóvenes quienes han alcanzado su madurez fisiológica pero no mental, asumir un evento como este, la orientación psicológica y el acompañamiento de los padres es de vital importancia en el tratamiento de esta población.
Los protocolos varían según el banco de semen, pero a nivel mundial se maneja la muestra a 37°C, el semen puede colectarse en casa, procurando no pasar de 40 minutos para llegar al laboratorio, deben tomarse todas las porciones seminales en recipientes especiales los cuales son analizados en el laboratorio donde se comprueba su calidad, en programas de pacientes oncológicos las muestras se tratan con especial cuidado ya que podrían ser muestras únicas. La criopreservación se hace con la presencia de un medio que es capaz de nutrir a los espermatozoides durante su congelación, la cual se realiza a temperatura de -196°C pudiendo permanecer allí durante décadas, el control del nitrógeno líquido y el almacenamiento de las muestras es de suma importancia, ya que un bajo nivel de este puede ocasionar descongelaciones abruptas que comprometerían la vitalidad de las muestras de manera definitiva, y su uso no sería viable. La OMS ha tratado de estandarizar las técnicas necesarias para la correcta evaluación de los parámetros seminales, y la mayoría de los centros utilizan esta normativa como base para sus estudios47.
Las principales causas de no criopreservar hacen mención a la ansiedad por la enfermedad, las creencias religiosas, los dolores por los efectos de los tratamientos, entre otras. El reto actual es el manejo de la población masculina adolescente, actualmente no hay directrices de acompañamiento, aún así se han desarrollado estrategias psicológicas que han mejorado la actitud de los padres, abren posibilidades para que la esperanza se cree en sus hijos y ayudan a la estabilidad emocional para afrontar un evento como el ser diagnosticado con cáncer. En pacientes con padecimientos graves donde su movilidad es limitada o nula, la recuperación quirúrgica es una opción para estos -biopsia testicular y resección de uno o ambos testículos está indicada para estos casos-.
Bancos de semenCerca de un 50 % de los pacientes con cáncer buscan una posibilidad para ser padres y la única alternativa para esto, es entrar en programas de criopreservación, sin embargo la gran mayoría de no lo hacen por falta de información. Hace una década la cantidad de bancos de semen era reducida debido a la alta inversión que deben tener, actualmente hay una alta afluencia de estos centros especializados en andrología con programas tanto de donadores como criopreservación espermática en pacientes oncológicos48.
Las mutaciones y deleciones génicas han sido reportadas en animales desde los comienzos de la quimioterapia hasta 2 años después de concluido el tratamiento49, algunos estudios recomiendan criopreservar semen hasta 10-15 días después de comenzar el tratamiento y esperar cerca de 12 a 18 meses de finalizado para continuar con los tratamientos de fertilidad50.
En 1995, Koeppel informó sobre 50,000 nuevos casos de cáncer en hombres menores de 35 años, este se dio cuenta de que con el aumento de las tasas de supervivencia y los efectos nocivos del tratamiento sobre la fertilidad debía dirigir sus intereses a generar programas de criopreservación del semen, los cuales deberían ofrecerse a estos pacientes51. El autor reconoció las controversias en cuanto a la practicidad y el uso de los bancos de esperma, incluyendo los desafíos que enfrentan los profesionales de la salud en la discusión de temas tan sensibles con los pacientes15.
Debe educarse y crearse estrategias de abordaje del tema con estos pacientes48. Los materiales educativos que incluyen folletos y material interactivo para los pacientes y sus familias son útiles. El desarrollo de estos programas deben ser claros y transparentes, la parte emocional es muy frágil en estos casos, además, los centros deben adecuar de manera preventiva consultorios de toma de semen con fácil acceso, ya que cualquier urgencia puede presentarse.
La edad exacta en la que la producción de esperma varía de factores individuales. La ampliación de los testículos representa una transición de fase Tanner I a II, después de este tiempo la espermatogénesis comienza a ser probable, incluso antes de la adolescencia. Sin embargo, en los adolescentes con cáncer, que van desde los 14 hasta a los 17 años, se han encontrado buenos parámetros seminales para ser criopreservados52. Hagenäs en 2010 realizó un estudio con 86 niños con edades de 12 a 18 años, que entraron a programas de quimioterapia por diversos tumores; después del tratamiento, el 88.4 % tenían espermatozoides y el 93.4 % de estos tenían calidad suficiente para ser criopreservado15,53.
La criopreservación de gametos provenientes de niños y adolescentes es un tema crítico y debe ser manejado de una manera muy profesional54. La decisión o no de preservar está limitada a muchos factores, entre ellos el pronóstico, el tipo de cáncer y el consentimiento de los padres que en muchos casos son los responsables de la autorización de estos procedimientos, evidenciando la necesidad de programas de acompañamiento para pacientes oncológicos y sus familiares55,56.
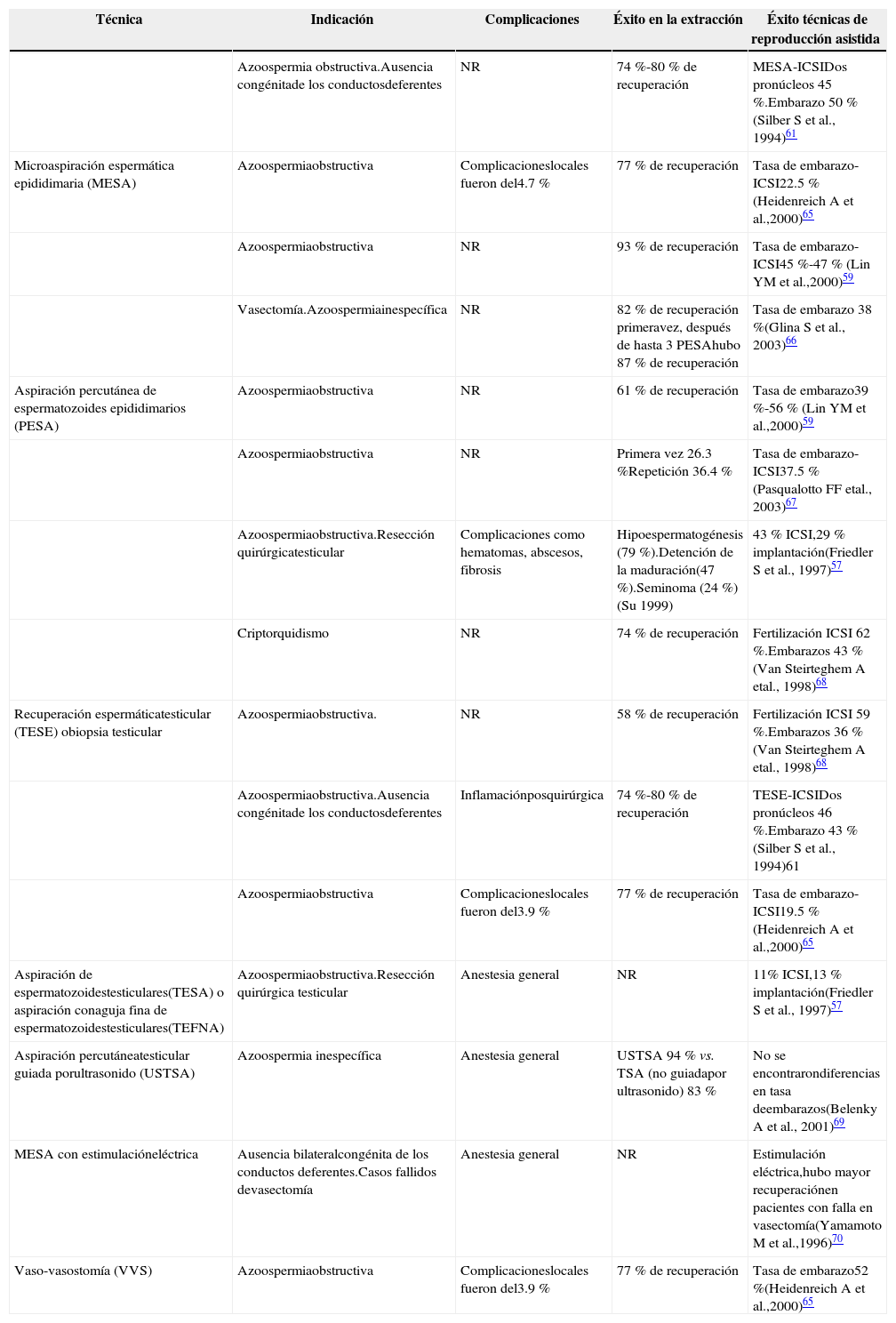
En casos donde los pacientes presenten azoospermia de manera permanente por cualquier razón, la recuperación quirúrgica es una opción, esto debe ser concertado con el oncólogo, urólogo, cirujano y Centro de Reproducción Asistida, ya que en la mayoría de los casos el tratamiento debe empezarse lo más rápido posible y el trabajo en conjunto es indispensable. La literatura reporta variaciones en las técnicas de obtención, desde la sedación del paciente hasta la microdisección testicular para la obtención de espermatozoides, todas bajo el mismo fundamento. La extracción de espermatozoides del testículo (TESE) hace referencia a la punción con aguja; esta recuperación puede contaminarse con sangre, lo cual la hace un procedimiento de cuidado y experiencia, aún así hay recuperación de espermatozoides capaces de fecundar57-59. Otras técnicas de recuperación son variaciones de ésta como la TESE con microdisección, con un 50 % de éxito después de la quimioterapia60. La obtención de espermatozoides de epidídimo está indicada en casos de azoospermia obstructiva, pacientes con prostatectomía parcial o total y por la aparición de células tumorales59,61. Éstas y otras técnicas se explican en la tabla 3. Cuando hay casos avanzados de cáncer y el paciente sea incapaz de incorporarse, eyacular o presente eyaculación retrógrada, las técnicas de recuperación espermática se basan en la electroeyaculación y electrovibración, diversas tasas de embarazos han sido reportadas con el uso de estas células62-64.
Técnicas de obtención de espermatozoides en pacientes con azoospermia clínica.
| Técnica | Indicación | Complicaciones | Éxito en la extracción | Éxito técnicas de reproducción asistida |
|---|---|---|---|---|
| Azoospermia obstructiva.Ausencia congénitade los conductosdeferentes | NR | 74 %-80 % de recuperación | MESA-ICSIDos pronúcleos 45 %.Embarazo 50 % (Silber S et al., 1994)61 | |
| Microaspiración espermática epididimaria (MESA) | Azoospermiaobstructiva | Complicacioneslocales fueron del4.7 % | 77 % de recuperación | Tasa de embarazo-ICSI22.5 % (Heidenreich A et al.,2000)65 |
| Azoospermiaobstructiva | NR | 93 % de recuperación | Tasa de embarazo-ICSI45 %-47 % (Lin YM et al.,2000)59 | |
| Vasectomía.Azoospermiainespecífica | NR | 82 % de recuperación primeravez, después de hasta 3 PESAhubo 87 % de recuperación | Tasa de embarazo 38 %(Glina S et al., 2003)66 | |
| Aspiración percutánea de espermatozoides epididimarios (PESA) | Azoospermiaobstructiva | NR | 61 % de recuperación | Tasa de embarazo39 %-56 % (Lin YM et al.,2000)59 |
| Azoospermiaobstructiva | NR | Primera vez 26.3 %Repetición 36.4 % | Tasa de embarazo-ICSI37.5 % (Pasqualotto FF etal., 2003)67 | |
| Azoospermiaobstructiva.Resección quirúrgicatesticular | Complicaciones como hematomas, abscesos, fibrosis | Hipoespermatogénesis (79 %).Detención de la maduración(47 %).Seminoma (24 %) (Su 1999) | 43 % ICSI,29 % implantación(Friedler S et al., 1997)57 | |
| Criptorquidismo | NR | 74 % de recuperación | Fertilización ICSI 62 %.Embarazos 43 %(Van Steirteghem A etal., 1998)68 | |
| Recuperación espermáticatesticular (TESE) obiopsia testicular | Azoospermiaobstructiva. | NR | 58 % de recuperación | Fertilización ICSI 59 %.Embarazos 36 %(Van Steirteghem A etal., 1998)68 |
| Azoospermiaobstructiva.Ausencia congénitade los conductosdeferentes | Inflamaciónposquirúrgica | 74 %-80 % de recuperación | TESE-ICSIDos pronúcleos 46 %.Embarazo 43 %(Silber S et al., 1994)61 | |
| Azoospermiaobstructiva | Complicacioneslocales fueron del3.9 % | 77 % de recuperación | Tasa de embarazo-ICSI19.5 %(Heidenreich A et al.,2000)65 | |
| Aspiración de espermatozoidestesticulares(TESA) o aspiración conaguja fina de espermatozoidestesticulares(TEFNA) | Azoospermiaobstructiva.Resección quirúrgica testicular | Anestesia general | NR | 11% ICSI,13 % implantación(Friedler S et al., 1997)57 |
| Aspiración percutáneatesticular guiada porultrasonido (USTSA) | Azoospermia inespecífica | Anestesia general | USTSA 94 % vs. TSA (no guiadapor ultrasonido) 83 % | No se encontrarondiferencias en tasa deembarazos(Belenky A et al., 2001)69 |
| MESA con estimulacióneléctrica | Ausencia bilateralcongénita de los conductos deferentes.Casos fallidos devasectomía | Anestesia general | NR | Estimulación eléctrica,hubo mayor recuperaciónen pacientes con falla en vasectomía(Yamamoto M et al.,1996)70 |
| Vaso-vasostomía (VVS) | Azoospermiaobstructiva | Complicacioneslocales fueron del3.9 % | 77 % de recuperación | Tasa de embarazo52 %(Heidenreich A et al.,2000)65 |
NR: no reportado; ICSI: por sus siglas en inglés, Intra-Cytoplasmic Sperm Injection.
En la mayoría de los casos las terapias y el mismo cáncer disminuyen la calidad espermática, la utilización de protocolos que conlleven radiación y/o quimioterapia la disminuyen aún más, los resultados de la utilización de células en reproducción asistida han sido reportadas de manera individual, mostrando diferencias y contradicciones entre ellos, la aparición de técnicas donde el número de células necesarias para la fecundación es mínima, como es el caso de la inyección intracitoplasmática de espermatozoides (ICSI, por sus siglas en inglés, Intra-Cytoplasmic Sperm Injection) y sus variaciones, hacen que las probabilidades de tener un hijo aumenten71-73.
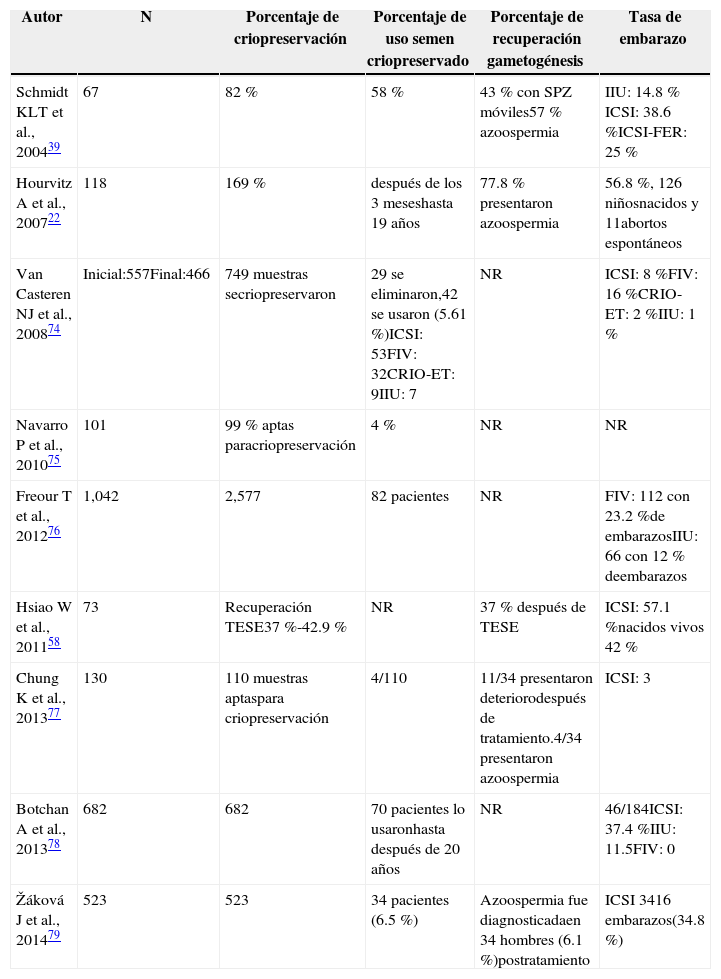
Parte de los estudios se muestran en la tabla 4, los resultados de estas investigaciones son una base científica a una opción de esperanza, por así llamarlo, para pacientes oncológicos que aún están indecisos en criopreservar. Muchos de estos varían tanto en la población estudiada, como en los métodos utilizados para realizar el estudio, las tasas de embarazos obtenidos varían dependiendo el tipo de tratamiento y el tipo de cáncer, la conclusión es que las técnicas de reproducción asistida más ICSI, tienen una mayor probabilidad de éxito y deben ser consideradas como una opción en ciclos con pacientes sobrevivientes al cáncer.
Tasas de embarazo con el uso de semen criopreservado de pacientes oncológicos.
| Autor | N | Porcentaje de criopreservación | Porcentaje de uso semen criopreservado | Porcentaje de recuperación gametogénesis | Tasa de embarazo |
|---|---|---|---|---|---|
| Schmidt KLT et al., 200439 | 67 | 82 % | 58 % | 43 % con SPZ móviles57 % azoospermia | IIU: 14.8 % ICSI: 38.6 %ICSI-FER: 25 % |
| Hourvitz A et al., 200722 | 118 | 169 % | después de los 3 meseshasta 19 años | 77.8 % presentaron azoospermia | 56.8 %, 126 niñosnacidos y 11abortos espontáneos |
| Van Casteren NJ et al., 200874 | Inicial:557Final:466 | 749 muestras secriopreservaron | 29 se eliminaron,42 se usaron (5.61 %)ICSI: 53FIV: 32CRIO-ET: 9IIU: 7 | NR | ICSI: 8 %FIV: 16 %CRIO-ET: 2 %IIU: 1 % |
| Navarro P et al., 201075 | 101 | 99 % aptas paracriopreservación | 4 % | NR | NR |
| Freour T et al., 201276 | 1,042 | 2,577 | 82 pacientes | NR | FIV: 112 con 23.2 %de embarazosIIU: 66 con 12 % deembarazos |
| Hsiao W et al., 201158 | 73 | Recuperación TESE37 %-42.9 % | NR | 37 % después de TESE | ICSI: 57.1 %nacidos vivos 42 % |
| Chung K et al., 201377 | 130 | 110 muestras aptaspara criopreservación | 4/110 | 11/34 presentaron deteriorodespués de tratamiento.4/34 presentaron azoospermia | ICSI: 3 |
| Botchan A et al., 201378 | 682 | 682 | 70 pacientes lo usaronhasta después de 20 años | NR | 46/184ICSI: 37.4 %IIU: 11.5FIV: 0 |
| Žáková J et al., 201479 | 523 | 523 | 34 pacientes (6.5 %) | Azoospermia fue diagnosticadaen 34 hombres (6.1 %)postratamiento | ICSI 3416 embarazos(34.8 %) |
NR: no reportado; ICSI: por sus siglas en inglés, Intra-Cytoplasmic Sperm Injection; IIU: inseminación intrauterina; FIV: fertilización in vitro; CRIO-ET: criotransferencia de embriones.
Los estudios realizados en células madre han abierto la posibilidad para una nueva opción de preservación de fertilidad, el trasplante de células germinales cultivadas in vitro y los injertos testiculares abren una nueva esperanza para la obtención y preservación de estos gametos80-82. También la criopreservación de células 1n (espermátides y/o espermatocitos) han alcanzado avances significativos en cultivos de maduración de espermatozoides83 y en trasplantes autólogos con separación de espermatogonias afectadas, esta última estaría indicada para niños que aún no han empezado la producción de espermatozoides, estos estudios se han realizado en primates y suponen buenos resultados a largo plazo15,84.
Otro campo interesante es el de la genómica. Grupos de investigación en cáncer como el del “Atlas del genoma del cáncer” (TCGA, por sus siglas en inglés, The Cancer Genome Atlas), busca realizar los mapas genéticos de los tipos y subtipos de cáncer, que ascienden a 200, el conocer el error genético y poderlo detectar abre un nuevo campo en el diagnóstico temprano, que hasta ahora ha sido la manera más relevante de curar junto con los medicamentos que tenemos en la actualidad85,86.
La detección de marcadores tumorales ha sido desde la última década parámetros determinantes en el diagnóstico temprano, actualmente ha ido en aumento su valor predictivo en recidivas postratamiento, tomando importancia clínica; los marcadores son sustancias producidas por las células normales que al tornarse cancerosas aumentan la concentración de estos, tanto en hiperplasias benignas como malignas, su diferenciación será importante y concluyente para la determinación del tratamiento; diversos estudios han llegado a presentar contradictorios resultados, debido a la diversidad de los diseños experimentales y la utilización de nueva tecnología hace que su repetitividad sea nula, aún así, estudios conjuntos con las ramas de la genómica, como la proteómica abren una esperanza para el avance en la detección temprana.
Los estudios realizados con células madre han estado limitados por el riesgo a la reaparición de células tumorales, se basa en la teoría de la señalización celular87, está aún en investigación y la capacidad de inactivarla será la mejor prueba para la radicación total del cáncer, estudios en el uso de telomerasas y enzimas de restricción podrían traer buenos resultados88-90.
ConclusionesEl manejo humano del paciente oncológico sin importar su edad es de cuidado y mucha paciencia, el acercamiento y las estrategias para desarrollar cualquier intervención u opción, sea la de un tratamiento nuevo o como en este caso de preservar su fertilidad, es de vital importancia.
Los avances en la investigación y en las técnicas de reproducción asistida cada vez obtienen mayores tasas de embarazos a término; la obtención de espermatozoides ya tiene varias técnicas que han sido perfeccionadas en los últimos años. Todo esto conforma la base para que le sea ofrecida esta opción. La esperanza es un bien psicológico para la aceptación y la recuperación de la calidad de vida después de un largo tratamiento, además de apoyar al fortalecimiento de lazos familiares tan importantes para estos casos y aún más en pacientes jóvenes y niños.
Por lo tanto, la criopreservación de semen es la principal opción para la preservación de la fertilidad, centros de reproducción asistida deben generar programas especiales para estos casos. La recomendación final es que se lleve a cabo antes de empezar cualquier tratamiento, la recuperación de procesos fisiológicos normales como la espermatogénesis es lenta, casi toma años y a veces no se da, la prevención debe ser fomentada y la utilización de estos servicios también.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
FinanciamientoNo se recibió patrocinio para llevar a cabo este artículo.