Revisar los mecanismos de acción de las bacterias probióticas, reportados en estudios in vitro, para la inhibición de bacterias cariogénicas.
MétodosSe realizó revisión exploratoria de literatura en PubMed, Scopus, Web of Science y Google Académico de artículos publicados desde el 2000 hasta 2021 en inglés y español, acerca de los mecanismos de los probióticos en la prevención de la caries dental.
ResultadosEn lo que concierne a la inhibición de microorganismos cariogénicos, se encontró que los probióticos poseen diversos mecanismos de acción dependiendo de la cepa estudiada, entre los cuales están la liberación de ácidos grasos libres, producción de peróxido de hidrógeno y bacteriocinas y la competencia por nutrientes.
ConclusiónLactobacillus es la cepa que ha sido más ampliamente estudiada in vitro como probiótico. La evidencia encontrada acerca de los mecanismos de acción sugiere que podrían ser útiles para la prevención de caries dental.
Review the action mechanisms involved in the inhibition of cariogenic bacteria reported in in vitro studies of probiotic bacteria.
MethodsA scoping literature review was performed in PubMed, Scopus, Web of Science, and Google Scholar of articles published from 2000 until 2021 in English and Spanish, about the mechanisms of probiotics for the prevention of dental caries.
ResultsRegarding the inhibition of cariogenic microorganisms, it was found that probiotics have different action mechanisms depending on the strain studied; among these are the release of free fatty acids, production of hydrogen peroxide and bacteriocins and the competition for nutrients.
ConclusionLactobacillus is the strain that has been most widely studied in vitro as a probiotic. The evidence found regarding their action mechanisms suggests that they could be useful for the prevention of dental caries.
El uso de probióticos no es algo nuevo, su historia data desde la antigüedad por egipcios y culturas orientales con la fermentación de la leche1. Sin embargo, en 1907, el científico ruso Elie Metchnikov sugirió que las bacterias ácido lácticas podrían reducir el pH en el colon, a través de la fermentación de la lactosa, inhibiendo el crecimiento de las bacterias proteolíticas, por lo que consideró que la ingesta de productos de consumo diario como la leche fermentada eran benéficos para la salud humana. En 1965, el término “probiótico” fue empleado por primera vez por Lilley y Stillwell, quienes lo describieron como sustancias secretadas por microorganismos que estimulan el crecimiento de otros2. En la actualidad, la Organización Mundial de la Salud (OMS) ha definido a los probióticos como “microorganismos vivos que administrados en cantidades adecuadas confieren un beneficio en la salud del huésped”3. En un meta-análisis de Ruszkowski et al. se analizaron 114 revisiones sistemáticas sobre el efecto de muy diversas cepas probióticas para el tratamiento o prevención de condiciones o patologías específicas4. Esto refleja la gran cantidad de literatura original que se ha publicado hasta el momento. Sin embargo, los únicos microorganismos probióticos, que aparecen en la lista de aditivos alimentarios aprobados por la Administración de Drogas y Alimentos de los Estados Unidos (FDA) hasta su última actualización (en abril del 2018), probióticos, reconocidos como seguros, son Lactobacillus bulgaricus (L. bulgaricus) y Streptococcus thermophilus (S. thermophilus)5.
Los beneficios clínicos de los probióticos han sido ampliamente estudiados en el sistema gastrointestinal, destacando el efecto de los probióticos en cuadros clínicos como diarrea asociada a antibióticos6. Además, los probióticos han sido probados como terapia de erradicación de Helicobacter pylori (H. pylori)7. Asimismo, han sido empleados en la prevención de enfermedades gastrointestinales, entre las que destaca la inflamación del íleon, la diarrea infecciosa, el síndrome del intestino irritable y la enfermedad por Clostridium difficile8. Por otro lado, también se ha postulado que son útiles en el área odontológica, para reducir la mucositis oral en pacientes con cáncer que han recibido quimioterapia, radioterapia o ambas intervenciones9. De igual forma, se han estudiado como terapia de prevención tanto para la enfermedad periodontal como de caries dental.
La caries dental es una enfermedad con alta prevalencia a nivel mundial, la cual produce daños irreversibles en los tejidos de los órganos dentarios. Existen distintos factores que intervienen en el desarrollo de la caries dental como la exposición a una dieta con gran contenido de carbohidratos fermentables y de alimentos con alta adherencia al esmalte dental; la patogenicidad de los microorganismos del ambiente oral; las características y cantidad de la saliva, así como la inmunidad del huésped10,11. En lo que concierne a los microorganismos, Streptococcus mutans (S. mutans) forma parte de la placa bacteriana y es el principal patógeno asociado al inicio de la caries dental12,13.
Las medidas de prevención de la caries dental están enfocadas en el uso de productos comerciales, entre los que destacan el uso de enjuagues bucales, pastas dentales, hilo dental, gomas de mascar y otros auxiliares de limpieza14. Actualmente, se están buscando nuevos enfoques de prevención de dicha enfermedad, uno de estos es el empleo de probióticos. Se han realizado diversos estudios clínicos sobre el uso de probióticos en el área de odontología, donde se ha reportado que el empleo de estos disminuye el conteo de S. mutans, así como la prevalencia de caries, en un 20%15,16.
A pesar de que existen diversos estudios in vitro en los que se ha demostrado que los probióticos inhiben la proliferación de bacterias cariogénicas17–19, aún no se define exactamente el modo de acción de los probióticos. Se ha propuesto, sin embargo, que los mecanismos de acción de los probióticos podrían ser:
- a)
las bacterias probióticas modulan las defensas del huésped a través del sistema inmune innato y adquirido;
- b)
las bacterias probióticas generan ácidos grasos (como el ácido láctico) a partir de la fermentación de carbohidratos y estos ácidos pueden atravesar las membranas celulares bacterianas y acidificar el citoplasma, lo que como consecuencia inhibe la proliferación bacteriana. Por su parte, el peróxido de hidrógeno (H2O2)
- c)
por su efecto altamente oxidante sobre los lípidos de la membrana celular y las bacteriocinas, que son péptidos catiónicos con acción bactericida o bacteriostático, mediante su unión a ciertos receptores crean un poro en las membranas y así despolarizan la célula objetivo o, pueden interferir con la formación del septo durante la división celular y;
la competencia por el medio o principio de exclusión competitiva, donde uno de los competidores siempre tendrá ventaja sobre el otro ya sea: 1) dificultando la adhesión de bacterias patógenas o; 2) compitiendo por los mismos nutrientes20.
MétodosEn orden de profundizar en los mecanismos de acción que se han propuesto para explicar el efecto positivo de los probióticos sobre la prevención de la caries dental se realizó una revisión exploratoria que tiene como objetivo brindar un panorama actual y comprehensivo de los posibles mecanismos de acción reportados en estudios in vitro de las bacterias probióticas para la inhibición de bacterias cariogénicas.
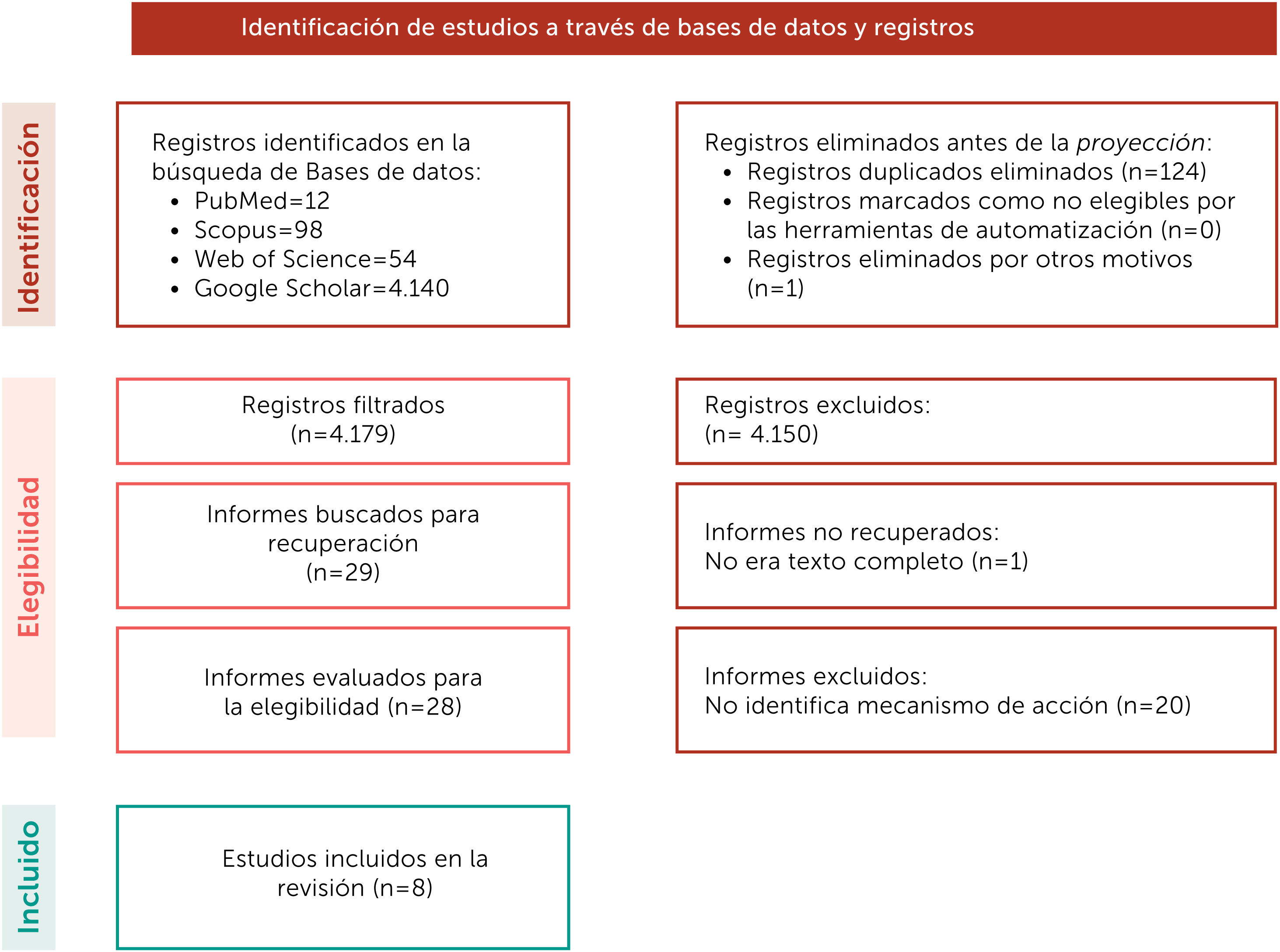
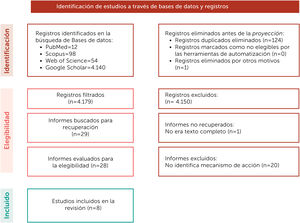
La presente revisión sistemática exploratoria se realizó siguiendo las recomendaciones de la red EQUATOR21. Dos revisores se encargaron de realizar la búsqueda de artículos acerca de los mecanismos de los probióticos para la prevención de la caries dental, los desacuerdos fueron consultados con un tercer revisor. Las bases de datos consultadas fueron PubMed, Scopus, Web of Science y Google Académico. La búsqueda se realizó de julio a diciembre del 2021. Dentro de los criterios de búsqueda se seleccionaron artículos de estudios in vitro publicados desde el año 2000 con restricción de idioma al inglés y español. La estrategia de búsqueda y algoritmos utilizados por cada base de datos se muestra en la tabla 1. El proceso de selección de los artículos a incluir, así como el proceso y motivo de exclusión se muestra en la figura 1. La información obtenida fue analizada y presentada bajo diferentes encabezados con el fin de sintetizarla para una mejor comprensión del tema.
Algoritmos utilizados en la estrategia de búsqueda
| Diseño de los estudios incluidos | Estudios in vitro |
| Pregunta de estudio | ¿Cuál es la evidencia reportada sobre los mecanismos de acción de los probióticos en la prevención de caries dental? |
| Bases de datos | Algoritmos utilizados |
| PubMed | “in vitro”+(“cariogenic bacteria” OR “cariogenic strain” OR “dental caries”)+“probiotics”+(“antagonism” OR “antibiotic-like” OR “mechanism” OR “inhibition” OR “bacteriocin” OR “reutin” OR “bacterial competition” OR “H2O2”) |
| Sin filtros | |
| Google Scholar | (“cariogenic bacteria” OR “cariogenic strain” OR “dental caries”)+“probiotics”+(“antagonism” OR “antibiotic-like” OR “mechanism” OR “inhibition” OR “bacteriocin” OR “reutin” OR “bacterial competition” OR “H2O2”)+“in vitro” |
| Filtro: 2000 a 2021. | |
| Scopus | “in vitro” AND “cariogenic bacteria” AND “probiotics” AND (“antagonism” OR “antibiotic-like” OR “mechanism” OR “inhibition” OR “bacterial competition”) |
| Sin filtros | |
| Web of Science | #1 (TS=“+(“probiotic”)) AND DOCUMENT TYPES: (Article) |
| #2 (TS=(“cariogenic bacteria” OR “cariogenic strain” OR “dental caries”) AND DOCUMENT TYPES: (Article) | |
| #3 (TS=“+(“antagonism” OR “antibiotic-like” OR “mechanism” OR “inhibition” OR “bacteriocin” OR “reutin” OR “bacterial competition” OR “H2O2”)) AND DOCUMENT TYPES: (Article) | |
| #4 (TS=“+(“in vitro)”)) AND DOCUMENT TYPES: (Article) | |
| #1 AND # 2 AND #3 AND 4. | |
| Indexes=SCI-EXPANDED, SSCI, A&HCI, CPCI-S, CPCI-SSH, BKCI-S, BKCI-SSH, ESCI |
La búsqueda arrojó 4.304 registros en las bases de datos utilizadas, se eliminaron 124 registros por duplicidad, posteriormente al evaluar el título y resumen se eliminaron 4.150 registros que no contestaban la pregunta de investigación y se descargaron 28 artículos completos, de estos se excluyeron 20 en donde no se identificaba el mecanismo de acción, quedando 8 artículos en la presente revisión (Tabla 2).
Estudios incluidos en la revisión de los mecanismos reportados de los probióticos para prevenir la caries dental
| Estudio | Cepa probiótica empleada | Mecanismo de acción de los probióticos en la prevención de caries dental |
|---|---|---|
| Samot et al. 201323 | Lactobacillus (66 cepas) | De las 66 cepas, sólo L. gasseri, L. paracasei, L. brevis, L. plantarum y L. acidophilus produjeron H2O2.L. plantarum, L. paracasei, L. rhamnosus y L. brevis son las cepas más involucradas en la inhibición de patógenos orales.Pero sólo L. brevis produjo H2O2, lo que confirma lo visto en algunos estudios que afirman que la producción de H2O2 no es el principal mecanismo de inhibición de los lactobacilos. |
| Tong et al., 201224 | L. lactis | L. lactis inhibe competitivamente el crecimiento de S. mutans, por competencia por nutrientes y por la acción de la bacteriocina nisina. |
| Lee et al. 201425 | B. bifidum,S. thermophilus,L. acidophilus,L. casei yL. rhamnosus GG | Los Lactobacillus inhiben fuertemente el crecimiento de Streptococcus.La cepa L. rhamnosus puede disminuir la formación de biopelícula al disminuir la producción de glucano de S. mutans.biopelícula al disminuir la producción de glucano de S. mutans.Disminuye también la actividad antibacteriana pero no se integra a la biopelícula. |
| Tahmourespour et al. 201126 | L. acidophilus | L. acidophilus reduce la adhesión de Streptococci (potencial cariogénico) probablemente por competencia por los sitios de adherencia o por los factores de crecimiento. |
| Tahmourespour et al. 201126 | L. acidophilus | L. acidophilus reduce la adhesión de Streptococci (potencial cariogénico) probablemente por competencia por los sitios de adherencia o por los factores de crecimiento. |
| Kang et al. 201127 | L. reuteri | L. reuteri tiene actividad antimicrobiana debido a la producción de H2O2, producción de ácidos orgánicos y reuterina. |
| Wasfi et al., 201828 | L. casei,L. reuteri,L. plantarum,L. salivarius | Lactobacillus sp. inhiben el crecimiento de S. mutans debido a la generación de ácidos orgánicos y producción de H2O2; reducen la adherencia celular y la biopelícula preformada; regulan negativamente varios genes de virulencia (incluidos los genes de tolerancia al ácido como genes atpD y aguD, genes productores de exopolisacáridos como gtfBCD y sacB y genes de detección de quórum como vicKR y comCD; y tiene un efecto inmunomodulador debido a la inducción de la producción de IFN-γ y la inhibición de la producción de IL-10. |
| Haukioja, et al. 200829 | L. rhamnosus,L. casei Shirota,L. reuteri SD2112 y BB12 | Lactobacillus sp. disminuyen la adhesión de las bacterias cariogénicas al modificar la composición proteica de la película salival. |
| Schwendicke et al.201430 | Bifidobacterium animalis BB12 inactivado por calor | BB12 inactivado por calor disminuye la adhesión y coagregación de las bacterias cariogénicas como S. mutans. |
Las cepas probióticas poseen características especiales e intrínsecas de cada especie y por tanto exhiben mecanismos distintos para la inhibición de la caries dental22.
LactobacilliSamot et al.23 realizaron ensayos de inhibición en donde se probaron 66 cepas salivales de Lactobacilli contra Actinomyces viscosus (A. vicosus) y S. mutans. Además, se realizó una prueba con proteinasa K para determinar si el efecto antibacteriano era atribuible a una proteína proveniente de las cepas probióticas. En sus resultados encontraron 4 cepas con mayor inhibición de las bacterias patógenas probadas, y fueron Lactobacillus plantarum (L. plantarum) (BMS2), Lactobacillus brevis (L. brevis) (22A, 31A, 57A1), Lactobacillus rhamnosus (L. rhamnosus) (34A) y Lactobacillus paracasei (L. paracasei) (CJS1). Además, se identificaron sólo a las cepas Lactobacillus gasseri (L. gasseri) (101A), L. paracasei (A24), L. brevis (21C, 22A), L. plantarum (BMS1), y Lactobacillus acidophilus (L. acidophilus) (B21, 21D) como cepas productoras de H2O2. En el mismo sentido, analizaron la expresión de los genes que codifican para la bacteriocina gassericina A y para la enzima glicerol deshidratasa; sin embargo, ninguna de las cepas probióticas con actividad inhibitoria expresó estos genes.
Tong et al.24 evaluaron la capacidad del Lactococcus lactis (L. lactis) (ATCC 11454) para antagonizar a la cepa S. mutans (UA159) en diferentes condiciones. Los ensayos de competencia bajo deficiencia nutricional, demostraron que L. lactis inhibe competitivamente el crecimiento de S. mutans. También, se analizó en la cepa L. lactis la expresión de algunos genes que regulan y controlan la síntesis de nisina (nisA, nisB, nisI y nisR) mediante la técnica de reacción en cadena de la polimerasa con transcriptasa inversa en tiempo real (RT-PCR) en presencia o ausencia de la cepa S. mutans. Estos resultados mostraron una expresión aumentada de los genes nisA, nisB y nisI, cuyos productos proteicos están relacionados con la detección de cuórum e involucrados en los mecanismos de comunicación entre especies dado por los metabolitos producidos por la cepa S. mutans. Así, L. lactis mantendrá sus ventajas en competencia con las bacterias patógenas. Demostraron además, que al inocularse primero la cepa L. lactis hay menor crecimiento de la cepa S. mutans, esto debido a la capacidad de producir bacteriocina nisina. Mediante el microscopio electrónico de barrido observaron la colonización de ambas bacterias sobre la superficie del esmalte, indicando que la cepa L. lactis puede disminuir la agregación de la cepa S. mutans. Además, observaron que después de la adhesión del microorganismo probiótico en la superficie del esmalte, ésta se encontró más lisa.
Lee et al.25 realizaron un estudio comparativo in vitro, a través de un modelo de biopelícula cariogénica. Los microorganismos probióticos que utilizaron fueron Bifidubacterium bifidum (B. bifidum), S. thermophilus y Lactobacillus (L. acidophilus, Lactobacillus casei (L. casei) (ATCC 334), L. rhamnosus GG (ATCC 53103)) y también usaron bacterias cariogénicas, Streptococcus gordonii (S. gordonii), S. mutans, Streptococcus oralis (S. oralis) y Streptococcus sanguinis (S. sanguinis); todos estos microorganismos integrados en saliva previamente recolectada.
Si bien las tres cepas de Lactobacillus mostraron una fuerte actividad antibacteriana para las cepas de estreptococos orales, la cepa L. rhamnosus fue la que inhibió intensamente la formación de biopelículas en comparación con L. acidophilus y L. casei. Por su parte, estas dos cepas se integraron en el modelo de biopelícula, no así la L. rhamnosus. Finalmente, las tres cepas de Lactobacillus redujeron la expresión de los genes glucosiltransferasas, pero la cepa L. rhamnosus la redujo significativamente. Estos resultados sugieren que L. rhamnosus puede inhibir la formación de biopelícula oral al disminuir la producción de glucanos por parte de S. mutans y por lo tanto, L. rhamnosus presenta un mayor potencial antimicrobiano contra dicha bacteria, al inhibir su integración en la biopelícula cariogénica, en comparación con las otras dos cepas probióticas estudiadas.
Tahmourespour et al.26 en un estudio in vitro determinaron la capacidad de formación de biofilm de S. mutans y no mutans, así como el efecto de L. acidophilus (DSM 20079) en la adherencia de algunos Streptococcus seleccionados. Aislaron 40 cepas de Streptococcus provenientes de placa y caries. De acuerdo con los resultados, se reportó que el 42% de los S. mutans eran fuertemente adherentes, mientras que, sólo el 23,5% de los S. no mutans también lo eran. Se observó una reducción de la adherencia de patógenos (mayor en S. mutans que en no mutans) en presencia de L. acidophilus. Además, se encontró una menor colonización con Streptococcus al inocular el probiótico antes que la bacteria patógena. Los autores hipotetizan que L. acidophilus compite por los sitios de adherencia y los factores de crecimiento.
Kang et al.27 determinaron la efectividad de tres cepas diferentes de Lactobacillus reuteri (L. reuteri) en la formación de biopelículas artificiales de S. mutans. En sus resultados demostraron que las cepas de L. reuteri inhibieron la proliferación y desarrollo de biopelículas de S. mutans. El efecto inhibitorio de las cepas se debió a la producción de H2O2, compuestos tipo bacteriocina y modificación del pH, además la cepa KCTC 3594 específicamente produjo bacteriocina reuterina. Además, evaluaron la neutralización de las cepas por medio de la modificación del pH, agregando catalasa y proteinasa K a los microorganismos probióticos, sin embargo, las tres cepas de L. reuteri neutralizadas pudieron inhibir el crecimiento de S. mutans. Finalmente, la cepa que demostró tener mayor efectividad sobre S. mutans fue L. reuteri (KCTC 3594).
Wasfi et. al.28 evaluaron el efecto de 4 cepas de Lactobacillus sobre el S. mutans mediante la determinación de inhibición de crecimiento, evaluación morfológica por microscopía electrónica de barrido y análisis de expresión de 10 genes relacionados con la producción de glucanos y fructanos, así como la tolerancia al ambiente ácido del S. mutans (gtfb, gtfc, gtfd, sacB, comC, comD, vick, vicR, aguD y atpD) mediante PCR en tiempo real. El equipo de investigación reportó que L. casei, L. reuteri, L. plantarum, y Lactobacillus salivarius disminuyen la adhesión, el crecimiento bacteriano y la resistencia del S. mutans mediante la reducción de la expresión de los genes envueltos en la producción de exopolisacáridos.
Bifidobacterium animalisHaukioja et al.29 utilizaron un modelo de la película salival sobre hidroxiapatita para determinar la adhesión de dos estreptococos orales, S. mutans y S. gordonii, después de estar en contacto con Bifidobacterium BB-12, B. dentium y B. longum y encontraron que, in vitro, la aglutinina salival gp340 y la peroxidasa salival disminuyeron después del tratamiento con probióticos. Por lo cual, dos mecanismos estarían involucrados, interferencia con la adhesión de las bacterias cariogénicas con el esmalte y la degradación de la peroxidasa a través de estas bacterias probióticas.
Schwendicke et al.30 empleando cultivos de biopelículas de probiótico Bifidobacterium animalis (B. animalis), subespecie lactis BB12, en una boca artificial evaluaron la pérdida de minerales, el pH y la cantidad de bacterias de las biopelículas. Se encontró que los probióticos tienen un efecto antiadherente, antimicrobiano y de coagregación, los cuales se postularon como mecanismos de acción. Los autores comprobaron la efectividad anticariogénica de BB12 en el esmalte y en superficies de la dentina utilizando bacterias viables y bacterias inactivadas por calor. Las bacterias BB12 inactivadas redujeron significativamente la cariogenicidad de S. mutans. Por lo que concluyeron que la cepa B. animalis BB12 inactivada es adecuada para el control de caries.
DiscusiónSi bien el desarrollo de la caries dental es multifactorial, esta patología está marcada por un cambio en la composición de la microbiota supragingival. Este cambio de composición puede estar mediado por el consumo dietético frecuente de carbohidratos fermentables.
Debido a la dureza relativa de las frutas, verduras y carnes, el dolor dental y la pérdida de los órganos dentarios pueden restringir la capacidad de comer alimentos saludables ya que el paciente busca alimentos más blandos y generalmente hipercalóricos (productos derivados de harinas y lácteos). Por otro lado, estas condiciones también pueden generar una disminución global de la ingesta de alimentos, afectando en ambos casos el estado nutricional del individuo31,32.
Asimismo, existen interacciones sinérgicas entre organismos acidúricos y acidogénicos, los cuales aumentan su proliferación y pueden modificar el ambiente en que se desarrolla la microbiota y con ello sus caracteristicas fenotipicas33. Esta ruptura de la homeostasis en la composición de la comunidad microbiana se conoce como disbiosis y es un fenómeno común de las enfermedades mediadas por microbiomas34. Debido a lo anterior, cambios moderados en los hábitos dietéticos y el consumo de probióticos podrían formar parte del tratamiento complementario para la prevención de la caries dental35.
Se han realizado estudios clínicos basados en el consumo de probióticos para inhibir la caries dental con la finalidad de comprobar su efectividad sobre S. mutans, no obstante, la OMS declara que antes de realizar estudios in vivo, es necesario realizar estudios in vitro para definir un candidato probiótico36. Al momento, la evidencia proveniente de estudios in vitro sugiere que la mayoría de los Lactobacillus estudiados presentan propiedades adherentes, actividad antimicrobiana contra especies patógenas, son productoras de H2O2, además de competir por nutrientes. En el mismo sentido, las Bifidobacterium poseen efecto adherente, antimicrobiano y de coagregación, así como competencia por nutrientes19,37.
En los últimos 20 años las publicaciones en el área médico-odontológico han aumentado de manera importante. Sin embargo, diversas publicaciones cuentan con resultados divergentes y muchas veces lo observado en estudios in vitro o in vivo no necesariamente se refleja en la clínica38–41. De ahí surge la importancia de la medicina basada en evidencia que permita un análisis en conjunto de la evidencia publicada mediante la revisión sistemática. Si bien, los resultados de estudios in vitro son valiosos estos no deben extrapolarse directamente al contexto clínico, se debe tener la precaución de evitar recomendar ciertos productos comerciales probióticos sin eficacia comprobada a través de ensayos clínicos aleatorizados con bajo riesgo de sesgo y alta calidad.
Limitaciones del estudioLa revisión sistemática exploratoria, aunque permite identificar conceptos clave y vacíos en la investigación, dentro de su simplificación con respecto a los otros tipos de revisiones sistemáticas, dado que se utilizan un número menor de bases de datos en la búsqueda, es posible que no se encuentren algunos reportes. Además, en la revisión exploratoria se puede omitir el registro del protocolo, así como la evaluación de calidad y sesgo de los artículos incluidos lo que puede generar sesgos dentro de la revisión sistemática realizada. Sin embargo, a pesar de que existen listas de cotejo para los estudios in vitro, no existen herramientas de evaluación de sesgo y calidad validadas y certificadas para este tipo de estudios. Por lo que, inicialmente la revisión sistemática exploratoria es un enfoque adecuado para tener una aproximación de los mecanismos de acción de los probióticos en estudios in vitro, lo cual puede ser complementado posteriormente con una revisión sistemática en ensayos clínicos controlados30,42.
ConclusiónLactobacillus como probiótico para la prevención de caries es la cepa que ha sido más ampliamente estudiada in vitro, presentando propiedades de inhibición de adhesión y del crecimiento de cepas cariogénicas. Además, estos probióticos compiten por nutrientes y modifican la patogenicidad de bacterias cariogénicas. Sin embargo, para recomendar su uso en la clínica se requieren más investigaciones y ensayos clínicos controlados.
Declaración de conflicto de interésLos autores declaran no tener ningún conflicto de interés.
Financiamiento AgradecimientoYLPL agradece a CONACYT por su beca de posgrado (No. 771456), LAF agradece al Programa de Cátedras CONACyT. Los autores agradecen al cuerpo académico UABJO-CA-63 por el apoyo.