Las Infecciones Asociadas a la Atención Sanitaria (IAAS) por Microorganismos Multirresistentes (MOMR), son una realidad generadora de brotes intrahospitalarios difíciles de erradicar. Dentro de las formas de manejo internacionalmente aceptadas destacan el uso racional de antimicrobianos y el aislamiento de los casos detectados. Para detectar los casos, CLC realiza simultáneamente tres tipos de vigilancia y frente a la presencia de MOMR en cualquiera de estas vigilancias, se establecen medidas de aislamiento de contacto. El objetivo del presente trabajo es evaluar el estado de colonización por MOMR en pacientes trasladados desde otro centro asistencial, mediante cultivo nasal y rectal.
Material y métodoSe definió como paciente trasladado, cualquier paciente que estuvo hospitalizado o que haya recibido atención en un Servicio de Urgencia de cualquier centro asistencial y desde el cual fue trasladado a CLC. Se analizó el 100% de las muestras estudiadas de pacientes trasladados sujetos a búsqueda activa de MOMR en el período entre julio de 2007 y diciembre de 2012.
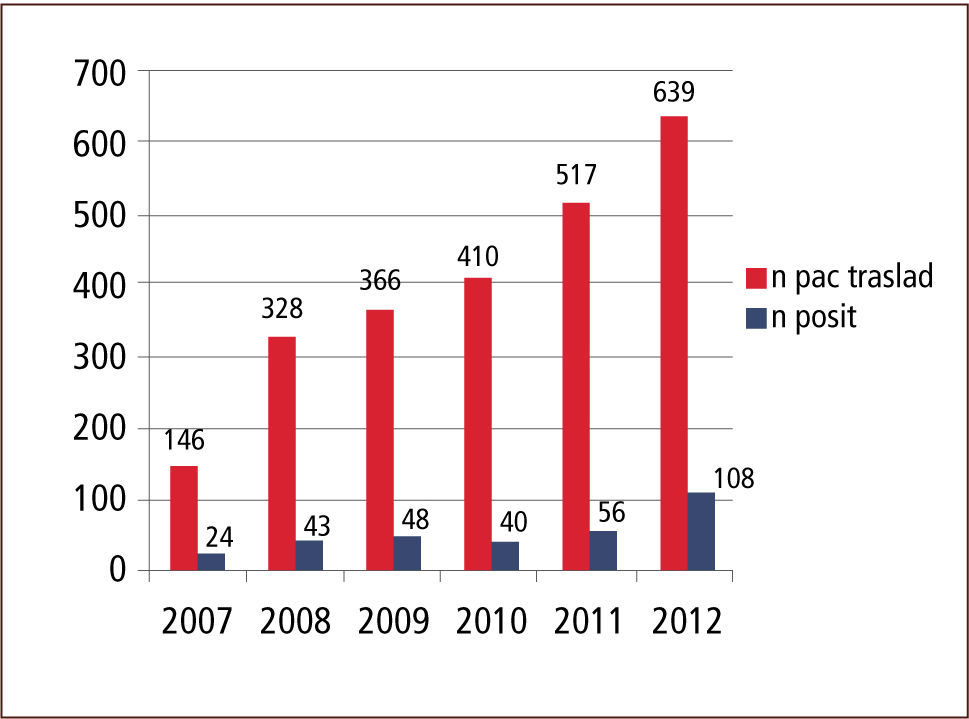
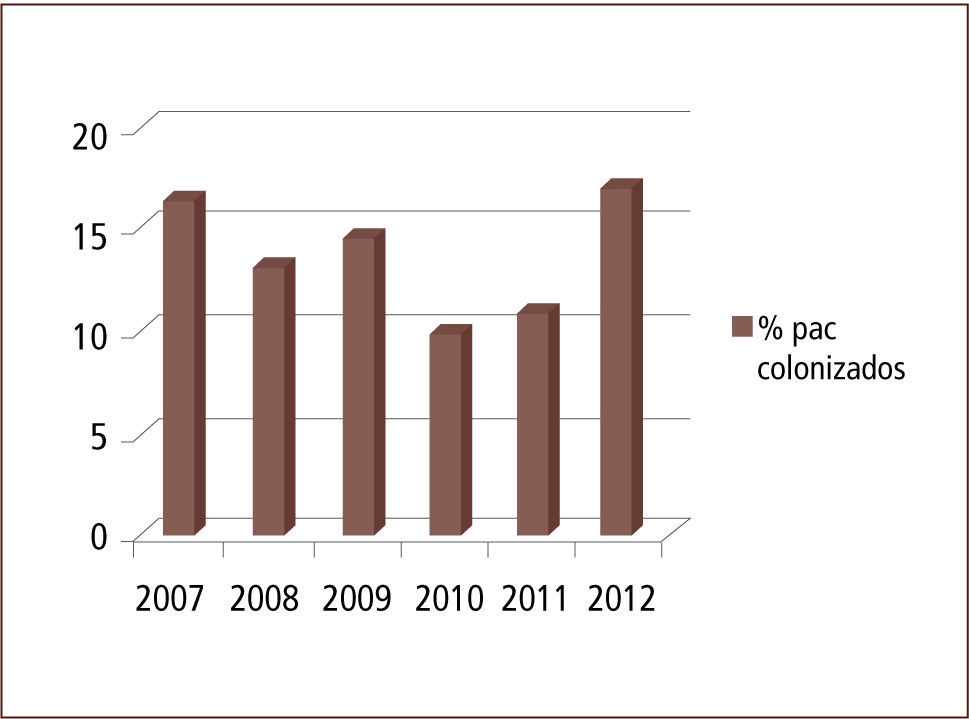
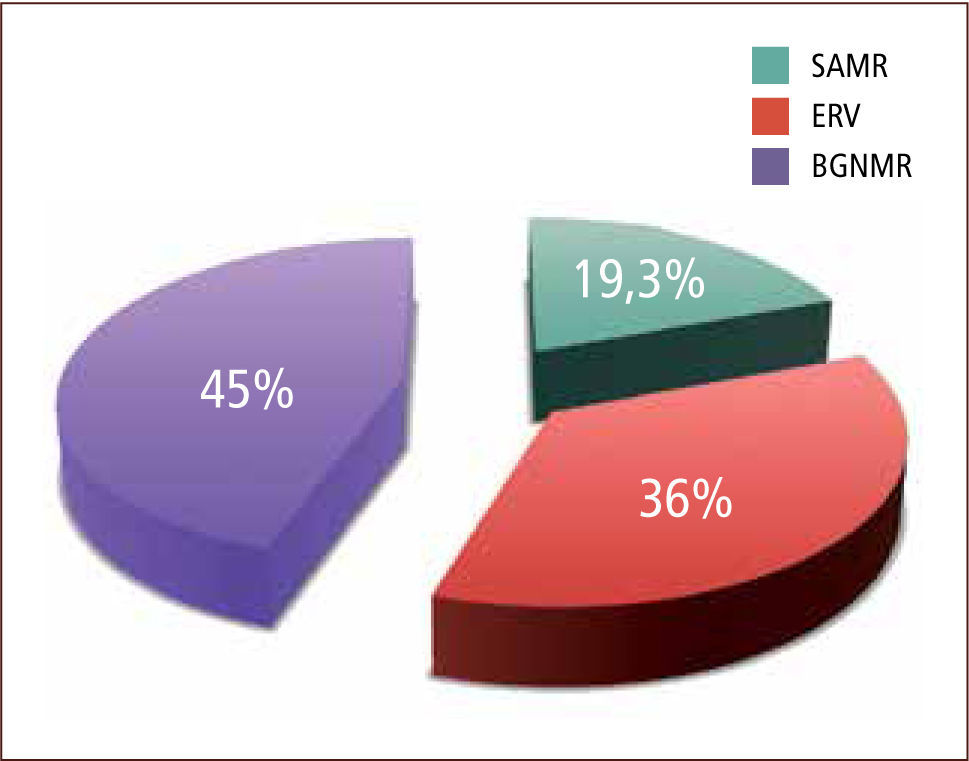
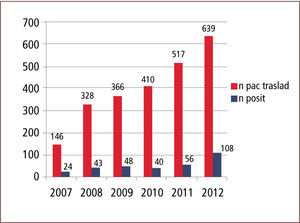
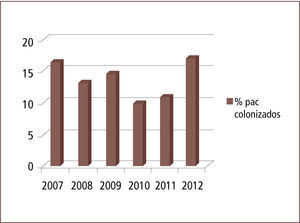
ResultadosEn los años estudiados la tasa de positividad para MOMR osciló entre 16,4% y 9,8%. La distribución por MOMR, para el conjunto de los años en estudio, fue la siguiente: SAMR un 20–25%; ERV, entre 35 y 49% y; B Gram negativos un 38–60%. Por otro lado, la sensibilidad del sistema de vigilancia evaluada durante el primer semestre de 2010 fue de un 91% para aislamiento y de un 93% para los cultivos. En base a los resultados obtenidos durante primer semestre de 2011 de características de pacientes colonizados, se estableció el 2012 un algoritmo que considera: centro de origen, edad, tiempo de permanencia en centro de origen y unidad de destino, para definir la necesidad de dejar o no a un paciente trasladado con medidas de aislamiento. Esto permite realizar una acción más racional y costo-efectiva para el control de MOMR en nuestro establecimiento, reduciendo la carga de aislamientos y cultivos en un 20%.
Healthcare Associated Infections (HAI) by multidrugresistant microorganisms (MDRO), are nosocomial infections difficult to eradicate. The internationally accepted forms of management are: rational use of antimicrobials, and isolation of cases detected. To identify cases, CLC performes three types of monitorization: a) search for rectal colonization with VRE, as national legislation; b) From July 2007, actively seeks these microorganisms in patients transferred from another medical center, by nasal and rectal culture at entry; and c) laboratory active surveillance reporting MDROs found in clinical samples as critical value by telephone. When an MDRO was present in any of the three types of surveillance, contact isolation measures were established. The aim of this study is to assess the colonization status with MDRO in patients transferred from another medical center by nasal and rectal culture.
Material and methodsWe defined as transferred patient, any patient who had been hospitalized or has received attention in any health center and has been transferred to CLC. The total of transferred patients in the period July 2007 to June 2012 were analyzed.
ResultsIn the years studied, the rate of positivity for MDRO of patients transferred from another institution ranged between 16.4% and 9.8 %. The proportion of MDRO for all the years of study was: 20–25% MRSA,35–49% VRE, and 38–60% Gram negative bacilli. Furthermore, the sensitivity of the surveillance system evaluated during the first half of 2010 stood at 91% for isolation, and 93 % for culture. Based on the results obtained, we defined in 2012 an algorithm that considered: center of origin, age, time spent in center of origin and destination to determine the need to leave or not a patient transferred on isolation measures. This allows for a more rational action and control MDRO in our establishment, reducing the burden of isolation and cultures by 20%.
Las Infecciones Asociadas a la Atención de Salud (IAAS) por microorganismos multirresistentes (MOMR), es una realidad cada vez más frecuente en las instituciones hospitalarias (oscilando entre 20% de E.coli BLEE+ en pacientes hospitalizados, hasta un 75% de E.faecium resistentes a Vancomicina en pacientes de Unidades Críticas) (1). Lo anterior constituye un desafío para el manejo antimicrobiano así como para los equipos de Prevención y Control de Infecciones, ya que de no ser detectados a tiempo pueden generar brotes intrahospitalarios con consecuencias económicas y de morbimortalidad no deseados (2–4). Se ha estimado que al menos un 70% de las bacterias que causan una IAAS son resistentes a uno o más antimicrobianos utilizados habitualmente para su tratamiento (5). Entre éstas, las que presentan mayor relevancia, tanto por su frecuencia como por su patogenicidad, se encuentran:
- 1)
Enterococcus spp. resistente a Vancomicina (ERV);
- 2)
Staphylococcus aureus resistente a Meticilina (SAMR);
- 3)
Enterobacterias productoras de betalactamasas de espectro extendido (blee+) y en el último tiempo también productoras de carbapenemasas.
- 4)
bacilos Gram negativos no fermentadores (Acinetobacter baumannii, Pseudomonas aeruginosa, Stenotrophomonas maltophilia, etc.), multirresistentes y pan-resistentes (MR) (6–9). Por otra parte, existe evidencia de que el estado de portación previo por un MOMR, favorece el desarrollo posterior de un cuadro infeccioso propiamente tal por ese MOMR (4–6).
Las formas internacionalmente aceptadas para controlar la presencia de estos microorganismos y evitar su diseminación incluyen, por un lado, el uso racional de antimicrobianos y por otro, el aislamiento de los casos que son detectados como portadores o infectados, ya sea por vigilancia activa o cultivos clínicos (10–13). En 2006, CDC publicó recomendaciones para el manejo de MOMR en pacientes hospitalizados, las cuales consideran como elemento central la realización de cultivo de vigilancia a los pacientes que provengan de otra institución, manteniéndolos en aislamiento de contacto hasta que se descarte su estado de portador (14–17).
Considerando los antecedentes expuestos y con el objetivo de detectar pacientes que estén colonizados o infectados por MOMR, en Clínica las Condes se realiza desde julio de 2007 la búsqueda activa de éstos en pacientes trasladados desde otro centro asistencial, mediante cultivo nasal y cultivo rectal al momento del ingreso.
A continuación se presenta la metodología utilizada para realizar vigilancia activa y los resultados obtenidos desde el inicio del programa en julio de 2007.
Material y Método- a)
Se definió como paciente trasladado, cualquier paciente que estuvo hospitalizado o haya recibido atención en un Servicio de Urgencia de cualquier centro asistencial y que desde ese centro asistencial haya sido trasladado a CLC.
- b)
El paciente trasladado queda con medidas de aislamiento de contacto en la unidad donde ingresa y se obtienen muestras nasal y rectal, que son enviadas al laboratorio de microbiología para cultivo y estudio de susceptibilidad.
- c)
Las muestras, una vez ingresadas al laboratorio, son estudiadas mediante inoculación de tórula en Agar sangre, Agar McConkey y Agar Cromógeno VRE. La identificación de microorganismos recuperados en estos medios, se realiza mediante pruebas bioquímicas convencionales o tarjeta de identificación Vitek 2 Compact. El estudio de susceptibilidad se realiza mediante difusión en disco (Kirby-Bauer), E-test o tarjeta AST Vitek2 Compact, según protocolos establecidos en la institución, para cada microorganismo identificado. La detección de betalactamasas de espectro extendido se realiza mediante método de doble difusión en disco, según recomendaciones de CLSI. Desde 2012 se realiza además screening de carbapenemasas, mediante la incorporación de disco de Ertapenem en el estudio de susceptibilidad de enterobacterias.
- d)
Se definió como MOMR en vigilancia: ERV (Enterococcus spp.resistente a Vancomicina), SAMR (Staphylococcus aureus resistente a Meticilina), Enterobacterias productoras de betalactamasa de espectro expandido (principalmente K.pneumoniae, E.coli y Proteus spp. BLEE+), y Bacilos No Fermentadores (BNF) con resistencia a tres o más grupos de antimicrobianos con efectividad comprobada contra ese BNF. Para efectos de análisis, se sumó las enterobacterias BLEE+ y los BNF Multirresistentes en un solo grupo, ya que ambos tipos de bacterias corresponden a Bacilos Gram Negativo Multirresistentes(BGN MR).
- e)
Frente a la detección de un MOMR en cualquiera de las muestras procesadas, se mantienen las medidas de aislamiento de contacto durante toda la hospitalización.
- f)
Se analizó el 100% de las muestras estudiadas de pacientes trasladados sujetos a búsqueda activa de MOMR en el período comprendido entre julio de 2007 y diciembre de 2012.
- g)
Con el objeto de evaluar la sensibilidad de esta vigilancia, durante el primer semestre de 2010 y de 2011, se revisaron los registros del 100% de los traslados buscando:
- 1.
La existencia de aislamiento al ingreso.
- 2.
La toma de cultivos de acuerdo al protocolo.
- 1.
- h)
Posteriormente, durante el primer semestre de 2011 se evaluó la correlación entre positividad de cultivos y: tipo de establecimiento de procedencia (público o privado); grupo etario (adulto, pediátrico, Recién Nacido); tiempo de permanencia en centro de procedencia (mayor o menor a 24hrs.); y tipo de unidad a la que viene destinado (unidad crítica o no crítica), con el objetivo de definir con mayor precisión los criterios para dejar o no con medidas de aislamiento a un paciente trasladado, al momento de su ingreso en CLC.
- i)
Solamente se determinó la frecuencia de portación o colonización, expresado en porcentaje del total de pacientes estudiados para cada grupo, sin realizar análisis de significancia estadística de las diferencias observadas.
- •
Entre 2007 y 2012 el número de pacientes trasladados aumentó progresivamente y la positividad para MOMR de los pacientes trasladados desde otra institución osciló entre 9,8% y 16,61% (gráficos 1 y 2).
- •
El cumplimiento del programa de aislamiento de pacientes trasladados desde otra institución y cultivos de vigilancia activa, evaluado en 2010 y 2011, fue de 93% y 90% respectivamente.
- •
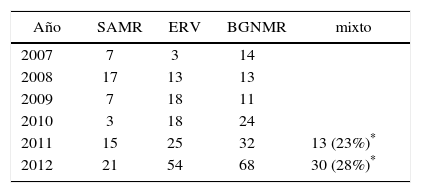
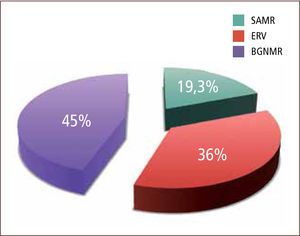
La distribución por MOMR para el conjunto de los años en estudio fue: SAMR 20 a 25%, ERV 35 a 49% y Gram negativos MR 38 a 60% (tabla 1 y gráfico 3).
- •
Existe un porcentaje de pacientes (hasta 26% de los pacientes colonizados), que vienen colonizados con más de un MOMR, en su mayoría incluye un bacilo Gram negativo MR. Esta información está disponible sólo desde 2011.
- •
Se analizó las características y factores asociados del 100% de pacientes que venían trasladados desde otra institución e ingresaron a CLC, entre enero y agosto de 2011 (359 pacientes consecutivos), obteniéndose los siguientes resultados (tablas 2, 3, 4 y 5):
- a)
En relación a grupo etario, los adultos trasladados presentan un porcentaje de colonización por MOMR más alto que los niños y que los Recién Nacidos (12,4%; 3,7%; y 6,3% respectivamente) (Tabla 2).
- b)
En cuanto a tipo de Servicio al que llegan (UTI o no UTI), los pacientes de Unidades Críticas presentan mayor grado de colonización (adultos 16,8% y niños 5,9 %) (Tabla 2).
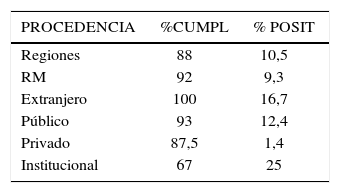
- c)
No se observa diferencia entre pacientes provenientes de regiones y de Región Metropolitana. Los pacientes que vienen del extranjero presentan mayor porcentaje de colonización (tabla 3).
- d)
Se observa que pacientes provenientes de centros privados en general presentan porcentaje de colonización menor que los provenientes del sistema público de salud (1,4% vs 12,4%) (tabla 3).
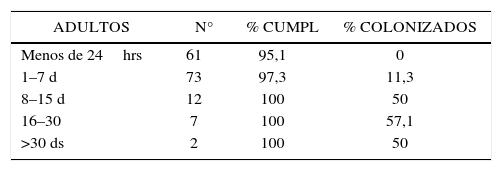
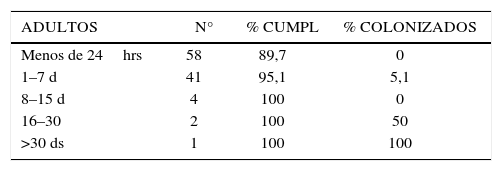
- e)
A mayor tiempo de permanencia en el centro de origen, mayor probabilidad de estar colonizado por un MOMR, con cero casos detectados en pacientes que permanecieron menos de 24hrs. en el centro de origen (tabla 4 y 5).
- a)
- •
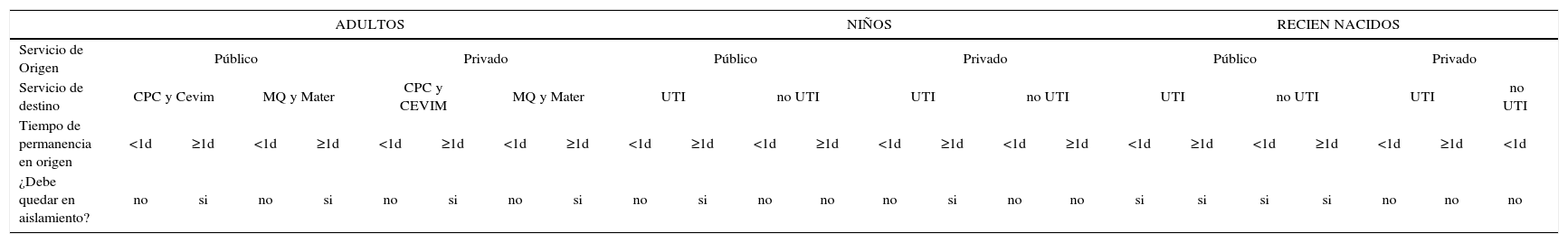
Según los resultados obtenidos en 2011, se creó un algoritmo que considera centro de origen y tiempo de permanencia en él, edad y unidad de destino para definir la necesidad de aislamiento (tabla 6).
Tabla 6.Algoritmo a seguir para aislamiento y cultivos de vigilancia en pacientes trasladados desde otra institución, al ingreso en CLC
ADULTOS NIÑOS RECIEN NACIDOS Servicio de Origen Público Privado Público Privado Público Privado Servicio de destino CPC y Cevim MQ y Mater CPC y CEVIM MQ y Mater UTI no UTI UTI no UTI UTI no UTI UTI no UTI Tiempo de permanencia en origen <1d ≥1d <1d ≥1d <1d ≥1d <1d ≥1d <1d ≥1d <1d ≥1d <1d ≥1d <1d ≥1d <1d ≥1d <1d ≥1d <1d ≥1d <1d ¿Debe quedar en aislamiento? no si no si no si no si no si no no no si no no si si si si no no no
- •
Los pacientes que llegan trasladados desde otras instituciones son fuente de contagio de MOMR, ya que uno de cada siete llega colonizado, siendo potencial generador de brote. La distribución por MOMR fue para el conjunto de los años en estudio de: SAMR un 20–25%, ERV, entre 35 y 49% y de B Gram negativos osciló entre 38–60%. Hay un porcentaje de pacientes (hasta 26%) que vienen colonizados con más de un MOMR. En más del 90% de los casos de colonización mixta, hay un bacilo gram negativo involucrado. Esto está descrito en la literatura (18,19).
- •
Por otro lado, la sensibilidad del sistema de vigilancia evaluada durante el primer semestre 2010 y 2011 fue de 93 y 90 % respectivamente.
- •
En base a los resultados obtenidos durante el primer semestre de 2011 de características de pacientes colonizados, se estableció en 2012 un algoritmo que considera: centra de origen, edad, tiempo de permanencia en centro de origen y unidad de destino, para definir la necesidad de dejar o no a un paciente trasladado con medidas de aislamiento. Esto permite realizar una acción más racional y costo-efectiva para el control de MOMR en nuestro establecimiento, reduciendo la carga de aislamientos y cultivos en un 20%.
- •
Cabe destacar que no se encontró diferencia entre pacientes provenientes de regiones y de Región Metropolitana, pero sí hubo una diferencia de casi diez veces entre el porcentaje de colonización observado en pacientes provenientes del sistema público al compararlo con el sistema privado. Esto muy posiblemente refleja la disponibilidad de recursos para implementar medidas de aislamiento en las diferentes realidades del país.
- •
Llama la atención que en el grupo de pacientes analizados, ningún paciente que haya permanecido menos de 24hrs. en el centra de origen venía colonizado con algún MOMR, y como era de esperar, a mayor número de días de permanencia en el centro de origen, se observó mayor frecuencia de colonización. Sin embargo, con posterioridad al estudio, se han encontrado en forma aislada en nuestra institución, casos de pacientes que habiendo permanecido menos de 24hrs. en el centro de origen, llegaron colonizados con MOMR. Existe evidencia en la literatura respecto de la mayor probabilidad de estar colonizado, a mayor tiempo de permanencia en un centro asistencial (20).
- •
Los ERV vigilados de acuerdo a la normativa del Minsal (vigilancia activa de ERV mensual en pacientes de unidades críticas con más de cinco días de hospitalización), representan solo el 36,6% de los MOMR generadores de Infecciones Asociadas a la Atención Sanitaria. Los bacilos Gram negativos multirresistentes también constituyeron un posible riesgo que conviene seguir vigilando, ya que un 45 % de los pacientes trasladados que llegaron colonizados, vinieron con uno de estos microorganismos MR.
- •
La mayor parte de las publicaciones y del desarrollo tecnológico para detectar pacientes colonizados (mediante técnicas de biología molecular), están orientados a cocáceas Gram positivo (ya sea ERV o SAMR), posiblemente debido a una mayor dificultad para detectar multirresistencia en Gram negativos comparado con la detección de una sola resistencia (vancomicina o meticilina, según sea el caso).
- •
Por último, como Comité de Prevención y Control de IAAS, consideramos que es necesario avanzar como país en el estudio de otros MOMR, y no focalizarse exclusivamente en las bacterias Gram positivas como se ha hecho hasta ahora (21).
Los autores declaran no tener conflictos de interés, en relación a este artículo.