Mujer de 65 años, portadora de linfoma difuso de células B grandes quien presentó falla respiratoria catastrófica por COVID-19. Se inició soporte con oxigenación por membrana extracorpórea. Posteriormente, desarrolló macroaglutinación y trombosis arteriovenosa multisistémica. ¿Qué factor activó la cascada de coagulación?
A 65-year-old woman, with diffuse large B-cell lymphoma and catastrophic respiratory failure due to COVID-19, requiring extracorporeal membrane oxygenation support. She developed macro agglutination and multisystem arterio-venous thrombosis. Which factor activated the coagulation cascade?
Desde la publicación, en 1856, de la fisiopatología del tromboembolismo pulmonar por Rudolf Virchow, cuando se estableció la tríada que lleva su nombre, la coexistencia de estasis sanguínea, daño endotelial e hipercoagulabilidad son parte de los ejes de análisis de todo fenómeno de coagulación que enfrentan los médicos clínicos1. Aunque se han identificado múltiples etiologías para estos tres fenómenos, hay situaciones clínicas en las que la coexistencia de causas se convierte en una avalancha procoagulante inmanejable, dejando aún muchas oportunidades de mejora en el manejo de casos complejos.
La presencia de factores predisponentes, como ciertos elementos genéticos específicos y una variedad de factores adquiridos, es cada vez más común en los pacientes. Entre estos factores adquiridos se encuentran estados inflamatorios como sepsis, neoplasias y enfermedades sistémicas, uso de fármacos procoagulantes, y daño directo causado por cirugías o dispositivos invasivos2–4. Estas condiciones son especialmente prevalentes en pacientes que requieren un mayor nivel de soporte médico, siendo la unidad de cuidados intensivos (UCI) el entorno donde se conjugan en mayor medida estos elementos.
Epidemiológicamente, la enfermedad tromboembólica venosa tiene una incidencia en la población general de 70 a 180 casos por cada 100.000 habitantes, aumentando a un 2% en hospitalización general, 10% en pacientes de UCI y a un 45% en pacientes en oxigenación por membrana extracorpórea (ECMO)5,6. Por otra parte, la enfermedad tromboembólica arterial sigue representado un problema clínico escasamente comprendido e investigado, siendo el origen cardioembólico y el síndrome antifosfolipídico las dos etiologías más frecuentemente asociadas a trombosis arteriales en sitios atípicos7. A su vez, la enfermedad relacionada al SARS-CoV-2 (COVID-19) se asocia a un aumento de incidencia de enfermedad tromboembólica (venosa y arterial), con una prevalencia del 11% en pacientes hospitalizados por dicha patología8.
Presentamos el caso de una paciente con múltiples eventos trombóticos arteriovenosos de causa multifactorial, donde la macroaglutinación fue un signo precoz de aparición de trombosis sistémicas.
Caso clínicoMujer de 65 años, con antecedente de linfoma difuso de células grandes B (LDCB), en tratamiento con quimioterapia en fase estable y esquema completo de inmunización contra COVID-19. Se hospitaliza por insuficiencia respiratoria secundaria a neumonía por COVID-19. Debido a su progresión clínica, se realiza tomografía computarizada (TC) pulmonar, que mostró lesiones compatibles con neumonía en organización. Se incrementó la dosis de esteroides sistémicos, conforme al protocolo local, a dexametasona endovenosa 20mg al día durante cinco días, requiriendo eventualmente intubación orotraqueal, conexión a ventilación mecánica invasiva y posición prono al séptimo día de internación. Se complementó estudio con angioTC de tórax que demostró tromboembolismo pulmonar multilobar, iniciándose anticoagulación. Se realizó una videobroncoscopía, que fue compatible con aspergilosis pulmonar invasora tanto por aspecto macroscópico como por detección de antígeno galactomanano, tratándose con voriconazol y anidulafungina.
La paciente progresó a falla multiorgánica, por lo que se apoyó con hemofiltración para contener el balance hídrico. No obtante, su falla respiratoria continuó progresando por lo que se conectó a ECMO veno-venoso al día doce de hospitalización. Siguiendo el protocolo local, se traslapó anticoagulación a heparina sódica, manteniendo el rango terapéutico definido durante toda la hospitalización, sin desarrollar trombocitopenia inicial. Se ajustó el esquema antimicrobiano a meropenem empírico, además de isavuconazol, anidulafungina y anfotericina B desoxicolato nebulizada y tópica mediante instilación por videobroncoscopía.
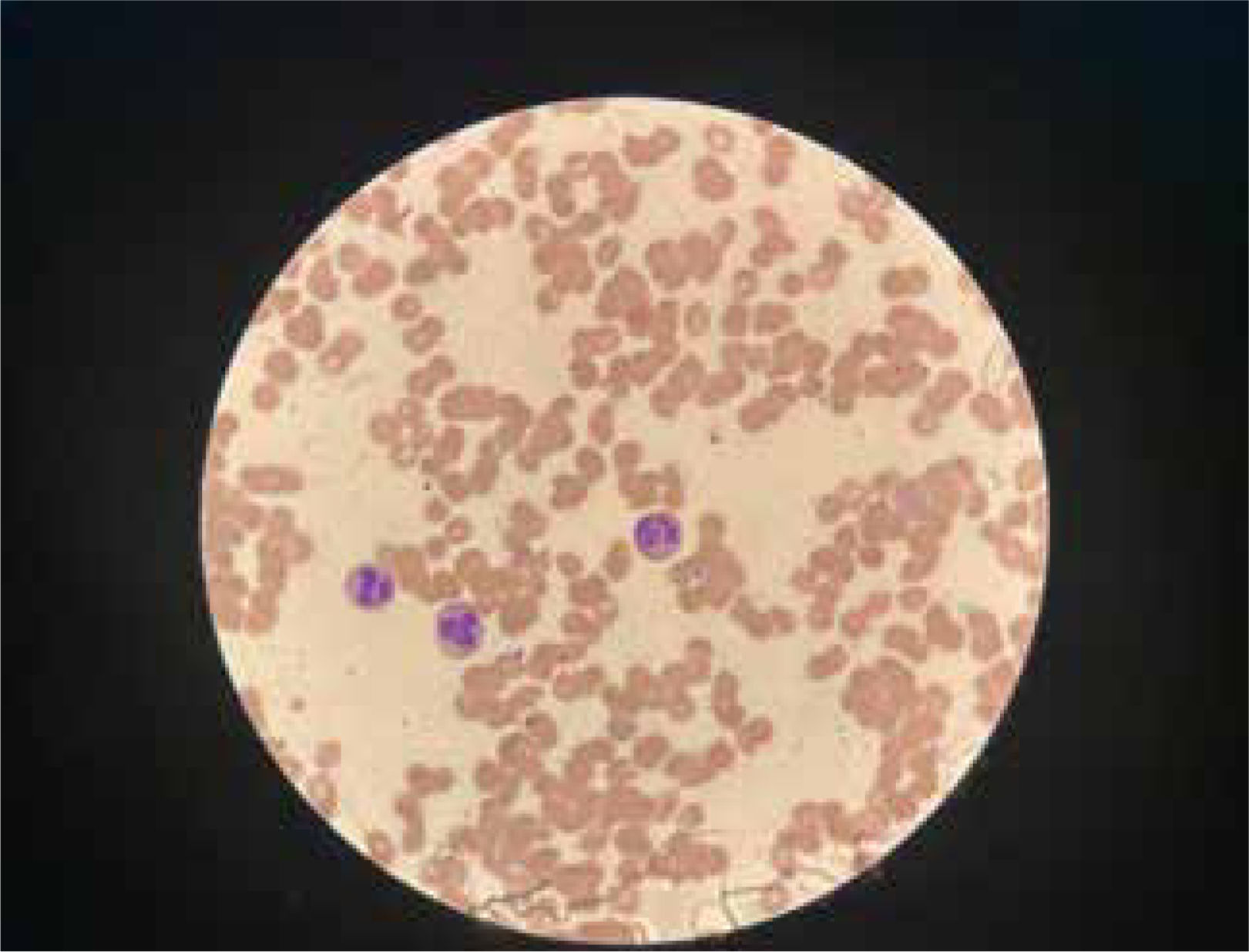
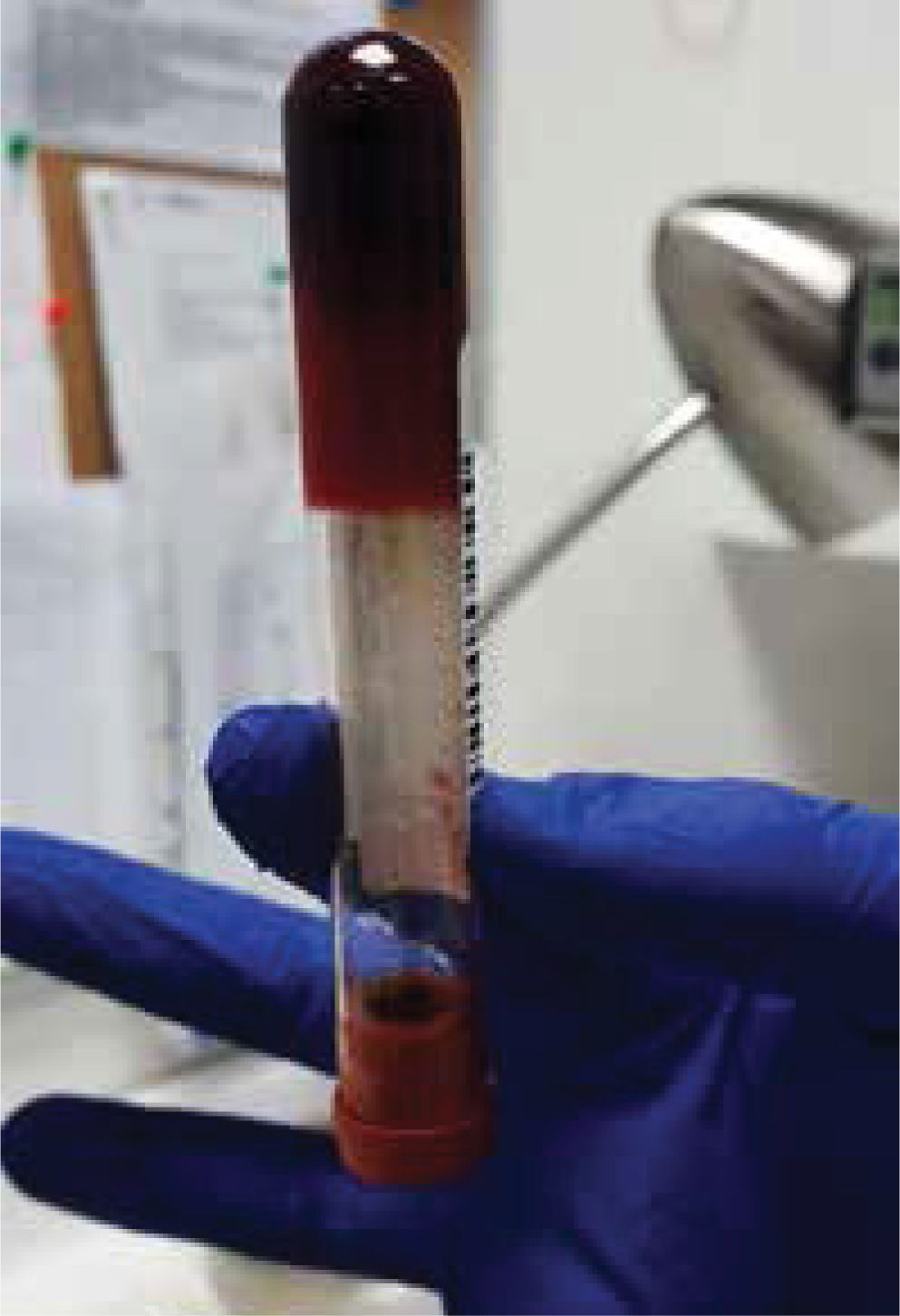
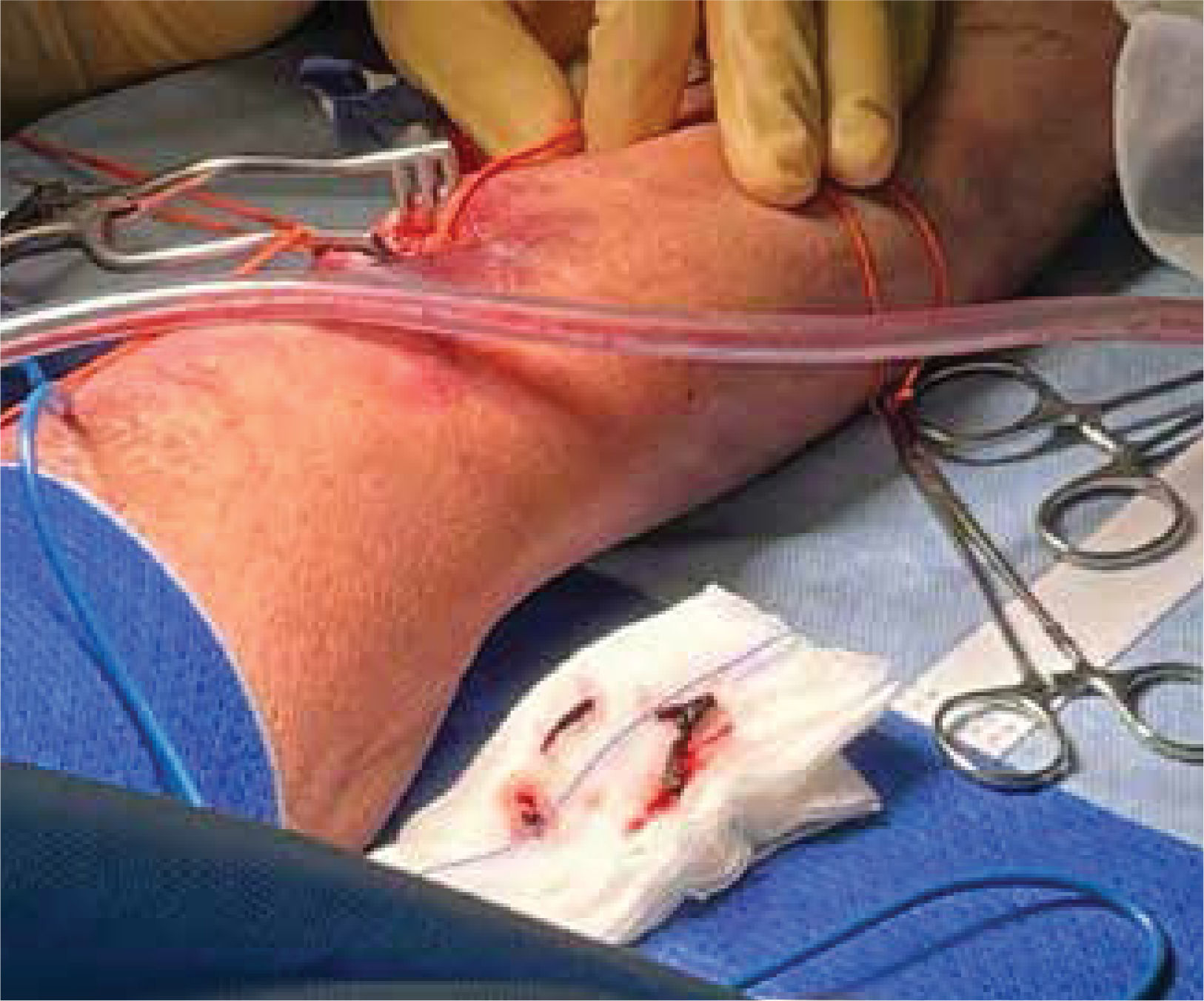
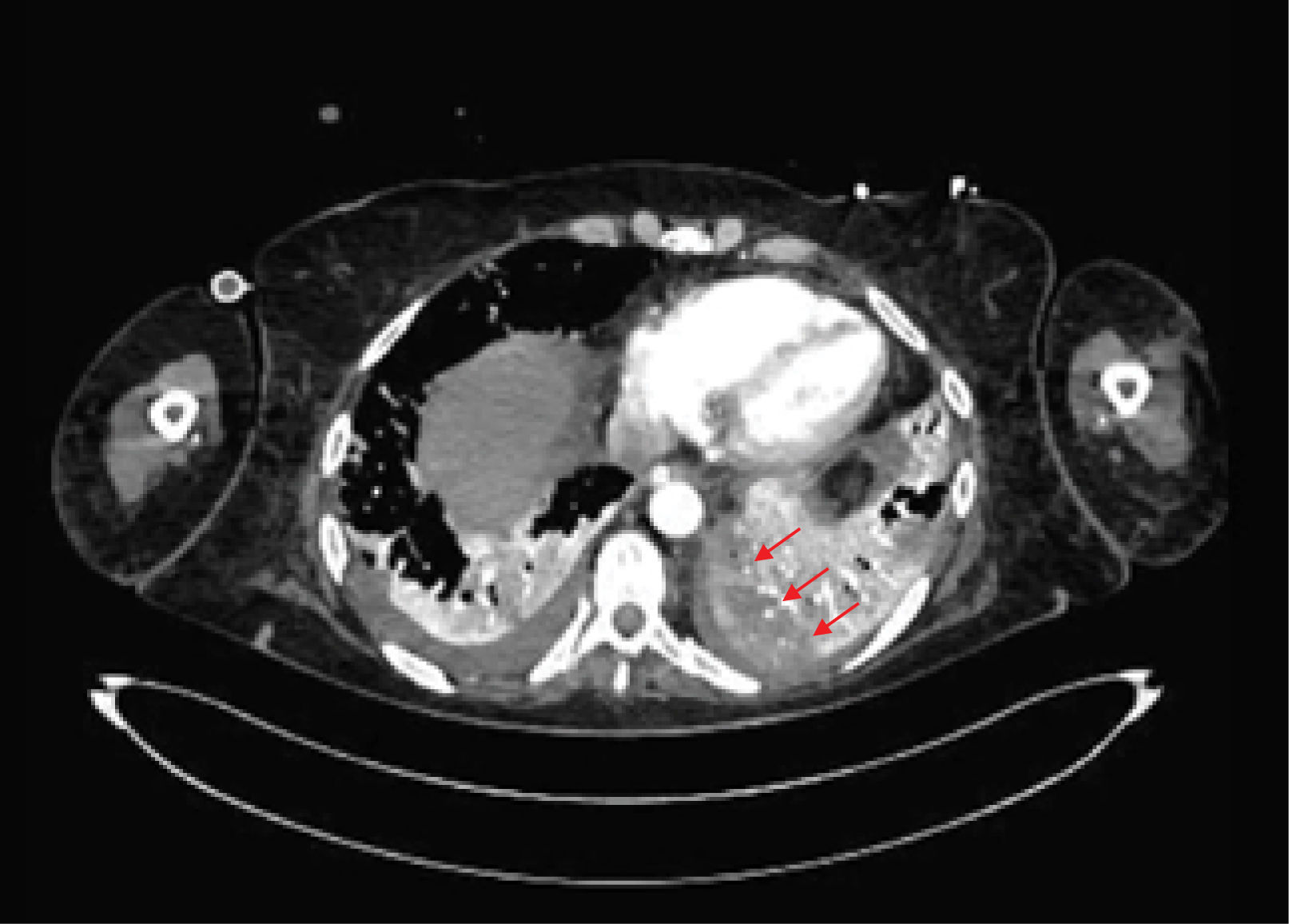
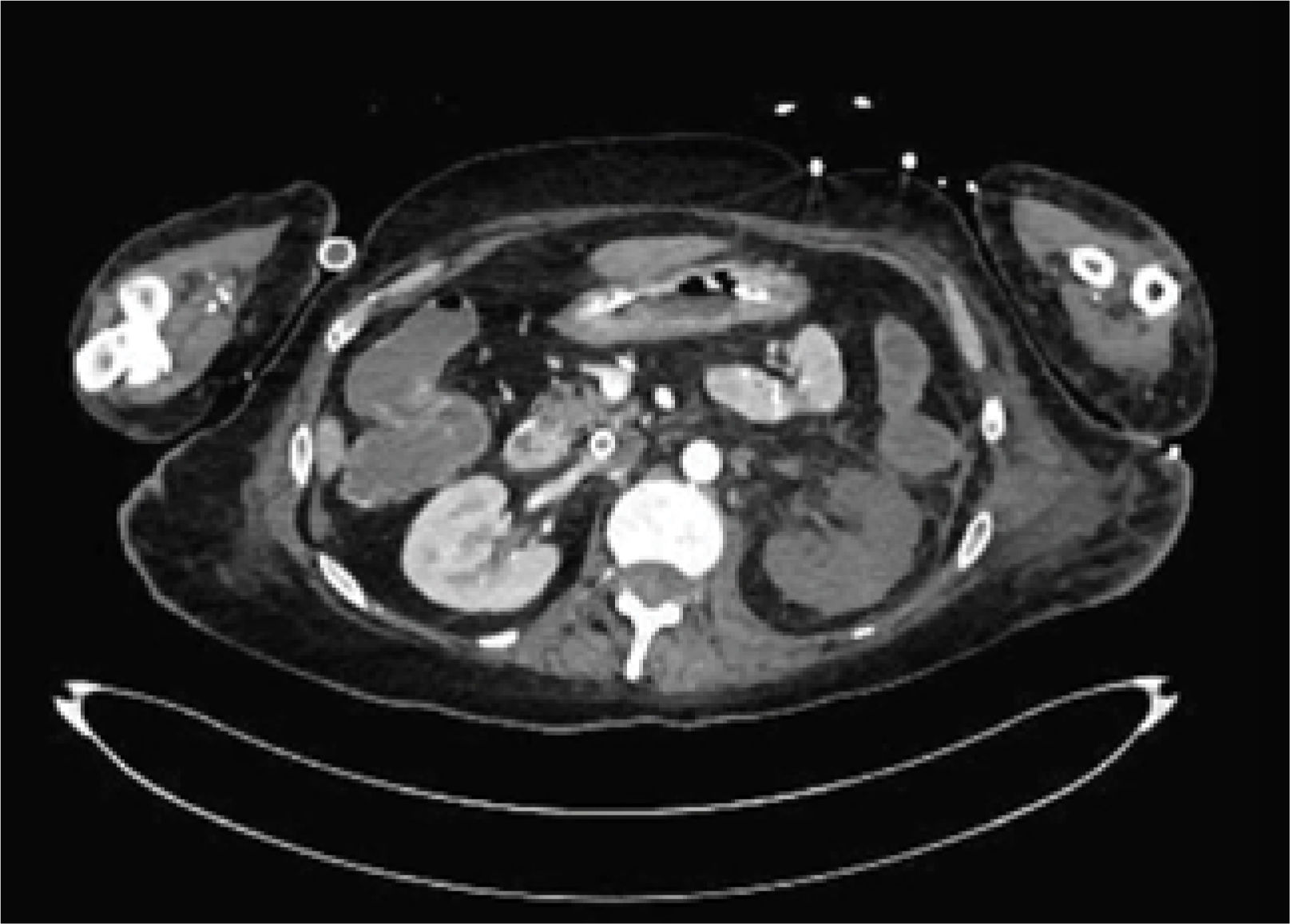
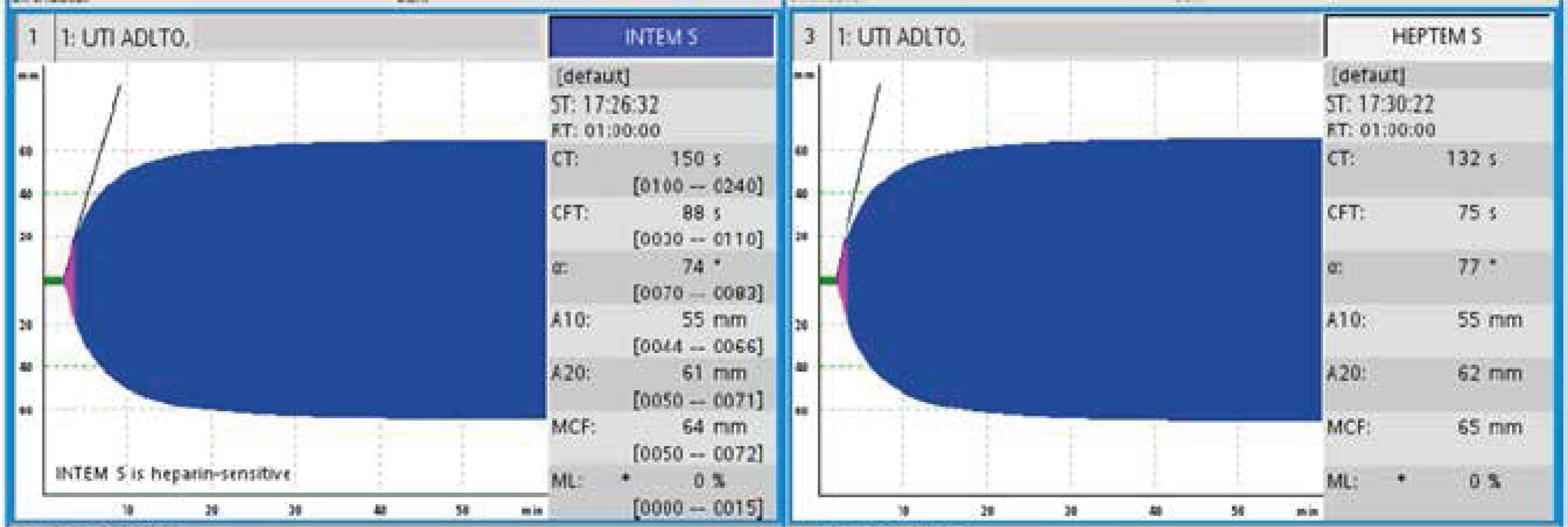
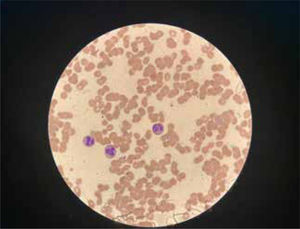
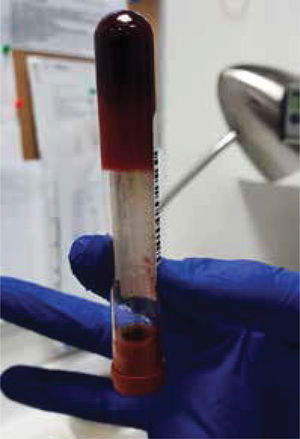
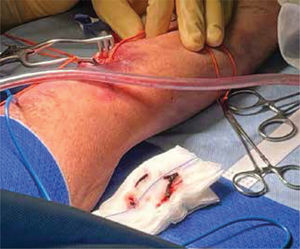
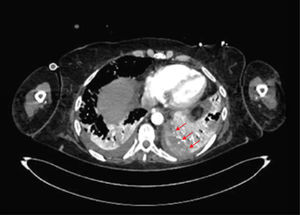
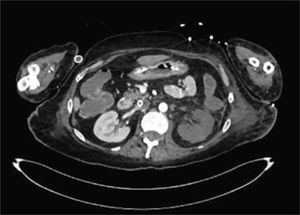
La unidad de hematología informó fenómenos progresivos de aglutinación de hematíes a nivel microscópico (figura 1) y, posteriormente, macroscópico (figura 2), con un aumento progresivo de lactato deshidrogenasa (LDH) y hemoglobina libre concurrente, sin alteración del tiempo de protombina, ni ascenso de la bilirrubinemia. Presentó, además, un fibrinógeno persistentemente elevado; solo se vio caída significativa de hemoglobina y recuento plaquetario las últimas 36 horas de evolución. Las pruebas de Coombs directo e indirecto fueron negativas. En el día dieciocho de internación, sexto de ECMO, la paciente desarrolló síntomas de oclusión arterial en mano derecha. Ecografía Doppler color confirmó trombo en arteria radial a pesar de anticoagulación en meta y ausencia de invasión arterial, realizándose embolectomía quirúrgica (figura 3). Concomitantemente, presentó en laboratorio un aumento persistente de la hemoglobina libre en plasma (pHb) hasta 30mg/dl. La paciente progresó con clínica de nuevos fenómenos tromboembólicos en extremidad contralateral y disfunciones hepáticas y hemodinámicas sobreagregadas, por lo que se complementó estudio con angioTC tórax, abdomen y pelvis que informó tromboembolismos multisistémicos arteriales y venosos en territorios esplénicos, hepáticos, renales y pulmonares lobares múltiples nuevos, así como un tromboelastograma que confirmaba hipercoagulabilidad y ausencia de fibrinolisis (figuras 4 y 5). No hubo evidencia de trombosis en el circuito de ECMO.
Se discutió en equipo multidisciplinario la evolución de eventos y ante la falta de opciones terapéuticas y la refractariedad a tratamientos instaurados se acordó adecuación de esfuerzos terapéuticos. Paciente fallece tras 19 días de internación.
DiscusiónLa evolución tórpida en este caso clínico genera diversas interrogantes en cuanto a los factores que determinaron el desenlace fatal de los acontecimientos. Las variadas complicaciones que incurrieron durante la internación de la paciente fueron un desafío para el equipo tratante. La hipótesis, transversal a todos los especialistas que intervinieron en el seguimiento de la paciente, es que el desarrollo de un desbalance entre factores pro y anti coagulantes fue determinante para la evolución del caso.
En el caso presentado destaca el antecedente de neoplasia, que es un ejemplo clásico de un estado procoagulante. De acuerdo con distintas líneas de estudio, las células tumorales expresan diversas proteínas como, por ejemplo, el factor tisular (FT), el cual juega un papel fundamental en la aparición de trombosis en el cáncer. Hay indicios que la expresión de dicho factor puede verse aumentado en procesos inflamatorios concomitantes que curse el paciente9. Los procesos infecciosos, entendidos como estados proinflamatorios, pueden generar una sobreexpresión del FT, llevando así a un estado de aún mayor hipercoagulabilidad.
En este caso particular, la infección es por SARS-CoV-2, virus que además tiene factores procoagulantes propios como es la proteína de espiga que ha sido ampliamente estudiada por sospecharse su asociación con los eventos trombóticos tan habituales que han presentado estos pacientes a nivel mundial. Las investigaciones en pos de dilucidar este mecanismo, han encontrado relación entre la proteína espiga y los glicoconjugados en las superficies de los glóbulos rojos (GR), otras células sanguíneas y células endoteliales, siendo clave estas uniones para la infectividad del virus y además para la morbilidad agregada, ya que in vitro se han evidenciado fenómenos de hemaglutinación asociados a esta interacción10,11. Por otro lado, siguiendo la línea de estados infecciosos que aumentan la “morbilidad protrombótica” de la patología oncológica de base, esta paciente además de COVID-19 presentó coinfección con aspergilosis invasiva. Parte de la fisiopatología de esta enfermedad es la invasión vascular por Aspergillus, causando trombosis de las pequeñas arterias y, algunas veces, de los vasos pulmonares mayores, además de infartos hemorrágicos del tejido pulmonar. Las trombosis mayores requieren tratamiento urgente para prevenir embolias sistémicas mortales12.
En este contexto de hiperinflamación: infección viral y fúngica, cáncer, quimioterapia, y disfunción multiorgánica, se agregó hemofiltración y ECMO; dos técnicas de soporte vital artificial que inducen hemólisis, perpetuación del estado inflamatorio y liberación de pHb, la cual está asociada a “secuestro” de óxido nítrico, pudiendo provocar una vasoconstricción exagerada. Concomitantemente la pHb plasmática elevada predispone a trombosis sistémicas, ya sea arteriales o venosas13,14.
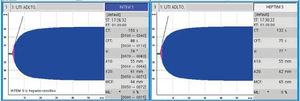
Tras el inicio del ECMO es indefectible la aparición de una reacción inflamatoria inmediata y compleja, similar a la observada en el síndrome de respuesta inflamatoria sistémica (SIRS). En ese momento, cuando la sangre del paciente entra en contacto por primera vez con la superficie extraña del circuito extracorpóreo, se activan diversas cascadas coagulativas e inflamatorias15. Las complicaciones hemorrágicas y trombóticas siguen siendo las principales causas de morbilidad y mortalidad en pacientes con ECMO. Con la llegada de los oxigenadores de menor resistencia, nuevos recubrimientos más biocompatibles y diferentes técnicas de manejo global, las complicaciones trombóticas han disminuido, pero aún así no se ha logrado eliminar este factor de morbilidad asociado que tiene la técnica per se16. Una de las maneras de disminuir este fenómeno, es anticoagular a los pacientes. Es por esto que la vasta mayoría de los pacientes están anticoagulados, ya sea con heparina sódica, bivalirudina o similares. Nuestra paciente mantuvo anticoagulación con heparina sódica, controlando con TTPK, que se mantuvo en rango terapéutico durante su conexión a ECMO. Una vez informado el proceso de aglutinación de los hematíes, se controló de forma seriada con tromboelastometría rotacional (ROTEM®), con tiempo de coágulo (CT) normal pese a heparina e hipofibrinolisis (figura 6) y Coombs directo e indirecto negativos. Adicionalmente se pudo ver un aumento de la pHb cercano temporalmente al proceso de aglutinación y posterior trombosis sistémica, evolución que resulta fuera de la tendencia habitual de un paciente en ECMO sin otras patologías de base. Esto hizo mantener la sospecha clínica de que este fenómeno respondía a múltiples causas y no solo al circuito.
La hemaglutinación es la agrupación de hematíes debido a la presencia de anticuerpos o bien de lectinas. La vía de la lectina del sistema del complemento puede activar el sistema de coagulación in vitro, pero no está claro su papel en la activación hemostática y la trombosis in vivo17. El mecanismo por el cual se generan los anticuerpos o la interacción con lectinas no está del todo dilucidado, pero el contexto es casi siempre en pacientes críticos con coexistencia de procesos de inflamación sistémica.
Dentro de nuevos mecanismos relevantes a considerar en la trombosis sistémica, y particularmente en aquellas asociadas a COVID-19 y estadios proinflamatorios, es el de la activación de neutrófilos y liberación de material nuclear que lleva a la formación de estructuras llamadas trampas extracelulares de neutrófilos, teniendo un rol relevante en la activación endotelial18, como la que se ha sospechado. De la misma forma, se ha descrito el rol de los multímeros de alto peso molecular del factor Von Willebrand como uno de los marcadores de disfunción endotelial y micro trombosis asociada a COVID-1919. Dichos elementos pudieron empeorar la situación protrombótica de esta paciente.
Ante este panorama, es crucial buscar herramientas de predicción temprana y eficaces para detectar la hipercoagulabilidad y trombosis. En este contexto, la macroaglutinación de glóbulos rojos vuelve a cobrar relevancia como un predictor a tener en cuenta. A pesar de su importancia, este fenómeno ha sido eclipsado por marcadores más recientes y sofisticados; no obstante, la utilidad clínica de la macroaglutinación no debe subestimarse. Como se muestra en el estudio de Nader et al. en 2021, los cambios reológicos sanguíneos asociados con el COVID-19, particularmente la hiperagregación de glóbulos rojos, se relacionan con la hipercoagulabilidad, la cual es secundaria a la infección viral. Este caso es un ejemplo reciente de la reaparición de la aglutinación y agregación como un factor relevante20.
Otras patologías que pudiesen haber contribuido al desarrollo de hemólisis, aglutinación y trombosis sistémica son el síndrome antifosfolípido, homocisteinemia, vasculitis, trombocitopenia inducida por heparinas, entre otras. Se desestimó su estudio dado el deterioro rápidamente progresivo de la paciente, así como por la imposibilidad de ajustes terapéuticos en caso de diagnósticos alternativos. La rapidez en la evolución de los eventos trombóticos sistémicos con fallo multiorgánico asociado llevó a tomar la decisión de la adecuación de esfuerzos terapéuticos.
ConclusiónLa conjunción e interacción de todos los factores enunciados (estado procoagulante de una enfermedad onco-hematológica, el potencial efecto aglutinante de la enfermedad por COVID-19, la alteración del endotelio con la consiguiente inflamación inducida por la sepsis, y la hemólisis inducida por dispositivos mecánicos con la liberación concomitante de pHb) hacen sospechar que la balanza de la hemostasia, donde de manera natural en un individuo sano se mantiene un equilibrio constante de efectos pro y anticoagulantes, se inclinó a una situación de pérdida de autorregulación hematológica. Dichas circunstancias llevaron al desarrollo de múltiples episodios trombóticos sistémicos, donde ni siquiera la mantención de un TTPK en rango de anticoagulación pudo evitar la precipitación de factores que llevaron a la aglutinación de los elementos formes de la sangre, detonando una cascada de reacciones cruzadas donde el resultado fue la trombosis generalizada con deterioro sistémico irreversible e intratable.
Esta situación poco frecuente de aglutinación hemática nos lleva a plantearnos si existe algún factor particular de la cascada de coagulación que interactúe con lectinas, si habrá anticuerpos derivados de la hemólisis, o si hay alguna molécula aún no estudiada que interactúe en este complejo sistema. Sospechamos que varios factores de la coagulación perdieron su equilibrio homeostático, y que la anticoagulación con heparina puede haber perdido su acción en contexto de esta compleja interacción, pero desconocemos el mecanismo por el cual sucedió, considerando que la paciente mantuvo TTPK en rango, con el proceso de hipercoagulabilidad evidenciado por un resultado de ROTEM® con CT normal pese a heparina e hipofibrinolisis. Lo que sí fue consistente, previo a la alteración de las otras pruebas diagnósticas, fue la aglutinación observada en los frotis llevándonos a plantear que la búsqueda y seguimiento de estas alteraciones debe ser parte del análisis seriado de estos pacientes.
Declaración de conflictos de interésNinguno de los autores del presente estudio declara conflictos de interés relacionados con el contenido del mismo.