La infección fetal por citomegalovirus (CMV) es la causa más común de infección fetal congénita, puede provocar muerte fetal, neonatal, así como graves secuelas en la infancia. Es la causa infecciosa más importante de pérdida de la audición neurosensorial y retardo mental. Su incidencia en el mundo varía entre 0,5 y 1% de los recién nacidos y nuestro país no está al margen de este flagelo, con cifras reportadas que van entre 1 y 2% de los recién nacidos (RN). Estudios chilenos de seroprevalencia, en embarazadas del sistema público, demuestran que alrededor del 95% de las ellas tienen anticuerpos contra el virus, lo que significa que la infección primaria en el embarazo es infrecuente en esta población. Sin embargo, la infección fetal y sus graves secuelas pueden ocurrir tanto en una primoinfección como en una reactivación o reinfección (infección no primaria), ocurridas generalmente durante el primer trimestre del embarazo.
La dificultad en el diagnóstico materno y la falta de evidencia de un tratamiento efectivo, fueron por largo tiempo factores que desincentivaron el cribado universal. Nuevos avances en herramientas de diagnóstico y tratamientos más efectivos desafían esta concepción y hacen cada día más imperioso el diagnóstico precoz de la infección materna, para evitar el pasaje transplacentario y secuelas en fetos infectados.
En esta publicación comenzaremos describiendo un caso clínico de infección fetal a las 28+2 semanas de embarazo, detectado por alteraciones al ultrasonido, que recibió tratamiento in utero. Luego revisaremos algunos conceptos epidemiológicos, los mecanismos propios de la infección por CMV, así como su patogenia y elementos nuevos del diagnóstico y tratamiento que creemos presionan fuertemente hacia el cribado universal en el embarazo.
Fetal infection by cytomegalovirus (CMV) is the most common cause of congenital fetal infection, causing fetal and neonatal death, as well as serious sequelae in childhood. It is the most important infectious cause of sensorineural hearing loss and mental retardation. CMV incidence in the world varies between 0.5 and 1% of newborns and our country is not exempt from this scourge, with reported figures ranging between 1 and 2% of newborns (NBs). Chilean seroprevalence studies in pregnant women in the public system show that around 95% of them have antibodies against the virus, which means that primary infection in pregnancy is rare in this population.
However, fetal infection and its serious sequelae can occur both from a primary infection and from a reactivation or reinfection (non-primary infection) that generally occurs during the first trimester of pregnancy. The difficulty in maternal diagnosis and the lack of evidence of an effective treatment were, for a long time, issues that discouraged universal screening. New advances in diagnostic tools and more effective treatments challenge this conception and make early diagnosis of primary maternal infection imperative, to avoid transplacental passage and sequelae in infected fetuses.
In this publication we commence by describing a clinical case of fetal infection at 28+2 weeks of pregnancy, detected through ultrasound abnormalities, who received in utero treatment. We then review epidemiological concepts, the mechanisms of CMV infection, as well as its pathogenesis and new elements of diagnosis and treatment that we believe make a strong case in favor of universal screening in pregnancy.
Comenzaremos con un caso clínico
Primigesta de 34 años, embarazo por fertilización in vitro, anemia severa transfundida (dos unidades de glóbulos rojos) un mes antes de su ingreso. Sin antecedentes de cuadro infeccioso clínico durante la gestación.
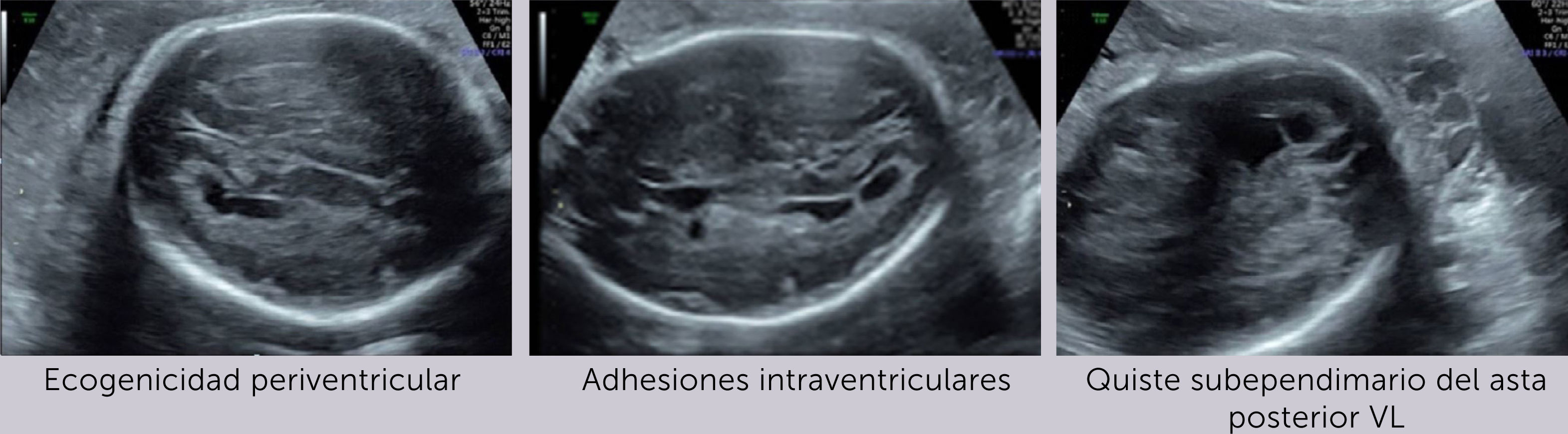
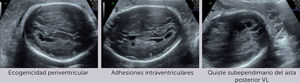
Ingresa a las 28+2 semanas, por alteraciones cerebrales del feto en ultrasonido de rutina, sugerentes de infección por citomegalovirus (CMV) (hiperecogenicidad periventricular, adhesiones intraventriculares y quiste subependimario temporal) (Figura 1 a-c). Al ingreso resulta PCR positiva para CMV por amniocentesis realizada a las 27 semanas y negativa en sangre materna.
La serología materna para CMV mostró IgG positiva, IgM negativa, en contra de una infección primaria. El estudio para toxoplasmosis, rubeola, lúes, virus de inmunodeficiencia humana (VIH), Epstein-Bar y hepatitis B fueron negativos. El crecimiento fetal y el Doppler materno-fetal fueron normales.
Ingresa para tratamiento de la infección fetal. Las pruebas hepáticas, hemograma y función renal fueron normales. Por antecedentes descritos, y por historia de bypass gástrico, con probable mala absorción de valaciclovir oral, se decide en conjunto con infectólogos iniciar tratamiento con aciclovir endovenoso, durante 10 días, el que resulta bien tolerado y sin complicaciones.
El control ecográfico previo al alta se mantiene sin cambio en los hallazgos cerebrales fetales.
Se otorga el alta continuando sus controles y tratamiento en ciudad de origen.
La resonancia magnética (RM) a las 33 semanas de embarazo muestra leucoencefalopatía con presencia de quistes subcorticales bitemporales y subependimarios periatriales, bilaterales. Se observa ventriculomegalia supratentorial.
Nace por cesárea de urgencia a las 36 semanas de embarazo por rotura de membranas y sufrimiento fetal.
La ecografía cerebral muestra hemorragia intraventricular de III grado. Fondo de ojo normal. Emisiones otoacústicas y potenciales evocados auditivos de tronco (PEAT) normales.
Recién nacida (RN) de 2400g, con petequias al examen físico. Sin hepato ni esplenomegalia. Se confirma infección neonatal por CMV con PCR en orina fetal. Plaquetas 25.000. Examen neurológico y EEG normal.
Se inicia tratamiento con valganciclovir vía oral por 7 meses. Ingresa al programa de Alteraciones del Desarrollo de Teletón, logrando avances sostenidos en todas las áreas del desarrollo, más lenta en contacto con terceros y desarrollo del lenguaje. Camina en forma independiente a los 19 meses. De alta a los 2 años y 7 meses, asistiendo a jardín infantil con buena adaptación. Hoy es una niña sana de 3 años de vida. RM al año de vida solo muestra áreas de hiperseñal de sustancia blanca supratentorial, (estas corresponden a áreas de desmielinización y gliosis según estudios histológicos), resto del examen fue normal.
Citomegalovirus es la infección más frecuente adquirida antes del nacimiento (infección congénita). El 90% de los recién nacidos con infección congénita son asintomáticos al nacer, sin embargo 15 a 20% de ellos desarrollará secuelas neurológicas permanentes, más comúnmente pérdida de la audición sensorio neural y otras como discapacidad intelectual, parálisis cerebral, pérdida de la visión y convulsiones.
EpidemiologíaLa infección por CMV es la causa más común de infección fetal congénita, es causa de muerte fetal y neonatal, así como de graves secuelas en la infancia1,2. Es la causa infecciosa más importante de pérdida de la audición neurosensorial y retardo mental3,4. Su incidencia en el mundo varía entre 0,5 y 1% de los RN1. Nuestro país no está al margen de este flagelo, con cifras reportadas que van entre 1 y 2% de los RN5. Esta infección es frecuente en todo el mundo, sin embargo, su seroprevalencia es variable dependiendo de varios factores como son la edad, nivel socioeconómico y cultural, ubicación geográfica y contacto cercano con niños pequeños. En Chile, el último reporte de prevalencia data del año 2005, en dicho trabajo se estudió la seroprevalencia en mujeres embarazadas en trabajo de parto en el área sur oriente de Santiago, encontrándose un 95% de mujeres seropositivas6.
La transmisión hacia el feto ocurre por vía transplacentaria y se produce con mayor frecuencia después de una primoinfección (riesgo de transmisión de 30–40%), sin embargo, tanto la primoinfección como la reactivación y la reinfección (infección no primaria) pueden generar compromiso fetal profundo y secuelas a largo plazo7, si éstas ocurren durante el primer trimestre del embarazo. En poblaciones con alta seroprevalencia la mayoría de las infecciones fetales ocurren secundariamente a una infección no primaria (países subdesarrollados), en cambio en poblaciones con baja seroprevalencia la mayoría de las infecciones fetales son secundarias a una primoinfección (países desarrollados)8. En Chile la seroprevalencia global es alta, pero podría haber diferencias entre el sector público y el privado, ya que al menos en Clínica Las Condes, la seroprevalencia reportada por el laboratorio, durante el último año fue de un 54% en mujeres en edad fértil: grupo de 15–44 años. Con estos resultados y considerando a esta población testeada como de alto riesgo, pensamos que la seroprevalencia en embarazadas sanas del sector privado podría ser aún más baja, dejando entonces un gran grupo susceptible para la primoinfección.
Mecanismo de transmisiónEl CMV es un virus DNA de la familia Herpesviridae, que se transmite de persona a persona a través de contacto estrecho de saliva, orina, secreciones genitales y otros fluidos corporales como transfusiones de sangre y trasplante de órganos. La infección primaria en embarazo es asintomática en el 95% de los casos9.
El mayor riesgo de primoinfección en embarazo se da en mujeres de grupos con baja seroprevalencia, que están en contacto con niños pequeños menores de 3 años de edad.
El periodo de incubación de la enfermedad fluctúa entre 20–60 días y cuando hay síntomas, se presenta como un síndrome mononucleósico, con fiebre por 2–3 semanas, linfoadenopatías, recuento alto de linfocitos y alteración de las pruebas hepáticas10. La infección fetal ocurre por vía transplacentaria con la viremia materna.
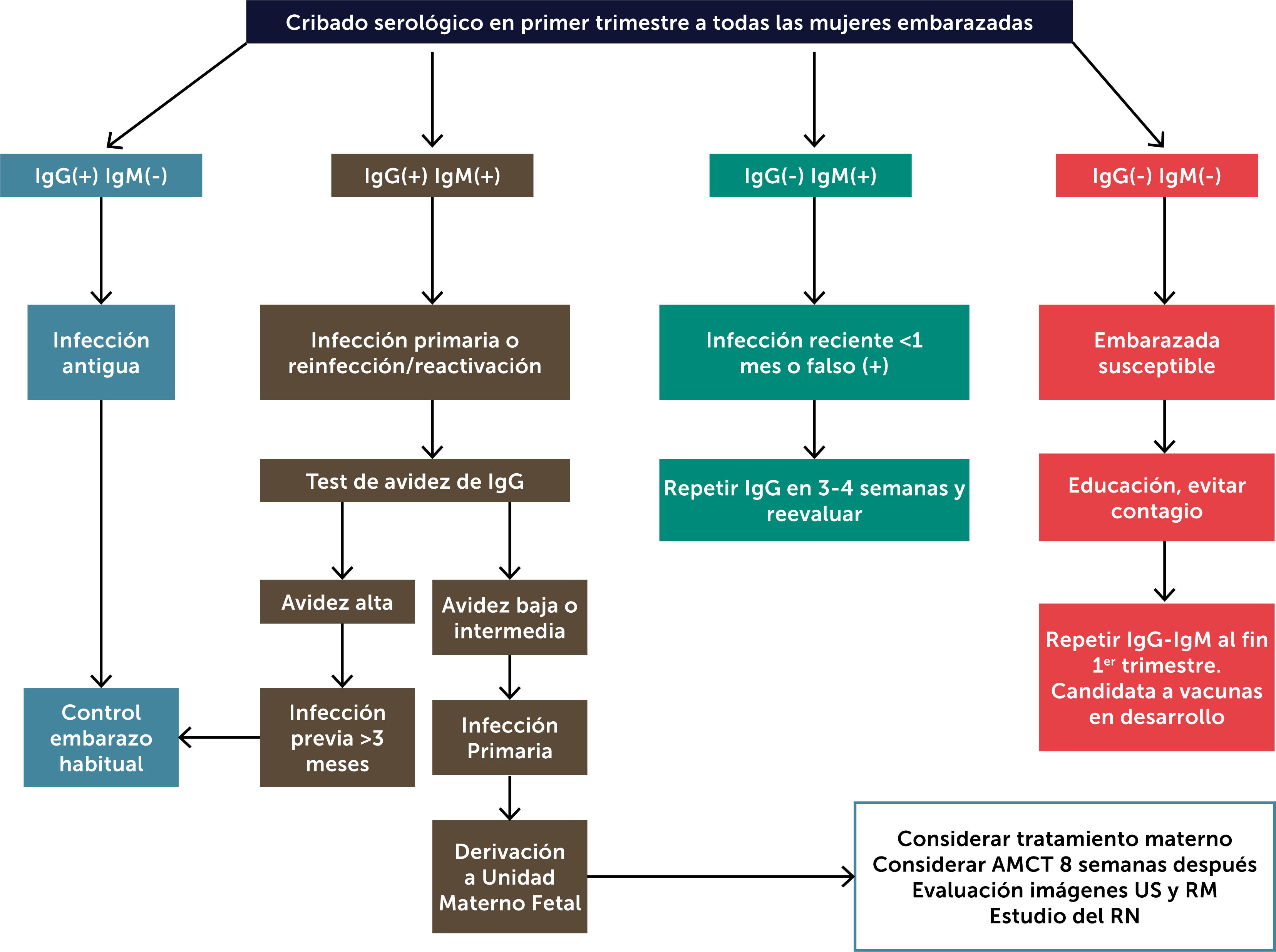
Diagnóstico de infección maternaEl diagnóstico de infección primaria podría realizarse en el contexto de una embarazada que presente un síndrome mononucleósico con:
a) Seroconversión de IgG específica en paciente previamente negativa (para lo cual sería necesario tener serología preconcepcional)11.
b) Detección de IgM positiva e IgG positiva con avidez baja12. Los anticuerpos IgM demoran 7–12 días en aparecer luego de la infección primaria, tardan 2-3 semanas en alcanzar su valor máximo y disminuyen hasta ser indetectables unos meses más tarde. Su positividad en embarazo debe hacernos pensar en infección primaria, reactivación o reinfección. Sin embargo, una IgM puede permanecer positiva por un largo periodo, hasta 6–12 meses o puede estar en el contexto de una reacción cruzada con otros virus o enfermedades autoinmunes. Su sensibilidad es del 80–100% y especificidad fluctúa entre 60–100%, pero debe complementarse con IgG para su adecuada interpretación13.
Los anticuerpos IgG pueden detectarse a partir de 3 semanas posteriores a la infección y aunque su nivel declina, pueden persistir en bajas concentraciones de por vida. Su positividad puede significar infección antigua, primoinfección, reactivación o reinfección.
El test de avidez se utiliza cuando IgG e IgM están positivas y nos sirve para discriminar si se trata de una infección reciente14, de menos de 3 meses (avidez baja, menor al 30%) o una infección antigua, mayor de 3 meses (avidez alta, mayor al 60%).
El diagnóstico de infección materna no primaria es más difícil y se basa principalmente en el hallazgo de IgG e IgM positiva y un test de avidez alto.
No existen puntos de corte validados de la PCR-CMV cuantitativa en sangre materna para establecer infección activa, por lo tanto, no es un test recomendado para cribado, sin embargo, podría ser de utilidad en algunos casos de complejidad diagnóstica por ejemplo una IgG con avidez intermedia.
Diagnóstico de la infección fetalConsecutivo a la viremia materna, se produce la infección de la placenta con la posterior diseminación al feto por vía hematógena. Los leucocitos maternos que portan el virus pueden traspasar la placenta y liberar el virus en la circulación fetal, cruzando a través de brechas en el sincitiotrofoblasto, especialmente en el tercer trimestre. Por otro lado, el pasaje transplacentario se ve influido por mecanismos inherentes al propio virus, mecanismos de tipo inmunológico maternos, tanto humorales como celulares, además de placentarios14. De esta manera la placenta constituye tanto una barrera, como un reservorio para la replicación viral.
A pesar que la documentación de una infección materna es siempre preocupante, debido a la particular evolución de la histología placentaria, el transporte del virus se facilita con el avance de la gestación y ocurre entre un 36 a un 66%, dependiendo de la etapa del embarazo en que se esta se adquiera (ver Tabla 1). Al mismo tiempo, la severidad del compromiso fetal varía en forma inversa, llegando a tasas de secuelas de hasta 22% en infecciones de primer trimestre y pueden ser inexistentes en infecciones más tardías15.
Riesgo de transmisión de la infección congénita por CMV y secuelas neurológicas de acuerdo aedad gestacional de la infección primaria
| Trimestre | Tasa de Transmisión | Hipoacusia/alteración del neurodesarrollo si el feto está infectado | Hipoacusia/alteración del neurodesarrollo si se desconoce transmisión |
|---|---|---|---|
| 1er | 36,8% | 22,8% | 8,4% |
| 2do | 40,3% | 0,1% | 0% |
| 3er | 66,2% | 0% | 0% |
Adaptado de Chatzakis, 20202.
Por otro lado, las infecciones primarias se traducen en una mayor posibilidad de infección fetal (32%), a diferencia de las reinfecciones o reactivaciones (1,4%)16, con igual grado de compromiso fetal. Sabiendo que no existen herramientas diagnósticas validadas para detectar infecciones no primarias, el esfuerzo debe orientarse al diagnóstico de la infección primaria. En países europeos, hasta un 50% de las infecciones por CMV son de este tipo, lo que ha motivado el desarrollo de diferentes estrategias y herramientas, además de la creación de grupos de interés, que hoy dictan los estándares.
Es importante hacer algunas precisiones respecto al estudio de infección fetal:
- 1.
En la actualidad el gold-standard para el diagnóstico de infección fetal es la detección del virus en líquido amniótico por técnica de PCR. Originalmente se utilizó cultivo viral, pero lo engorroso de la técnica y el alto número de falsos negativos lo hacen poco aplicable al día de hoy, donde las técnicas moleculares han alcanzado confiabilidad y bajo costo.
- 2.
Debido al tiempo que toma la infección, replicación viral en la placenta, transmisión al feto, infección del riñón fetal y excreción urinaria, se considera necesario esperar al menos 6 a 8 semanas desde la infección materna, para realizar amniocentesis. Por otro lado, se debe tener en cuenta que para que el virus sea excretado en la orina fetal, se requiere cierto grado de madurez del sistema renal, por lo que hoy día se recomienda realizar el procedimiento desde las 17 semanas17.
- 3.
Debido a que la infección fetal durante el primer trimestre es la causa exclusiva de daño neurológico e hipoacusia sensorioneural, es natural que exista presión hacia el diagnóstico en edades cada vez más precoces de la gestación. Es así como nuevos reportes han demostrado posible la detección de infección fetal, con el uso de biopsia de vellosidades coriales (CVS, por sus siglas en inglés), entre la semana 12 y 1418.
La serología es la herramienta más conocida y sabemos que es muy útil en el diagnóstico de infección primaria por CMV, pero pierde valor en infecciones no primarias. Existen muchos casos donde la sospecha de infección fetal surge al detectarse alteraciones imagenológicas en el ultrasonido de rutina, como ocurrió en el caso clínico antes descrito. Claramente este constituye un grupo de diagnóstico más tardío, severo y con secuelas más frecuentes.
Citomegalovirus es un virus neurotrópico, por lo que la mayoría de las lesiones se refieren al sistema nervioso central, sin embargo, podemos encontrarlas en diferentes órganos y sistemas (Tabla 2).
Alteraciones fetales que produce la infección congénita por CMV en los distintos órganos
| Craneanas | No craneanas | Placenta y Líquido Amniótico |
|---|---|---|
| Mega cisterna magna | Esplenomegalia | Placentomegalia |
| Agenesia del cuerpo calloso | Hepatomegalia | Calcificaciones placentarias |
| Ventriculomegalia | Hidropericardio | Oligohidramnios |
| Cambios periventriculares | Hidrotórax | Polihidramnios |
| Adhesiones intraventriculares | Ascitis | |
| Calcificaciones cerebrales | Hidropesía fetal | |
| Quistes germinolíticos | Intestino ecogénico | |
| Quistes periventriculares | Restricción de crecimiento | |
| Quistes subependimarios | Calcificaciones hepáticas | |
| Trastornos corticale |
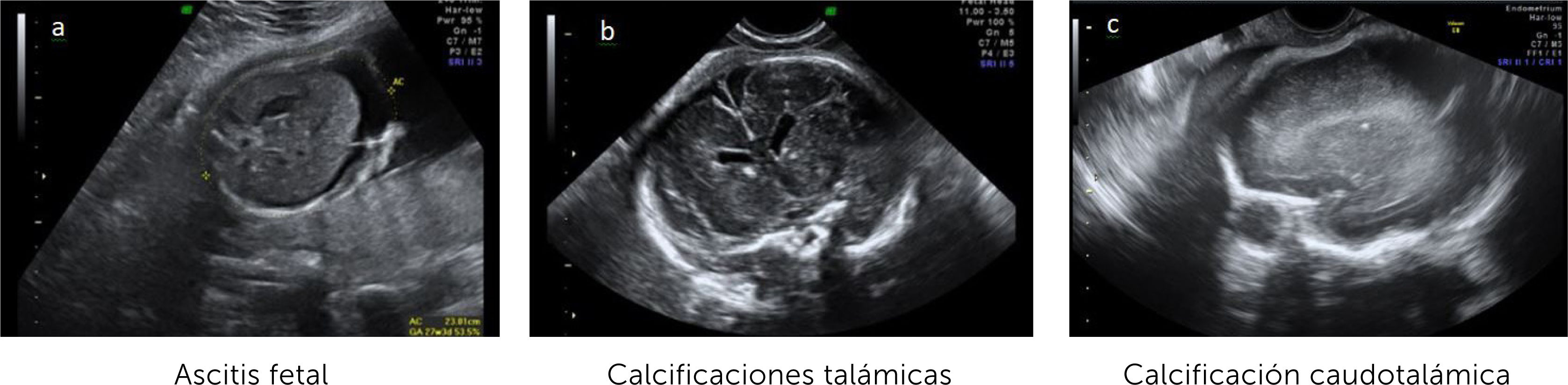
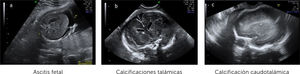
El diagnóstico por ultrasonido no es fácil, depende de factores como el hábito materno, posición fetal, localización placentaria, requiere entrenamiento y no es específico, ya que muchos agentes etiológicos dan hallazgos similares. Su sensibilidad es de alrededor de 80–85% 21, pero aumenta a un 95% al combinar con RM y sobre todo cuando el diagnóstico de infección ya está verificado22, reforzando el concepto que ambas son técnicas complementarias, que además tienen un alto valor predictivo negativo para compromiso fetal grave23. En general las alteraciones imagenológicas se suelen ver unas 12 semanas después de la infección materna y, en ausencia de hallazgos, si bien, no se descarta lesiones auditivas, si se sabe que hay buen pronóstico neurológico fetal. (Figura 2 a-c).
Tratamiento de la infección fetalEn obstetricia clásica la infección fetal por CMV tradicionalmente fue manejada de manera conservadora, reservando el tratamiento con antivirales para después del parto. Afortunadamente, en los últimos años, hemos asistido a una gran revolución en el desarrollo de distintos tipos de terapia fetal que hoy permiten minimizar los riesgos de infección y secuelas de un gran número de pacientes.
La terapia antiviral para CMV, en pacientes inmunosuprimidos es efectiva con ganciclovir y valganciclovir, con buenas tasas de pasaje transplacentario y concentraciones inhibitorias muy efectivas contra el virus, sin embargo, el bajo perfil de seguridad y potencial teratotoxicidad, no permiten autorizar su uso en embarazadas24. Valaciclovir es un fármaco bastante menos efectivo, pero mucho más seguro y cuya utilidad ha sido demostrada en fetos infectados, reduciendo a la mitad el número de niños sintomáticos al nacer25. Se recomienda la administración de 8g al día, por vía oral, desde el momento del diagnóstico, hasta el parto. Sus efectos secundarios son generalmente leves, de índole digestivo (náuseas y vómitos) y hepáticos. La alta dosis puede causar insuficiencia renal aguda por uropatía obstructiva, debido a la acumulación de cristales de aciclovir a nivel del túbulo proximal. Esta se da en un 4% de las pacientes y se evita fraccionando la dosis diaria en cuatro tomas de 2g26. Se recomienda mantener buena hidratación y hacer seguimiento con creatinina y transaminasas, cada 15 días en estas pacientes27.
Otros antivirales actualmente en estudio son letermovir y maribavir, que tienen buen pasaje transplacentario y logran concentraciones fetales muy superiores a la máxima efectiva28. Su perfil de seguridad, aparentemente favorable, se encuentra actualmente en evaluación. Letermovir se da en dosis única diaria y no debería interferir con el metabolismo fetal, ya que inhibe enzimas inexistentes en células humanas (complejo terminasa), con lo que impide el empaquetamiento del virus en su cápside. Maribavir, a su vez, inhibe la excreción celular del virus, retardando la eficacia de su replicación. Ambos han sido recientemente aprobados por la FDA para uso en prevención de infección por CMV en algunos tipos de trasplante29. Aún están en desarrollo los estudios con estos antivirales en embarazadas.
Prevención de la transmisión verticalDemostrar infección materna supone la diseminación hematógena del virus, por lo tanto, un feto en riesgo. Esto nos obliga a plantear un tratamiento que lo proteja si aún no ha sido alcanzado. Recientemente un estudio doble ciego, controlado, aleatorizado, hecho en madres con infección primaria durante el primer trimestre, demostró una reducción significativa (71%, OR 0,29) del número de fetos infectados. Se usó valaciclovir 8g/día desde el diagnóstico serológico y se mantuvo hasta la realización de la amniocentesis durante el segundo trimestre30.
Otra alternativa para evitar la transmisión vertical es el uso de inmunoglobulinas, que se viene intentando desde hace algunos años31 con resultados inciertos. Un estudio aleatorizado32 no demostró diferencias significativas con el uso de esta terapia, sin embargo, recientemente esto ha sido cuestionado en base a una publicación que obtiene resultados favorables aumentando las dosis y frecuencia de administración al doble, basado en la particular fisiología de la embarazada Se usaron 200 UI/kg de inmunoglobulina endovenosa, cada 2 semanas, en mujeres con infección primaria por CMV, adquirida durante el primer trimestre. La tasa de transmisión durante el embarazo fue de 7,5%, significativamente menor que en el grupo control (35%)33.
Diagnóstico en recién nacidos (RN) y sus complicacionesSe realizará PCR-CMV en orina fetal34 antes de los 21 días de vida a todo RN que:
- -
Tenga antecedentes de infección materna conocida durante el embarazo o que tenga hallazgos en ecografía prenatal compatibles con infección fetal.
- -
Tenga diagnóstico de infección fetal confirmada por PCR-CMV de líquido amniótico.
- -
Presente signos clínicos sugerentes de infección fetal congénita (pequeño para la edad gestacional (PEG) grave, microcefalia, petequias, hepato-esplenomegalia)
- -
Hijo de madre con infección por VIH
- -
Con tamizaje auditivo alterado
- -
PEG<p3, o PEG p3-10 asociado a otro hallazgo clínico y/o de laboratorio.
Se realizará además estudio de laboratorio (hemograma con plaquetas, pruebas hepáticas, función renal), estudio de imágenes (ecografía cerebral o RM), PCR-CMV en sangre y LCR, evaluación auditiva, oftalmológica y neurológica para clasificar la severidad del compromiso neonatal y evaluar la necesidad de tratamiento antiviral postnatal que generalmente se hace con valganciclovir por 6 meses. Adicionalmente se planifica el seguimiento postnatal35.
ConclusiónA la luz de nueva evidencia en relación a herramientas de diagnóstico y tratamiento, cada vez más precoces y efectivas, vemos que incorporando la serología en el set de exámenes de primer trimestre, es posible identificar fetos en riesgo de adquirir la infección desde una madre infectada, así como detectar y tratar a aquellos donde ya hubo pasaje transplacentario del virus, evitando o mitigando sus posibles secuelas.
El feto de nuestra paciente del caso clínico, presentaba ya lesiones cerebrales secundarias a la infección viral, iniciamos tratamiento durante el embarazo, con aciclovir endovenoso, dado que la paciente tenía una cirugía bariátrica y que probablemente la absorción del valaciclovir oral no habría sido la adecuada, pese a que en la literatura no encontramos casos de otras pacientes en los que se haya usado el medicamento con este fin por vía endovenosa, luego se continuó con ganciclovir en el período neonatal por 7 meses, y hoy es una niña sana en todas sus evaluaciones. Si bien no es posible cuantificar con exactitud el impacto del tratamiento, es claro que si no se hubiera hecho el diagnóstico en el embarazo sus secuelas podrían haber sido mucho mayores.
La alta seroprevalencia de la infección por CMV en nuestro país ha desincentivado la inversión en recursos de laboratorio más específicos, como el test de avidez de IgG, que hasta hace muy poco no era posible realizar en nuestro medio y que nuestra institución ha incorporado recientemente dentro de su arsenal de exámenes.
Por otro lado, creemos importante considerar que existen poblaciones en nuestro país con seroprevalencia, muy baja y comparable a países desarrollados, donde el cribado universal se encontraría justificado y sería costo-efectivo36.
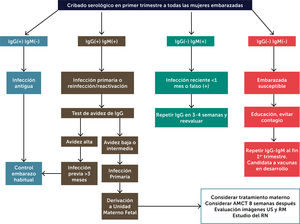
De acuerdo a lo presentado creemos que es nuestra obligación considerar el estudio materno de CMV, al menos en los grupos de riesgo y tal vez extenderlo a todas las embarazadas en un futuro cercano. La propuesta de estudio sería realizar serología al diagnóstico de embarazo y luego al final del primer trimestre, si los anticuerpos fueran negativos (Figura 3). De esta forma es posible estimar el momento de la infección materna, lo que permite planificar racionalmente el estudio y eventual tratamiento fetal.
Con el objetivo de tener mayor información nacional de la infección connatal por CMV, recientemente se creó en Chile una red integrada por investigadores de los hospitales Exequiel González Cortés, Barros Luco Trudeau, Roberto del Río, San José, Luis Calvo Mackenna, San Juan de Dios, Luis Tisné y San Borja Arriarán. Se pretende tener un registro actualizado de citomegalovirus congénito (CMVc), en recién nacidos y embarazadas, con seguimiento activo hasta los seis años, mediante la utilización de la plataforma REDCap, que la Dirección de Innovación de la Facultad de Medicina de la Universidad de Chile dispuso para estos fines (mail: redcmvc.med@uchile.cl).
Declaración de conflicto de interésLos autores declaran no tener conflictos de intereses.
Agradecemos la contribución de la Dra. Beatrice Hervé con datos obtenidos del laboratorio de Microbiología de Clínica las Condes.