Los trastornos primarios observados en Parálisis Cerebral son, debilidad, trastornos del equilibrio, déficit de control motor selectivo e hipertonía, esta última, espástica o distónica. La hipertonía es determinante en el futuro funcional de estos pacientes y uno de los que podemos tratar adecuadamente. Este artículo se refiere a las nuevas técnicas disponibles, en nuestro medio, para su tratamiento.
Presentamos dos técnicas neuro-quirúrgicas, una irreversible, ablativa, que exige perfecta selección de pacientes: Rizotomía Dorsal Selectiva. La evidencia ha mostrado que determina cambios en la historia natural de la enfermedad. La otra: Infusión de baclofeno intratecal, por bomba, técnica reversible, que involucra un dispositivo de alto costo, complicaciones potenciales y cuya evidencia a la fecha, es débil/ moderada, respecto a lograr cambios en la historia natural de la enfermedad, pero creemos que es suficientemente útil, para ser considerada.
Ambas tienen en común que son de relativa reciente incorporación en nuestro medio, involucran un manejo multidisciplinario de alto nivel y selección precisa de pacientes. Han mostrado que permiten acceder a cambios en las dimensiones de la CIF.
Los resultados preliminares, en nuestra experiencia, son promisorios y alientan a abrir nuevos caminos de tratamiento y pronóstico para nuestros pacientes con PC.
The primary disorders observed in Cerebral Palsy are weakness, balance disorders, selective motor control deficit and hypertonia, spastic or dystonic. The hypertonia is critical for the functional future of these patients and one that can be adequately treated. This article refers to the new techniques available in our country, for its treatment.
We present two neuro-surgical techniques, one of them, irreversible, ablative, which requires perfect selection of patients: Selective Dorsal Rhizotomy. Evidence has shown that determines changes in the natural history of the disease. The other one: Infusion of intrathecal baclofen pump, reversible technique, which involves a device of high cost, potential complications and whose evidence, at to date, is weak / moderate, relative to effect in the change in the natural history of the disease, but to us is sufficiently useful to be considered. Both have in common that are of recently use in our country, need a multidisciplinary senior management and precise selection of patients. They have shown that permits access to changes in the dimensions of the ICF.
Preliminary results in our experience, are promising and opens new paths encourage treatment and prognosis for our patients with PC.
Generalidades: La Parálisis Cerebral (PC) es la causa más frecuente de discapacidad física en el niño(a). Afecta a cerca de 2/1000 recién nacidos vivos, con una prevalencia estimada en Europa entre 1,04 -2,5/1000 llegando en un estudio en Atlanta, USA, a 3,6/1000 1 (1). En Chile la prevalencia estimada, de acuerdo a datos del Ministerio de Salud, es de 2/1000 habitantes.
Actualmente, una de las definiciones más aceptada es la establecida en el Taller Internacional para la Definición y Clasificación de la Parálisis Cerebral en Washington (Bethesda) en julio del 2004: “Grupo de trastornos del desarrollo del movimiento y la postura, que causan limitación en la actividad, atribuidos a una lesión no progresiva en el cerebro en desarrollo en el periodo fetal o durante la infancia. El trastorno motor se acompaña con frecuencia, de alteraciones de la sensibilidad, cognición, comunicación, percepción, comportamiento y/o epilepsia” (1). Todas estas alteraciones limitarán al niño(a) en mayor o menor medida, en su desarrollo social, su movilidad, autonomía e integración.
Desde el punto de vista motor, se caracteriza por el trastorno del control motor selectivo (CMS), del Tono Muscular (TM), de la fuerza muscular (FM) y del balance.
Por definición ocurre durante los primeros años de vida, siendo en la mayoría de los casos, en el período de recién nacido y por lo tanto, acompaña al niño durante prácticamente todo su crecimiento y desarrollo, es decir durante el período en el cual se logra el aprendizaje y la adquisición de las funciones más importantes para su desempeño en la vida tanto a nivel individual como social.
Es una patología discapacitante progresiva, porque si bien la injuria cerebral no es progresiva, el compromiso músculo esquelético va aumentando, con la aparición de deformidades óseas y articulares, produciéndose un deterioro significativo y progresivo de las funciones motoras, durante el período de crecimiento. Por esta razón, se le ha denominado “la enfermedad de las palancas.”
Los trastornos más frecuentes del TM son la Espasticidad (80% de los casos) (1) y en segundo lugar, la Distonía.
La Espasticidad y la Distonía parecen ser la principal causa del compromiso funcional y del deterioro músculo-esquelético. En el compromiso funcional, porque al restringir la movilidad producen interferencia en el aprendizaje, adquisición y ejecución de engramas motores adecuados, alteran el control selectivo de los movimientos y evitan el adecuado fortalecimiento muscular. En el deterioro músculo esquelético, porque impiden el crecimiento muscular acorde al crecimiento óseo, ocasionándose las torsiones óseas y las retracciones articulares que alteran las palancas y con ello, la postura y la eficiencia del movimiento. El niño (a) se va “derrumbando”.
Esta cadena de eventos va también a interferir el potencial desarrollo cognitivo y social del menor, al no poder explorar su entorno y relacionarse fluidamente con los demás. Un niño que no se mueve, difícilmente puede aprender...
De esta manera, el tratamiento oportuno, adecuado y efectivo de la Espasticidad y la Distonía parece ser imperativo para posibilitar el máximo desarrollo de las capacidades funcionales potenciales del menor e impedir el desencadenamiento progresivo de deformaciones músculo-esqueléticas y la pérdida progresiva de las capacidades funcionales.
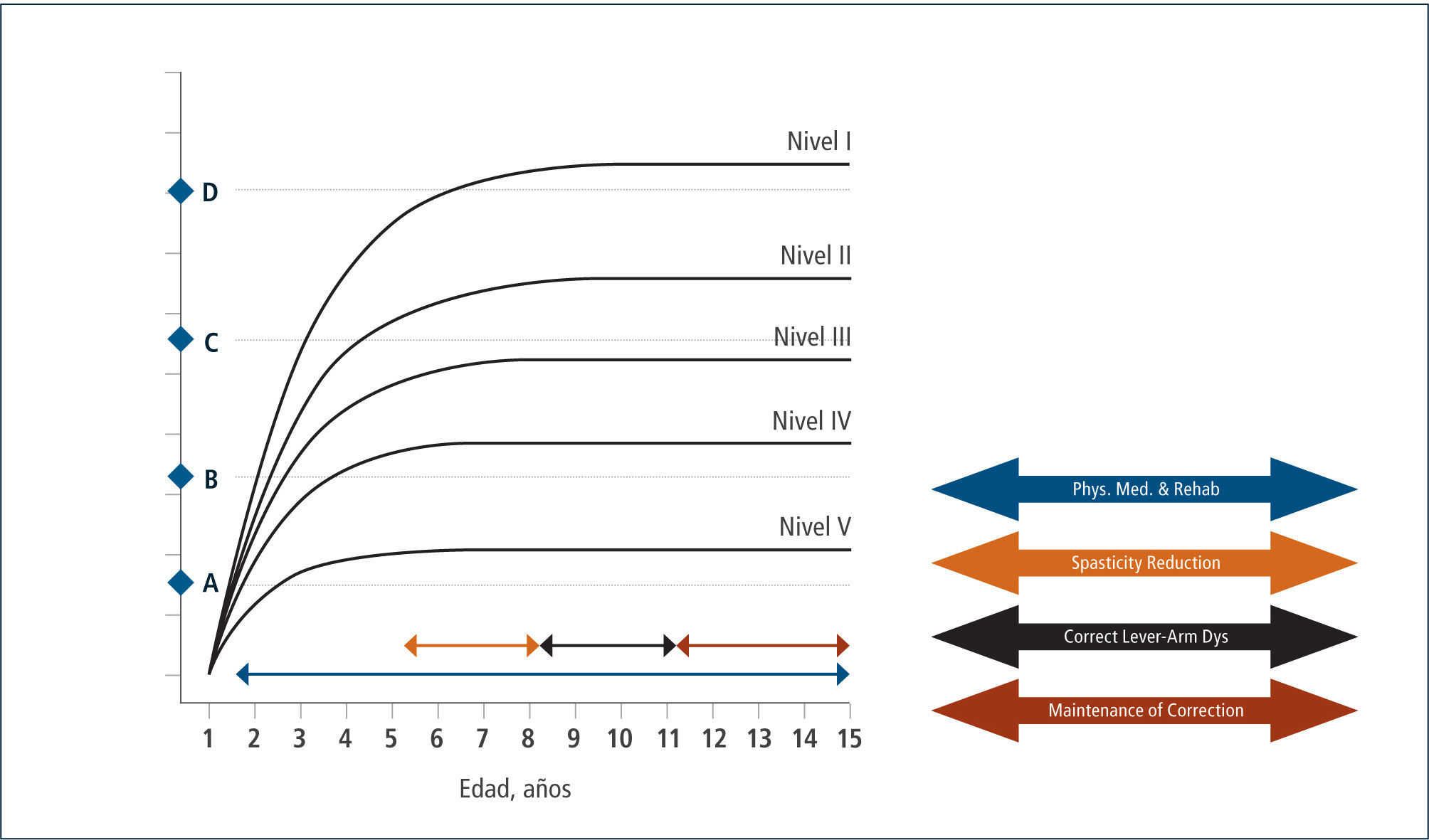
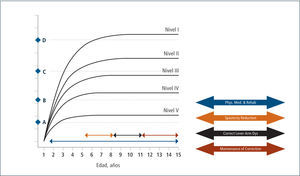
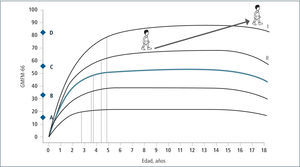
Evaluación: Para el establecimiento del desempeño motor grueso del niño con PC, se utiliza el Sistema de Clasificación de la Función Motora Gruesa (Gross Motor Functional Clasification System (GMFCS) (2) para niños entre 0 y 12 años de edad y su versión extendida (3). Este sistema de clasificación se basa en el movimiento que el niño realiza voluntariamente, con énfasis en su capacidad de sedestación, transferencias y desplazamiento, estableciendo 5 niveles de severidad, siendo el nivel I el más leve y el V el más severo. Permite clasificar el tipo de desplazamiento logrado en las diferentes edades y su pronóstico de marcha en el tiempo, estableciendo su curva esperada de desarrollo motor. (Figura 1).
La versión extendida de GMFCS incorpora jóvenes de 12-18 años, que considera el deterioro funcional que presentan con el crecimiento.
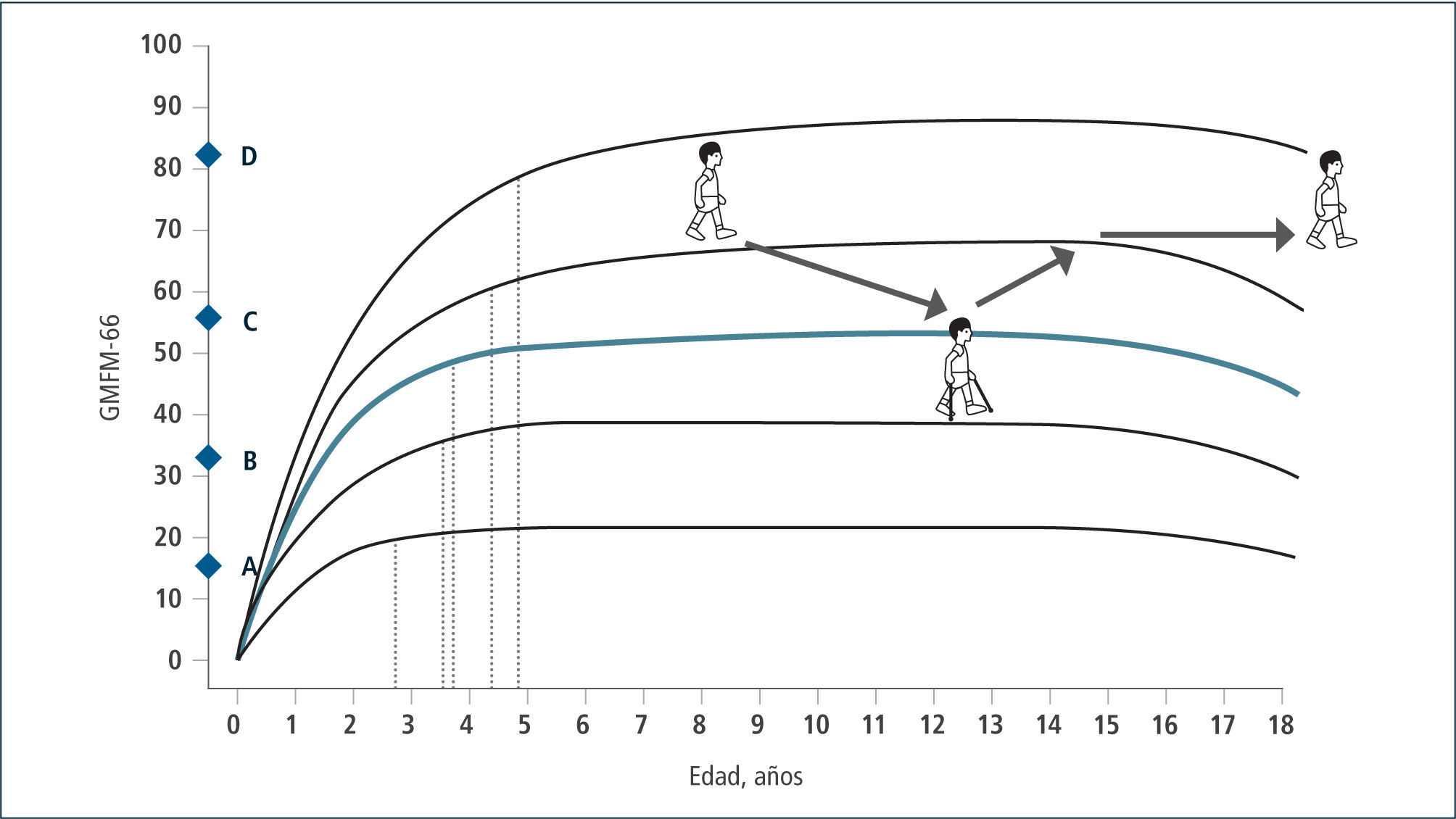
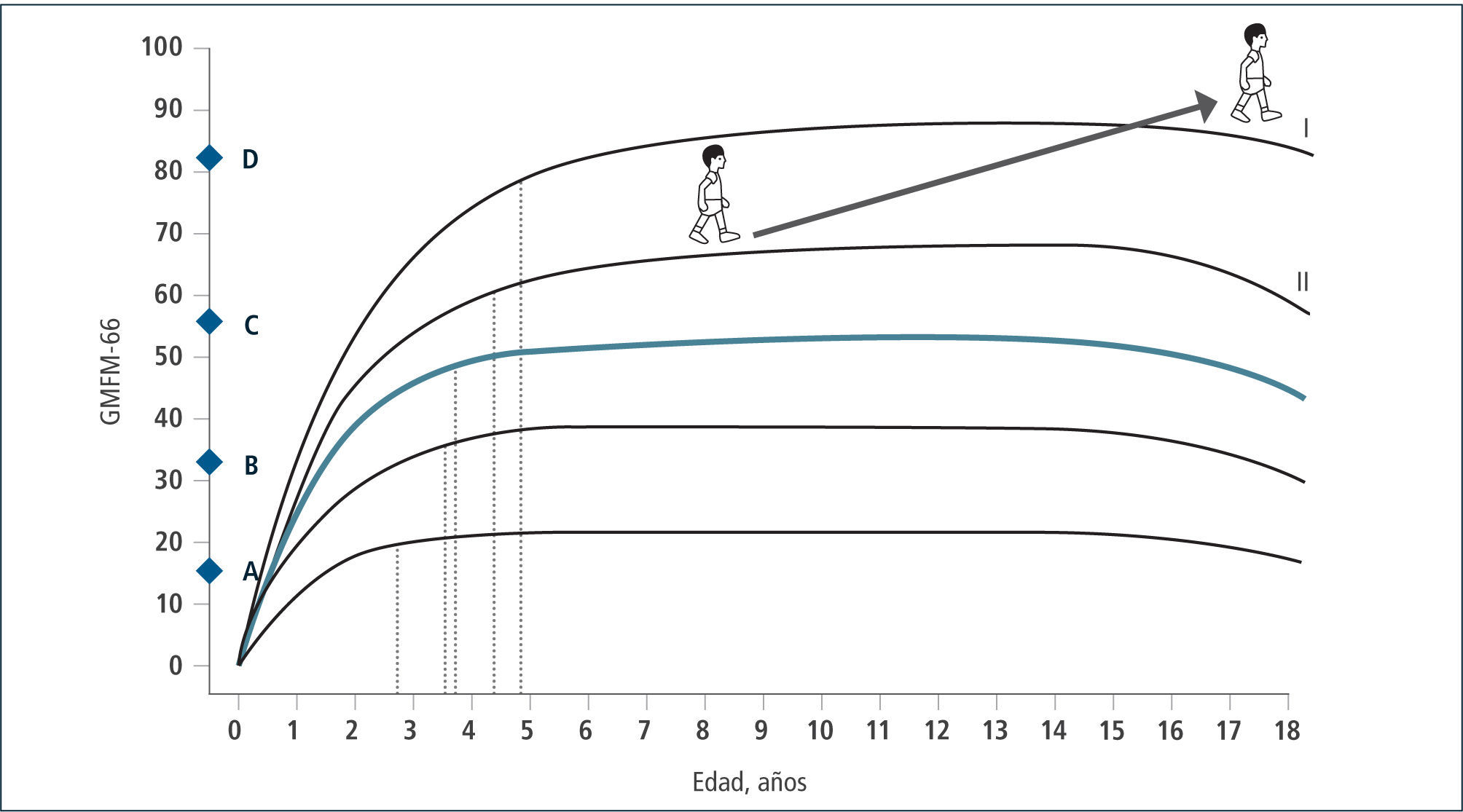
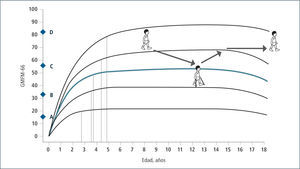
Esta clasificación permite hablar un lenguaje común sobre el nivel de compromiso motor de los pacientes con PC y su evolución. En base a ella, se han consensuado las terapias adecuadas en el transcurso del tiempo que permitan por un lado que el niño(a) se mantenga en su curva de desarrollo y no descienda, como también que con una determinada terapia, sea capaz de recuperar su curva cuando ésta se ha deteriorado en relación a su crecimiento. Asimismo permite evaluar cuándo una terapia ha sido capaz de subir al niño de nivel y de esta manera, cambiar favorablemente el curso natural de su evolución (Figura 2 y 3). En la evaluación funcional de las extremidades superiores (EESS), la escala más utilizada es MACS, (Manual Ability Classification System) que evalúa la función manual, entre los 4 y 18 años de edad, en 5 niveles, siendo el nivel I función normal y el nivel V el más severo.
Para establecer las condiciones funcionales y su nivel de participación en la sociedad, se consideran los criterios establecidos por la Clasificación Internacional de Funcionamiento, Discapacidad y Salud (CIF) de la Organización Mundial de la Salud (4), que considera tres dimensiones fundamentales: la Dimensión Corporal, la Dimensión Actividad y la Dimensión Participación. Esta clasificación permite definir el sistema u órgano comprometido, el impacto que ello produce en el desempeño personal del individuo y en su nivel de integración en la comunidad, entregando por lo tanto, una visión integral de la situación funcional de la persona y en base a ello, establecer y medir el impacto de los tratamientos. Las terapias que incidan favorablemente en al menos dos de estas dimensiones, generarán un impacto muy significativo en su funcionalidad y cambiarán el curso natural de la enfermedad hacia un devenir más positivo.
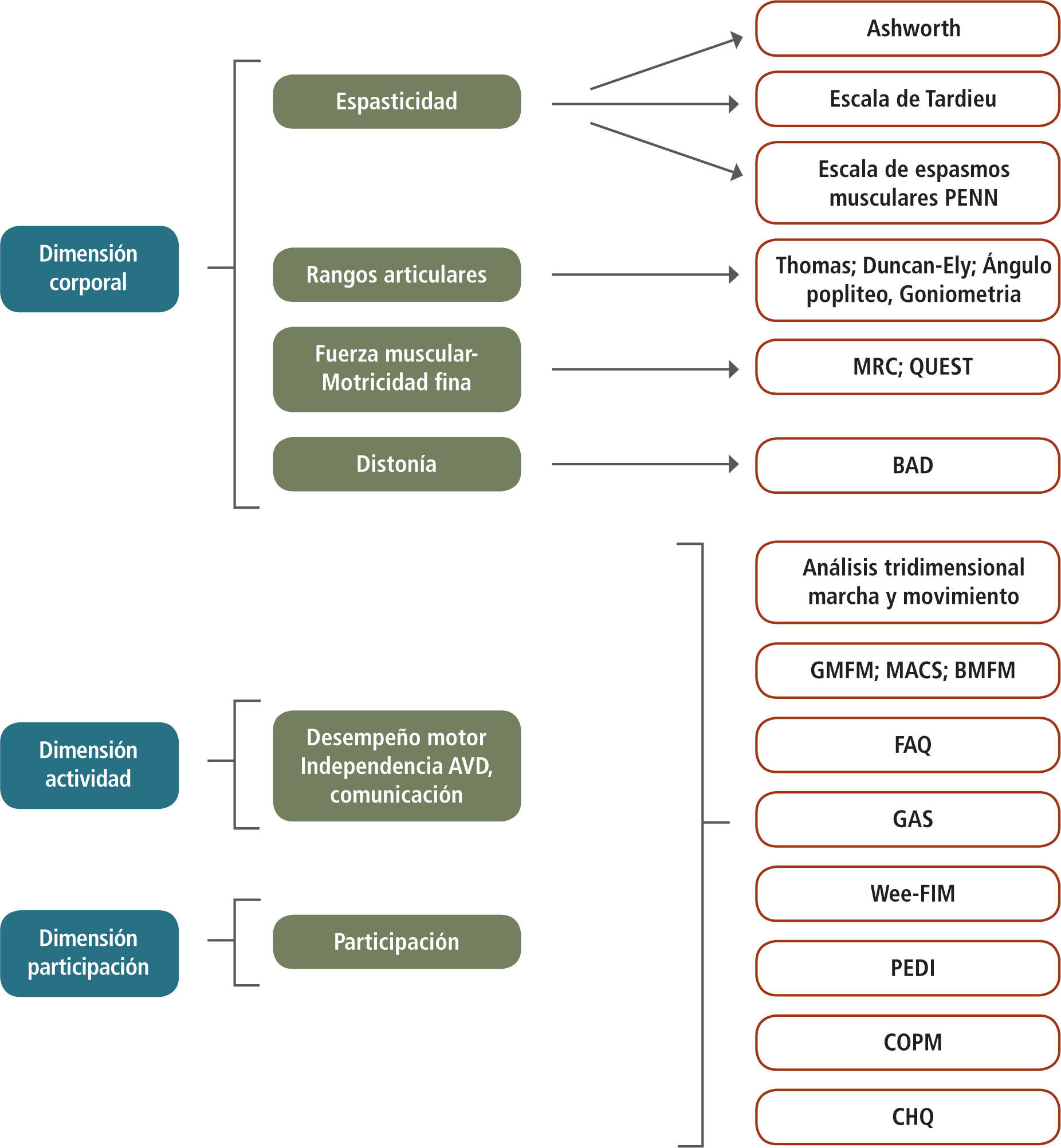
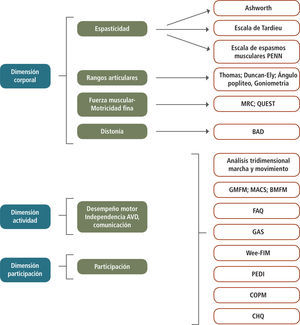
Las pautas e índices más frecuentemente usados en cada una de las Dimensiones, se muestran en la Figura 4.
Índices de Evaluación Funcional
Índices de Evaluación Funcional en las Dimensiones Corporal, Actividad y Participación; Escala de Ashworth modificada; Escala de Tardieu modificada; Escala de espasmos musculares de Penn; MRC: Muscle Research Council; QUEST: Quality of Upper Extremity Skills Test; BAD: Escala de Distonía de Barry- Albright; GMFM: Gross Motor Function Measure; MACS: Manual Ability Classification System; BMFM: Bimanual fine Motor; FAQ: Functional Assesment Questionnaire; GAS: Goal Attainment Scale;WeeFIM: Functional Independence Measure, for children; PEDI: Paediatric Evaluation of Disability Inventory; COPM: Canadian Occupational Performance Measure; CHQ: Child Health Questionnaire.
Espasticidad: La Espasticidad se define como un trastorno motor caracterizado por un aumento, velocidad dependiente, del reflejo tónico de estiramiento (tono muscular), acompañado de hiperreflexia, ligada a la hiperexcitabilidad del reflejo miotático (5). Es un elemento del síndrome piramidal. La espasticidad es un fenómeno dinámico, que varía en reposo o movimiento. Sus principales efectos en el niño (a) con PC se resumen en la Tabla N° 1.
Efectos de la espasticidad
| • Freno y desorganización del movimiento | • Inhibición del control motor selectivo |
| • Alteración de la capacidad del músculo de generar fuerza suficiente | • Inhibición de la relajación del músculo antagonista en la actividad (co-contracción) |
| • Limitación del crecimiento del músculo | • Compromiso de los rangos articulares |
| • Alteración de la remodelación ósea | • Inestabilidad articular |
| • Dolor | Aumento del consumo energético |
| • Trastornos del sueño | • Espasmos musculares |
Actualmente existen consensos y revisiones sistemáticas sobre los tratamientos más efectivos para la Espasticidad en PC, de acuerdo a la edad y el grado de compromiso del menor (6,7). Entre ellos, los que cuentan con mayor grado de evidencia son: Diazepam como antiespástico oral, la Toxina Botulínica (TB) como antiespástico local, la Rizotomía Dorsal Selectiva (RDS), la terapia de Infusión de Baclofeno Intratecal (BIT) por Bomba y la Cirugía Multinivel en un solo evento (CMN). Estos deben ser asociados y complementados con otras terapias coadyuvantes de rehabilitación, aplicadas en un contexto multidisciplinario para el logro de los objetivos funcionales.
En este artículo analizaremos la RDS y el BIT en el manejo de la Espasticidad.
Distonía: La Distonía en PC se manifiesta como contracciones musculares sostenidas que causan movimientos repetitivos de torsión o posturas anormales (8). Incluye:
- a)
Resistencia al movimiento a muy baja velocidad.
- b)
Co-contracción de músculos agonistas y antagonistas.
- c)
Empeoramiento frente al intento de movimiento voluntario.
- d)
Variación de la amplitud de la actividad involuntaria según el grado de entusiasmo/intención en realizar una tarea.
La Distonía en PC se presenta tanto en reposo como en movimiento volitivo.
Su evaluación aislada en pacientes con PC es compleja, pues con frecuencia presentan además otros déficits, (debilidad muscular, espasticidad, trastorno del control motor, dificultad en la comunicación y/o déficit cognitivo). La escala de Distonía publicada por Barry - Albright (BAD) es válida y confiable para su evaluación y seguimiento (9). Esta escala considera 8 regiones del cuerpo, que evalúa separadamente: Ojos, boca, cuello, tronco, cada extremidad superior e inferior. Define la distonía como “contracción muscular sostenida, que causa torsiones y movimientos repetitivos o posturas anormales” y solicita que en base a esta definición se puntúe cada una de las estructuras corporales definidas, de acuerdo a una escala que va de 0 a 4, según el grado de severidad y limitación en la función. (0: Ausencia de distonía; 4 Severa distonía, que impide la función) (9).
En este artículo analizaremos la Infusión Mantenida del Baclofeno Intracraneal (BIT) en el manejo de la Distonía en PC.
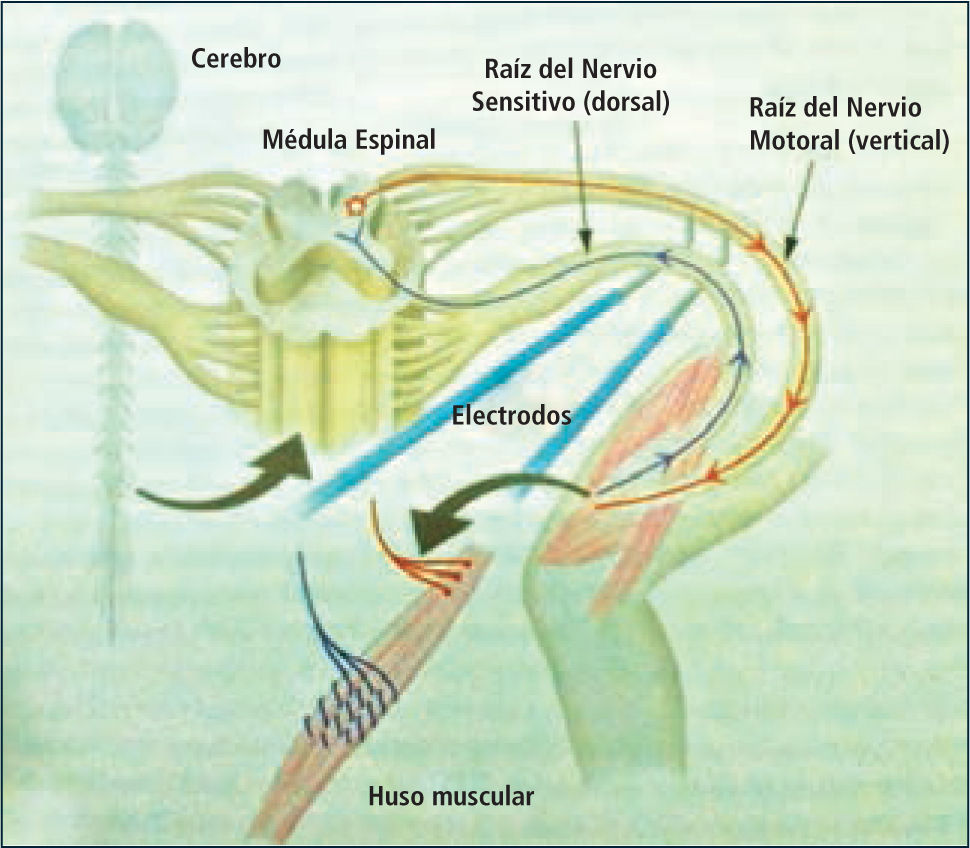
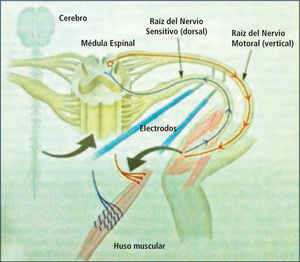
Rizotomía dorsal selectivaLa Rizotomía Dorsal Selectiva (RDS), consiste en la sección quirúrgica parcial y bilateral de las raíces posteriores (sensitivas) lumbosacras (L1 a S1-S2) para reducir las aferencias excitatorias. Se basa en que la génesis de la espasticidad se origina en la ausencia del control inhibitorio de las vías motoras descendentes, producto de la lesión cerebral, que determina la hiperexcitabilidad de las motoneuronas espinales, en respuesta a dichas aferencias excitatorias (liberación del arco reflejo) (Figura 5). Dado que el gesto quirúrgico no incluye las raíces ventrales (motoras), no se afecta el potencial de desarrollo de fuerza muscular.
La sección de las raíces posteriores no debe abarcar más del 50%, para preservar un contingente de fibras aferentes espinales suficientes que aseguren la mantención de las funciones sensitivas. Asimismo se debe limitar caudalmente hasta el nivel sacro S1 (muy ocasionalmente hasta S2) para evitar el riesgo de disfunción esfinteriana.
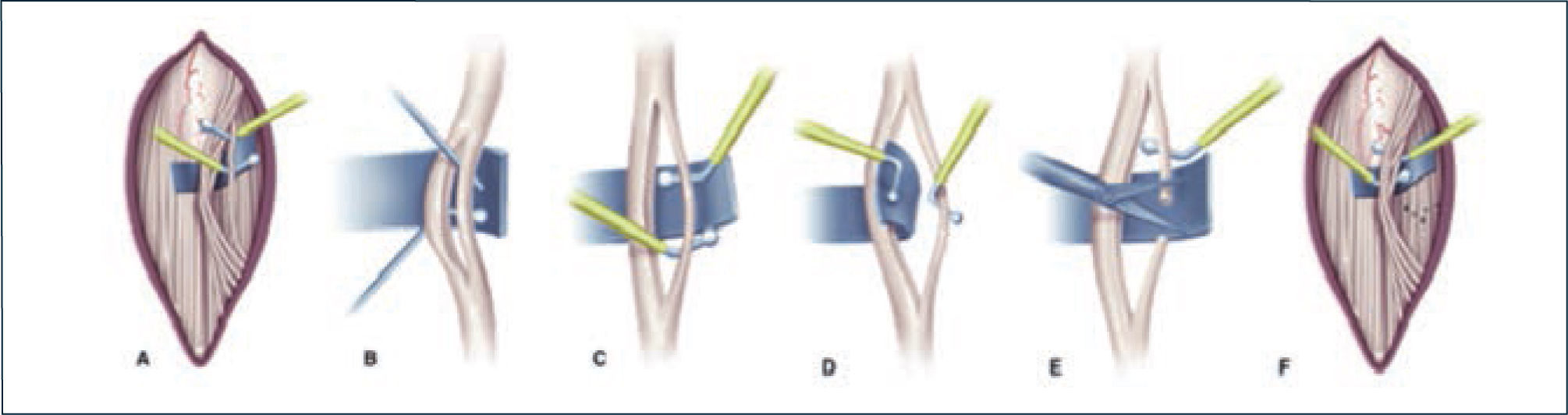
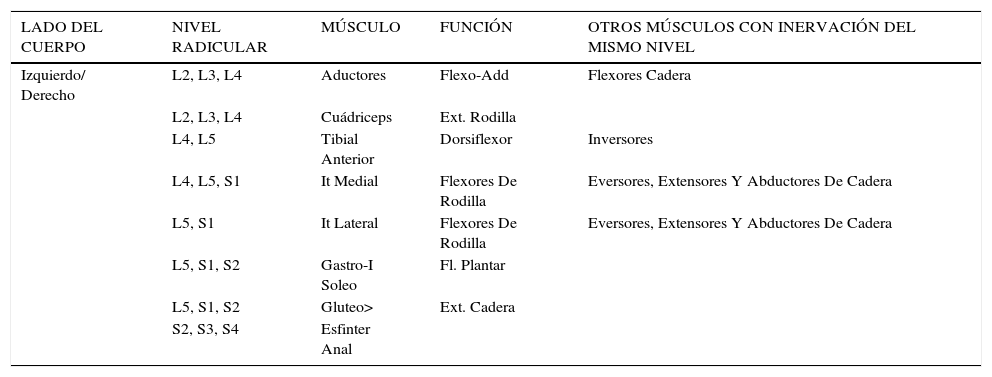
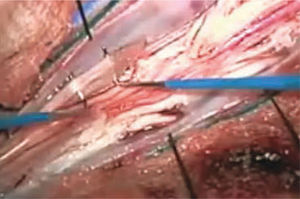
Para realizar la RDS, se realiza una laminotomía, bajo anestesia general, sin relajantes musculares y con control electromiográfico (EMG) que guía la sección de las raíces, de acuerdo a las respuestas de los músculos representativos de cada nivel radicular; (Tabla N° 2). Fotos 1 y 2. El Monitoreo EMG Intra-operatorio permite corroborar el nivel radicular, diferenciar la raíz motora de la raíz sensitiva en cada nivel y, luego por estimulación ortodrómica de la raíz sensitiva, definir cuáles radicelos se seccionarán (Figura 6) Foto 3.
Músculos representativos de cada nivel radicular
| LADO DEL CUERPO | NIVEL RADICULAR | MÚSCULO | FUNCIÓN | OTROS MÚSCULOS CON INERVACIÓN DEL MISMO NIVEL |
|---|---|---|---|---|
| Izquierdo/ Derecho | L2, L3, L4 | Aductores | Flexo-Add | Flexores Cadera |
| L2, L3, L4 | Cuádriceps | Ext. Rodilla | ||
| L4, L5 | Tibial Anterior | Dorsiflexor | Inversores | |
| L4, L5, S1 | It Medial | Flexores De Rodilla | Eversores, Extensores Y Abductores De Cadera | |
| L5, S1 | It Lateral | Flexores De Rodilla | Eversores, Extensores Y Abductores De Cadera | |
| L5, S1, S2 | Gastro-I Soleo | Fl. Plantar | ||
| L5, S1, S2 | Gluteo> | Ext. Cadera | ||
| S2, S3, S4 | Esfinter Anal |
Gentileza Gillette Children’s Specialty Helthcare (Traducido).
Población Objetivo e Impacto:
Esta técnica ha mostrado ser útil y segura en el manejo de la espasticidad, favorecer el desarrollo de la marcha y otras habilidades motoras gruesas, así como mejorar el grado de independencia funcional en niños (as) portadores de Parálisis Cerebral (PC), con compromiso motor bilateral (Diplegia espástica (DE), Tetraplegia espástica (TE)). Los pacientes presentan espasticidad significativa y difusa que perturba el movimiento, impidiendo la expresión y desarrollo de fuerza útil, frenando así el progreso motor y provocando contracturas y deformidades ortopédicas, que de no manejarse adecuadamente pueden ensombrecer el pronóstico motor y la calidad de vida de mediano y largo plazo.
Existe evidencia clase A de la efectividad de la RDS en reducir espasticidad y mejorar habilidades motoras gruesas (7,10), permitiendo mejorar el rendimiento energético de la marcha, la velocidad, el largo del paso y la kinemática articular de las extremidades inferiores (11). Estos efectos tienden a mantenerse en el largo plazo (12).
En consecuencia la RDS se traduce en mejorías sustanciales de las capacidades de ambulación en la comunidad, especialmente en aquellos niños/as que requieren dispositivos de asistencia para caminar (GMFCS III y IV). Los niños/as con GMFCS I-II-III mejoran sus capacidades de ambulación en la comunidad, y un porcentaje no menor, el 32%, de aquellos del nivel III pueden pasar a nivel II, lo que además de mejorar su eficiencia en la marcha, puede impactar en su integración social y autoestima (11).
Al mejorar el tono muscular, la RDS disminuye las contracturas músculo-tendinosas, corrigiendo las fuerzas rotacionales que actúan sobre los huesos largos. De esta manera, disminuye las necesidades de cirugías ortopédicas posteriores. No obstante, la RDS y la cirugía ortopédica deben entenderse como terapias complementarias y no excluyentes. Se ha reportado que los mejores resultados se obtienen en aquellos subgrupos de pacientes en quienes se ha realizado RDS seguido de cirugía ortopédica (CO), algunos años después, al compararlos con subgrupos de RDS sin cirugía ortopédica y cirugía ortopédica sin RDS (13).
En aquellos niños con déficits más severos (GMFCS IV y V), la RDS permite además mejorar su desempeño en actividades de la vida diaria, tales como aseo, vestuario, transferencias y movilidad corporal general, disminuyendo significativamente las necesidades de ayuda y aliviando la tarea del cuidador (14). Estos logros se relacionan además, con la reducción de la espasticidad de extremidades superiores post RDS.
También se han observado ganancias cognitivas post RDS, especialmente relacionadas con la capacidad de atención, el aprendizaje visuo-auditivo y la velocidad de reacción a estímulos externos, probablemente favorecidos por una mayor estabilidad postural y libertad de movimientos que posibilitan un mayor aprendizaje (15).
Todo lo anterior configura un escenario radicalmente diferente para el niño, el cual post RDS y apoyado por un programa de rehabilitación adecuado, puede aspirar no sólo a mejorar sus capacidades locomotrices, sino además sus habilidades manuales, su autoestima e integración social. Podemos esperar quebrar la historia natural de la enfermedad y evitar la pérdida de función y retroceso social inevitable que se produce en la mayoría de los niños con PC, cuando no se logra controlar adecuada y oportunamente su espasticidad.
Para obtener los resultados aquí descritos es crucial una adecuada selección del paciente que va a RDS, la selección debe ser perfecta, porque el procedimiento es irreversible.
Los criterios favorables se enumeran en la tabla N°3.
Criterios de selección rds
| • PC forma Diplegia Espástica secundaria a Prematuridad con Leucomalacia periventricular en neuroimágenes |
| • GMFCS niveles I-V |
| • Edad 4-10 años: suficientemente joven con menor riesgo de retracciones musculoesqueléticas, y a la vez con madurez emocional aceptable para colaborar en el proceso de cirugía y rehabilitación. |
| • Edad mayor de 10 años se pueden considerar si reúnen las características mencionadas. |
| • Condición psicosocial apta del paciente y familia para asegurar su colaboración durante todo el proceso quirúrgico y de rehabilitación post-operatorio. |
| • Espasticidad pura, difusa en miembros inferiores (entre 2-4 de Ashworth modificada), sin distonía asociada (o mínima); |
| • FM igual o mayor de M3 en flexores de caderas |
| • Buen CMS en miembros inferiores. |
Como criterios desfavorables para RDS se plantea:
La presencia de retracciones músculo-tendinosas avanzadas y múltiples en los miembros inferiores, por sí mismas, pero también, porque las deformidades osteo-musculares generan un esfuerzo extra que perturba el desplazamiento, lo que indirectamente genera un aumento del tono en las extremidades inferiores.
Los pacientes ambulantes (GMFCS I-II-III) deben ser analizados en Laboratorio de Marcha, el cual permitirá objetivar criterios adicionales de selección para la RDS.
Rehabilitación Post RDS: El objetivo es lograr el re-aprendizaje motor del niño con un nuevo tono muscular, sin la interferencia de la espasticidad. En palabras de uno de nuestros pacientes intervenido de RDS: “Esta sensación es mejor que la mejor aplicación de toxina botulínica que he tenido”.
Debe ser prolongada e intensiva y desarrollada por un equipo multidisciplinario y experto.
Debe prolongarse mientras existan ganancias y habilidades posibles de trabajar y lograr.
Los objetivos específicos son reeducar en forma progresiva los engramas motores desde cefálico a caudal, recuperar rangos de movimiento, reducir retracciones, mejorar la fuerza muscular y dependiendo del nivel funcional de cada paciente, reeducar marcha y/o actividades de la vida diaria y uso de extremidades superiores.
Experiencia en RDS del Instituto Teletón Santiago: Dada la magnitud de la prevalencia de PC y DE en Chile (el 36% de la población activa del Instituto de Rehabilitación Infantil Teletón a nivel nacional es portadora de PC, y entre ellos un 30-40% corresponden a DE), el Instituto de Rehabilitación Infantil Teletón inició el Programa de RDS, en DE en noviembre del año 2010, siguiendo los lineamientos del centro especializado infantil Hospital Gillette, de Saint Paul Minnesotta.
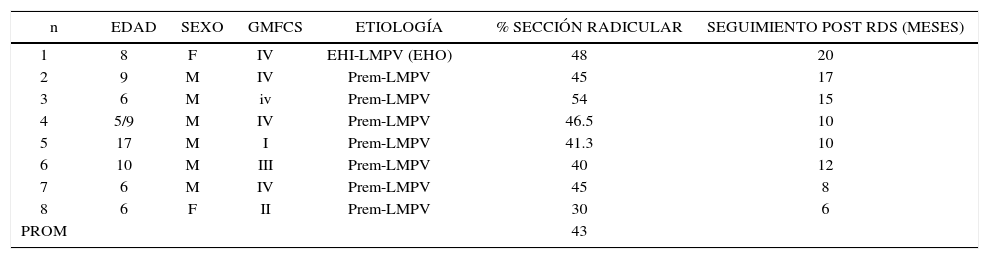
A la fecha se han intervenido 15 pacientes, en una fase piloto. Los resultados animan a expandir y potenciar dicho programa.
En todos los casos la reducción de la espasticidad ha sido significativa y durable (reducciones de 2 puntos en la escala de Ashworth modificada), eliminando, en la práctica, las necesidades de toxina botulínica y postergando toda cirugía ortopédica, excepto en dos casos de subluxación progresiva de caderas.
En los 8 casos de la Tabla N° 4 que tienen un seguimiento post RDS mayor de 9 meses, se observaron: mejorías funcionales de marcha, corroboradas con estudio instrumental de laboratorio de marcha (índice GDI, que refleja el comportamiento cinemático) en todos los casos ambulantes (4 casos). Uno de ellos, mejoró significativamente el tono muscular, la fuerza, movilidad y control motor selectivo (CIF: dimensión corporal); mejoró su condición de marcha, reduciendo sus necesidades de ayudas técnicas, pasó de carro posterior a bastones canadienses (CIF: dimensión actividad); por último, mejoró su marcha comunitaria, en eficiencia y accesibilidad, que favorece una mejor integración social y escolar que le permitió cambiarse de escuela especial a escuela normal.
Experiencia inicial en rds instituto teletón santiago noviembre 20.0 - noviembre 2012
| n | EDAD | SEXO | GMFCS | ETIOLOGÍA | % SECCIÓN RADICULAR | SEGUIMIENTO POST RDS (MESES) |
|---|---|---|---|---|---|---|
| 1 | 8 | F | IV | EHI-LMPV (EHO) | 48 | 20 |
| 2 | 9 | M | IV | Prem-LMPV | 45 | 17 |
| 3 | 6 | M | iv | Prem-LMPV | 54 | 15 |
| 4 | 5/9 | M | IV | Prem-LMPV | 46.5 | 10 |
| 5 | 17 | M | I | Prem-LMPV | 41.3 | 10 |
| 6 | 10 | M | III | Prem-LMPV | 40 | 12 |
| 7 | 6 | M | IV | Prem-LMPV | 45 | 8 |
| 8 | 6 | F | II | Prem-LMPV | 30 | 6 |
| PROM | 43 |
8 Primeros casos de RDS. EHI-LMPV: Encefalopatía Hipóxico-Isquémica, Leucomalacia Periventricular. Prem-LMPV: Prematuridad-Leucomalacia Periventricular
En todos los niños con GMFCS IV, observamos mejorías significativas en habilidades motoras gruesas (GMFM 88 y 66), que permitieron mejorar la marcha con asistencia (2 casos), los giros en decúbito, el confort en sedente y control de tronco, así como su desplazamiento en silla de ruedas. Cuatro niños, de cinco lograron independencia en vestuario, aseo menor o mínima asistencia, se trasladan con mayor independencia, participan más de los juegos y realizan sus tareas escolares y recreativas con mayor fluidez del movimiento y mejoraron el uso de sus miembros superiores. En relación a la satisfacción de los padres, se obtuvo un puntaje de 8,1 (entre 0 y 10), lo que refleja no sólo lo medido y observado por nosotros, sino una variedad de ganancias en actividades de la vida diaria que sólo ellos en su propio contexto psicosocial son capaces de percibir y valorar. Además, en 2 casos se documentó mejoría clínica de vejiga neurogénica (normalización de ritmo miccional). Nuestros resultados son semejantes a la Evidencia Científica Internacional.
Seguridad: En consonancia con lo reportado en los centros de mayor experiencia en RDS (11), el número de complicaciones postoperatorias observado en nuestra experiencia, ha sido bajo y manejable: vejiga neurogénica transitoria, en 2 casos, resuelta espontáneamente; fístula de líquido cefalorraquídeo, en 1 caso; infección de herida operatoria en 1 caso; dolor músculo-esquelético, en rodillas, en 3 casos, que atribuimos a sobre-elongación de partes blandas, secundario al menor tono muscular y debilidad muscular, que fue también de carácter transitorio; cicatriz operatoria hipertrófica en 2 casos; constipación en 4 casos, que se han resuelto con terapia específica antes de los 15 días. No hemos observado dolor, a nivel de zona operatoria lumbar, ni tampoco dolores neuropáticos, intensos o de difícil manejo.
Entre los 7-15 días pos-operatorio los pacientes están, habitualmente libres de fármacos analgésicos. Ningún paciente ha debido postergar el inicio de la rehabilitación postoperatoria por dolor.
Terapia de infusión mantenida de baclofeno intratecal (bit) en parálisis cerebral (pc)Consiste en la infusión permanente al espacio subaracnoideo espinal, de baclofeno, poderoso antiespástico agonista de receptores GABA-b cuya acción farmacológica a nivel de las capas II y III de las astas posteriores espinales provoca una inhibición de los reflejos tanto mono como polisinápticos, lo que se traduce en una reducción importante de la espasticidad y los espasmos musculares, pudiendo además tener cierta acción analgésica.
También esta terapia permite el control de las distonías secundarias, mediante una acción aún no bien conocida, que radicaría en receptores a nivel encefálico (16).
Dado que el baclofeno no atraviesa la barrera hematoencefálica, la infusión intratecal permite que el fármaco esté en directo contacto con el sistema nervioso central, consiguiendo efectos 50 -100 veces más potentes que por vía oral, lo que permite usar dosis del orden de microgramos, produciendo además una menor tasa de efectos secundarios.
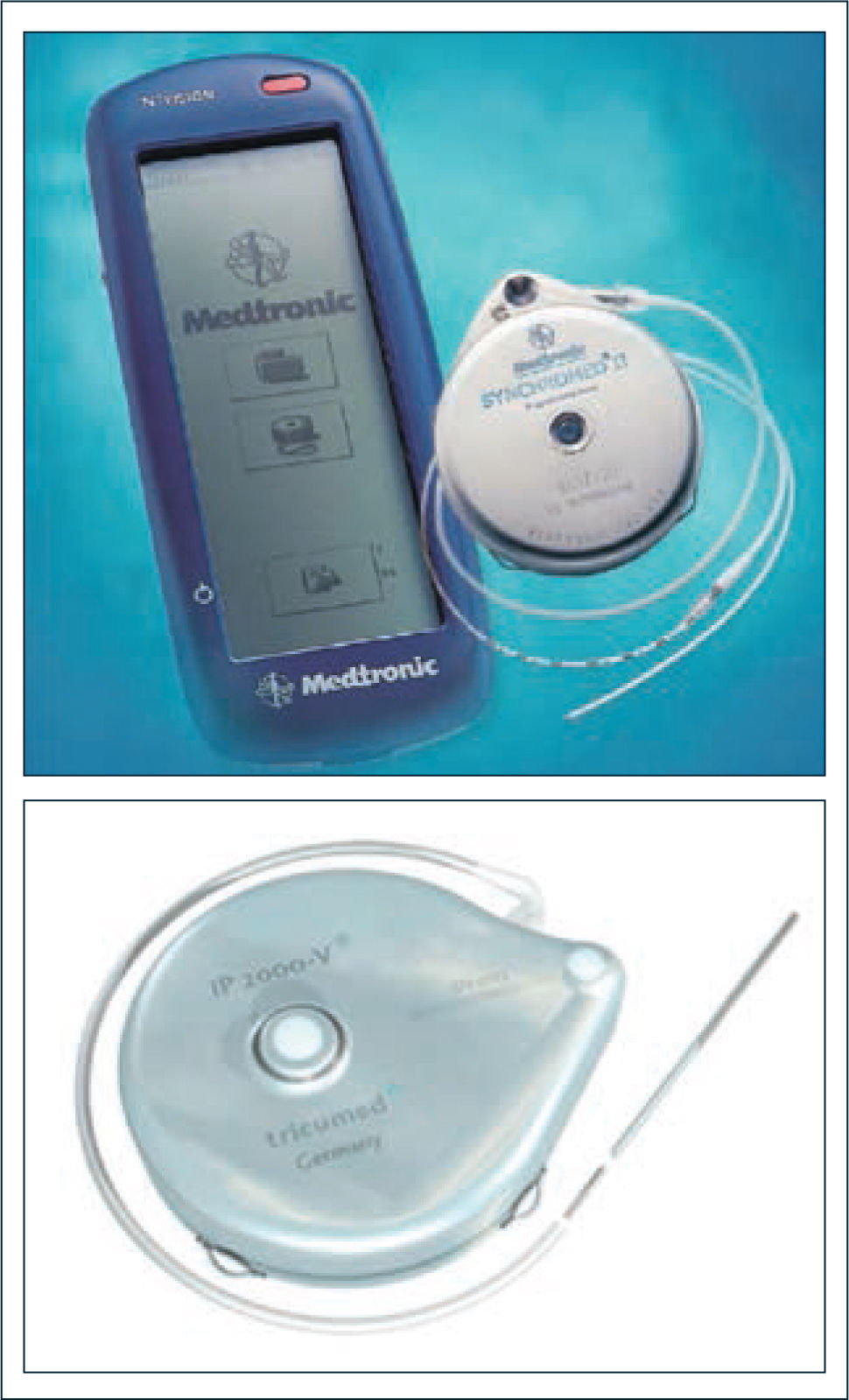
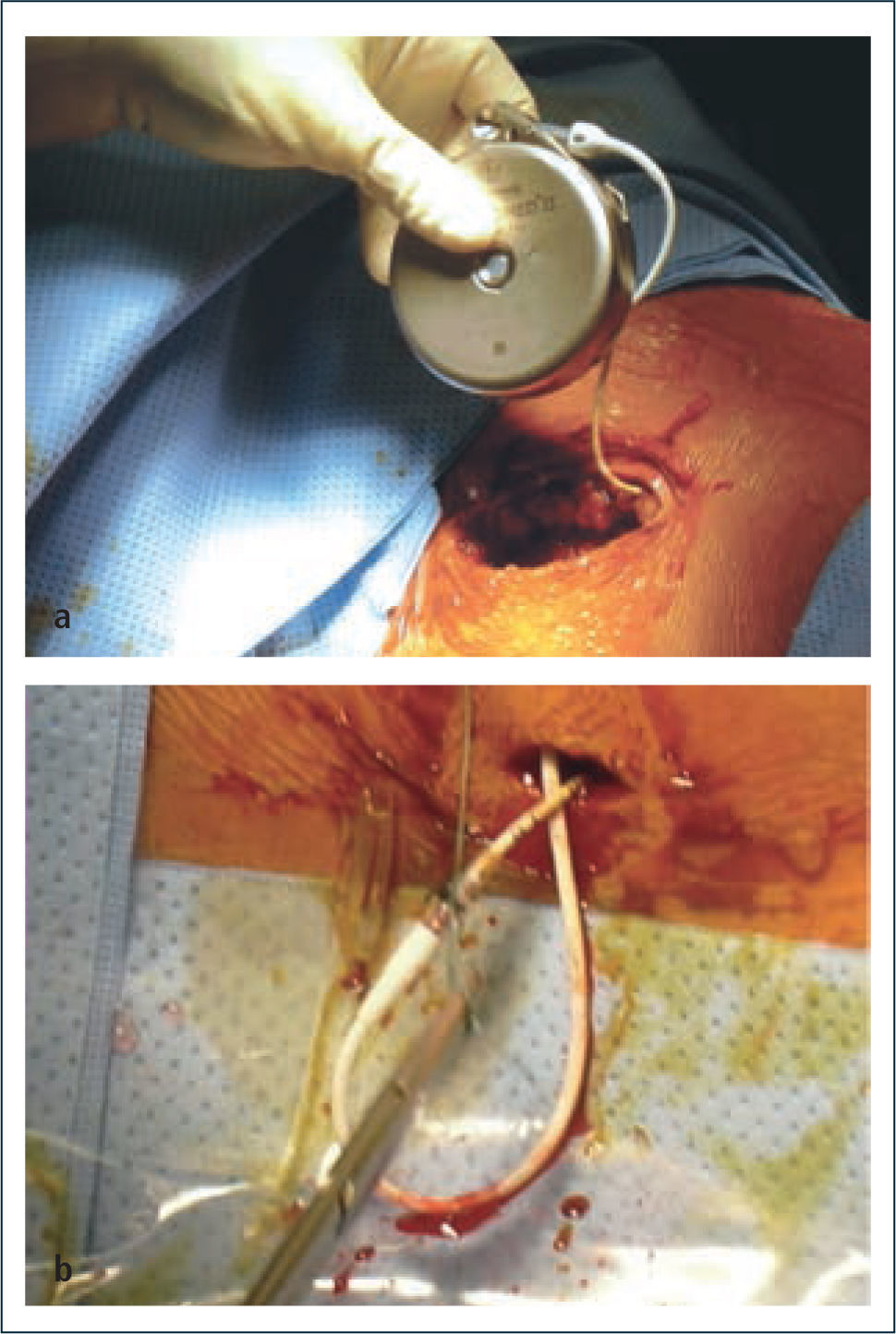
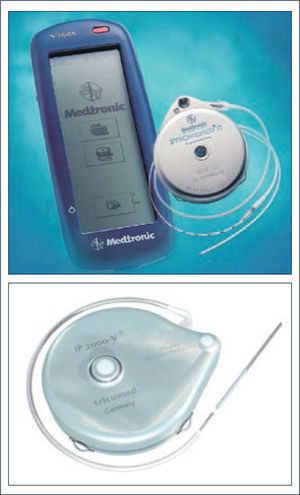
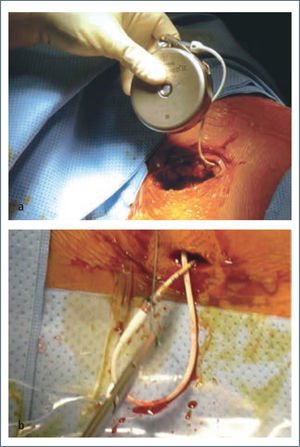
El sistema consiste en una bomba electromecánica (Figura 7 y 8), que se implanta quirúrgicamente en la pared abdominal junto con un caté ter subcutáneo que la conecta al espacio intratecal (Fotos N° 4a y 4b). La bomba posee un reservorio presurizado, desde el cual el fármaco en solución es transportado por un motor hacia el puerto de salida donde se conecta el catéter en su extremo proximal. El extremo distal va al espacio intratecal.
Técnica quirúrgica de implante de bomba de baclofeno. Arriba: bomba de baclofeno con catèter intratecal ya conectado, dispuesta a ser localizada en bolsillo subcutáneo abdominal. Abajo: Región lumbar. Catéter intratecal ya ubicado en espacio subaracnoideo a través de técnica percutánea guiada por radioscopía. La porción sobrante proximal será traccionada y enrollada bajo la bomba de baclofeno en el bolsillo subcutáneo, previo al cierre de las 2 incisiones quirúrgicas. Foto tomada por los autores.
En el mercado existen bombas programables (flujo variable, ej Synchromed II de Medtronic) que permiten programar y modificar tanto la dosis diaria como el modo de infusión (simple o flexible), así como bombas de flujo fijo (ej, IPV 2000 de Tricumed), en las que para cambiar la dosis se requiere cambio de concentración de la solución del fármaco a utilizar.
Esta es una terapia reversible y crónica, e implica para el paciente y familia, obligatoriamente la adherencia estricta a los controles médicos y rellenos periódicos de la bomba (habitualmente cada 2-3 meses), así como saber reconocer los síntomas iniciales de las potenciales complicaciones y consultar oportunamente. Debe existir un sistema de atención médica organizado y preparado para atender prontamente las posibles complicaciones, algunas de las cuales pueden ser graves.
Población Objetivo e Impacto: El (BIT) se ha reportado útil en diferentes tipos de pacientes portadores de espasticidad difusa de origen espinal o cerebral. En PC los criterios más importantes para considerar al BIT se presentan en la Tabla N° 5.
Criterios de selección para tratamiento con bit
| Espasticidad difusa y simétrica ≥ 2 en miembros superiores y/o ≥ 3 en miembros inferiores (escala de Ashworth modificada). |
| Distonía perturbadora de la movilidad, postura y el confort. |
| Espasticidad o distonía refractaria a tratamiento farmacológico oral y/o local. |
| Cadera espástica dolorosa en paciente severamente afectado (GMFCS V). |
| Perturbación de la movilidad, confort, actividades de vida diaria, cuidados de enfermería debidas a espasticidad o distonía. |
| Diplejia espástica moderada a severa (GMFCS III-IV y V |
| Tetraparesia Espástica. |
| Tetraparesia Mixta (espástico-distónica |
| Tetraparesia Distónic |
| Dolor o espasmos musculares invalidantes asociados a espasticidad y/o Distonía. En estos casos, especialmente dolor lumbar. |
| Buena respuesta a test de baclofeno intratecal |
Requisitos: Peso mayor de 15 kg; buena condición nutritiva; ausencia de alergia a baclofeno; familia con adecuado acceso al centro especializado, así como tener características de educación y asertividad óptimas que permitan cooperar con esta terapia de largo plazo, especialmente en lo que respecta a adherencia a controles y a la pesquisa precoz de posibles complicaciones. Esta terapia sólo puede plantearse en un contexto especializado y multidisciplinario y debe contarse con claros protocolos clínicos y de proceso para el seguimiento y manejo de las posibles complicaciones.
La coexistencia de Epilepsia no es contraindicación a priori para BIT. Existe evidencia clase A y consenso en que el BIT reduce significativamente la espasticidad de miembros superiores e inferiores (17). Sin embargo, no existe igual nivel de evidencia respecto a los beneficios que esta terapia produciría en las dimensiones de Actividad y Participación de la CIF, en PC. Una revisión sistemática exhaustiva reciente, califica al BIT como opción terapéutica con evidencia disponible insuficiente en estos dominios, en pacientes portadores de PC (7). A pesar de lo anterior, la terapia de BIT se ha demostrado útil en pacientes portadores de espasticidad discapacitante de diferentes etiologías, especialmente en aquellos casos de mayor incapacidad o severidad (ej. PC GMFCS IV y V), donde mejora la capacidad de estar sentados fuera de la cama, y la facilidad para los cuidados de enfermería (18)18. En aquellos pacientes que usan silla de ruedas, el baclofeno puede mejorar el uso de ésta. Estudios retrospectivos o no controlados en PC, han reportado mejorías en el uso de silla de ruedas, transferencias, disminución de disartria y mayor comunicación social (18).
Esta terapia puede reducir significativamente la carga de trabajo para los padres/cuidadores (19). Asimismo podría reducir la necesidad de cirugía ortopédica correctora hasta en un 60% (20). También se ha reportado en estudio prospectivo, mejorías en el score GMFM 88 dimensión Sedente y en calidad de vida 12-24 meses post implante de BIT (21). El trabajo de Krach y colaboradores nos entrega un interesante complemento a la información de los párrafos precedentes, al reportar elevados grados de satisfacción obtenido a largo plazo por 103 pacientes (74% PC tipo Cuadriplegia espástica) y/o sus cuidadores 1-4 años post- implante de BIT, a través de entrevistas estructuradas. El 82% de los pacientes se mostró satisfecho y dispuesto a volver a operarse, retrospectivamente. La mayoría de ellos referían haber mejorado su participación en actividades recreacionales, el uso de sus miembros superiores, el vestuario y las transferencias (22).
Efectos de BIT sobre la Marcha en PC: El nivel de evidencia es hasta ahora débil para sustentar el beneficio de BIT en la ambulación en PC, a pesar de que en los numerosos estudios se reporta que una proporción elevada de pacientes habría mejorado sus habilidades de marcha (23). Los pacientes pueden reportar claras mejorías en su capacidad de marcha en la comunidad, pese a escasos o nulos cambios kinemáticos post BIT, lo que podría explicarse por reducción en el consumo de oxígeno, al reducirse la espasticidad (24).
En los análisis cuantitativos de la marcha, se ha registrado una mejoría de la extensión de la cadera y una mayor longitud del paso. La mayoría de los niños mantuvo o mejoró sus habilidades funcionales de la marcha, de acuerdo al puntaje FAQ del Hospital Gillette (24).
El efecto del BIT, es diferente en cada niño y no se ha precisado una regla para predecir el cambio que se podrá generar.
BIT en Distonía: En la mayor serie de pacientes de BIT en el manejo de la distonía secundaria, generalizada en PC (25), se obtiene mejoría significativa en el Score de Distonía de Barry-Albright, entre 12 y 36 meses post implante Tabla N° 5. Los aspectos que mejoraron, con mayor frecuencia, fueron la facilidad de cuidados y confort (85%), el lenguaje (30%) y la función de miembros superiores (30%). Considerando que la inmensa mayoría de estos pacientes pertenecían a los grupos IV y V de la GMFCS, los resultados parecen ser razonables, ya que las expectativas de ganancias funcionales son habitualmente muy bajas.
Prueba de Baclofeno Intratecal: Consiste en la administración de un bolo de baclofeno, directamente al espacio Intratecal, por punción lumbar y observar, en base a una pauta o protocolo preestablecido, las respuestas obtenidas en términos de: reducción de la espasticidad y espasmos musculares; reducción del dolor asociado; mejoría en los rangos de movimiento articular.
Asimismo, se proyectan los posibles cambios funcionales o de confort, medidos a través de la aplicación de Escalas e Instrumentos de evaluación. En casos de PC Distónica o cuando se desea evaluar potenciales efectos sobre la marcha, se puede optar por hacer la Prueba de Baclofeno, a través de un catéter intratecal, conectado a una bomba de microinfusión externa, lo que permite a diferencia del bolo, titular progresivamente la dosis y evaluar así sus efectos de manera más confiable. Cuando se obtienen cambios positivos objetivos, descenso significativo de Espasticidad y/o Distonía, la prueba se considera positiva y constituye un criterio decisivo para la indicación de la terapia. Si por el contrario, no se objetivan cambios positivos, aparece deterioro funcional o efectos adversos, se descarta la indicación de BIT.
Nuestra Experiencia en BIT en niños: En nuestro medio la experiencia es muy limitada debido al relativo desconocimiento de esta opción y al alto costo de la terapia con BIT. Nuestra experiencia se resume a 6 casos Tabla N° 6. En el caso portador de PC 6 meses post implante se ha observado reducción de la espasticidad promedio de miembros inferiores de 3,5 a 2, mejoría funcional de miembros superiores y mejorías en el sedente, lo que ha impactado positivamente la vida escolar y recreativa de la paciente. En el caso de PEH, 6 meses post implante, la titulación de la terapia ha sido lenta, observándose reducción parcial de la espasticidad promedio de miembros inferiores de 3 a 1,5, pero sin impacto en la marcha por ahora. En el caso de paciente con PPE de etiología no precisada, se redujo la espasticidad de miembros inferiores de 3,5 a 2,5, siendo posible realizar cirugía ortopédica posterior a este tratamiento, con mejoría de la independencia en vestuario, la eficiencia de la marcha y la integración social, manteniéndose las ganancias observadas en sus 10 años de seguimiento.
Serie de casos tratados con bit, experiencia acumulada por los autores. ppe enp: paraparesia espástica de etiología no precisada
| PACIENTES | EDAD (EN AÑOS, AL MOMENTO DEL IMPLANTE) | DIAGNÓSTICO | SEGUIMIENTO POST-IMPLANTES (MESES) |
|---|---|---|---|
| 1 | 15 | PPE ENP | 120 |
| 2 | 63 | TRM | 17 |
| 3 | 68 | TRM | 15 |
| 4 | 13 | PC | 6 |
| 5 | 8 | PPEH | 5 |
| 6 | 31 | TEC | 3 |
TRM: Traumatismo Raquimedular. PC: Parálisis Cerebral. PPEH: Paraparesia Espástica Hereditaria. TEC: Traumatismo Encéfalo Craneano.
Seguridad de la terapia de BIT: Si bien se han demostrado niveles de seguridad razonables post BIT (21), pueden aparecer diferentes tipos de complicaciones, las que pueden agruparse en infecciosas, en aquellas relacionadas al procedimiento quirúrgico o al dispositivo en sí.
La incidencia reportada de complicaciones oscila entre 0,06-0,09 por paciente/mes (26). La infección es del orden del 10%, la fístula de líquido cefalorraquídeo entre 15-20% y las relativas al catéter (desplazamiento, obstrucción, ruptura), del orden del 10% (26,27). De estas últimas, 2/3 pueden ser potencialmente graves por el riesgo de privación que podría llevar a estados de hiperespasticidad o convulsivos con riesgo de rabdomiólisis e hipertermia maligna. Se ha reportado explantación de bomba de hasta un 30% a causa de infección (28). Sin embargo, dadas las mejorías de diseño de las bombas de baclofeno (menor diámetro y grosor), y de aplicación de técnica quirúrgica de implante sub-fascial, las complicaciones infecciosas se han reducido significativamente. Los pacientes más expuestos a infecciones son los de menor edad y peso, así como aquellos muy postrados o con comorbilidad asociada, por lo que es crucial tomar en cuenta estos factores antes de indicar una BIT. En nuestra limitada experiencia (6 casos), hemos observado: 3 complicaciones relativas al catéter resueltas adecuadamente (taponamiento, acodamiento y desconexión) y 1 fístula contenida líquido cefalorraquídeo que mejoró con medidas de compresión y reposo. No se ha observado hasta ahora complicaciones 6 meses post implante en el único caso operado de BIT portador de PC.
ConclusionesLa PC es la causa más frecuente de Discapacidad Física en pediatría. Su incidencia no ha disminuido en las últimas décadas y con las mejorías en la atención de salud, su prevalencia está aumentando (1). Las implicancias para la persona, su familia y la sociedad son altas, con un costo individual, familiar, social y económico elevado.
Su denominador común es el compromiso motor, pero con frecuencia se acompaña de otros déficits (sensoriales, cognitivos, de lenguaje, etc.), que complejizan aún más su evolución y tratamiento.
Todo lo anterior obliga a un abordaje terapéutico integral y efectivo, con miras a lograr el máximo nivel de funcionamiento, actividad y participación, considerando estas tres dimensiones al evaluar la respuesta a los tratamientos.
Las alteraciones del tono muscular más frecuentes, son la Espasticidad y en segundo lugar la Distonía y su rol en la generación de discapacidad es preponderante, por lo que su tratamiento es clave para el logro de los objetivos de rehabilitación.
La RDS y en segundo lugar, la terapia con BIT tienen altos niveles de evidencia en la mejoría funcional y de participación en los niños con PC y los estudios de costo-efectividad las apoyan, por lo tanto, deben ser consideradas dentro del arsenal terapéutico, lo cual hace necesaria su difusión, desarrollo e implementación en nuestro país.
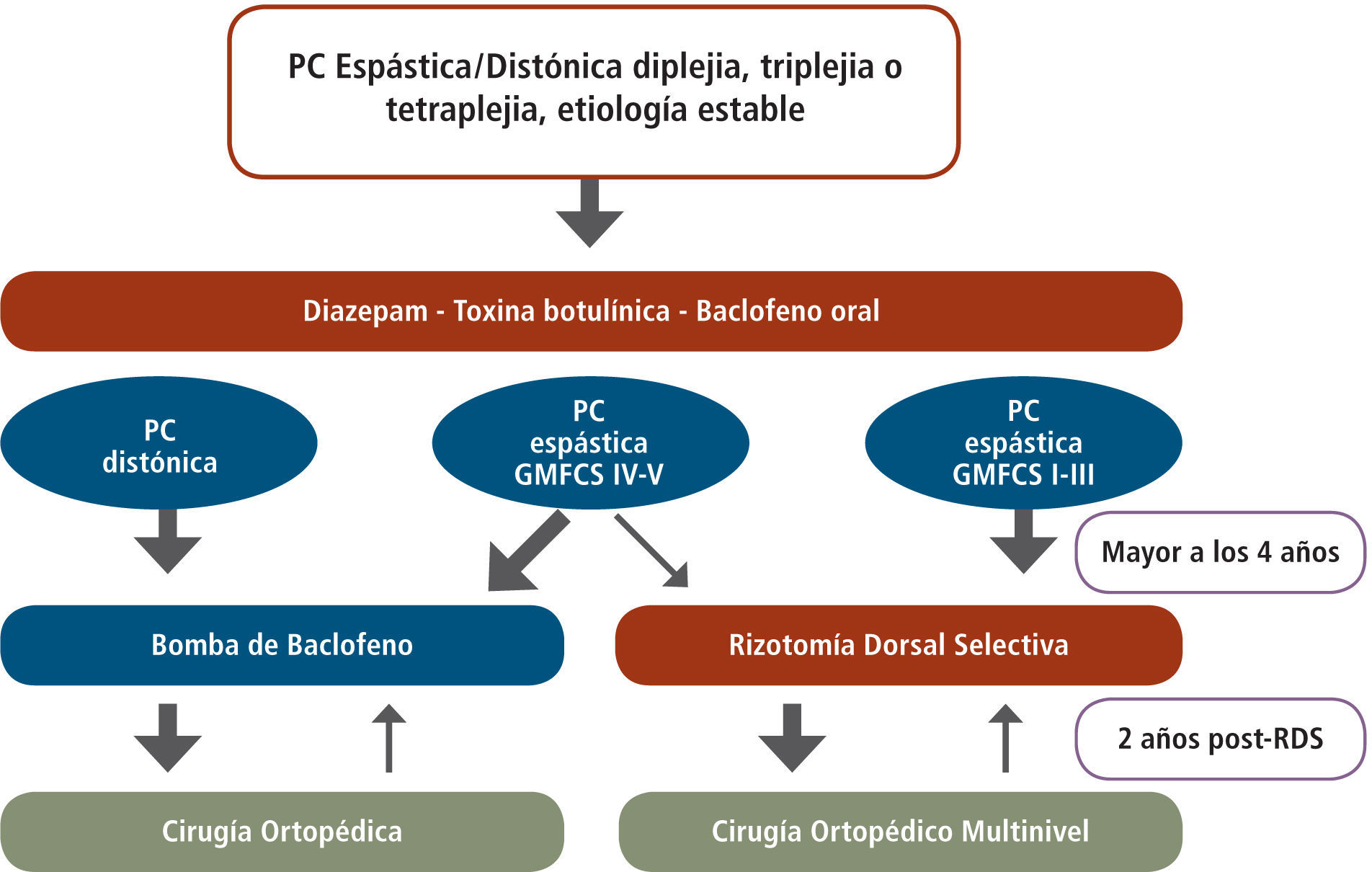
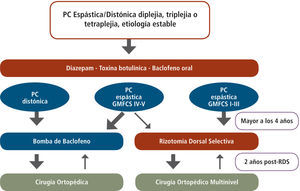
Como un resumen gráfico de este artículo, los autores queremos plantear un algoritmo de manejo de la Hipertonía en Parálisis Cerebral en la Figura N° 9 (ver página siguiente).
Las autoras declaran no tener conflictos de interés, en relación al artículo.