La oxigenación extracorpórea mediante membrana (ECMO, por sus siglas en inglés) es una técnica utilizada en pacientes con insuficiencia respiratoria y/o cardíaca catastrófica. En este artículo, se revisan las diferencias y similitudes fisiológicas entre el ECMO y la función cardiopulmonar normal. Se describen los procesos involucrados en la transferencia gaseosa, así como los factores que influyen en la eficiencia de la oxigenación y eliminación del dióxido de carbono. Se hace énfasis en la relevancia clínica de la fisiología del ECMO para la atención de pacientes críticos.
Extracorporeal membrane oxygenation (ECMO) is used in patients with catastrophic respiratory and cardiac failure. In this article, the physiologic similarities and differences between normal and ECMO cardiopulmonary function are reviewed. The processes involved in gas transfer are described, as well as the factors that influence the efficiency of oxygenation and elimination of carbon dioxide. Emphasis is placed on the clinical relevance of the physiology of ECMO for critically ill patients.
La oxigenación extracorpórea mediante membrana (ECMO) surgió como una opción de soporte en la década de 1970 para tratar la insuficiencia respiratoria refractaria. Consiste en la extracción a presión negativa (bomba centrífuga) o por gravedad (bomba roller) de sangre venosa a través de una cánula, la que luego circula a presión positiva a través de un dispositivo (oxigenador de membrana) que oxigena la sangre y disminuye el dióxido de carbono (CO2), retornándola a alta presión a una vena y/o arteria. Este proceso permite la oxigenación de la sangre y una eliminación de CO2 eficiente, aunque con limitaciones, mientras se reduce la carga de trabajo en los pulmones y/o corazón. En este artículo, proporcionaremos una descripción sencilla de la fisiología del ECMO veno-venoso y de las claves para optimizar el intercambio gaseoso1,2.
El dispositivo ECMO se basa en los principios de la circulación extracorpórea y consta de una bomba que genera flujo sanguíneo, un oxigenador que permite la transferencia gaseosa y una red de tubuladuras y cánulas para conectar al paciente al circuito ECMO. De cierta manera, intenta imitar el funcionamiento habitual pulmonar, pudiendo hacerse un paralelo entre ambos, presentando el ECMO una funcionalidad – y disfuncionalidad – en gran medida similar a los órganos nativos.
El presente artículo versa principalmente sobre el ECMO veno-venoso (en adelante ECMO VV), su funcionamiento (similar, por cierto, al ECMO veno-arterial, en adelante ECMO VA) y su comparación con la fisiología de los pacientes sin ECMO; manteniendo un lenguaje amigable y comprensible para quienes están iniciando su entendimiento y estudio de la técnica.
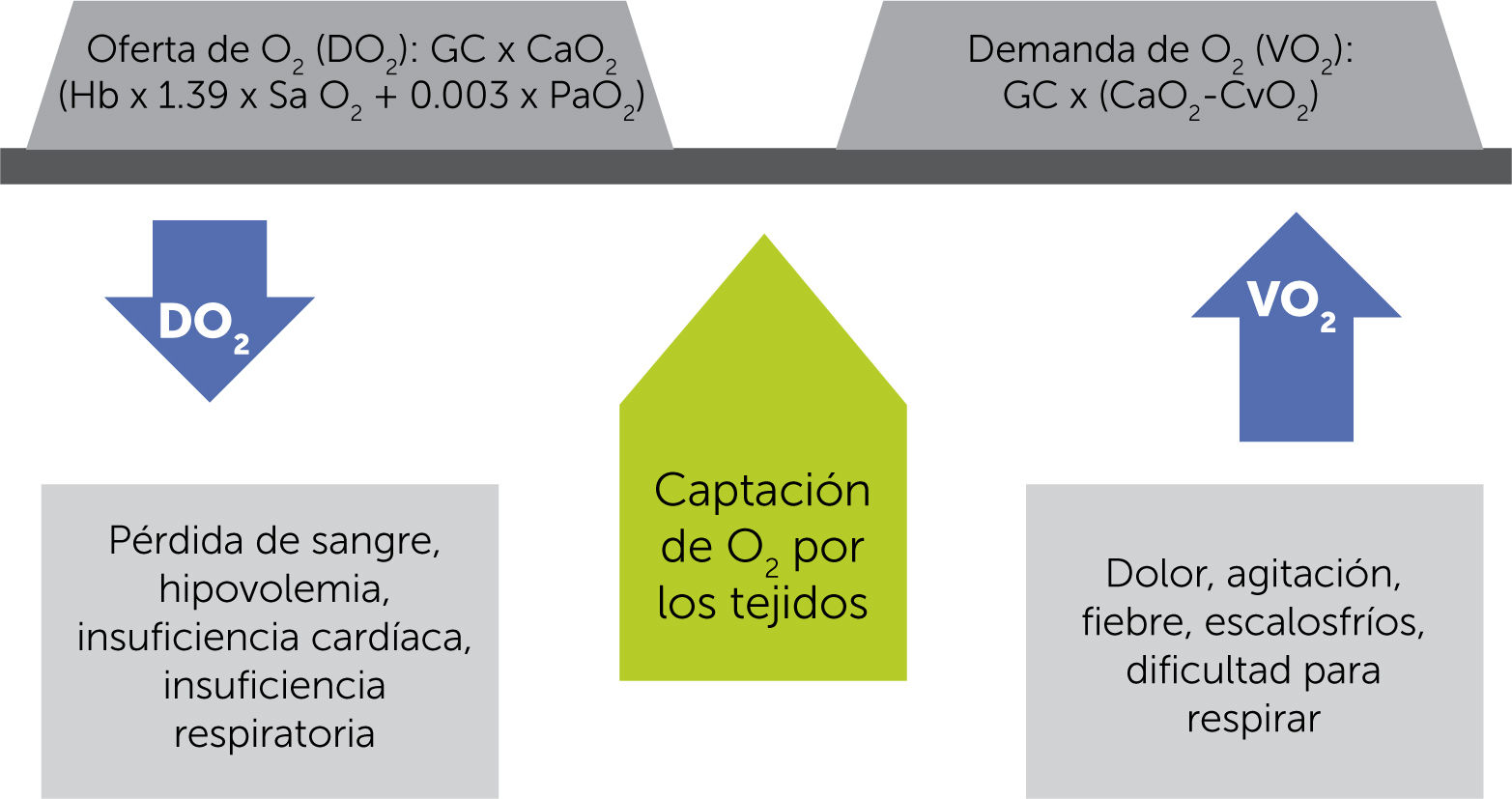
DO2/VO2 (o: el para qué tenemos sistema cardiopulmonar)Para vivir necesitamos que llegue oxígeno (O2) a las mitocondrias en la cantidad que éstas requieren, para luego eliminar el producto de desecho del metabolismo (CO2).
Este equilibrio entre disponibilidad de O2 (DO2) y consumo de O2 (VO2) debe ser mantenido para permitir un metabolismo aeróbico adecuado. En caso de que el aporte no sea suficiente, ya sea por su disminución o bien porque el consumo aumenta más allá de los posibles mecanismos de compensación en la entrega, el organismo inicia el proceso de deuda de O2, lo que, de no ser intervenido, llevará a la muerte3,4 (figuras 1 y 2).
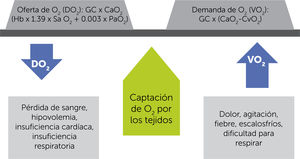
Equilibrio entre la disponibilidad u oferta (DO2) y el consumo o demanda de oxígeno (VO2) y las condiciones que lo afectan. GC=gasto cardíaco; CaO2=contenido de oxígeno arterial; Hb=hemoglobina; SaO2=saturación de oxígeno arterial; PaO2=presión parcial de oxígeno arterial; CvO2=contenido de oxígeno venoso3.
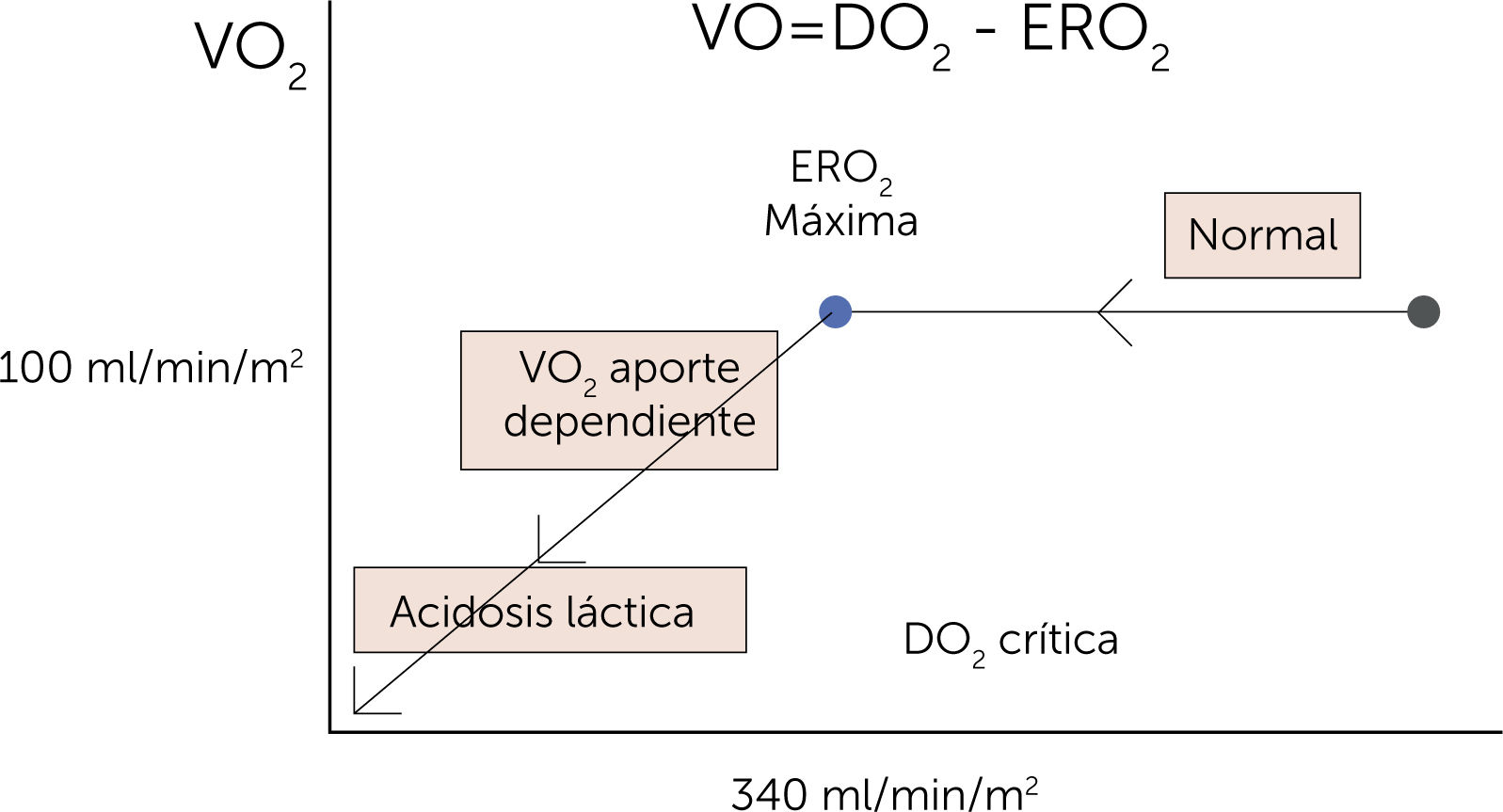
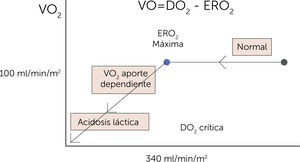
Relación entre disponibilidad y consumo de oxígeno (O2). Relación entre la oferta (DO2) y la demanda de oxígeno (VO2) y la transición del metabolismo energético desde aeróbico hacia anaeróbico. El lado derecho de la curva muestra la relación independiente entre la DO2 y la VO2. En condiciones en las que la DO2 disminuye por debajo de la DO2 crítica (donde la tasa de extracción de O2 es máxima: 340ml/min/m2), la VO2 pasa a ser dependiente de la DO2. En estas condiciones se presenta el déficit de O2 que lleva a un estado isquémico. La magnitud del déficit de O2 explica la deuda de O2. ERO2=tasa de extracción de oxígeno3.
El sistema cardiopulmonar, desde la orofaringe hasta la mitocondria, está finamente ajustado para lograr este objetivo. La enfermedad subyace cuando este equilibrio se quiebra. La atención de salud está orientada a restablecer el equilibrio, desde el acetaminofeno que disminuye la fiebre y con ello el consumo de O2 (VO2 o tasa metabólica) hasta una cirugía que retira un absceso. Por otro lado, una transfusión o aportar O2 suplementario, aumentará la entrega de O2 (DO2)3,4.
El rol del ECMO es aumentar la entrega de O2, controlar el CO2, y en el caso del ECMO VA, presurizar el sistema arterial. Es un soporte, no una terapia, que estará instaurado mientras los órganos nativos se recuperan4.
Los determinantes del contenido sanguíneo de O2 son en primer (y más importante) lugar la concentración de hemoglobina (Hb), luego la saturación con O2 de ésta, y por último la cantidad de O2 disuelto.
Los determinantes de la entrega de O2 a los tejidos son el contenido arterial de O2 multiplicado por el gasto cardíaco: a mayor contenido y mayor gasto cardíaco, mayor entrega.
Al aumentar el metabolismo (aumento de VO2), los mecanismos de compensación fisiológicos lograrán un aumento de la entrega, por ejemplo, con aumento del gasto cardíaco (frecuencia). Esto se observa al realizar ejercicio. A su vez, se deberá barrer más CO2 (aumentar la ventilación alveolar), esto es fácil de evidenciar al observar el aumento de la frecuencia respiratoria posterior al ejercicio, o en un paciente séptico3,4.
El VO2 está controlado por el metabolismo, y así aumenta con actividad, hipertermia, catecolaminas e hipertiroidismo, y disminuye con sus opuestos: reposo, parálisis, hipotermia. El DO2 suele ser 5 veces superior al VO2, manteniendo así mecanismos de reserva fisiológica. Cuando el DO2 disminuye hasta el punto crítico (este punto es variable dependiendo de la patología a la que nos enfrentamos) donde se produce una dependencia de la DO2/VO2, se entra en franca deuda de O2 y muerte mitocondrial3,4 (figura 2).
| - Contenido arterial O2(CaO2)=(Hb×1,36)×(SaO2/100)+(PaO2×0,0031)CaO2: contenido arterial de oxígeno (ml/dl); Hb: hemoglobina (g/dl); SaO2: saturación arterial de oxígeno (%); PaO2: presión arterial de oxígeno (mmHg).- Contenido venoso O2(CvO2)=(Hb×1,36)×(SvO2/100)+(PvO2×0,0031)CvO2: contenido venoso de oxígeno (ml/dl); Hb: hemoglobina (g/dl); SvO2: saturación venosa de oxígeno (%); PaO2: presión venosa de oxígeno (mmHg.)1g de Hb fija 1,36ml de O2. El contenido venoso de O2 disuelto es habitualmente 3%.- DO2=GC×CaO2×10DO2: delivery o entrega de O2 (ml/min); GC: gasto cardíaco (l/min).Se multiplica CaO2 (ml/dl) por 10 para ajustar unidades a ml/l.Esta fórmula puede ser indexada, utilizando índice cardíaco en lugar de gasto cardíaco.- VO2=(CaO2- CvO2)×GCVO2: consumo de oxígeno |
Por otra parte, la producción de CO2 (VCO2) se empareja con el VO2 (las mismas moléculas utilizadas deben ser removidas). Un paciente con mayor catabolismo requiere aumento de la ventilación alveolar para mantener un estado ácido-base estable. La eliminación de CO2 no se afecta por la hemoglobina (Hb) ni por aumento del gasto cardíaco.
| • Los principales determinantes del contenido sanguíneo de O2 son la concentración de Hb, la saturación de O2 de ésta y la cantidad de O2 disuelto.• La entrega de O2 a los tejidos se determina por el contenido arterial de O2 multiplicado por el gasto cardíaco.• El VO2 está controlado por el metabolismo y varía con la actividad, la fiebre, las catecolaminas y el hipertiroidismo.• El DO2 suele ser cinco veces mayor que el VO2, lo que mantiene mecanismos de reserva fisiológica. |
La instalación de un ECMO VV tiene como objetivo aumentar el contenido arterial de O2 y disminuir en contenido de CO2, permitiendo reposar los pulmones, pero manteniendo la DO2 y la descarboxilación sanguínea.
Existen diferentes modalidades de ECMO, clasificadas según el soporte proporcionado. Si bien la configuración del circuito y su funcionamiento se mantienen, la diferencia subyace en el lugar de introducción de las cánulas, el soporte aportado, y las posibles complicaciones5.
La sangre siempre se extrae a través de una cánula, la que suele poseer fenestraciones. Esta cánula está en una vena, ergo la abreviación “veno o V” inicial. Las siglas que le siguen pueden hacer referencia a una segunda cánula de extracción y luego al retorno5 (tabla 1).
Nomenclatura simplificada y posición cánulas retorno
| POSICIÓN CÁNULAS RETORNO | ||
|---|---|---|
| POSICIÓN DE CÁNULA DE RETORNO | NOMENCLATURA SIMPLIFICADA | FUNCIÓN PRINCIPAL DEL ECMO |
| Vena | ECMO VV | Soporte respiratorio |
| A bajo flujo, sólo | ||
| extracción de CO2 | ||
| Arteria | ECMO VA | Soporte respiratorio y cardíaco (presor) unidos |
| Arteria y vena | ECMO veno arterio venoso | Soporte respiratorio y cardíaco (independientes) |
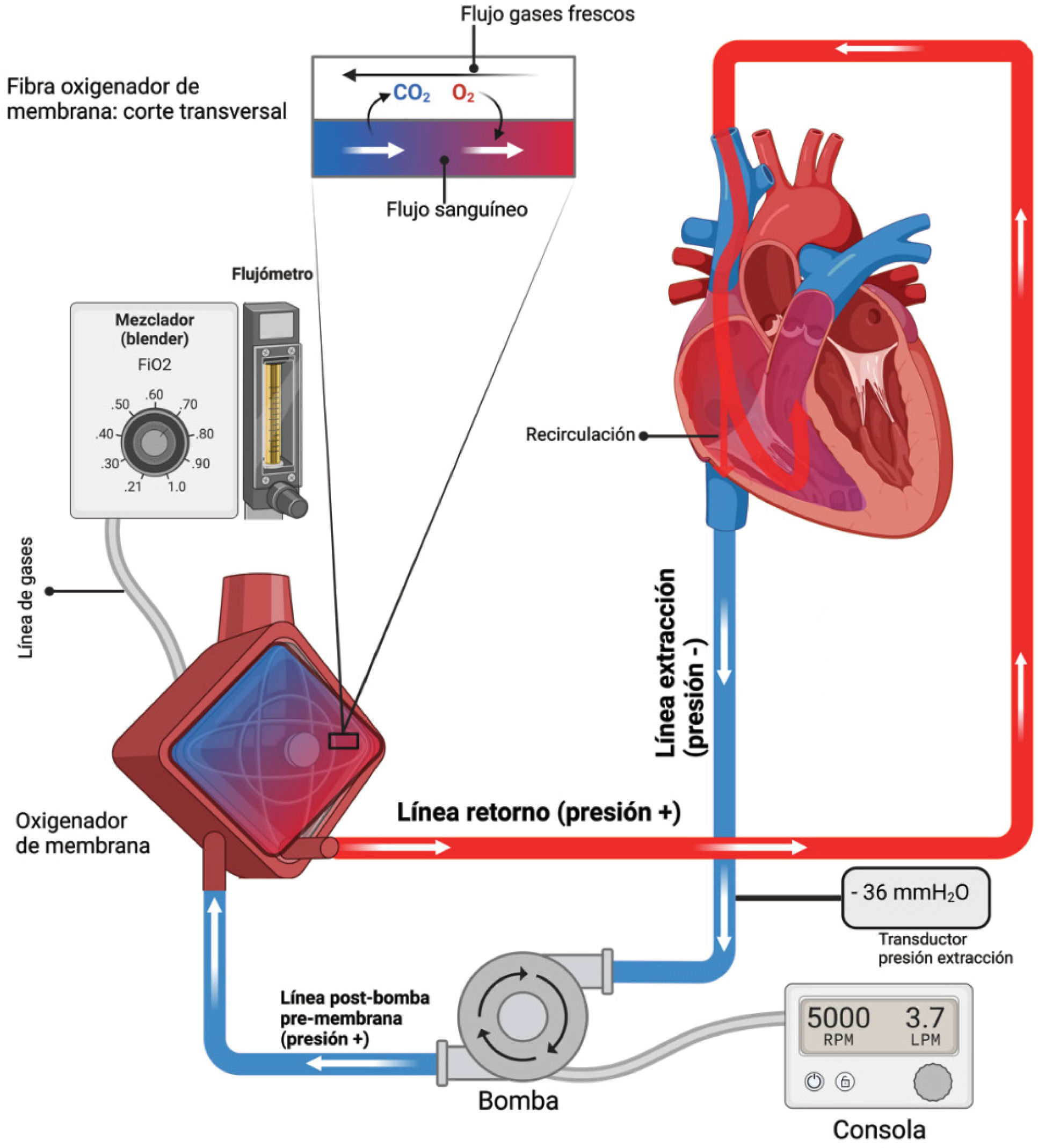
En ECMO VV se extrae sangre venosa a través de la cánula de extracción desde alguna vena de calibre mayor (yugular superior/cava superior; femoral/cava inferior; subclavia), se oxigena y retorna oxigenada y con CO2 controlado a otra vena mayor del cuerpo (cualquiera de las ya descritas) a través de la cánula de retorno5. Desde allí, esta sangre oxigenada, que es un porcentaje del gasto cardíaco (y se mezcla con el resto del retorno venoso no oxigenado), ingresa a aurícula derecha, luego al ventrículo derecho, al pulmón en insuficiencia respiratoria (esto es, parcial o no funcionante), para luego ingresar a cavidades cardíacas izquierdas y al resto del cuerpo, supliendo parte de la función pulmonar.
Por ende, la sangre que egresa del oxigenador saturada de O2 en un 100%, al mezclarse con la parte no oxigenada del retorno venoso, llegará a la circulación con una saturación menor al 100%, lo que es evidenciado en la saturometría periférica que suele estar entre un 80-90%. Si con el tiempo su saturación periférica aumentase, sin haber modificado el soporte extracorpóreo, significará que los pulmones están aportando a la oxigenación, lo cual implicaría una mejoría del sistema nativo. La sangre mezclada nativa/ECMO que ingresa a través de la arteria pulmonar recibirá más O2, egresando a través de la vena pulmonar más saturada aún6 (figura 4).
De la figura 4 podemos desprender que, si la punta de un catéter venoso central se encuentra en la aurícula derecha, y desde allí tomamos una muestra para análisis gasométrico, esta muestra no corresponderá a gases venosos “centrales”, sino que será una mezcla del flujo nativo no oxigenado con el retorno del ECMO. Lo más similar a una gasometría venosa central (esto es, el O2 restante luego del consumo celular), se encuentra en la cánula/línea de extracción).
Componentes del ECMOA continuación, se describirán los componentes del ECMO, se realizarán comparaciones con el sistema cardiopulmonar nativo (tabla 2). Para mayor información, se recomienda enfáticamente revisar el libro ECMO2 de la ELSO (Extracorporeal Life Support Organization), en particular capítulos 2, 8, 9 y 10, el artículo de revisión de Brodie et al.7 y referirse a la figura 4.
Equivalencias entre componentes ECMO y funciones nativas
| NATIVO | ECMO |
|---|---|
| Pulmón | Oxigenador |
| Alvéolo | Membrana |
| Flujo al pulmón (gasto cardíaco “derecho”) | Flujo a la membrana |
| Ventilación alveolar | Flujo de gases frescos |
| Fracción inspirada de oxígeno | % O2 desde mezclador |
| Venas cavas/aurícula | Cánula y línea de extracción |
| Arteria pulmonar | Línea y cánula de retorno (en ECMO VV) |
| Hipotálamo | Intercambiador de calor |
| Cerebro | Consola |
Tabla comparativa entre la fisiología nativa y su equivalente en ECMO.
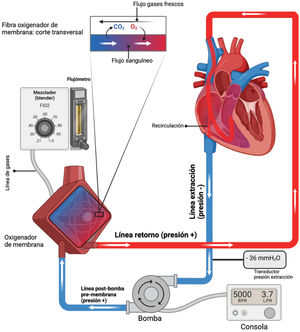
La cánula de drenaje se conecta a una línea (llamada líneadedrenaje o venosa, dado que es sangre desoxigenada). Como el sistema venoso funciona a bajas presiones, para extraerla a alto flujo se utiliza presión negativa (“succión”), lo que se genera a través de la bomba, la que es comandada desde la consola. La bomba puede ser centrífuga (también llamado “cono”), o una roller (o peristáltica). Para propósitos de este artículo, y dado que es la bomba que más se utiliza en nuestro centro, hablaremos de la centrífuga.
La líneavenosa llega a la bombacentrífuga, que en su interior posee un disco que gira a altas revoluciones, produciendo fuerza centrífuga – la sangre ingresa a presión negativa por el centro del cono, y se eyecta a altas presiones por su lateral. Es por tanto el cono el hito de presión del sistema (sangre ingresa a presión negativa y se eyecta a presión positiva). La presión negativa que se ejerce para llevar la sangre hacia el cono es llamada presión de extracción.
Desde la bomba se conecta por una línea hasta el oxigenador, o pulmón artificial, el que está conectado a los gases frescos (principalmente O2). En el oxigenador se produce el intercambio gaseoso, pudiéndose modificar también la temperatura de la sangre con el intercambiador de calor. La sangre oxigenada continua a alta presión hacia la línea de retorno (o arterial, llamada así porque la sangre en ella está arterializada, con O2 elevado). Esta línea reingresa al paciente a través de la cánula de retorno, que puede ser venosa (ECMO VV) o arterial (ECMO VA).
Los gases frescos o sweep gas se regulan desde el flujómetro, y sus componentes (O2 y aire) se titulan desde el mezclador o blender. Un aumento de flujo de gases producirá un mayor barrido de CO2 (es el equivalente a la ventilación alveolar), y su suspensión provocará suspensión del intercambio gaseoso a nivel de la membrana (el equivalente a apnea), pero la entrega de O2 se mantendrá mientras exista un mínimo flujo de gas con O2. Una disminución del porcentaje de O2 en los gases frescos sí disminuirá el aporte de éste.
| • El circuito ECMO incluye una cánula de drenaje conectada a una línea venosa, que utiliza presión negativa para extraer sangre del sistema venoso.• La sangre fluye a través de una bomba centrífuga o una bomba roller hacia el oxigenador, donde ocurre el intercambio de gases.• El gas fresco, generalmente O2, se mezcla con la sangre en el oxigenador para oxigenarla y eliminar el CO2.• La sangre oxigenada se devuelve al paciente a través de una cánula de retorno, que puede ser venosa (ECMO VV) o arterial (ECMO VA). |
La bomba es el “ventrículo derecho” del circuito. A mayor presión negativa ejercida, se puede extraer mayor cantidad de sangre desde el sistema venoso. Sin embargo, esto tiene una limitante principal: el “retorno venoso” al ECMO. No siempre mayores revoluciones por minuto (giros del cono) producirán mayor flujo sanguíneo. El operador puede regular las revoluciones por minuto desde la consola (el equivalente de aumentar el cronotropismo), con la intención de regular el flujo, sin embargo, esto no siempre es así y es crucial saber sus limitantes.
Para comprender los puntos que limitan este retorno debemos tener presente que la extracción de sangre se genera a presión negativa y es dependiente de la presión venosa – por tanto, del volumen de ésta. La cánula y línea de extracción son la “vena cava” del circuito. La presión de la sangre venosa está dada por su relación de continente versus contenido. A mayor contenido en un mismo continente, habrá mayor presión. Dentro del circuito ECMO el continente siempre es estable (plástico no complaciente). De lo anterior se desprende que si hay fluctuaciones en las presiones venosas (presión venosa central, presión de arteria pulmonar, presión de extracción), es que está ocurriendo un cambio o un fenómeno nuevo: aumento de la volemia, compresión de una línea, entre otros.
Un aumento de revoluciones llevará a generar presión aún más negativa (mayor negativización de la presión de extracción). Si alguno de los actores mencionados anteriormente está sub-óptimo, la presión negativa continuará profundizándose, pero sin aumentar el retorno venoso. Esto no llevará a un aumento de flujo, sino que a complicaciones: mayor hemólisis, recirculación, acoplamiento de las fenestraciones a la pared venosa llevando el flujo a cero (que puede observarse por tiraje o “rattling” de las líneas). En casos extremos se puede producir cavitación (los gases disueltos en el plasma pueden aumentar su volumen dada la presión negativa), llegando a producir microburbujas que pueden circular y llegar al paciente.
Los principales determinantes del flujo y presiones se resumen en la tabla 3.
Principales determinantes del flujo a la membrana de intercambio
| NO MODIFICABLES | |
| Diámetro y fenestraciones de la cánula de extracción y línea venosa. | Mayor diámetro y más fenestraciones aumentan la posibilidad de extraer mayor volumen de sangre. |
| Diámetros y largo del circuito y sus componentes | Menor diámetro y mayor largo aumentarán la resistencia, disminuyendo el flujo a la membrana. |
| MODIFICABLES RELACIONADOS AL CIRCUITO | |
| Velocidad del cono | A mayor velocidad, y teniendo en cuenta los parámetros no modificables, la pre y la post carga del circuito, habrá mayor flujo, con limitaciones. |
| MODIFICABLES RELACIONADOS A PRE Y POST CARGA AL CIRCUITO | |
| Diámetro de la vena en donde está instalada la cánula | Equivale a la precarga. Venas de mayor calibre tendrán mayor contenido sanguíneo. Se podrá aumentar en forma parcial al volemizar al paciente. |
| Posición de la cánula de extracción | Su desplazamiento o mal posicionamiento puede llevarla a una zona de menor calibre, produciendo incluso una ocupación total de la vena y limitando completamente el flujo hacia el oxigenador al producir efecto succión entre fenestraciones y pared venosa. |
| Presiones intratoráxicas (PIT) e intraabdominales (PIA) | Un aumento de estas presiones generará compresión extrínseca al sistema venoso; si la cánula de extracción está femoral y aumenta la PIA, se comprimirá la cava inferior, disminuyendo su contenido sanguíneo, y por tanto la cánula de extracción tendrá “menos sangre” desde donde extraer (precarga). Aumento de las PIT también determinarán aumento de la postcarga (en caso de que cánula de retorno esté toráxica), aumento de las PIA aumentarán la postcarga en caso de cánula de retorno infradiafragmática. |
| Volemia del paciente | Mayor volemia, mayor posibilidad de extraer más sangre. |
PIA: presión intraabdominal; PIT: presión intratorácica.
El oxigenador intenta imitar el funcionamiento pulmonar, y en particular, de la membrana alveolo-capilar. Funcional (y disfuncionalmente) es como el pulmón. La fase sanguínea sería el capilar pulmonar, la membrana será la membrana alveolo-capilar, y la fase gaseosa es el símil del espacio alveolar. Revisaremos los principales determinantes del intercambio gaseoso (tabla 4).
| • El oxigenador de membrana busca replicar el funcionamiento pulmonar al imitar la membrana alveolo-capilar. Está compuesto por una membrana sintética altamente permeable a los gases e impermeable a los componentes sanguíneos.• La transferencia de gases en el oxigenador depende de la diferencia de presión entre la sangre y el gas fresco, lo que permite que el O2 y el CO2 se difundan a través de la membrana.• La velocidad de los gases frescos afecta la eliminación de CO2, mientras que la anemia puede afectar la eficiencia de la transferencia de gases al influir en la circulación de glóbulos rojos. |
Determinantes de intercambio de gases
| PRINCIPALES DETERMINANTES DE INTERCAMBIO GASEOSO | ||
|---|---|---|
| O2 | CO2 | DATO |
| Saturación O2inlet (preOx) | pCO2 sangre inlet (preOx) | Diferencia de presiones parciales y recirculación |
| FiO2 del flujo de gases frescos | Flujo (velocidad) de los gases frescos | Factores modificables directamente por el operador. Sólo la suspensión completa del flujo de gases llevará a cero intercambio. |
| Tiempo de residencia de la sangre | Flujo sanguíneo mínimo | Rated flow |
| Concentración de hemoglobina | No se afecta | Principal determinante del transporte de O2 |
| Flujo de sangre al ECMO | (-) | Mientras mayor flujo de sangre al “pulmón”, más sangre se oxigenará (con límites) |
| Especificaciones técnicas del oxigenador | Pulmón artificial es un pulmón “fibrótico” | |
Se enumeran los principales determinantes a evaluar para optimizar el intercambio de gases – O2 y CO2 - a nivel del oxigenador de membrana, y un correlato simplificado. ECMO: extracorporeal membrane oxygenation; PreOx: pre-oxigenador; FiO2: fracción inspirada de oxígeno.
La membrana del oxigenador tiene espesor y características de permeabilidad que influyen en la eficiencia de la transferencia de gas. Habitualmente está hecha de polimetilpenteno, una membrana sintética altamente permeable a gases e impermeable a productos sanguíneos. Si esta membrana se engrosase (por ejemplo, por depósitos de fibrina), el intercambio gaseoso se verá limitado.
La transferencia de gas en el oxigenador depende de la diferencia de presión parcial de gases (O2 y CO2) entre la sangre y el gas fresco, el que fluye en sentido contrario a la sangre en la membrana. La difusión de los gases depende sólo y exclusivamente de la mentada diferencia de presiones parciales. Si hay mayor concentración a un lado de la membrana, se equiparará con el lado donde hay menos concentración, hasta idealmente lograr equipararse – esto requiere un cierto flujo sanguíneo y tiempo de circulación (principio de Fick).
Al ingreso al oxigenador, la sangre estará mínimamente oxigenada y con elevada concentración de CO2, y el gas fresco será rico en O2 y bajo (o nulo) CO2. Esto produce diferencia de presiones parciales, y a medida que la sangre circula por la membrana irá disminuyendo su concentración de CO2 hasta equiparar presiones parciales. Lo contrario ocurrirá con el O2: la sangre desoxigenada logrará equiparar presiones parciales con la FiO2 del gas fresco, hasta saturarse.
A mayor velocidad (flujo) de gases frescos, más rápido se barrerá el CO2 que en esta fase se acumula, permitiendo nuevamente una diferencia de presiones parciales, y así lograr barrer más CO2. Es así que la velocidad de barrido de los gases frescos es el principal determinante de la eliminación de CO2 – es entonces el equivalente de la ventilación alveolar (o su subrogado el volumen minuto) (figura 4).
Mientras más sangre llegue al oxigenador (flujo al ECMO) mayor será la cantidad de sangre que se pueda oxigenar, siendo este uno de los determinantes principales del intercambio de O2 a nivel de la membrana y del aumento de DO2. El símil sería “mientras más sangre vaya a los pulmones, más sangre se oxigenará”. A continuación, veremos que esto tiene un límite.
El gas fresco será alto en O2 (habitualmente 100%), produciendo la diferencia de presiones parciales que permitirá que el O2 difunda hacia el glóbulo rojo, hasta equiparar las presiones parciales, logrando de esta manera la arterialización sanguínea. Si el glóbulo rojo circula “muy rápido”, no se alcanzarán a equiparar las presiones parciales, y egresará desoxigenado de la membrana. Esto no es por disfunción de la misma, sino que por no alcanzar los tiempos mínimos para el intercambio de O2. Este tiempo mínimo se denomina rated flow. El ratedflow está definido como la cantidad máxima, en litros por minuto, que cada oxigenador es capaz de llevar desde saturación de 70% a 100%2,6.
Otra manera de comprender el concepto de ratedflow es pensar en el oxigenador como un pulmón fibrótico. Si a un paciente con fibrosis se le realiza un test de caminata de 6 minutos, e inicia saturando 90%, puede finalizar dicho test saturando 80%. La anatomía cardiopulmonar (incluida membrana alveolo-capilar engrosada) no han cambiado en esos minutos: lo que ocurre es que su frecuencia cardíaca aumenta (para aumentar el gasto cardíaco, con esto el DO2, para suplir el aumento en VO2 dado por la caminata), por lo que los glóbulos rojos circularán más rápido a través del alvéolo. La escasa reserva funcional que daba tiempo a que el glóbulo rojo equiparara presiones parciales en espacio alveolar (tiempo necesario para que los gases difundan) se pierde por falta de tiempo adecuado de recorrido del glóbulo. Esto mismo pasa en el pulmón artificial, desde el momento de su instalación. Con el tiempo, se puede ir depositando fibrina en la membrana en su fase sanguínea, disminuyendo aún más su eficiencia. Muchas veces, en un intento de oxigenar más sangre, se aumenta el débito al ECMO, sobrepasando su capacidad de oxigenar, logrando lo contrario: menos oxigenación.
La anemia también influye en el correcto o mejor funcionamiento del intercambio. Sabiendo que la Hb es el principal determinante del contenido de O2 sanguíneo, en el caso del oxigenador se agregan motivos reológicos. A mayor anemia, el glóbulo rojo circulará por el centro de la fase sanguínea, no entrando en íntimo contacto con la membrana, haciendo que la difusión de gases sea menos eficiente. En palabras sencillas, el O2 del espacio alveolar o fase gaseosa no alcanza la distancia adecuada en el tiempo adecuado para equiparar las presiones parciales. En la tabla 4 encontrará un resumen de los principales determinantes del intercambio de gases5,6.
Intercambiador de calor (o: hipotálamo externo)El intercambiador de calor es uno de los elementos complementarios al ECMO. Es un radiador cuya función es mantener una temperatura deseada en la sangre del paciente. Como ha sido mencionado, es el hipotálamo del circuito. Posee en su interior cristaloides o agua, la que se puede calentar a la temperatura deseada. Esta fluye a través de una manguera hacia el oxigenador, “bañándolo”, sin entrar en contacto con la sangre o el gas, manteniendo el flujo sanguíneo a dicha temperatura; luego el fluido egresa, llegando nuevamente al intercambiador. Las funciones del intercambiador de calor se detallan en la tabla 5.
Funciones del intercambiador de calor
| FUNCIONES DEL INTERCAMBIADOR DE CALOR | |
| Mantener estable la temperatura del paciente | El flujo sanguíneo que pasa por las líneas y membrana está expuesto a temperatura ambiente (22°C aprox.), volviendo a la circulación del paciente y pudiendo provocar hipotermia (particularmente en niños). El intercambiador mantendrá la temperatura estable (habitualmente 35-37°C). A la inversa, si hay fiebre podemos disminuir la temperatura, actuando como un antipirético no farmacológico. |
| Manejo del VO2 | La normo o hipotermia disminuye el VO2. No se debe llegar a extremos, dado el impacto en otros procesos (coagulación, curva de disociación O2, entre otros). |
| Monitorizar fiebre o hipotermia central | Si la temperatura del líquido que regresa al intercambiador desde el paciente está a mayor temperatura que la que se eyecta hacia el paciente (se calentó al estar cerca de la sangre), demuestra hipertermia del paciente. Si el intercambiador demuestra que progresivamente requiere elevar su temperatura para lograr la temperatura indicada, nos demuestra que el agua se “enfrió” al pasar cerca de la sangre, sugiriendo hipotermia o bien una temperatura ambiental muy baja. |
Abreviaturas: VO2: consumo de oxígeno.
Una vez que a un paciente se le inicia ECMO VV, la función pulmonar nativa puede verse afectada por supresión de la vasoconstricción hipóxica ya que la sangre que ingresa a la arteria pulmonar ahora será altamente oxigenada como consecuencia del ECMO VV. Esto, por fisiología, aumentará el shunt pulmonar8.
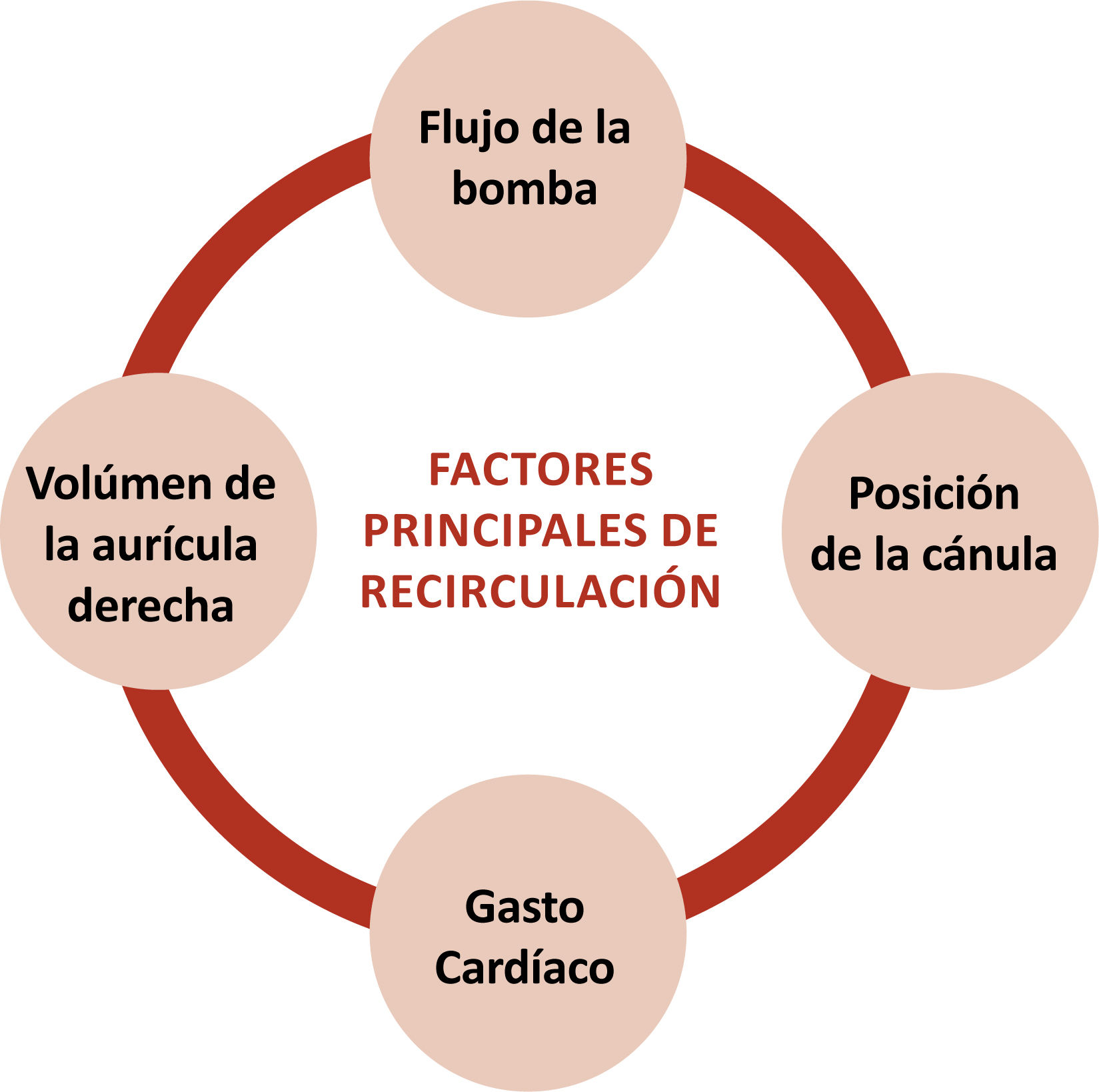
Recirculación (o shunt de izquierda a derecha del ECMO)La recirculación es el fenómeno en el cual la sangre oxigenada y descarboxilada que se eyecta por la cánula de retorno se devuelve a la cánula de extracción (figura 4). El objetivo del ECMO es que la sangre oxigenada se dirija a la circulación nativa del paciente y se distribuya por el cuerpo; sin embargo, parte del flujo reingresará al circuito, quitando de esta manera eficacia al soporte (tanto por que disminuye la cantidad de O2 aportado al paciente como porque disminuye la eficacia de la transferencia gaseosa en el oxigenador)10. La recirculación sólo ocurre en caso de ECMO VV, dado que las cánulas están en línea y en el mismo circuito: el venoso. En el ECMO VA no se produce recirculación, dado que la cánula de extracción y la de retorno están separadas por el septum interventricular, interauricular y los pulmones.
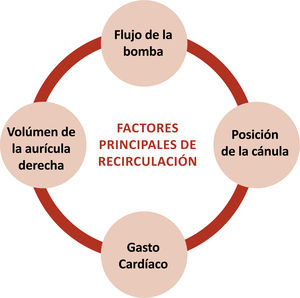
La recirculación debe minimizarse, pero siempre habrá un porcentaje de ésta. La recirculación se observa como disminución de la saturación del paciente, aumento de la saturación preoxigenador, y similitud de colores en la sangre de las tubuladuras (la venosa estará arterializada, menos oscura e incluso roja vibrante). Motivos de aumento de recirculación son: hipovolemia, cercanía de cánula extracción/retorno, aumento de flujo al ECMO, disminución gasto cardíaco, aumento de presiones pulmonares, taquicardia extrema, aumento de presiones intratorácicas e intraabdominales. Se detallan y explican en la tabla 6 y figura 59,10.
Causas de recirculación
| MOTIVO | EXPLICACIÓN |
|---|---|
| Hipovolemia | Existe menor contenido (sangre) en un mismo continente (venas). Al ser colapsables, las venas disminuirán su calibre, acercándose más a las cánulas. La cánula de extracción podrá succionar menos sangre, y con la cánula de retorno devolviendo sangre a alta presión, será más “fácil” succionar esta misma sangre: recirculación. |
| Cercanía de cánula extracción/retorno | Si las puntas de las cánulas están en exceso cercana (no habiendo un estándar, se recomienda alrededor de 10 cm), será más “fácil” para la sangre oxigenada y a alta presión dirigirse a un tubo de plástico “abierto” y a presión negativa, en lugar de pasar hacia el VD. Este fenómeno se puede observar cuando el paciente se sienta. |
| Aumento del flujo al ECMO | Aumentará la velocidad de la sangre, y al pasar más “rápido” desde el retorno hacia el cuerpo, será nuevamente más “fácil” para esta ir hacia la cánula de extracción (un tubo plástico abierto y a presión negativa) que hacia la válvula tricúspide y el VD. |
| Disminución gasto cardíaco o aumento de presiones pulmonares | Cualquier restricción al flujo de salida del VD (por presiones o fenómenos anatómicos como TEP o PEEP) y/o la estasia que puede producir una disminución severa del gasto cardíaco harán que la sangre que se eyecta desde la cánula de retorno reingrese a la de extracción que ejerce presión negativa. |
| Taquicardia | En extremo, produce defecto de vaciamiento auricular, disminución del débito cardíaco y estasis sanguíneo, con la consecuente recirculación. |
| Aumento de las presiones intratorácica (PIT) o intraabdominales (PIA) | El pneumotórax, hemotórax, hemopericardio y el aumento de la PIA por el motivo que fuese, el pujo y la tos, entre otras, producen efecto de hipovolemia al comprimir las cavas o la aurícula derecha, llevando al mismo fenómeno que la hipovolemia. |
ECMO: extracorporeal membrane oxygenation; VD: ventrículo derecho; TEP: tromboembolía pulmonar; PEEP: presión positiva al final de la espiración; PIA: presión intraabdominal.
Habitualmente se inicia un ECMO VV, y se hacen los cálculos del flujo y superficie del intercambiador, esperando cubrir/oxigenar/presurizar (en ECMO VA) un 80% del gasto cardíaco del paciente. Con esto se lograría un contenido arterial de O2 determinado.
Si el gasto cardíaco del paciente aumentase, por ejemplo, en el contexto de sepsis con su consecuente mecanismo de compensación, y no se modifica el flujo del ECMO, la proporción de gasto oxigenado disminuirá, llevando a desaturación sistémica. Si en casos como estos es necesario aumentar el contenido de O2, tenemos dos alternativas: aumentar el flujo del ECMO o disminuir el gasto cardíaco, hasta lograr la proporción adecuada.
ConclusionesLa oxigenación extracorpórea mediante membrana (ECMO) es uno de los soportes para el cuidado de la insuficiencia respiratoria refractaria. Comprender sus principios fisiológicos y sus componentes mecánicos es esencial para proporcionar un soporte eficaz a los pacientes. Mantener un equilibrio adecuado en la entrega de oxígeno y el control del dióxido de carbono es fundamental para el éxito de esta terapia. Una de las maneras más amigables de enfrentarse a este soporte es realizar comparaciones entre los componentes y funcionamiento de éste con el funcionamiento natural del sistema cardiopulmonar.
Referencia no citada[9].