La fractura osteoporótica es una entidad clínica que afecta seriamente la calidad y expectativa de vida del paciente, agregándose un impacto socioeconómico elevado, superando incluso a los gastos de patologías como el infarto agudo de miocardio, accidente cerebrovascular y cáncer de mama, y cuya incidencia y prevalencia va en aumento a medida que la población mundial envejece.
La gran mayoría de los casos cursan inadvertidos y sub diagnosticados, dejando a tres de cuatro pacientes, sin tratamiento y expuestos a nuevos eventos.
El foco mundial en los países desarrollados como estrategia de enfrentamiento de esta patología endémica ha sido el de la prevención, vale decir medicina primaria. Sin embargo, una vez diagnosticada la fractura osteoporótica, no existe consenso en el tipo de tratamiento óptimo, así como sus plazos en estos pacientes.
La mayoría de las guías internacionales y los trabajos publicados, presentan diferencias en el manejo de esta lesión.
The osteoporotic fracture is a clinical entity that seriously affects the quality and life expectancy of the patient, adding a high socioeconomic impact, even exceeding the expenses of pathologies such as acute myocardial stroke, vascular cerebral stroke and breast cancer, and whose incidence and prevalence is increasing as the world population ages.
The vast majority of cases are non-diagnosed, leaving three of four patients with non treatment at all.
The target in developed countries as a strategy to confront this endemic pathology has been prevention, or, primary medicine. However, once the osteoporotic fracture is diagnosed, there is no consensus on the type of optimal treatment, as well as its deadlines in these patients.
The majority of international guidelines and published articles show differences in the management and treatment of this fracture.
La osteoporosis (O) es un problema de salud pública que crece exponencialmente con el envejecimiento de la población. Se estima que, en todo el mundo, una persona sufre una fractura por fragilidad osteoporótica cada 3 segundos y una fractura vertebral cada 22 segundos1, presentando un impacto en la expectativa y calidad de vida que repercute tanto en aspectos médicos, sociales como económicos.
Siendo la población actual de Chile de 17 millones de habitantes, el 25% es mayor de 50 años y el 6% mayor de 70, proyectándose para el 2050 a un 43% y 17% respectivamente2, marcando un claro aumento de la longevidad de la población.
En Chile, como ejemplo, los costos estimados de una fractura de cadera por O van desde 2000 a 7000 USD1. Un análisis retrospectivo reciente demostró que el costo anual del cuidado de la fractura osteoporótica excede los costos anuales del cuidado del cáncer de mama, infarto de miocardio o accidente cerebrovascular en mujeres de 55 años o más3.
Considerando las cifras demográficas expuestas y que la posibilidad de que una mujer sufra una fractura de cadera o columna vertebral en toda su vida alcanza aproximadamente el 14% y 28%, respectivamente1, transforma este tema en una problemática de suma importancia de salud pública.
Sin embargo, y pese a ser una patología prevenible y tratable, solo una pequeña proporción de las personas son diagnosticadas y tratadas. Menos de 1 de cada 4 mujeres mayores de 67 años, con una fractura osteoporótica se somete a una medición de densidad ósea y/o comienza tratamiento para la O4.
EPIDEMIOLOGÍAEn EE.UU., La Fundación Nacional de Osteoporosis (NOF) estima que 10,2 millones de estadounidenses tienen O y que 43,4 millones adicionales tienen baja masa ósea. Más de 2 millones de fracturas relacionadas con la O ocurren anualmente en los EE.UU. Un 27% de estas ocurren a nivel de la columna vertebral. Más del 70% de ellas ocurren en mujeres5.
Se ha calculado que en el año 2050 se producirán 6,3 millones de fracturas por año en todo el mundo y más de la mitad ocurrirá en América Latina y Asia6.
El estudio latinoamericano de osteoporosis vertebral (LAVOS) incluyó a cinco países (Argentina, Brasil, Colombia, México y Puerto Rico). Se encontró una prevalencia general de fractura vertebral del 14% para todas las combinaciones de edades y países. Cabe destacar que el índice de prevalencia de fractura vertebral alcanzó el 38% en mujeres de 80 años o más7.
Se estima que en el año 20088 se produjeron 5.236 y 2.104 fracturas por osteoporosis en mujeres y hombres chilenos (ambos mayores de 45 años) respectivamente. Las proyecciones estimadas para el año 2050 muestran un aumento en las cifras a 9.988 y 4.007 para mujeres y hombres, respectivamente2.
Es importante destacar la escasez de datos confiables y falta de registros nacionales sobre fracturas osteoporóticas, que exponen el escenario actual, no solo en nuestro país, sino también en el resto de Latinoamérica, según expone la “International Osteoporosis Foundation”1.
MARCO TEÓRICODefinición de Osteoporosis: La OMS define la O como “una enfermedad sistémica, caracterizada por una disminución de la masa ósea y un deterioro de la microarquitectura del tejido óseo que incrementa la fragilidad del mismo, con el consecuente aumento del riesgo de fractura”9. Teniendo especial incidencia a nivel de la columna vertebral, muñeca, cadera, pelvis y el húmero, en donde, y en ciertas ocasiones, pueden producirse sin siquiera un antecedente traumático.
Clasificación de fracturas vertebrales por osteoporosis: Hasta ahora, ninguna clasificación ha ganado aceptación. Sugita et al.10 describió un sistema de clasificación pronóstica para este tipo de lesiones. Define de este modo, 5 tipos según las radiografías laterales (Tabla 1). Según esta clasificación, observaron que las fracturas de tipo I, II y III, tenían un mal pronóstico con una mayor incidencia de colapso tardío y a menudo mostraban una hendidura de vacío.
Clasificación morfológica de Sugita et al
| Tipo I | “Frente hinchado” (swelled-front type), en el que el 50% de la pared anterior del cuerpo vertebral estaba hinchado. |
|---|---|
| Tipo II | “Tipo de arco” (bow type), en el que la pared anterior estaba pellizcada y la placa terminal caía, pareciéndose al arco de un barco. |
| Tipo III | “Tipo proyección” (projecting type), en el que se proyectaba el 50% de la pared anterior del cuerpo vertebral y que aparecía como una pequeña protuberancia sin una línea de fractura. |
| Tipo IV | “Tipo cóncavo” (concave type), en el que la placa terminal estaba cayendo y la pared anterior estaba intacta. |
| Tipo V | “Tipo abollado” (dented type), en el que el centro de la pared anterior del cuerpo vertebral estaba abollado y se mostraba una línea de fractura en el cuerpo vertebral. |
| OF 1 | Sin deformación vertebral (edema del cuerpo vertebral solo en MRI-STIR) |
| OF 2 | Deformación sin o con una participación menor de la pared posterior (menor a 1/5) |
| OF 3 | Deformación con clara afectación de la pared posterior (mayor a 1/5) |
| OF 4 | Pérdida de estructura del marco vertebral, colapso del cuerpo vertebral o fractura tipo pinza |
| OF 5 | Lesiones con distracción o rotación |
(Ref. 10).
Schnake et al.11 en su estudio prospectivo y multicéntrico, propuso una nueva clasificación de fracturas osteoporóticas según su morfología (clasificación OF) con 5 subgrupos (Tabla 2).
Clasificación OF
| OF 1 | Sin deformación vertebral (edema del cuerpo vertebral solo en MRI-STIR) |
|---|---|
| OF 2 | Deformación sin o con una participación menor de la pared posterior (menor a 1/5) |
| OF 3 | Deformación con clara afectación de la pared posterior (mayor a 1/5) |
| OF 4 | Pérdida de estructura del marco vertebral, colapso del cuerpo vertebral o fractura tipo pinza |
| OF 5 | Lesiones con distracción o rotación |
Sin embargo, y como se expuso en un principio, no existe, aun, una clasificación globalmente aceptada que pueda establecer un factor pronóstico, así como una guía terapéutica, para este tipo de lesiones.
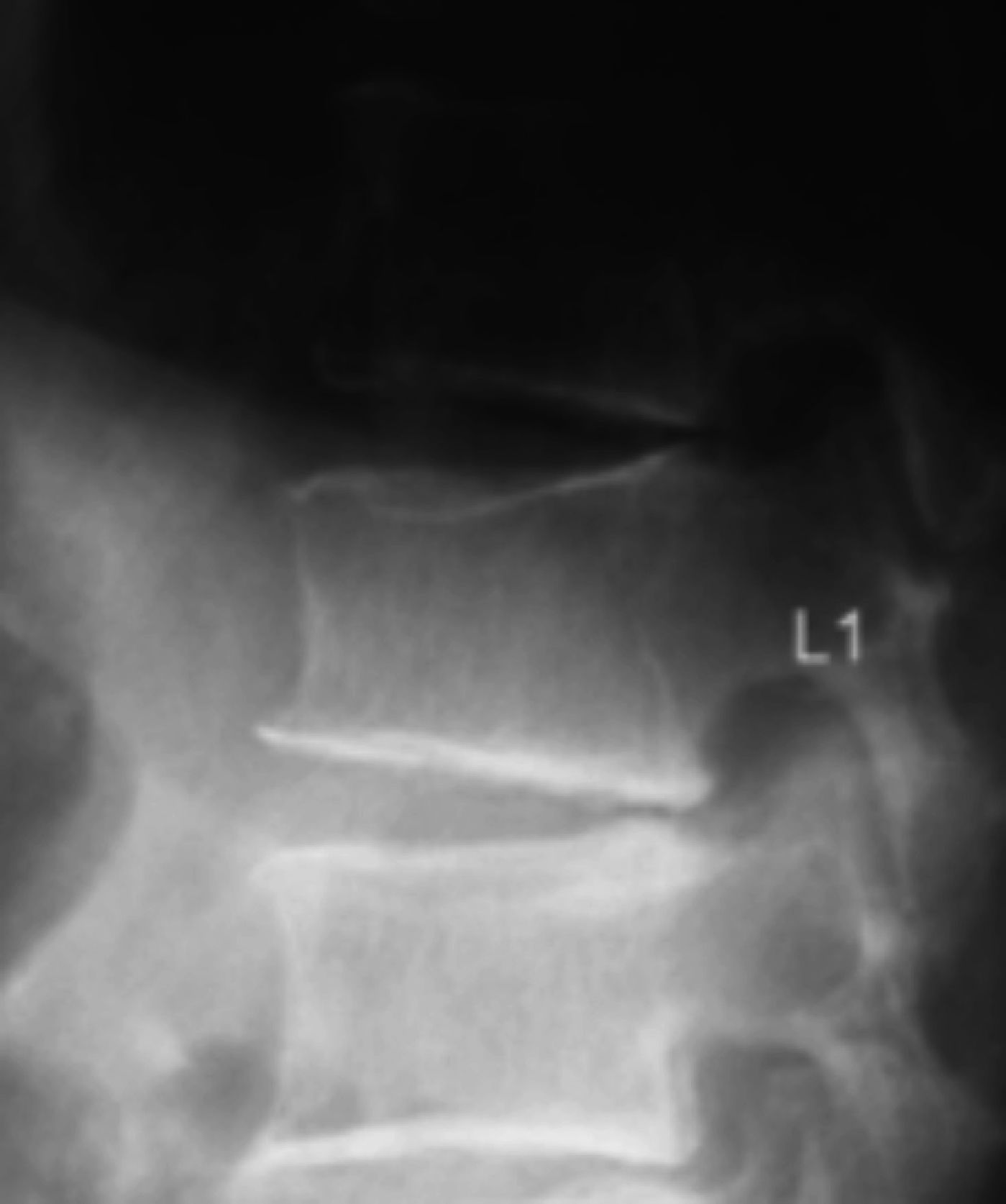
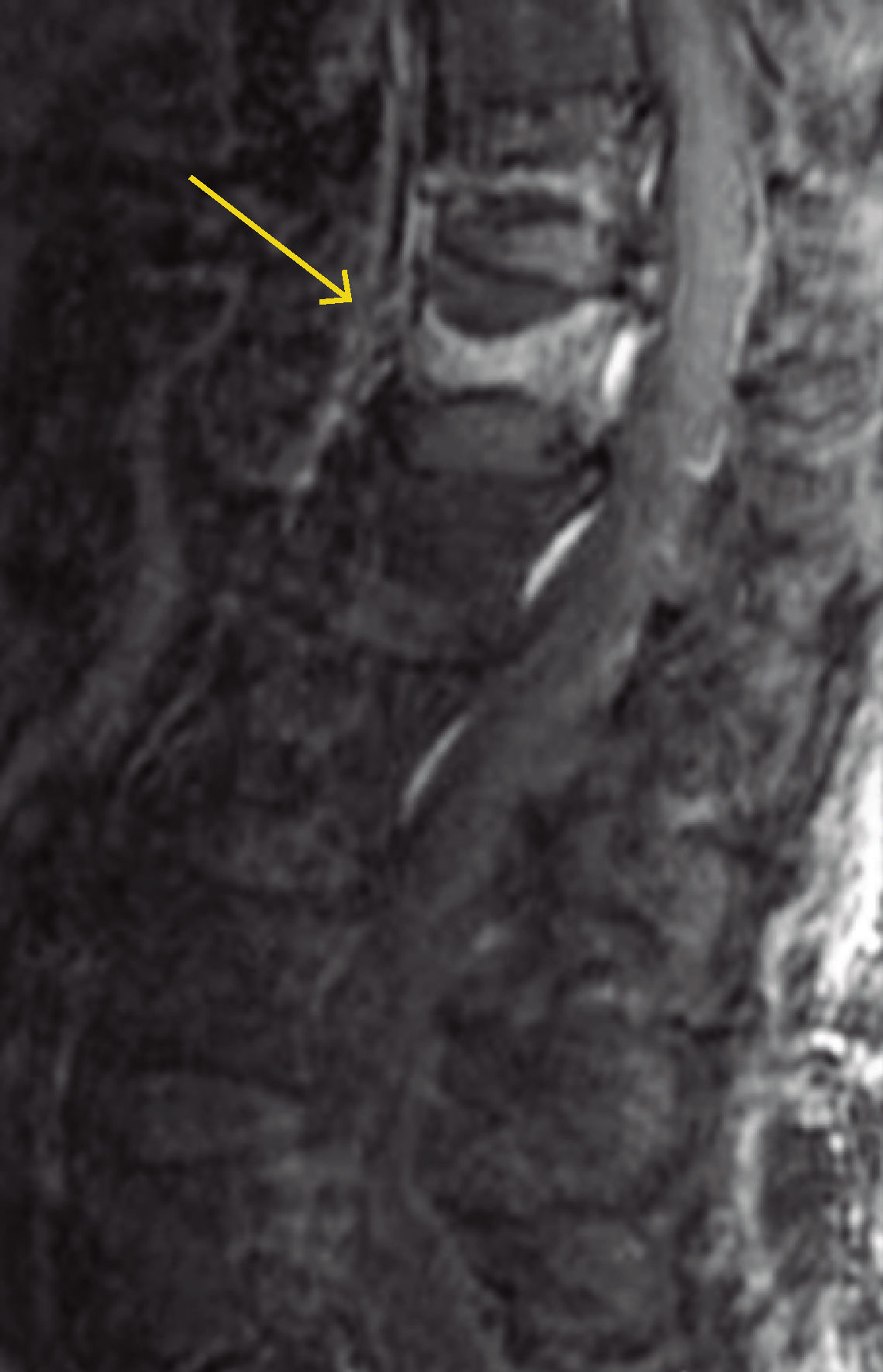
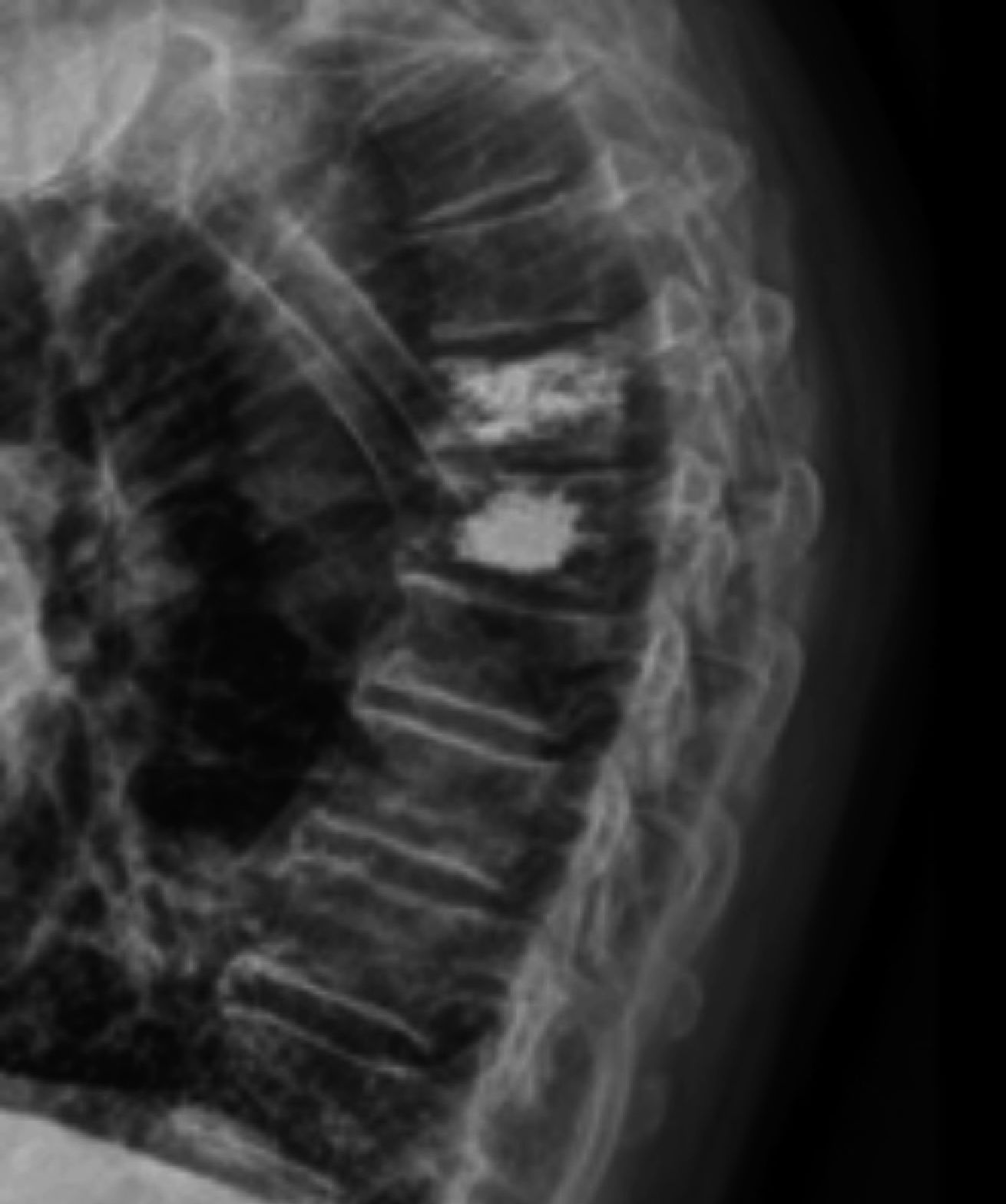
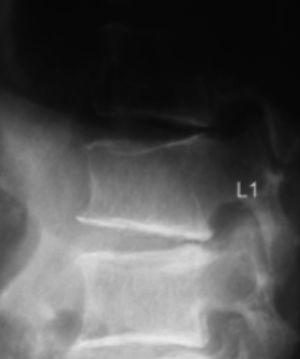
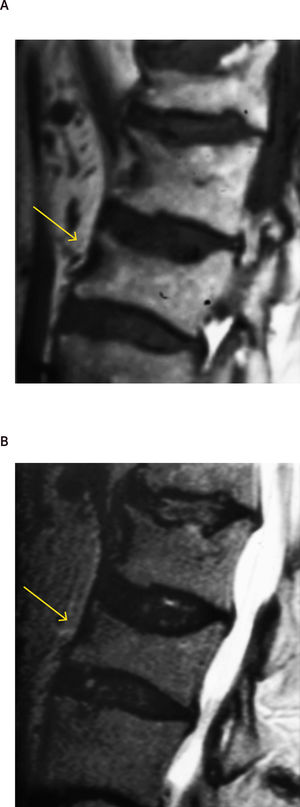
Diagnóstico de fracturas vertebrales osteoporóticas: Más de dos tercios de las fracturas vertebrales osteoporóticas, son asintomáticas y suelen ser diagnosticadas por estudios radiográficos no dirigidos12 en forma de “hallazgo”, estimándose hasta un 50% de sub diagnóstico12,13. Cualquier pérdida de altura vertebral mayor al 20%, con presencia de deformidades en las plataformas vertebrales con alteración de la morfología vertebral (Figura 1), deben considerarse como una fractura y evaluarse más a fondo14.
Tres de cuatro fracturas vertebrales no se diagnostica15, ya sea por su manifestación “silenciosa” o por manifestarse con dolor y limitación del movimiento, clínica comúnmente presente en paciente osteoporótico, haciendo que esta sea subvalorada y retrasando la consulta15,16.
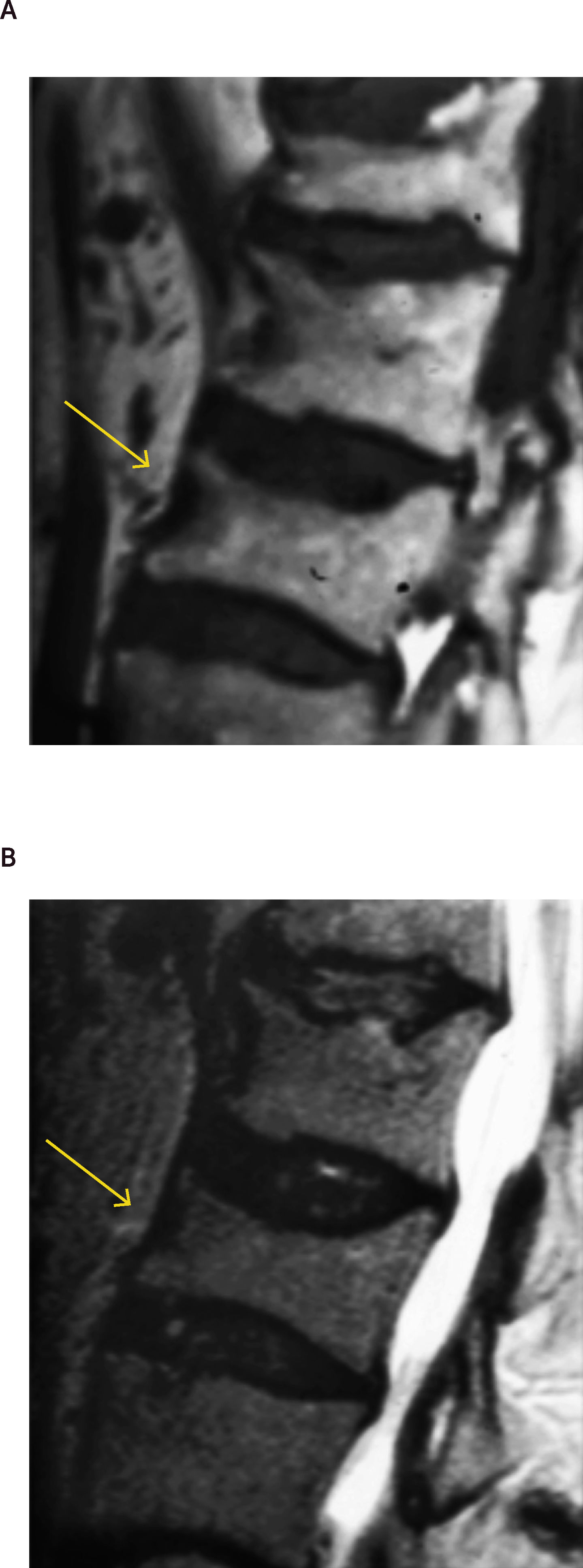
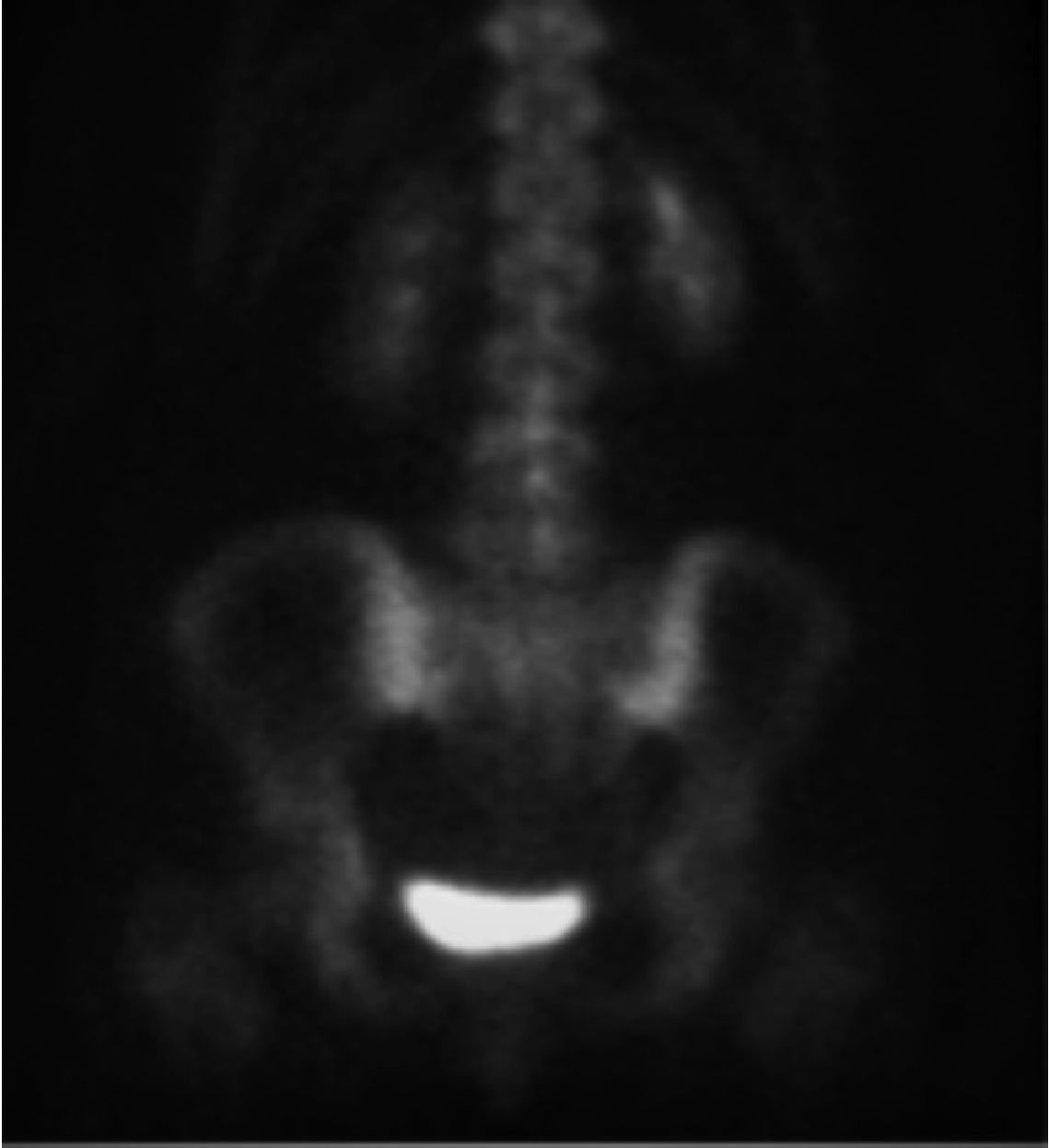
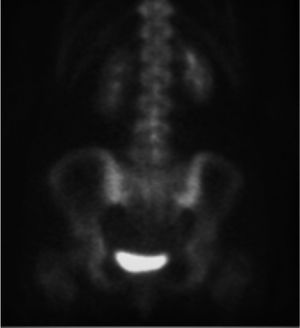
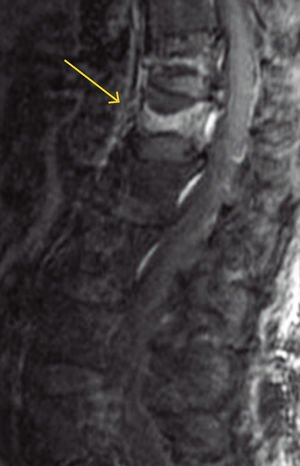
A menudo es difícil determinar la data de la fractura, a menos que se puedan comparar radiografías previas. Si hay interrupción cortical o impactación de las trabéculas, entonces se sugiere una lesión aguda. Sin embargo, a veces, esta diferenciación no es tan clara. La resonancia magnética (Figuras 2, 3 y 4) y el cintigrama óseo pueden aclarar estas situaciones, la falta de edema y la falta de captación, respectivamente, indican una fractura antigua17.
Diagnóstico de osteoporosis: Esta se realiza en base a la medición densidad mineral ósea, por medio de la absorción de rayos X de energía dual axial (axial dual-energy X-ray absorptiometry (DXA)) en columna y cadera total y/o 33% (uno- tercero) radio1. En base a esta se coteja el T-Score (número de SDs a partir de los valores medios normales de adultos jóvenes), así como el Z-Score (número de DE a partir del valor medio normal para sujetos de control de edad, raza o etnia y sexo). Un puntaje T-Score de–2.5 o inferior, es diagnóstico de O. Un rango entre -2.5 y -1 es diagnóstico de osteopenia, sin embargo, la presencia de fractura patológica en ausencia de otros trastornos óseos, en este rango de DMO, hace también al diagnóstico de O (tabla 3)4,18.
Existe una relación inversamente proporcional entre los valores de DMO y el riesgo de fractura. A menor valor de DMO, mayor riesgo de fractura. Dicho esto, se ha demostrado que los pacientes pueden sufrir fracturas por debilidad ósea a diferentes niveles de DMO, indicando la existencia de otros factores que influyen en el riesgo de fractura osteoporótica. Por este motivo, surge una nueva forma de diagnóstico de O en pacientes con mejor stock oseo (mayores a–2,5 en DMO), pero con mayor riesgo de fractura evidenciado con herramientas como “Fracture Risk Assessment Tool” (FRAX®). FRAX® integra la contribución de la DMO y otros factores de riesgo clínico y calcula la probabilidad de fractura de manera individual18.
Se deben considerar pruebas de laboratorio para todas los pacientes con diagnóstico de O18 con el fin de descartar cualquier causa de O secundaria (Tabla 4)19.
Exámenes de laboratorio para evaluación de osteoporosis secundaria
| Laboratorio para evaluación de osteoporosis secundaria |
|---|
| Hemograma |
| Perfil bioquímico (calcio, fosfato, proteínas totales, albúmina, enzimas hepáticas fosfatasa alcalina, creatinina, electrolitos) |
| Calcio, sodio y creatinina en orina de 24 hs (Identificación de sindrome de malabsorción o hipercalciuria) |
| 25-hidroxivitamina D |
| Test adicionales |
| Hormona paratiroidea (Hiperparatiroidismo primario o secundario) |
| Tirotropina |
| Anticuerpos antiglutaminasa (Enf. celiaca) |
| Electroforesis de proteínas plasmáticas (Mieloma) |
| Cortisol en orina de 24hs (Síndrome de Cushing) |
| Tipasa plasmática y N-metilhistamina (Mastocitosis) |
| Aspiración de médula ósea y biopsia (Enf. de médula ósea) |
Una adecuada educación en el estilo de vida puede ayudar en la calidad ósea, preservando y/o mejorando la densidad mineral. El consumo de calcio y la vitamina D, practicar ejercicios en forma regular, evitar el uso de tabaco y el uso excesivo de alcohol, la eliminación de posibles factores de riesgo de caída, son algunas de ellas.
El rol de la vitamina D es participar en la absorción de calcio y mejorar la respuesta a la terapia con drogas (bifosfonatos)20. Se recomienda entre 1.000–4.000 UI por día en adultos mayores de 50 años21, con el fin de mantener concentraciones plasmáticas de 25 (OH) D ≥30ng/ml8.
La ingesta adecuada de calcio es un aspecto fundamental. La suplementación de calcio aumenta la DMO, con disminución de riesgo de fractura de 15%22. Se recomienda una ingesta diaria, para adultos mayores de 50 años de 1200mg/día23.
El magnesio participa en la absorción de calcio. Este se encuentra en cantidades adecuadas en una dieta normal, por lo que la ingesta suplementaria, no ha mostrado beneficios30, excepto, en pacientes con riesgo de hipomagnesemia (síndrome de malabsorción, enfermedad hepática crónica, alcohólicos o usuarios de diuréticos)24.
El ejercicio regular es beneficioso (caminar 30-40 minutos diarios y ejercicios de reeducación postural, 3-4 días por semana) ayudan a la salud ósea reduciendo el riesgo de fractura por osteoporosis en aproximadamente un 10%25.
El consumo de algunos elementos puede afectar la estructura ósea. La cafeína se correlaciona en varios estudios con ocurrencias de fracturas, por lo que se sugiere, limitar la ingesta a menos de 1 a 2 porciones (8-12 onzas/porción) diarias26. La ingesta excesiva de alcohol, actúan de forma negativa sobre la formación ósea, generando deficiencia de calcio, afectando la función hepática y predisponiendo a caídas, asociándose con un mayor riesgo de fracturas27. Si bien el mecanismo exacto no está claro, posiblemente por alteraciones hormonales o efectos directos a nivel del metabolismo óseo, múltiples estudios han demostrado que la nicotina aumenta también el riesgo de fracturas osteoporóticas28.
TRATAMIENTOExisten dos tipos de enfoques terapéuticos, para este tipo de lesiones, el conservador y el intervencionista, ambos, deben perseguir los siguientes objetivos:
- •
Manejo del dolor
- •
Restauración temprana de la movilidad
- •
Preservar la estabilidad biomecánica (prevenir progresión de colapso vertebral y progresión de cifosis regional)
- •
Prevención a futuro
En la literatura, existe una falta de consenso sobre el manejo apropiado de esta patología, que se refleja en las contradicciones existentes entre las distintas guías clínicas, respaldadas por ensayos de baja calidad29 con criterios de inclusión desiguales, con bajo rigor metodológico y por ende resultados contradictorios.
Un porcentaje importante de los pacientes presentan dolor leve a moderado, con muy buena respuesta al tratamiento conservador, consistente fundamentalmente en el uso de analgesia oral, limitación de actividad según la tolerancia y en ciertas circunstancias, uso de una ortesis rígida de tres puntos, como el corsé de Jewett o un corsé Toracolumbar, dependiendo del nivel de la vertebra lesionada. Deben mantenerse hasta cumplido el periodo biológico de consolidación y consiguiente alivio del dolor.
Sin embargo, algunos pacientes persisten con dolor incapacitante, requiriendo hospitalización y/o tratamiento farmacológico y reposo por largos periodos de tiempo que corresponde a un fracaso del tratamiento conservador, muchas veces mal tolerada, particularmente en pacientes de mayor edad, produciendo problemas adicionales30.
La analgesia a base de morfina y sus derivados, presenta como principal efecto adverso las náuseas. Entre otros se puede ver, estreñimiento, retención urinaria, sedación y confusión. Con menos frecuencia, pero más grave, pueden producir depresión respiratoria y delirio hipoactivo31. La hiperalgesia inducida por opioides es caracterizada por aumentar la sensibilidad tanto al dolor (hiperalgesia) como a los estímulos no dolorosos (alodinia) debido a los metabolitos tóxicos de los opioides 32.
El reposo en cama afecta negativamente a todos los sistemas del cuerpo humano33. La depleción del líquido corporal con pérdida de volumen plasmático, genera alteración del funcionamiento cardíaco, hipotensión postural, riesgo neumonía por decúbito y aumento de la viscosidad de la sangre, con el consiguiente aumento de riesgo de eventos tromboembólicos (venoso y pulmonar). Además, la hipoxia tisular conlleva el riesgo de úlceras por presión, a nivel de prominencias óseas34. La consecuencia más grave es la atrofia muscular, durante los primeros siete días se produce una pérdida de fuerza del 12% y una pérdida significativa de masa muscular35. Por ello uno de los objetivos del tratamiento, además del control del dolor, es permitir la deambulación precoz, resguardada, si es necesario, con ortesis de columna.
El fracaso de la terapia médica se define como un alivio mínimo o nulo del dolor con el tratamiento conservador, o el alivio adecuado de este, solo con altas dosis de analgésicos, que inducen efectos adversos como los antes mencionados36. Ante este escenario es que la terapia intervencionista cobra lugar, idealmente en pacientes, más añosos, con comorbilidades, con mala tolerancia a los efectos adversos del tratamiento conservador30.
El tratamiento quirúrgico, contempla alternativas percutáneas, mini invasivas y quirúrgicas abiertas. Dentro de estas el “estándar óptimo”, está representado por las técnicas percutáneas, que contemplan la aumentación vertebral con cemento biológico (polimetilmetacrilato (PMMA), tales como la vertebroplastia percutánea (VP) y la cifoplastia (CP).
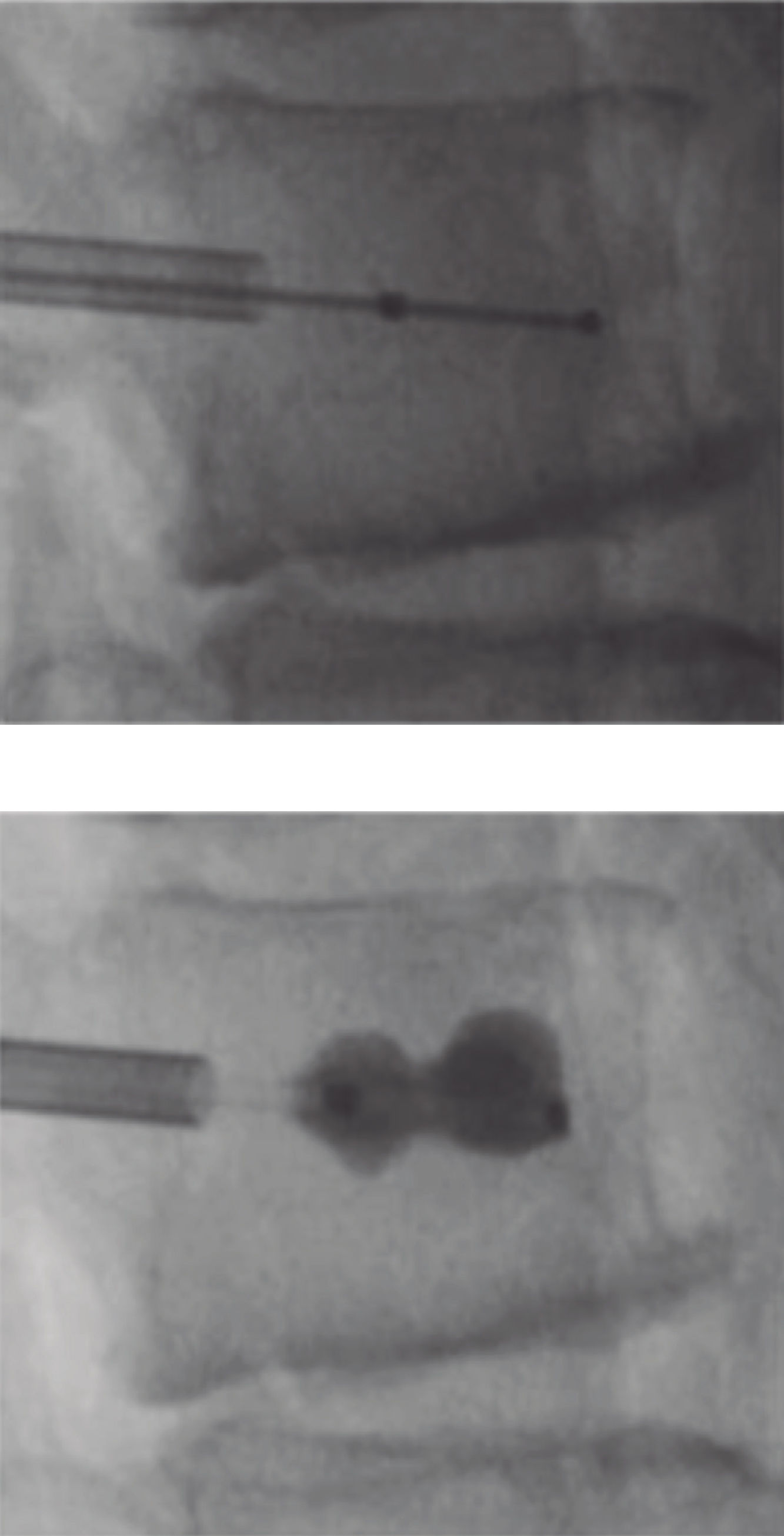
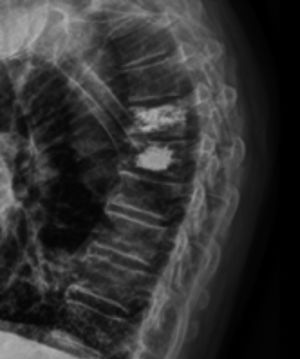
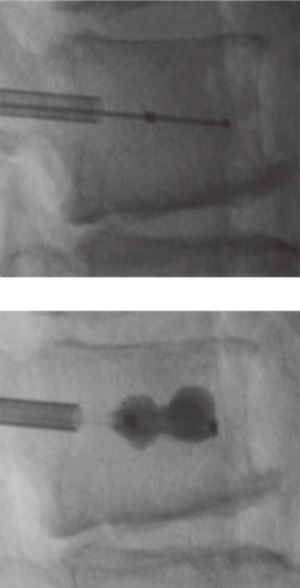
Vertebroplastia percutánea - Percutaneous vertebroplasty (PVP)La VP es un procedimiento guiado por apoyo radioscópico, en el cual se inyecta cemento óseo radiopaco en el cuerpo vertebral comprometido, con el fin de dar estabilidad inmediata al foco de fractura y con ello alivio rápido del dolor, permitiendo la deambulación precoz (Figura 5).
Se recomienda como indicación de primera elección, ante el fracaso del tratamiento médico. Varios estudios demuestran un alivio importante del dolor, en comparación con la terapia conservadora, permitiendo a su vez, restablecer precozmente la movilidad y reducción de riesgo de mayor colapso vertebral37,38.
Cifoplastia percutánea con balón - Percutaneous Balloon Kyphoplasty (PBK)Técnicamente similar a la anterior, la CP percutánea con balón (PBK), intenta, a su vez, restablecer la altura del cuerpo vertebral colapsado, además de proporcionar estabilidad y alivio del dolor (Figura 6). Mediante el inflado a presión de un balón introducido en el foco fracturario, previo a la inyección del cemento biológico óseo39. Las indicaciones para este procedimiento son similares a las de la VP, aunque la indicación óptima, corresponde a aquellas fracturas agudas (menos de 7-10 días) con un ángulo cifótico mayor que 15°39.
Se estima que el mecanismo mediante el cual estos procedimientos producen alivio del dolor, es una combinación biomecánica que ocurre, al restablecer con el cemento, la rigidez estructural de la vertebra y toxicidad química del efecto exotérmico de la polimerización del cemento en las terminaciones nerviosas40.
Dos ensayos controlados, aleatorios, doble ciego, del 2009 encontraron que las inyecciones simuladas proporcionaron un alivio del dolor similar a la VP41, llevando a debate sobre el beneficio de estas técnicas. Por su parte, estos estudios, presentaban fallas metodológicas como la falta de imágenes de RMN previas al procedimiento, sin diferenciar procesos agudos con crónicos o el pequeño volumen de cemento utilizado, entre otros, que pusieron en duda los resultados obtenidos42.
El ensayo VAPOUR43, multicéntrico, aleatorizado, doble ciego, controlado con placebo del 2016, sugirió que la VP es superior a la intervención con placebo para la reducción del dolor. Además, al compararlo con la terapia placebo, informaba un mayor alivio del dolor en las primeras semanas, manteniéndose significativo a los 6 a 12 meses. De igual manera, la revisión sistemática más reciente de Cochrane, sobre la eficacia de la VP, publicada en el 201844, identifica a seis ensayos que comparaban la VP con el tratamiento conservador, demostrando una disminución significativa, pero pequeña del dolor a las dos semanas, al mes y a los 12 meses, a favor de la VP.
Otro punto de controversia, representa el momento óptimo para la intervención, ya que el tratamiento, generalmente y en primera instancia, es conservador durante varias semanas antes de tener en cuenta la indicación quirúrgica. El estudio de seguimiento VERTOS III, evaluó el curso natural del dolor en una cohorte de pacientes con fractura vertebral osteoporótica sintomática y encontró que aproximadamente la mitad de los pacientes tenían un alivio insuficiente del dolor a los 12 meses, mientras que, en la otra mitad, presentaban un alivio progresivo del dolor a partir del tercer mes45. Sin embargo, resulta conflictivo la idea de mantener un paciente con un EVA (Escala Visual Análoga) elevado, pese al tratamiento conservador instaurado, por tres meses esperando la “posible” evolución natural de la lesión. Agregando a esto, el ensayo antes nombrado43, en concordancia con el de S. Lou et al.46, mostro que el alivio del dolor significativamente superior se daba en pacientes intervenidos, con fracturas agudas (menos de seis semanas).
La indicación de estas técnicas, debe ser considerada idealmente en pacientes con menos de cuatro meses de evolución (inicio del dolor agudo) y tener al menos tres semanas de fracaso del tratamiento conservador47.
El tratamiento por aumentación presenta una tasa general de complicaciones sintomáticas de 2 a 4%;- •
Quirúrgicos generales: infección del sitio, sangrado, hematoma, etc.
- •
Específicas del procedimiento: neumotórax, lesión neural directa durante la instrumentación y/o producto de la fuga de cemento. Esta última puede producir anafilaxia, compresión neural intracanal o radicular, hipotensión, función miocárdica deprimida, embolia pulmonar y muerte48.
Existen también complicaciones asintomáticas, tales como la fuga de cemento que son diagnosticadas solo al solicitar una imagen post procedimiento. La imagen por tac es de utilidad para evidenciar estos casos de fuga asintomática de cemento; 42% de fugas asintomáticas evidenciadas por tomografía49, versus 27% para las identificadas por fluoroscopia intraoperatoria y radiografía posoperatoria50.
Uno de los beneficios aludidos a la CP es una menor tasa de extravasación de cemento, lo cual se explicaría por la menor presión de inyección de cemento, ya que habría una cavidad creada dentro del cuerpo vertebral, mediante la inflación de un globo, que a su vez restaura la altura del cuerpo vertebral, corrigiendo la cifosis. En base a esto último, en el estudio de Papanastassiou et al. la restauración de la altura del cuerpo vertebral y la corrección del ángulo cifótico demostraron ser mejores en las CP, en comparación con las VP51,52.
Un evento que puede ocurrir, respecto a este tipo de procedimientos, es la probabilidad de mayor riesgo de fractura vertebral, en los segmentos adyacentes, posterior a una aumentación. Algunos autores sugieren que el cemento podría crear un mayor estrés biomecánico, resultando en un aumento de riesgo de nuevas fracturas en niveles adyacentes. Este concepto actualmente se encuentra en debate. Dos revisiones sistemáticas recientes concluyeron que la aumentación vertebral no resultó en un aumento en la incidencia de fractura adyacente53,54, al igual que el ensayo VAPOUR43. En la revisión sistemática Cochrane de Buchbinder et al. proporciona evidencia de calidad moderada (3 ensayos o 281 participantes) que la VP no disminuye ni aumenta el riesgo de fracturas futuras44.
Al confrontar la CP y la VP, un metaanálisis reciente mostró que la VP puede proporcionar un mejor alivio del dolor que la CP. Respecto a la teórica corrección de la cifosis regional proporcionada por la CP, y su beneficio en la calidad de vida fue menos claro55. En otra revisión sistemática, la CP, resultó en un mejor alivio del dolor, mejoría en la disfunción de Oswestry y resultados radiográficos con menos fuga de cemento en comparación con la VP56.
Procedimientos de implantación percutánea - Percutaneous implantation procedures (PIP)Estos sistemas se introdujeron como opción de soporte complementario, que busca dar mayor estabilidad, además de mantener la corrección de altura intraoperatoria lograda con la CP. Estos dispositivos incluyen receptáculos de cemento, insertos en el cuerpo vertebral. Pueden ser un globo de vaso poroso (vesselplasty), soportes expansibles de titanio (SpineJack; VEXIM SA, Balma, Francia), o un sistema lleno de bobinas (Kiva; Benvenue Medical, Inc., Santa Clara, California, EE.UU.). Todos ellos cumplen con el mismo objetivo, el cual es, restaurar la altura vertebral al mismo tiempo que proporciona rigidez estructural del montaje.
Se recomiendan que se reserve para pacientes más jóvenes, con mejor stock óseo y al igual que en la CP, que sean fracturas agudas (menos de siete días) y un ángulo cifótico local significativo (mayor de 15°), ya que, se desea la corrección de la deformidad47.
Estos procedimientos invasivos, en su conjunto, han mostrado ser más efectivos en pacientes con dolor severo y refractarios a tratamiento conservador. Entre los distintos estudios del meta-análisis de S. Lou et al.46 se sugiere que los pacientes con puntajes de dolor menos severos (<7) podrían experimentar un alivio del dolor inferior, volviendo al procedimiento, quizá, innecesario. Respaldando esta idea, el estudio de VAPOUR43, mostró resultados favorables en pacientes con dolor más severo, de 7 o más, a favor de la VP, a diferencia del ensayo de Firanescu57 donde pacientes con puntuación promedio de 5, no mostraron beneficio de la VP, similar al estudio de Kallmes41 con pacientes con rango de puntuación de dolor más amplio, que tampoco pudo determinar el beneficio de PVP.
Pese a todas las alternativas propuestas de tratamiento a la fractura vertebral osteoporótica, es fundamental insistir en el óptimo tratamiento de la enfermedad de base, la O, por medio de la prevención y la terapia farmacológica adecuada a cada paciente en particular
CONCLUSIÓNLa osteoporosis es una enfermedad “silenciosa”, que representa un problema de salud pública de carácter progresivo. Esta enfermedad suele manifestarse en forma de fracturas, teniendo una grave implicancia en la calidad como expectativa de vida del paciente, así como un gran costo para la sociedad.
Las fracturas vertebrales por osteoporosis son sub diagnosticadas hasta en un 50% de los casos, dejando al paciente sin tratamiento y expuesto a nuevos eventos. De ahí la importancia de su sospecha y reconocimiento para un correcto abordaje del paciente.
No existe, aun, una clasificación globalmente aceptada que proporcione un factor pronostico y guía terapéutica, de hecho, muchas de las guías actuales presentan diferencias entre ellas. La mayoría de estas lesiones pueden presentarse con dolor de leve a moderado, volviéndolas pasibles de un tratamiento conservador. Sin embargo, existen casos refractarios a este (incapacidad de control del dolor, de forma segura) o escenarios clínicos particulares donde estas terapias no son bien toleradas, haciendo que la indicación del tratamiento quirúrgico cobre valor, como un procedimiento con márgenes de seguridad aceptables, siendo las aumentaciones con cemento óseo, como la vertebroplastia, el “estándar óptimo”.
Según la bibliografía, los pacientes que obtendrían mayor beneficio de estos procedimientos, serían pacientes con fractura por osteoporosis, con menos de seis semanas de evolución (desde el comienzo del dolor) y con el intento fallido, de al menos tres semanas de tratamiento conservador, manteniendo un EVA mayor igual a 7, reservando procedimientos como la cifoplastia o el uso de implantes de colocación percutánea, en pacientes de menor edad, con lesiones de no más de una semana de evolución y con una angulación mayor a 15°.
Entendiendo a la fractura osteoporótica, como un síntoma de una enfermedad de base, la osteoporosis, resulta primordial la prevención y tratamiento de esta.
Declaración de conflicto de interésNo se recibieron fondos en apoyo de este trabajo. No se han recibido ni se recibirán beneficios de ninguna forma de una parte comercial relacionada directa o indirectamente con el tema de este manuscrito.