La incidencia y mortalidad del melanoma cutáneo en Chile ha presentado un aumento sostenido en las últimas décadas. El conocimiento de que la exposición excesiva a la irradiación ultravioleta es un importante factor de riesgo modificable para desarrollar melanoma cutáneo, ha permitido disminuir, en algunos países, la incidencia del melanoma cutáneo con campañas de educación y políticas que disminuyan la exposición solar. Una vez producida la enfermedad, el principal factor determinante de su pronóstico es la precocidad del diagnóstico. Las estrategias de detección precoz constituyen la intervención de mayor relevancia para la población. Estas estrategias pueden ser dirigidas a la población general o a poblaciones específicas de alto riesgo de melanoma como, por ejemplo, miembros de familias con melanoma hereditario.
El conocimiento y la correcta aplicación de estas técnicas diagnósticas tiene un efecto significativo sobre la sobrevida y la morbilidad asociada al tratamiento del melanoma cutáneo. El objetivo del presente trabajo es entregar una breve síntesis de las estrategias de detección precoz que han demostrado ser de utilidad en la prevención primaria y secundaria de melanoma maligno.
The incidence and mortality of malignant melanoma in Chile has increased over the last decades. Current knowledge regarding ultraviolet radiation exposure as a modifiable risk factor to develop melanoma, has enabled a decrease in the incidence of melanoma in some countries that have applied population based education strategies against sun exposure. Once melanoma has developed, early diagnosis is the main factor determining its prognosis, strategies focused on early detection are the most important intervention over the population. These strategies can be directed towards the general population or focused over specific populations sharing high risk of malignant melanoma: for example, family members with familial melanomas.
The knowledge and correct usage of these diagnostic methods has a significant effect on mortality and morbidity related to the treatment of cutaneous melanoma.
Our objective is to give a brief synthesis of early detection strategies that have demonstrated to be useful in primary and secondary prevention of melanoma.
La tasa de mortalidad de melanoma en Chile es de 1.1 por 100.000 habitantes en hombres y de 0.8 por 100.000 habitantes en mujeres, observándose variaciones significativas a lo largo del país, con las tasas de mortalidad más alta en la XII y VIII región.
La incidencia es de 2.9 por 100.000 en hombres y de 3.2 por 100.000 en mujeres, con las mismas variaciones regionales.
Se ha observado, en los últimos años, un aumento en la mortalidad e incidencia en hombres y mujeres, sin una disminución de los tumores detectados en etapas tardías de la enfermedad. Además, hay diferencias socioeconómicas significativas. En estudio de muestras obtenidas en la población atendida en el sistema privado el 75% eran melanomas in situ, en contraste con la del sistema público en la que solo el 25% eran melanomas in situ.
El melanoma cutáneo reúne las condiciones para una efectiva prevención primaria y secundaria. La exposición a la luz ultravioleta es el principal factor de riesgo modificable con campañas de educación y políticas que promuevan la protección a la exposición solar. Por otro lado, la detección precoz es favorecida por: a) una larga fase presintomática, b) métodos de detección sensible, específicos y de muy baja morbilidad, c) un tratamiento efectivo de la enfermedad en las etapas tempranas, y d) un mejor resultado oncológico y menores secuelas secundarias al tratamiento cuando la enfermedad es detectada en su etapa inicial. La relación costo-efectividad mejora significativamente cuando se selecciona para los programas de detección precoz, a poblaciones de alto riesgo, que en el caso del melanoma cutáneo son claramente identificables.
Estrategias orientadas a la población generalLas estrategias de detección precoz en melanoma maligno pueden ser orientadas a la población general o a población específica de alto riesgo. En el primer caso, se ha observado que la campañas educativas tendrían un efecto beneficioso en la población ya que aumentan la conciencia del problema y promueven el uso de medidas preventivas universales (1). Incluso en algunos países se han atribuido a estas campañas, las mejorías observadas en los índices de mortalidad e incidencia (2).
En relación a la información que se entrega al paciente en estas campañas, existe acuerdo en que serían la enseñanza del ABCDE (Asimetría, Borde irregular, más de dos Colores, Diámetro mayor a 6mm. y Evolución en el tiempo) y la técnica del autoexamen cutáneo las que tendrían un mayor impacto en la detección precoz (3-5). Aunque El ABCDE ha demostrado tener sensibilidades y especificidades variables, 57% - 90% y 59% - 90%, respectivamente, se recomienda ampliamente su uso por su simpleza y buena concordancia interobservador (3, 4). En relación a la educación en autoexamen, se ha visto que aumenta la pesquisa de melanomas delgados y disminuiría la mortalidad de éste (6). La recomendación general es que el autoexamen sea realizado mensualmente e idealmente, con apoyo fotográfico digital (7).
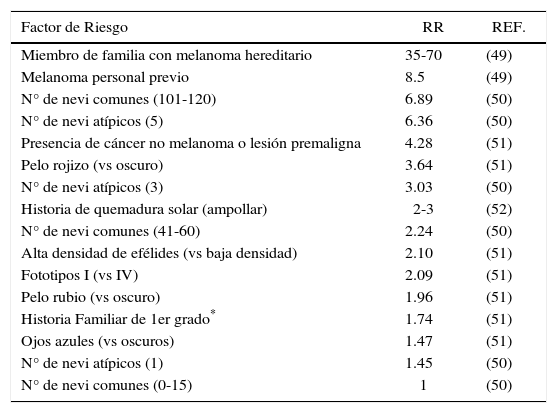
Otra estrategia que se ha aplicado sobre la población general son los programas de pesquisa precoz. El objetivo de éstos es realizar un examen cutáneo completo sobre toda una población determinada, sin preselección de individuos. Este tipo de estrategia no ha demostrado ser útil en disminuir la mortalidad o morbilidad en consecuencia, no sería recomendable su implementación en grandes poblaciones blanco (8). En contraste, existe un amplio consenso en que las estrategias de detección precoz de melanoma si son muy útiles cuando se aplican en población específica de alto riesgo (Tabla 1).
Factores de riesgo para melanoma maligno cutáneo
| Factor de Riesgo | RR | REF. |
|---|---|---|
| Miembro de familia con melanoma hereditario | 35-70 | (49) |
| Melanoma personal previo | 8.5 | (49) |
| N° de nevi comunes (101-120) | 6.89 | (50) |
| N° de nevi atípicos (5) | 6.36 | (50) |
| Presencia de cáncer no melanoma o lesión premaligna | 4.28 | (51) |
| Pelo rojizo (vs oscuro) | 3.64 | (51) |
| N° de nevi atípicos (3) | 3.03 | (50) |
| Historia de quemadura solar (ampollar) | 2-3 | (52) |
| N° de nevi comunes (41-60) | 2.24 | (50) |
| Alta densidad de efélides (vs baja densidad) | 2.10 | (51) |
| Fototipos I (vs IV) | 2.09 | (51) |
| Pelo rubio (vs oscuro) | 1.96 | (51) |
| Historia Familiar de 1er grado* | 1.74 | (51) |
| Ojos azules (vs oscuros) | 1.47 | (51) |
| N° de nevi atípicos (1) | 1.45 | (50) |
| N° de nevi comunes (0-15) | 1 | (50) |
RR: Riesgo relativo
El examen completo de la superficie cutánea es la instancia más relevante en la detección precoz del melanoma. Su relevancia radica en el hecho de que más de un 50% de los melanomas diagnosticados no son el motivo de consulta del paciente (9). Es un método simple, rápido y con alta sensibilidad (89-97%) cuando es realizado por expertos (9-11). Estudios realizados con dermatólogos han demostrado que la mayoría de los melanomas detectados tienen índices de Breslow menores a 750 micras en comparación a las lesiones detectadas por médicos no dermatólogos (12). Además, dentro del grupo de los dermatólogos, se ha demostrado que la capacidad diagnóstica es dependiente de los años de experiencia y la frecuencia de lesiones pigmentadas observadas en la práctica diaria (11).
Se han descrito dos claves de gran utilidad al momento de realizar un examen cutáneo completo: el patrón personal de los nevi (13) y el signo del “patio feo” (14, 15). El primero es especialmente útil en aquellos pacientes con múltiples nevi atípicos y consiste en encontrar el patrón morfológico más repetitivo en los nevi del paciente. Dado que los nevi que comparten este patrón personal tendrían menos riesgo de corresponder a un melanoma, se logra disminuir el universo de nevi potencialmente sospechosos (13).
El signo del “patito feo” es aquella lesión que destaca por ser diferente al resto de los nevi del paciente. Normalmente es una lesión clínicamente atípica dentro de un pool de lesiones “típicas”, sin embargo, también puede corresponder a aquel nevus de aspecto “normal o típico” en el contexto de múltiples nevi atípicos (14, 15).
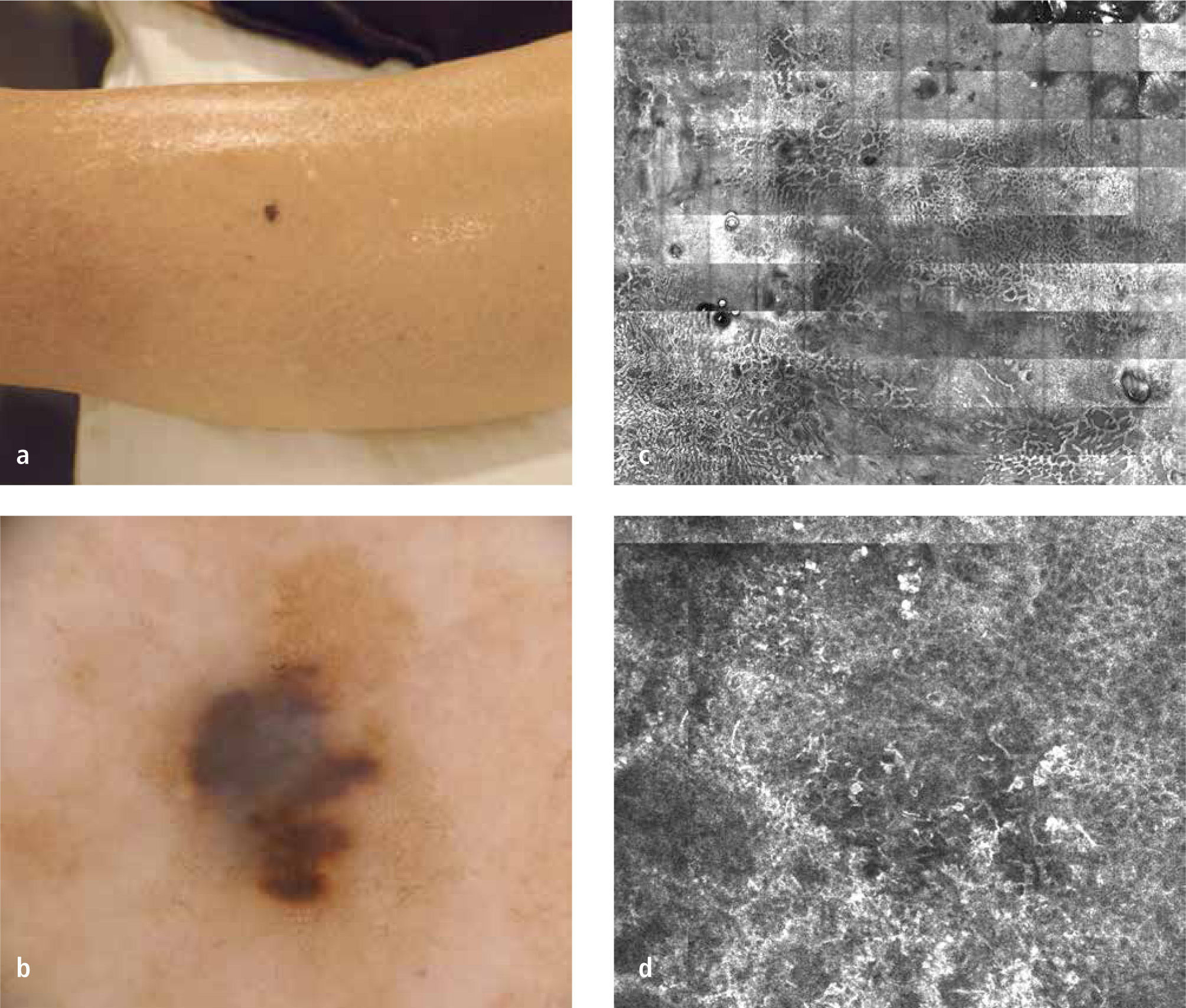
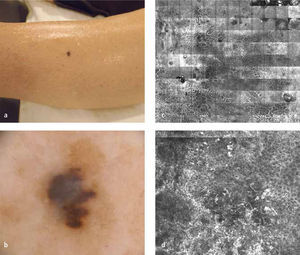
DermatoscopíaLa dermatoscopía es una técnica diagnóstica que consiste en la visualización de lesiones cutáneas mediante su amplificación con un instrumento óptico y una interface líquida (dermatoscopía con contacto) o con filtros de luz polarizada (dermatoscopía sin contacto). Mediante la eliminación del brillo de la superficie cutánea se logra visualizar estructuras más profundas e invisibles para el ojo desnudo (Figura 1a y b). Existe un consenso internacional sobre la nomenclatura aceptada para describir el conjunto de atributos morfológicos observables (16).
En la última década se ha estudiado exhaustivamente la utilidad de este método para el diagnóstico de melanoma. En general, se ha concluido que la dermatoscopía mejora la sensibilidad del diagnóstico de lesiones melanocíticas en aproximadamente un 20% (17, 18), mejora el índice benigno/maligno de lesiones sospechosas extirpadas y disminuye el numero de biopsias innecesarias (17). Sin embargo, es relevante destacar que la utilidad de la técnica es altamente dependiente de la experiencia del operador. Esto fue demostrado en un estudio en que se observó que en dermatólogos con 5 años de experiencia en dermatoscopía, la sensibilidad fue de 92% para detectar melanomas versus un 62% en aquellos sin experiencia (19).
Con el fin de estandarizar la técnica, se han propuesto múltiples algoritmos diagnósticos (análisis de patrones, CASH, ABCD, “7 point checklist”, entre otros) con sensibilidades y especificidades variables (20, 21), cuya utilidad mayor se aprecia en el ámbito de los estudios clínicos más que en la práctica clínica diaria.
Si bien la técnica tiene una gran utilidad en la práctica, se debe considerar que hay un subgrupo de melanomas que al no presentar características demoscópicas sugerentes, no son detectables con este método (22).
Seguimiento dermatoscópico digital (SDD)Una técnica derivada de la anterior, el SDD, consiste en el registro digital de las imágenes dermatoscópicas de lesiones melanocíticas sospechosas y su posterior comparación en un intervalo de tiempo determinado. La principal ventaja del SDD es que permite detectar cambios sutiles en la morfología de lesiones y de esta manera seleccionar mejor aquellas en que es realmente necesario realizar una biopsia. Hay múltiples estudios que han reportado que el SDD implica una mejoría adicional de la sensibilidad de la dermatoscopía en la detección del melanoma (23, 24). En la práctica, el SDD es utilizado en lesiones con atipia clínica leve en pacientes con alguno de los factores de riesgo de melanoma, previamente mencionado.
Mapeo corporal total (MCT)El MCT consiste en el registro fotográfico de toda la superficie cutánea de un individuo. El procedimiento se realiza según un protocolo que estandariza las posiciones corporales adecuadas, y mantiene condiciones de luz, fondo y distancia repetibles. El conjunto de imágenes obtenidas se utiliza como una referencia al momento de examinar al paciente en controles futuros. Estudios que han evaluado la utilidad del método han reportado que su principal utilidad sería mejorar la detección de lesiones nuevas y lesiones con cambios morfológicos significativos, disminuir el número de biopsias innecesarias y aumentar la probabilidad de detectar melanomas en estadíos más precoces (25-27). El MCT es de mayor utilidad en pacientes con nevi atípicos múltiples o en pacientes con nevi múltiples y riesgo de melanoma.
Microscopía confocal de reflectancia (MCR)El MCR es un instrumento no invasivo que permite la visualización in vivo de la morfología de la piel hasta un nivel celular. Mediante un láser de baja energía, se obtienen cortes virtuales horizontales de la piel hasta una profundidad máxima de 350 a 400 micrones (Figura 1 c y d). Aunque se creó hace varias décadas sólo en los últimos años se ha ido incorporando y masificando su uso en el ambiente clínico. Se han publicado múltiples estudios en que se observa una excelente correlación con la dermatoscopía y con la histología convencional.
Su sensibilidad para el diagnóstico de melanoma varia entre 92% y 97% y su especificidad entre un 70% y 90% (28-30). Además, se ha reportado que cuando se agrega a la dermatoscopía, permite una mejoría adicional en la sensibilidad de ésta (28). En la práctica, la mayor utilidad del MCR es en lesiones con atipia clínica leve en que se requiere información adicional para evaluar la real necesidad del estudio histopatológico.
En base a la experiencia de los autores, consideran importante destacar que ninguna de estas técnicas es capaz de entregar un diagnóstico definitivo y que el gold standard sigue correspondiendo al estudio histológico de las lesiones.
Otro aspecto relevante a mencionar es que la utilización de cada una de estas técnicas diagnósticas debe ser evaluada caso a caso ya que son múltiples los escenarios clínicos en que la detección precoz del melanoma es el objetivo. Por ejemplo, nos enfrentamos frecuentemente a pacientes con múltiples nevi atípicos, a pacientes con múltiples nevi no atípicos, pacientes con antecedentes personales de melanoma y múltiples excisiones previas de nevi benignos, pacientes con historia familiar de melanoma pero sin factores de riesgos personales, pacientes pediátricos, pacientes muy ansiosos o “melanofóbicos”, entre otras. Cada caso requiere un abordaje particular, analizando los pro y contras de utilizar una u otra tecnología de apoyo al diagnóstico.
Melanoma familiarLa etiología del melanoma familiar depende de la interacción entre factores ambientales y genéticos. La concentración familiar de casos de melanoma se observa en cuatro grupos: 1) Melanomas que corresponden a casos esporádicos que por azar o hábitos de exposición solar compartidos ocurren en una misma familia, 2) Melanomas de causa genética desconocida, 3) Melanomas asociados con variantes alélicas en genes de baja susceptibilidad y, 4) Melanomas que se originan debido a mutaciones en genes de alta susceptibilidad y penetrancia. Se estima que 5 a 10% de los casos de melanoma cutáneo ocurre en familias con predisposición genética (31). El patrón de susceptibilidad genética es consistente con herencia autosómica dominante con penetrancia incompleta. La penetrancia es afectada significativamente por la edad, factores ambientales (grado de exposición solar, localización geográfica) y la presencia de otros genes que moderan la respuesta a la exposición solar (32).
Se han identificado cuatro genes que predisponen al melanoma cutáneo, tres de ellos de alta penetrancia (CDKN2A, p14, y CDK4) y uno de baja penetrancia (MC1R). El gen en el que con mayor frecuencia se observan mutaciones en el melanoma familiar es el CDKN2A. Hay factores que predicen significativamente la presencia de mutación en este gen: mayor número de pacientes con melanoma en la familia, diagnóstico de la enfermedad a edad temprana, ocurrencia de múltiples melanomas primarios en un individuo y la historia de cáncer de páncreas en la familia (33) Se ha observado una mayor incidencia de cáncer de páncreas en miembros de familias con mutación en el gen CDKN2A. La asociación en un paciente de melanoma con cáncer de páncreas es prácticamente diagnóstica de mutación en el gen CDKN2A (34, 35).
En los estudios epidemiológicos se observa un riesgo mayor de desarrollar un melanoma en los familiares de los casos (36) con o sin mutación demostrada. El riesgo de melanoma aumenta entre 30 a 70 veces en personas con historia familiar de melanoma en relación a la población general. En los familiares de primer grado el riesgo acumulado a los 80 años de haber desarrollado melanoma es de 6%. Y en los familiares de los casos de melanoma diagnosticados antes de los 50 años, el riesgo acumulado a los 80 años es de 10%. Si además de una fuerte historia familiar de melanoma tiene nevi displásicos, el riesgo de desarrollar melanoma durante su vida puede llegar al 80%. En los portadores de mutaciones que pertenecen a familias CDKN2A (+) la penetrancia es en promedio de 30% a los 50 años y 67% a los 80 años.
La incidencia de un segundo melanoma es significativamente mayor en pacientes con historia familiar de melanoma, con tasas a 1 y 5 años de 8.3% y 19.1% respectivamente, comparado con 5.1% y 10.3% en pacientes sin historia familiar para melanoma (37). Después de un segundo melanoma la incidencia de un tercer melanoma casi se triplica. La incidencia de un tercer melanoma a 1 y 5 años desde la fecha del segundo melanoma es de 15.6 % y 30.9 % (37).
Existe acuerdo que los miembros de familias con melanoma deben ser invitados a participar en programas preventivos. Para detectar familias con predisposición genética se deben buscar antecedentes familiares en todos los casos de reciente diagnóstico, y luego verificar los antecedentes de melanoma y otros cánceres con los informes de estudios histopatológicos. Una vez confirmada la información, confeccionar un pedigrí con ayuda del paciente y mantenerlo actualizado anualmente. Se recomienda que los familiares sean examinados y las lesiones sospechosas biopsiadas cuando corresponda, según los métodos diagnósticos comentados. Además, se debe entregar información oral y escrita sobre cómo protegerse de la irradiación solar y cómo conducir un autoexamen. Se debe ofrecer una evaluación médica semestral no sólo a los pacientes portadores de nevi atípicos, sino que a todos los familiares de primer grado de cada caso dentro de la familia. Los niños deben ser examinados por primera vez a los 10 años o antes si está clínicamente indicado. La vigilancia se debe acentuar en la pubertad y durante el embarazo.
El test genético se recomienda en la actualidad sólo para investigación. Hay variados argumentos en contra del uso rutinario del test genético: a) en muchas familias con varios miembros afectados no se puede detectar ninguna de las mutaciones conocidas, b) el riesgo de melanoma y otros cánceres en individuos con mutaciones constitucionales esta todavía insuficientemente caracterizado, haciendo imprecisas las implicancias de un test positivo, c) dado que los no portadores de mutaciones en familias CDKN2A positivas también pueden tener nevi displásicos y desarrollar melanomas, un test negativo puede debilitar las necesarias actividades preventivas en este grupo de individuos d) finalmente, en ausencia de un método de screening validado para cáncer de páncreas, un test positivo tiene muy poco impacto en el manejo de estas familias (32).
En familias con predisposición a desarrollar melanoma cutáneo, con una buena educación y un seguimiento estricto, se puede disminuir la incidencia de la enfermedad, detectar precozmente los casos y mejorar su pronóstico. Esto fue recientemente demostrado en un estudio de 14 años de seguimiento de 280 familias con predisposición a desarrollar melanomas (2.080 individuos). De 1.912 lesiones cutáneas biopsiadas durante el seguimiento, 41 eran melanomas. De estos, 15 (37%) era melanoma in situ y 26 (63%) invasores. El espesor promedio de los invasores fue de 0.5mm. Estas características pronósticas se comparaban favorablemente con las de población general. Por otro lado, la incidencia de melanoma en estas familias, fue menor durante el período de seguimiento (38).
Impacto del diagnóstico precozEl diagnóstico precoz del melanoma maligno tiene implicancias favorables en cuanto a mejor sobrevida y menor morbilidad relacionada con el manejo quirúrgico de la lesión, que hasta hoy es el pilar en el tratamiento y que ofrece los mejores resultados terapéuticos.
Hay una serie de factores clínicos e histológicos asociados al pronóstico y por ende a la sobrevida, algunos modificables con pesquisa precoz y otros no.
Hay factores pronósticos clínicos, como la edad al diagnóstico, sexo, localización anatómica, mediciones bioquímicas, como la lactato deshidrogenada sérica (LDH) y factores pronósticos histológicos presentes en la lesión como son: el grosor o índice de Breslow, niveles de profundidad de Clark, presencia de ulceración, estadío ganglionar, tipo de tumor, angiogénesis, invasión vascular, tasa mitótica, índice mitótico, etc.
Cada uno de ellos en forma individual y la integración de ellos, permiten determinar el pronóstico en un paciente determinado.
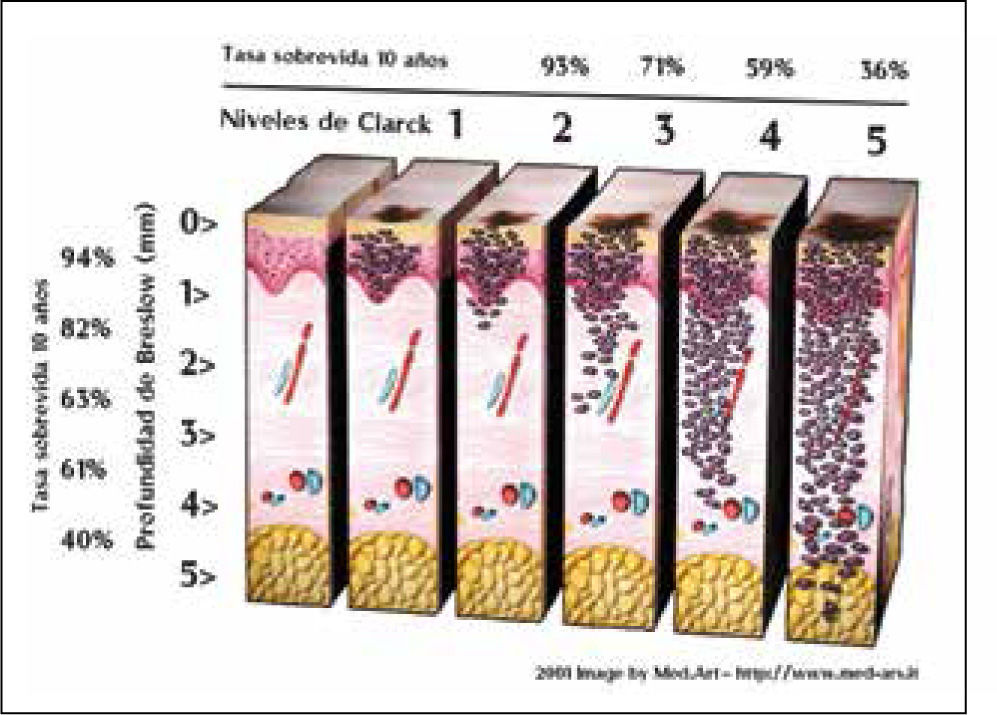
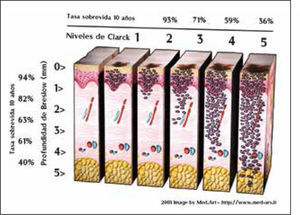
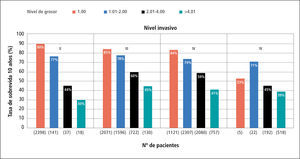
Factores pronósticos histológicosEn la clasificación de Clark, la estadificación de la lesión primaria está relacionada con el nivel anatómico de invasión en la dermis y tejido subcutáneo y es así que la sobrevida a 10 años bajo este parámetro es de 99%, 96%, 90%, 67% y 26% para los niveles de I a V respectivamente (39).
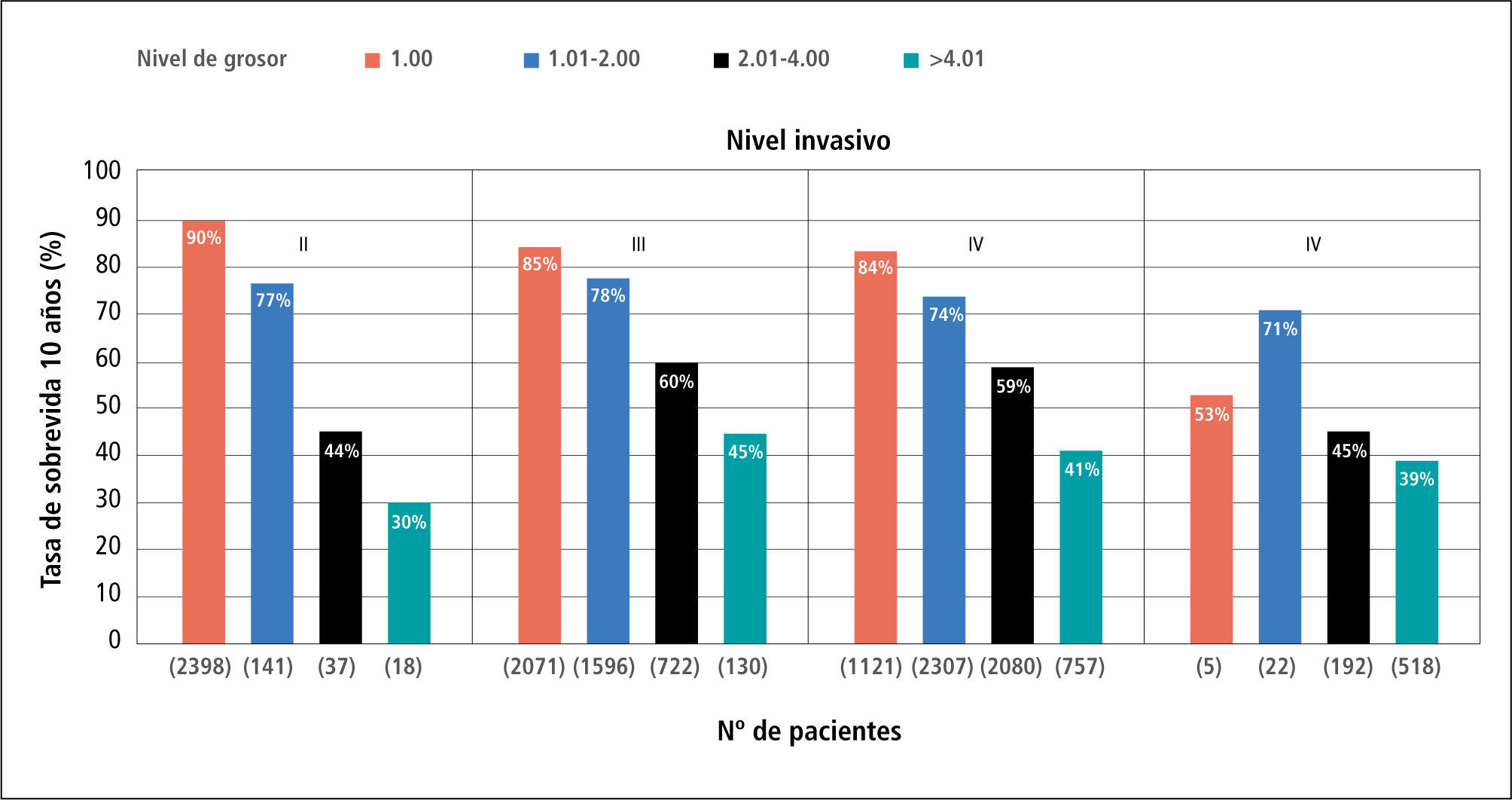
La medición del grosor en profundidad vertical, o índice de Breslow, es una variable continua y más precisa y actualmente el indicador local de pronóstico más importante aunque integrado con el nivel de Clark (Figura 2) (Figura 3).
Dr. Horvath Bela; Melanoblog. www.med-ars.it.
La ulceración está relacionada con agresividad inherente del propio tumor u otros factores como el apoyo angiogénico y conlleva mal pronóstico, especialmente cuando es mayor de 3mm. de ancho y en análisis multivariables ofrece información pronóstica significativa en todos los melanomas invasivos (40).
La tasa mitótica se correlaciona de manera directa con el pronóstico. Kopf demostró en lesiones de entre 1,5 y 2,49mm. de Breslow una supervivencia global a 5 años de 84,1% pero en un subgrupo con índice mitótico de 19 o superior está era sólo del 57,6% (41).
En relación al tipo histológico, el valor pronóstico va en relación a sus diferentes fases de crecimiento ya sea superficial o profunda en un análisis univariable, sin embargo la diferencia pronóstica se explica más por el grosor y por su localización anatómica. Una excepción posible a esto es el poco frecuente melanoma desmoplástico neurotrópico en que la posibilidad en estos de recidiva local, es francamente mayor (42).
El compromiso linfonodal es el factor pronóstico más relevante en la sobrevida y mayor aun dependiendo de la carga tumoral ya sea micro o macroscópica y del número de ellos comprometidos, lo que se refleja en la estadificación de la enfermedad y sus índices de sobrevida.
Factores pronósticos clínicosLa localización del tumor en cabeza, cuello y tronco tienen un riesgo relativo de falal local y a distancia de 1,34 en comparación con las lesiones de extremidades y en estas, las axiales y acrales (manos y pies) son aún de peor pronóstico.
La edad y el género son de escasa relevancia, sin embargo, las mujeres tienen un pronóstico a largo plazo mejor.
El nivel sérico de la LDH es un factor pronóstico independiente, especialmente en enfermedad metastásica, que confiere un riesgo relativo de muerte de 1,89.
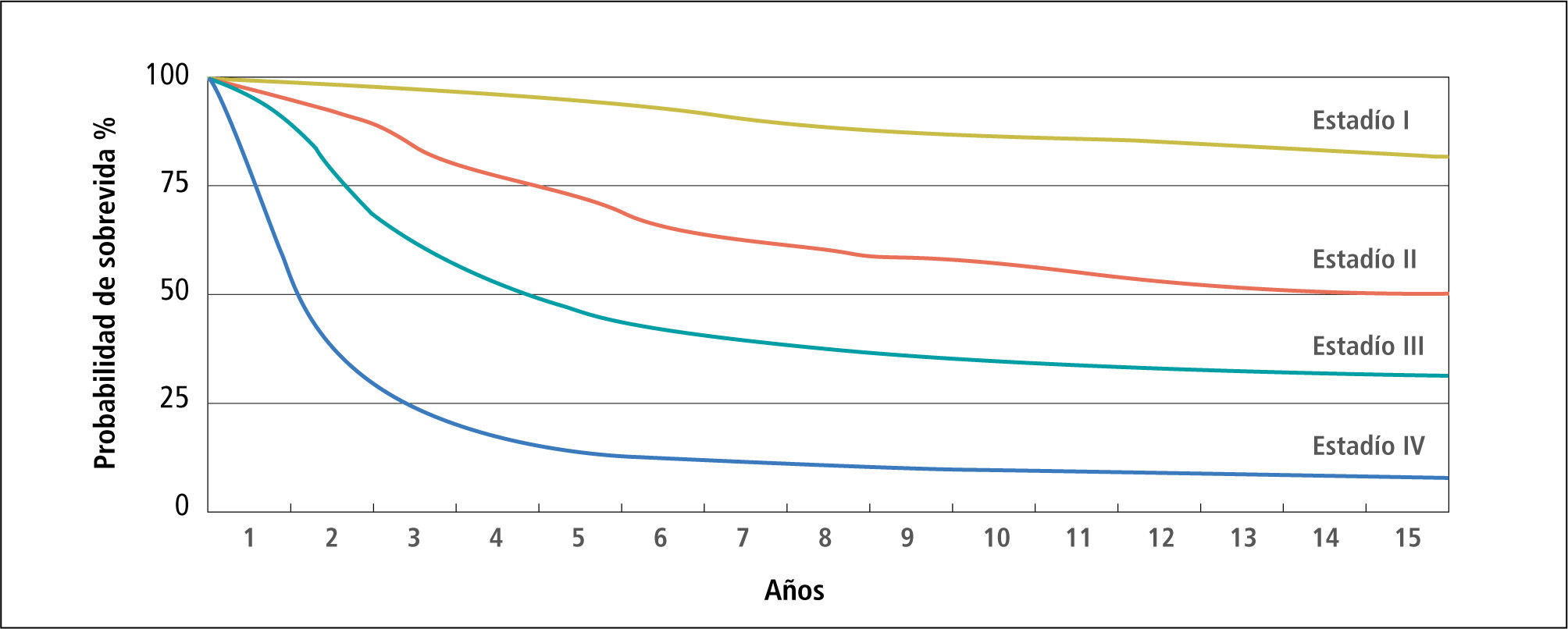
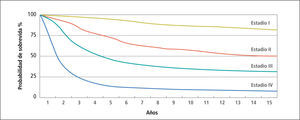
Etapificación de la enfermedad y manejo locoregionalPara un mejor entendimiento y manejo unificado, la clasificación clínica sobre Melanoma Maligno del Comité Americano Conjunto sobre Cáncer (AJCC) está claramente establecida mediante el modelo TNM (tumor - linfonodos - metástasis), de la que se definen las distintas etapas o estadíos (43) en que la etapa al diagnóstico determina la probabilidad de sobrevida a través de los años (Figura 4).
La etapificación real se inicia con un adecuado estudio histológico de la lesión sospechosa a la pesquisa clínica, al examen dermatológico y/o la tecnología de apoyo, y para esto, la biopsia debe contener el grosor necesario para su estudio integral, lo que es considerado el procedimiento quirúrgico inicial.
La toma de una muestra por rasurado de la piel (shave biopsy) puede no representar el adecuado escenario de la situación, fundamentalmente por la mala evaluación de la profundidad, por lo que lo pertinente es efectuar inicialmente una biopsia excisional conteniendo toda la lesión, idealmente con un margen de al menos 2mm de piel normal y en profundidad hasta el estrato de la fascia muscular, en que en el caso de lesiones pigmentadas pequeñas y de bajo grado de sospecha, esta biopsia puede ser tanto diagnóstica como terapéutica.
Si la lesión no es susceptible de una biopsia excisional, ya sea por su ubicación anatómica o por su tamaño, es factible una biopsia incisional o una en sacabocado (punch biopsy), que aunque en rigor, no son representativas de la lesión total, no aumentan el riesgo de recurrencia o metástasis en caso de confirmarse un melanoma maligno.
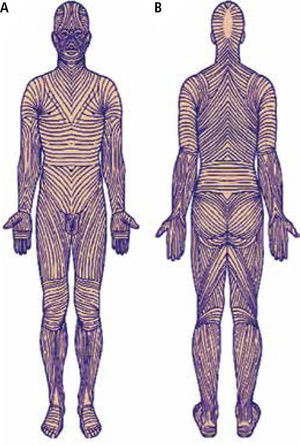
Es importante considerar que en cualquiera de las circunstancias en que se efectúe una incisión, ésta se debe realizar siguiendo las líneas de tensión o líneas de Langer (Figura 5) a nivel cutáneo, lo cual es oncológicamente adecuado, considerando la posibilidad de requerir una ampliación o un estudio regional ganglionar posteriormente, lo que puede influir en disminuir los riesgos y complicaciones, o sea, la morbilidad inherente al tratamiento.
El primer punto a considerar en la cirugía del melanoma maligno es el margen necesario y adecuado de su extirpación definitiva.
Hay numerosos ensayos clínicos prospectivos y randomizados que respaldan las recomendaciones actuales de los márgenes quirúrgicos adecuados en la lesión primaria al igual que la evaluación ganglionar (44). A mediados del siglo XIX, el cirujano británico William Norris, reconoció la importancia de extirpar no sólo la lesión sino que partes aparentemente sanas a su alrededor. Es así que durante mucho tiempo se recomendaban márgenes quirúrgicos muy amplios, sin embargo, distintos estudios han acotado esta fundamental conducta quirúrgica y han demostrado que no hay diferencias estadísticas significativas tanto en recurrencia local, metástasis a distancia y sobrevida global con un manejo menos agresivo de la resección con estas recomendaciones.
Con el respaldo de las guías de la Nacional Comprehensive Cancer Network (45) estas recomendaciones son: 0,5cm. de margen para lesiones in situ, 1cm. para lesiones < de 1mm. de profundidad, 2cm entre 1,01 y 4mm y margen mayor o igual a 2cm. en lesiones > a 4mm, las cuales pueden ser modificadas para adecuarse a consideraciones anatómicas o estéticas individuales.
El otro punto importante en la etapificación de la enfermedad es el estado ganglionar, lo que tiene implicancia en la sobrevida y en el manejo quirúrgico y por consecuencia en la mayor morbilidad relativa.
La biopsia del linfonodo centinela (BLC) ha reemplazado la disección ganglionar electiva (DGE) especialmente ante la sospecha de compromiso regional ganglionar en pacientes con examen clínico negativo, permitiendo una mejor etapificación y evaluación pronóstica.
Aunque la DGE fue muy recomendada hasta fines del siglo pasado en melanomas de etapa intermedia, hay múltiples estudios prospectivos que no han demostrado beneficios en sobrevida ante una disección ganglionar además de una morbilidad importante propia del procedimiento como complicaciones locales de la zona operatoria, parestesias y el temido linfedema (46).
El criterio de selección para BLC se basa en que su positividad es solo 1% en lesiones menores a 0,8mm, 8% en menores de 1,5mm, 23% entre 1,51 y 3,9mm, y 36% sobre 4mm. de profundidad (47), al igual que otras numerosas publicaciones con similares resultados y que confirman el peor pronóstico de su positividad.
Como se ha mencionado reiteradamente el diagnóstico precoz de un melanoma maligno no solo tiene impacto en la sobrevida sino que también en la morbilidad asociada al manejo quirúrgico tanto de la lesión cutánea de base como del manejo regional cuando es necesario. La morbilidad asociada a la BLC es baja en relación a la disección ganglionar completa (DGC), siendo de 13,8% versus 65,5% (p<0,000001). Las principales complicaciones a corto plazo de la BLC son la reacción alérgica al azul patente utilizado en su visualización, hematomas o infección de herida operatoria y principalmente el seroma que ocurre en el 7% de los casos, mientras que a largo plazo son el tatuaje cutáneo persistente de la aplicación del azul patente, déficit funcionales y dolor, todas ellas en menos del 1% de los casos.
Con la DGC ocurren complicaciones a corto y largo plazo del orden del 50% de los casos siendo principalmente los déficit funcionales, neuralgias e inflamación, lo cual es aun mayor en caso de DGC a nivel inguinal (p=0.0015) (48).
ConclusiónEl melanoma maligno constituye un modelo ideal donde aplicar estrategias y avances tecnológicos orientados al diagnóstico precoz. El impacto de estas medidas sobre la sobrevida y morbilidad es especialmente evidente en este tipo de cáncer de piel.
Los autores declaran no tener conflictos de interés, en relación a este artículo.