La estimulación cerebral profunda (DBS deep brain stimulation en inglés) implica la administración de micropulsos eléctricos hacia localizaciones subcorticales específicas. Inicialmente utilizada para manejar trastornos motores; es también efectiva sobre patologías neuropsiquiátricas, como la agresividad refractaria a tratamiento convencional. Este trabajo analizó estudios que emplearon DBS en la agresividad refractaria con la finalidad de identificar los parámetros de estimulación más utilizados.
MétodosSe realizó una revisión en bases Scopus, Cochrane, ScienceDirect y PubMed, identificando reportes o series de casos en humanos donde se utilizó DBS como terapia hacia comportamiento agresivo refractario, que expliciten parámetros de estimulación.
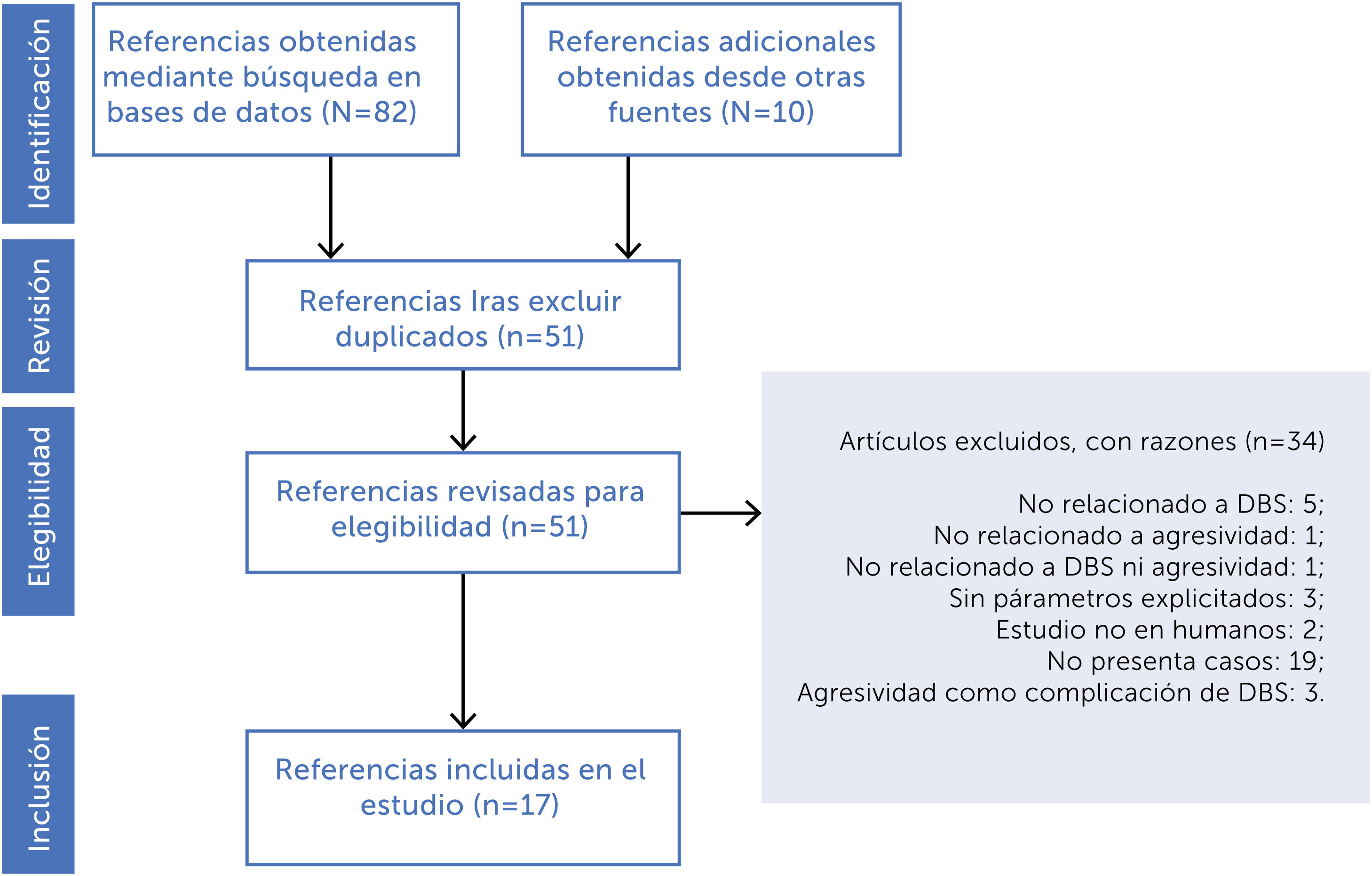
ResultadosSe incluyeron 17 trabajos con un total de 58 pacientes, considerando los criterios establecidos. El blanco más utilizado fue el hipotálamo posteromedial. La mayoría de los pacientes mejoraron significativamente tras iniciar DBS. El rango de frecuencias predominante fue entre 180-185Hz (75,8% del total) y el ancho de pulso predominante fue entre 60-90μs (84,4% del total).
ConclusionesLa DBS sobre el hipotálamo posteromedial a altas frecuencias y ancho de pulso relativamente bajo parece ser efectiva para tratar la agresividad refractaria; pero se desconoce la programación óptima para la terapia. Se requieren más estudios sobre el fundamento fisiológico del procedimiento, al igual que cohortes más grandes para el seguimiento.
Deep brain stimulation (DBS) consists of the administration of electrical micropulses towards specific subcortical locations. Initially used as a treatment for motor disorders; It is also effective in neuropsychiatric pathologies, including aggressiveness refractory to conventional treatment. This study aims to review experiences with DBS for refractory aggressiveness and identify the most frequent stimulation parameters.
MethodsA review of databases Scopus, Cochrane, ScienceDirect and PubMed was carried out, identifying reports or case series in humans where DBS was used to manage refractory aggressive behavior and which contained stimulation parameters.
Results17 papers with a total of 58 patients were included, according to the established criteria. The posteromedial hypothalamus was the most frequently used target. Most of the patients improved significantly after starting DBS. The predominant frequency range was between 180-185Hz (75.8% of cases) and the predominant pulse width range was between 60-90μs (84.4% of cases).
ConclusionsDBS of the posteromedial hypothalamus at high frequencies and relatively low pulse width seems to be effective for the treatment of refractory aggression; but the optimal setting for treatment is unknown. More studies are required on the physiological basis on which it operates, as well as larger cohorts of individuals for follow-up.
La conducta agresiva es un fenómeno observado con frecuencia en múltiples patologías psiquiátricas y del neurodesarrollo, así como en procesos vinculados a daño cerebral y discapacidad intelectual1,2. Para ciertos autores, obedece a impulsos primitivos relacionados con supervivencia geno-fenotípica entre individuos; mientras que otros lo dotan de intencionalidad de daño. Existirían múltiples factores que modifican la expresión agresiva individual, como personalidad, patologías concomitantes, experiencia subjetiva y procesos atribucionales que influyen sobre la resolución de problemas y control emocional3,4.
La agresividad tipo impulsiva se correlaciona, en general, con una alta actividad amigdalar y baja actividad de la corteza orbitofrontal5. El circuito neural subyacente a la agresión posee varios núcleos interconectados, incluida la porción medial amigdalar, el núcleo del lecho de la estría terminal, la parte ventrolateral del hipotálamo ventromedial y la parte ventral del núcleo premamilar. También se observa que la inhibición de las neuronas que expresan receptores D1 dopaminérgicos en el núcleo accumbens podría modular la respuesta de ataques6. Dado lo anterior, es razonable suponer que la modulación de la actividad neuronal en estas áreas tendría un impacto en la conducta agresiva. Es así que desde el 20057, se ha reportado el uso de la estimulación cerebral profunda (DBS, deep brain stimulation en inglés) para el tratamiento de la agresividad refractaria tanto a terapia conductual como psicofármacos en dosis máximas. Esta técnica consiste en la administración crónica de pulsos eléctricos mediante electrodos implantados en zonas profundas encefálicas. El desarrollo de la DBS está basado en las antiguas cirugías de lesión de estructuras cerebrales con fines terapéuticos, difiriendo en su naturaleza reversible y modificable. En cuanto a la estimulación, esta puede ser suspendida o modificada en sus parámetros8.
La DBS genera campos eléctricos que interactúan con elementos neurales como axones y dendritas, cuya mayor proximidad a los contactos favorece la estimulación del soma neuronal, que presenta umbrales superiores para su excitación8,9. Si bien no se han dilucidado completamente los mecanismos globales operantes de la DBS10, los estudios muestran efectos terapéuticos rápidos mediante:
- -
Inhibición. Inhibición en las redes neuronales cercanas al sitio estimulado. Los pulsos inducen despolarización neuronal sostenida, inactivando canales de sodio, y aumentando las corrientes de potasio; disminuyendo la probabilidad de nuevos potenciales de acción8. Este mecanismo resulta análogo a una lesión tisular, diferenciándose en el carácter reversible de esta terapia mediante la suspensión de la estimulación8. Además, es posible activar directamente aferentes neuronales inhibitorias, que operan con el neurotransmisor GABA10.
- -
Excitación. Símil a la estimulación directa, la DBS es capaz de excitar ciertas redes neuronales. Se sugiere que la estimulación subumbral produce inhibición de los disparos intrínsecos del soma, mientras que la estimulación supraumbral induce espigas en los axones sin corresponder a disparos en el soma. Una vez que se alcanza el núcleo blanco, la DBS altera tal tasa de disparos10.
- -
Interrupción. La interrupción está relacionada con los circuitos neuronales sobre los núcleos basales, y los primeros estudios fueron realizados en la enfermedad de Parkinson (EP). La estimulación cortical induce excitación temprana por vía hiperdirecta, inhibición por vía directa y excitación tardía por vía indirecta. Esto implica una disrupción del flujo de información normal entre las diferentes áreas encefálicas10.
Sobre los efectos de mediano y largo plazo, estudios ligados a EP mencionan cierta correlación entre la DBS y el aumento del flujo sanguíneo en el globo pálido, tálamo y núcleo subtalámico; aumento de glutamato extracelular en el globo pálido e incremento de GABA en sustancia nigra. Asimismo, la DBS sería responsable del aumento de la expresión de factores neurotróficos como BDNF y GDNF, y cambios en la neuroplasticidad; sin embargo, tales efectos no han sido demostrados en humanos11.
Al encender el dispositivo de DBS, la corriente eléctrica fluye en forma de pulsos con parámetros establecidos, tales como amplitud o intensidad de corriente, frecuencia (Hertz, (Hz)) y ancho de pulso (en unidades de tiempo, generalmente microsegundos, (μs))9. La programación de la DBS es modificable en función de la maximización de su efecto terapéutico y disminución de efectos adversos8,9. Cada proceso neural alcanzado por el estímulo será polarizado con diferentes magnitudes, dependiendo de la localización relativa al electrodo como también de los parámetros utilizados, por lo que se generarán potenciales de acción como respuesta a estímulos lo suficientemente fuertes, tanto en sentido ortodrómico como antidrómico7. Aquellos axones de mayor radio y perpendiculares al campo eléctrico se estimulan con voltajes y anchos de pulso más bajos8.
Se han documentado resultados favorables utilizando DBS en EP, temblor esencial, distonía idiopática y epilepsia refractaria, también en algunos casos de trastorno obsesivo compulsivo (TOC), depresión refractaria y dolor crónico2,9. Considerando la aplicación de la DBS en enfermedades neuropsiquiátricas, este trabajo busca, mediante una revisión de la literatura, identificar los parámetros de DBS más utilizados para mitigar el comportamiento agresivo en pacientes refractarios a tratamiento médico-psicológico.
MetodologíaSe realizó una búsqueda electrónica en bases de datos Scopus, Cochrane, ScienceDirect y PubMed con los términos “deep brain stimulation” AND “aggressive behavior” ubicados en título y resumen, comprendidos entre el año 2005 (primer reporte de caso con DBS sobre hipotálamo posterior contra agresividad) y el 16 de mayo del 2023. Los criterios de inclusión fueron reportes o series de casos clínicos realizados en humanos con o sin afecciones neurológicas concomitantes, en los cuales se usó DBS para tratar la agresividad. Como requisito adicional, en línea con el objetivo planteado, solo se seleccionaron artículos que explicitaron el lugar de implante y parámetros utilizados para su programación. Los autores LB, JC y JMC inspeccionaron los títulos y resúmenes de todos los artículos, excluyendo aquellos con contenido irrelevante para el objetivo planteado. También existieron referencias derivadas de la bibliografía obtenida como resultado de los documentos que cumplieran los criterios de inclusión.
ResultadosEstudios incluidos en este trabajoLa búsqueda en las bases de datos y referencias derivadas arrojó un total de 92 artículos. Luego de eliminar los duplicados se obtuvo 51 artículos, de los cuales 17 cumplieron los criterios de inclusión (figura 1).
Descripción de los casosLa tabla 1 resume los estudios seleccionados respecto al número de pacientes, parámetros de estimulación en el último control, día postoperatorio en que se encendió el DBS, localización del electrodo de estimulación, y resultados clínicos. A continuación, se realiza una descripción de los elementos destacados de cada estudio.
Resumen de los trabajos incluidos en la revisión
| Autor principal y año del artículo | Número de pacientes (N) | Parámetros de estimulación en último control | Día postoperatorio en que se encendió DBS | Lugar de estimulación | Resultado clínico |
|---|---|---|---|---|---|
| Franzini (2005)1 | 2 | Caso 1: 1 V; 60μs; 185 | 1 | Porción medial del hipotálamo posterior.2mm lateral al tercer ventrículo, 3mm posterior, y 5mm inferior al punto medio entre la comisura anterior y la comisura posterior. | ↓↓comportamiento agresivo↓ convulsiones (1/2)↓ distonía (1/2) |
| Cif (2007)12 | 1 | 1,6 V; 450μs; 130Hz | 0 | Porción anteroventral y posterior del globo pálido interno bilateral. | ↓↓ comportamiento agresivo↓ distonía |
| Hernando (2008)13 | 1 | 0,9 V (izquierda), 0,6 V (derecha); 450μs; 15Hz | 0 | Porción medial del hipotálamo posterior.2-4mm inferior al punto medio entre la comisura anterior y la comisura posterior, 2mm lateral al tercer ventrículo. | ↓ comportamiento agresivo↓ sociabilidad |
| Kuhn (2008)14 | 1 | 1,5 V; 90μs; 130Hz | 0 | Hipotálamo posterior. 2,5mm caudal al punto medio entre la comisura anterior y la comisura posterior. 2mm ventral y 2,5mm lateral al tercer ventrículo. | ↓↓ comportamiento agresivo |
| Maley (2010)15 | 1 | 2 V; 360μs, 1min on y 1min off; 20Hz | 30 | Debajo de la estría terminal, en las proyecciones de corona radiada más inferiores desde la corteza frontobasal hasta el hipotálamo, cercano al NAc.15mm anterior al plano midcomisural, 5mm lateral al plano medio-sagital y 3mm inferior al punto medio entre la comisura anterior y la comisura posterior. | ↓↓ comportamiento agresivo↓ calidad de vida |
| Franzini (2013)16 | 7 | 1-3 V; 60-90μs; 185Hz | 0 | Porción medial del hipotálamo posterior.Misma ubicación que Franzini (2005)1 | ↓ comportamiento agresivo (5/7)↓↓ comportamiento agresivo (1/7) |
| Torres (2013)17 | 6 | Ajustes último seguimiento:Caso 1: 2.4 V; 60μs; 180 HzCaso 2: 1.8 V; 210μs; 130 HzCaso 3: 1.8 V; 90μs; 185 HzCaso 4: fallecióCaso 5: 2.5 V; 60μs; 185 HzCaso 6: 1.3 V; 450μs; 15 Hz | 1-5 | Porción medial del hipotálamo posterior.2mm lateral al tercer ventrículo y 2mm inferior al punto medio entre la comisura anterior y la comisura posterior. | ↓ comportamiento agresivo↓ patrones de sueño↓ sociabilidad↓ convulsiones (1/3) |
| Benedetti-Isaac (2015)18 | 5 (9 iniciales) | Inicial en cohorte de 9 pacientes:3 V; 90μs; 185HzDetalle de 5 pacientes seguidos:Casos 1 y 2: 2,7 V; 90μs; 185HzCaso 3: 2,4 V; 90μs; 185HzCaso 4: 3 V; 90μs; 185Hz | 30 | Porción medial del hipotálamo posterior.Misma ubicación que Franzini (2005)1 | ↓ comportamiento agresivo (4/5)↓ calidad de vida↓ convulsiones |
| Harat (2015)19 | 1 | Hipotálamo posterior:1,5mA; 180μs; 130HzNAc:4,5 mA; 208μs; 130Hz | pHyp:0NAc:0 | Hipotálamo posterior, NAc y brazo anterior de la cápsula interna. | ↓↓ comportamiento agresivo↓obsesiones↓ ansiedad |
| Giordano (2016)20 | 1 | 2,5 V; 210μs; 130Hz | 30 | Cápsula ventral/estriado ventral, brazo anterior de cápsula interna bilateral. | ↓↓ comportamiento agresivo↓ sociabilidad |
| Doshi (2019)21 | 1 | 2,6 V; 60μs; 130Hz | 3 | NAc derecho e izquierdo. | ↓↓ comportamiento agresivo (golpes)↓ sintomatología obsesivo compulsiva, depresiva y ansiosa |
| Bernal-Pacheco (2020)22 | 1 | 4 V; 60μs; 130Hz | 20 | Porción medial del hipotálamo posterior.Misma ubicación que Franzini (2005)1 | ↓ comportamiento agresivo↓↓ convulsiones↓ concentración |
| Gouveia (2021)23 | 1 | 2,3 V; 150μs; 250Hz | 15 | Porción medial del hipotálamo posterior.Misma ubicación que Franzini (2005)1 | ↓↓ comportamiento agresivo↓ agitación↓ calidad de vida |
| Contreras (2021)24 | 4 | Caso 1: 1,2mA; 120μs; 113HzCaso 2: 1mA; 70μs; 170HzCaso 3: 1mA; 90μs; 185HzCaso 4: 3mA; 60μs; 185Hz | 15 | Porción medial del hipotálamo posterior.Misma ubicación que Franzini (2005)1 | ↓ comportamiento agresivo↓ calidad de vida |
| Escobar (2022)25 | 9 (11 iniciales) | Inicial en cohorte de 11 pacientes:1 V; 60μs; 180 HzDetalle de 9 pacientes seguidos:Caso 5: 2,5 V; 60μs; 205 HzResto: 3 V; 60μs; 180 Hz | 0 | Porción medial del hipotálamo posterior.Misma ubicación que Franzini (2005)1 | ↓ comportamiento agresivo↓ satisfacción de padres y/o cuidadores (8/9) |
| Benedetti-Isaac (2023)26 | 12 | 2 V; 90μs; 180 Hz | 30 | Porción medial del hipotálamo posterior.Misma ubicación que Franzini (2005)1 | ↓ comportamiento agresivo |
| Benedetti-Isaac (2023)2 | 5 | 2 V; 90μs; 180Hz (1min “on”, 5min “off”) | 30 | Porción medial del hipotálamo posterior.Misma ubicación que Franzini (2005)1 | ↓ comportamiento agresivo |
El resultado clínico se indica en la última columna: abolición del síntoma (↓↓), mejora (↓).
Franzini et al.1 aportan los primeros casos de DBS del hipotálamo posterior; edades 36-37 años, con daño neurológico post hipóxico o infeccioso, respectivamente, que presentan importante conducta agresiva refractaria a tratamiento, uno de ellos comórbido con epilepsia y distonía; utilizando dosis máximas de neurolépticos, antiepilépticos y benzodiacepinas; que derivaron incluso en toxicidad hepática. Se inicia estimulación a alta frecuencia, permitiendo la retirada de neurolépticos en ambos casos, y rehabilitación posterior del trastorno conductual de agresividad. Uno de los pacientes conservó los parámetros iniciales, el segundo requirió ajuste de amplitud, manteniendo los buenos resultados.
Cif et al.12 exponen el caso de un adolescente con enfermedad de Lesch–Nyhan, patología asociada a daño renal y neurológico, con retraso psicomotor, distonía, y autoagresión mutilante severa; con falla del tratamiento farmacológico para control motor y conductual. Se realizó doble estimulación por DBS en parte anteroventral (límbica) y posterior (motora) del globo pálido interno. Se observa una marcada disminución de los síntomas agresivos con la estimulación límbica, permitiendo descontinuar neurolépticos; y mejoría parcial de distonía mediante estimulación motora. Este trabajo representa el funcionamiento independiente de los circuitos dentro del globo pálido, mediante pruebas de apagado alternado de las zonas estimuladas y observación de efectos (regresión a estado basal).
Hernando et al.13 utilizaron DBS en la porción medial del hipotálamo posterior para tratar crisis agresivas refractarias en un hombre de 22 años con discapacidad intelectual (DI) y epilepsia frontal controlada. Se aplicó el score ICAP (Inventory for Client and Agency Planning) obteniendo un puntaje basal de -32 (severo), según el manual del ICAP. Posterior a la cirugía se realizaron ajustes paramétricos debido a efectos indeseados (descarga simpática, contracciones musculares involuntarias y convulsiones). En una tercera configuración, con frecuencia de 15Hz y ancho de pulso de 450μs, se experimentó una reducción de las crisis de agresividad, mejor sociabilidad e ICAP +1 (normal) a los 18 meses de seguimiento.
Kuhn et al.14 presentan una paciente de 22 años, con agresividad automutilante posterior a un traumatismo abierto craneano, que requirió contención de extremidades superiores y cirugía reconstructiva de labios; con fracaso de la terapia farmacológica y conductual. Se implantó DBS en el hipotálamo posterior, realizando seguimiento durante 4 meses, durante los cuales se eliminó el comportamiento autoagresivo.
Maley et al.15 exponen el caso de una adolescente de 19 años nacida por parto traumático, con DI moderada y depresión; que requiere sedación profunda como contención por agresividad intratable. Después de 12 meses de seguimiento tras iniciar DBS sobre tractos hacia corteza orbitofrontal y núcleo accumbens (NAc); y múltiples ajustes de estimulación, se obtuvo una mejoría de su sintomatología agresiva y calidad de vida. Los parámetros finales corresponden a un patrón inédito en el cual los electrodos se mantienen encendidos y apagados alternadamente durante un minuto.
Franzini et al.16, reportan el seguimiento de 7 pacientes (edades 20-68 años) con DI, comportamiento agresivo refractario, puntaje OAS (Overt Aggression Scale) preoperatorios mayores a 8; y epilepsia multifocal generalizada refractaria en 2/7 pacientes. Se instala DBS, ajustando parámetros de estimulación con intensidad de 1-3V; ancho de pulso de 60-90μs; frecuencia de 185Hz. El seguimiento se realizó durante1-9 años posteriores a la cirugía constatando que 6 pacientes redujeron su agresividad (OAS ≤4), en tanto un sólo paciente mantuvo el basal (OAS 9). Se describe el caso de un paciente con respuesta inicial a la DBS, sin embargo, tras un apagado del dispositivo y posterior reinicio, presentó menor reducción de agresividad; lo cual podría sugerir una evolución de la enfermedad psiquiátrica. Este estudió también señaló una reducción en la frecuencia y severidad de los episodios epilépticos de los pacientes.
Torres et al.17 reportan 6 pacientes (edades 22-48 años, 2 mujeres) con eretismo refractario (agresión sin provocación), 3 de ellos con epilepsia. Todos los participantes poseían un puntaje ICAP menor a -40 (muy severo). Se inició DBS con ajuste de 450μs y 15Hz (baja frecuencia) en 5/6 pacientes, lo cual fue decidido tras la respuesta simpática experimentada por el paciente N°1 con una frecuencia superior (180μs y 60Hz). El seguimiento, de 46 meses promedio, permitió incrementar gradualmente la frecuencia y voltaje. Durante este periodo también fallecieron 2 pacientes por causas externas. Se observó una reducción estadísticamente significativa en puntuaciones de agresividad en 5 de los 6 pacientes. Adicionalmente se observaron beneficios en la regularidad del sueño, sociabilidad, necesidad de contención mecánica; incluso 1 de 3 pacientes con epilepsia disminuyeron un 30% sus convulsiones.
Benedetti-Isaac et al.18 publicaron una cohorte de 9 individuos con agresividad que recibieron terapia con DBS, detallándose los resultados de 5 de ellos, quienes además padecían epilepsia refractaria. El puntaje OAS previo a la intervención era >8 puntos. En 4 de 5 pacientes se describe una reducción en esta escala (≤6 puntos), y un incremento percibido de la calidad de vida. Este estudio se enfoca en la reducción de convulsiones, las cuales disminuyeron en todos los casos. Sin embargo, un paciente no mantuvo la reducción de agresividad pese a una mejoría postoperatoria inicial.
Harat et al.19 reportan el caso de una mujer de 26 años, diagnosticada con TOC y agresividad refractaria. Inicialmente se implantaron dos electrodos en hipotálamo posteromedial, mejorando su sintomatología agresiva durante las primeras 4 semanas. Desde ese punto en adelante, volvió a su estado inicial, realizándose infructuosamente sucesivos ajustes paramétricos. Posteriormente se instalaron 2 electrodos extra en el NAc y cápsula interna (brazo anterior), observando resolución completa de los episodios agresivos, disminución de las obsesiones y la ansiedad concomitante. Los autores de este estudio plantean que, si bien existe la posibilidad de que solo los electrodos instalados en NAc hayan corregido la sintomatología, también podría deberse a una interacción conjunta entre estos electrodos y los ya instalados en hipotálamo posterior.
Giordano et al.20 presentan un paciente de 21 años con DI moderada y eretismo refractario, requiriendo contención física durante hospitalizaciones; cuyo puntaje preoperatorio en escala OAS modificada fue de 34. Aplicaron DBS sobre cápsula ventral/estriado ventral, observando en el seguimiento de 22 meses mejoría significativa de agresividad con reducción de 25 puntos promedio en OAS modificada. Se confirmó la efectividad de la estimulación tras el apagado intencional del dispositivo, con lo que reapareció furia explosiva; la que se detuvo posterior al reinicio con los parámetros ya descritos.
Doshi et al.21 tratan con DBS dirigida al NAc a una paciente de 42 años con trastorno del espectro autista (TEA) con agresividad y TOC. La programación inició el tercer día post intervención. En los días inmediatamente posteriores a la cirugía cesó su comportamiento autoagresivo, empezó a desarrollar contacto visual y sonrisa; además mejorando su comportamiento relacionado al TOC, la sociabilidad, depresión y ansiedad.
Bernal-Pacheco et al.22 reportan el caso de un hombre de 18 años con DI, comportamiento agresivo y epilepsia refractaria. La programación se realizó 20 días después de la cirugía y consistió en el aumento progresivo del voltaje hasta 4V, 130Hz y 60μs. A los 3 meses, se los contactos 2 y 10 a 3V, 140Hz y 60μs. Se reduce un 70% la frecuencia de los episodios de ira; y desaparecen las convulsiones. Añ reajustar a 3,4V, aparecieron efectos indeseados que motivaron bajar a 3,2V. A los 18 meses, el paciente continúa con un comportamiento agresivo reducido, además de un excelente autocontrol y mejor atención.
El estudio de Gouveia et al.23 realiza seguimiento anual por 5 años posterior a instalación de DBS, a un paciente de 31 años con TEA, DI severa, epilepsia refractaria y agresividad. La configuración inicial del dispositivo fue con los siguientes parámetros: 2V; 120μs; 180Hz, encendido 15 días postquirúrgico, observándose una reducción de 90% de frecuencia y severidad del comportamiento agresivo, 61% en grado de agitación, e incremento de 25% en calidad de vida. A los 13 meses de seguimiento, se detectó un empeoramiento de los resultados, requiriendo aumentar el voltaje a 2,5V, recuperando el curso de mejoría. A los 4 años, y posterior a la descarga de la batería, el paciente volvió a empeorar, lo cual fue corregido tras el cambio de esta. Los últimos valores obtenidos en cuestionarios mostraron una abolición del comportamiento agresivo, reducción de la agitación en un 40% comparado con el momento previo al reemplazo de la batería, e incremento en la calidad de vida.
Contreras et al.24 reportan cambios a nivel de agresividad y calidad de vida 12 meses posterior al inicio de tratamiento con DBS, en 4 pacientes de 27±2,8 años, que tenían diagnóstico de desorden explosivo intermitente refractario (rIED, por sus siglas en inglés), con alto riesgo autolesionante y heteroagresivo, además de DI y una pobre calidad de vida. Se midió la variación mediante OAS y cuestionario SF-36. Al encender el DBS sus parámetros fueron 1,5mA; 90μs; 119Hz, ajustándose posteriormente. Se pesquisa una reducción del puntaje OAS basal (todos inicialmente >10) evidenciado principalmente al tercer mes de iniciada la estimulación; al año la totalidad de los pacientes presentó mejoría de la calidad de vida.
La cohorte publicada por Escobar et al.25 refleja el trabajo con DBS en hipotálamo posteromedial en 11 individuos jóvenes con condición agresiva y DI moderada a severa. Se observa mejoría en 9 pacientes, a los cuales se les realiza seguimiento de 4 años, obteniéndose una reducción significativa de la agresividad mediante OAS del 69% respecto al basal. Destaca el caso de una paciente cuyo DBS fue instalado dos años después de una cirugía de hipotalamotomía bilateral que no había proporcionado la mejoría esperada, y que posteriormente consiguió una reducción del 63% en OAS tras iniciar DBS.
Benedetti-Isaac et al.26 publican un estudio con 12 adolescentes con DI y agresividad, con imágenes de atrofia cortico-subcortical generalizada, a los cuales les aplican DBS en hipotálamo posteromedial; realizando seguimiento postoperatorio a los 6, 12 y 18 meses, en los que se observa una acelerada disminución de la sintomatología, con diferencia de OAS entre pre y postoperatorio (18 meses) de 12,8 puntos en promedio.
En otro estudio realizado por Benedetti-Isaac et al.2, 5 adolescentes (edades 12-17 años) con TEA severo, agresividad intratable y gran deterioro de la calidad de vida, son intervenidos con DBS en el hipotálamo posteromedial; con diferencia de OAS entre el pre y postoperatorio (18 meses) de 12 puntos en promedio. El máximo cambio fue reportado durante el primer año, alcanzando una estabilidad posterior.
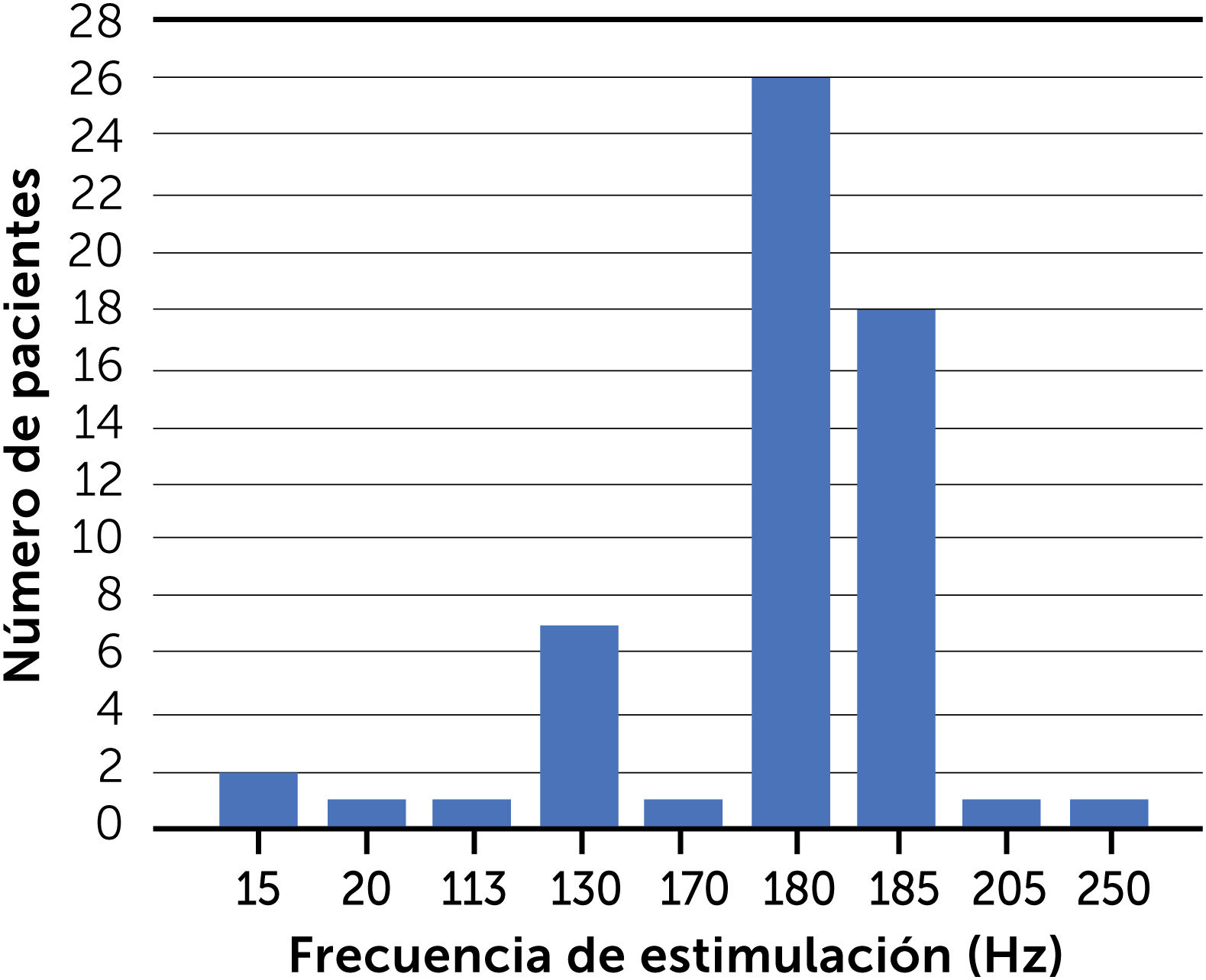
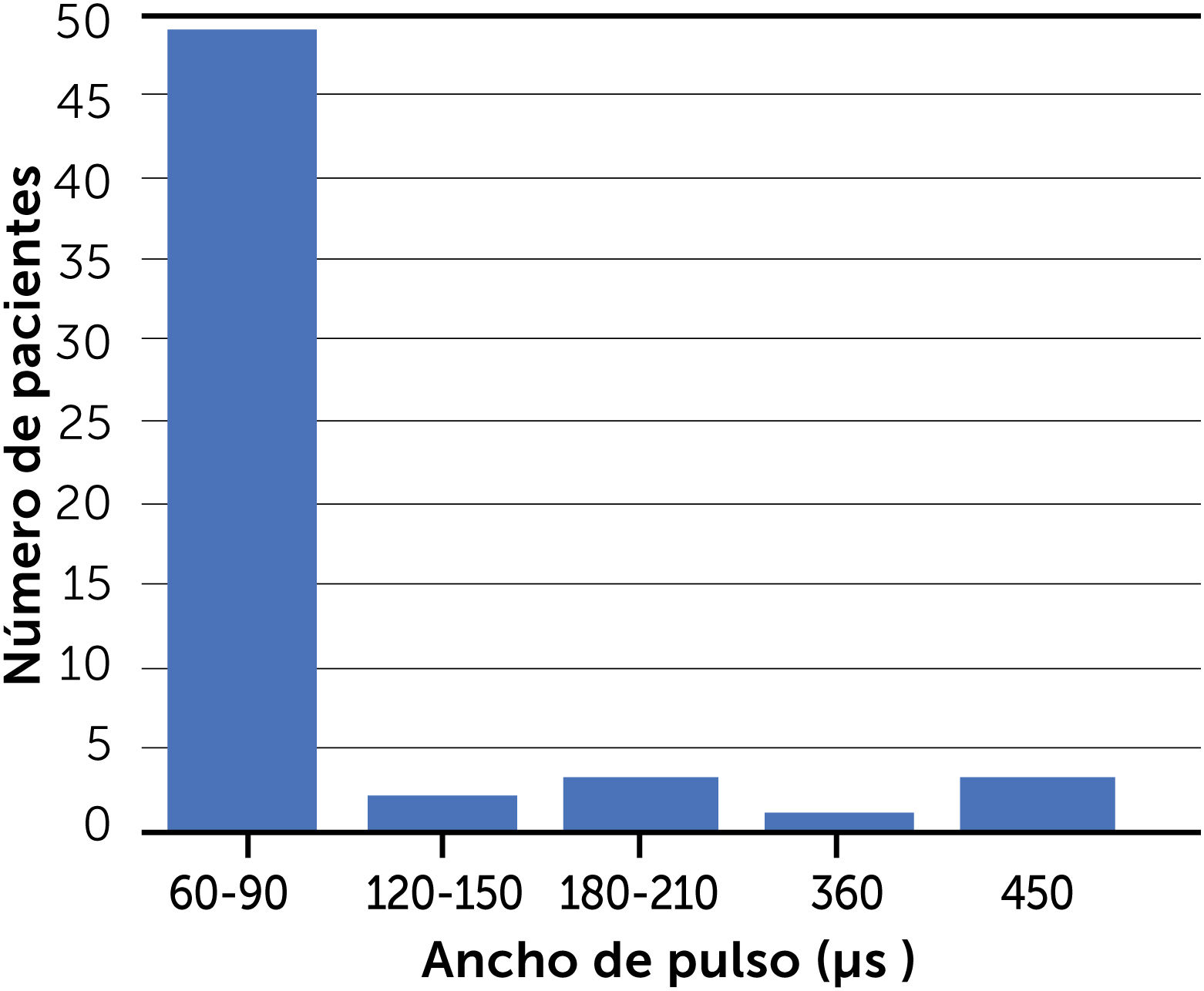
Frecuencias y anchos de pulso utilizadosLas figuras 2 y 3 muestran la distribución de las distintas frecuencias de estimulación y ancho de pulso respecto al número de pacientes incluidos. Esto, tomando en cuenta los parámetros conocidos de 58 pacientes, restándose uno de los casos fallecidos de Torres17. No se construyó un gráfico similar para amplitud puesto que las unidades de intensidad de estimulación entregadas en la mayoría de los estudios están en voltios y no en densidad de corriente, y por tanto no son directamente comparables entre sí.
La frecuencia más utilizada (44,8% de los casos, 26/58) corresponde a 180Hz; seguida de 185Hz (18/58 casos). El uso de las altas frecuencias [113-250Hz] es predominante (55/58 casos) respecto a las bajas [15-20Hz]) (figura 2).
Respecto a los anchos de pulso, predomina el rango de 60-90μs (49 casos). El resto corresponde a cifras mayores con uno a tres casos cada rango, abarcando valores entre los 120 y 450μs (figura 3).
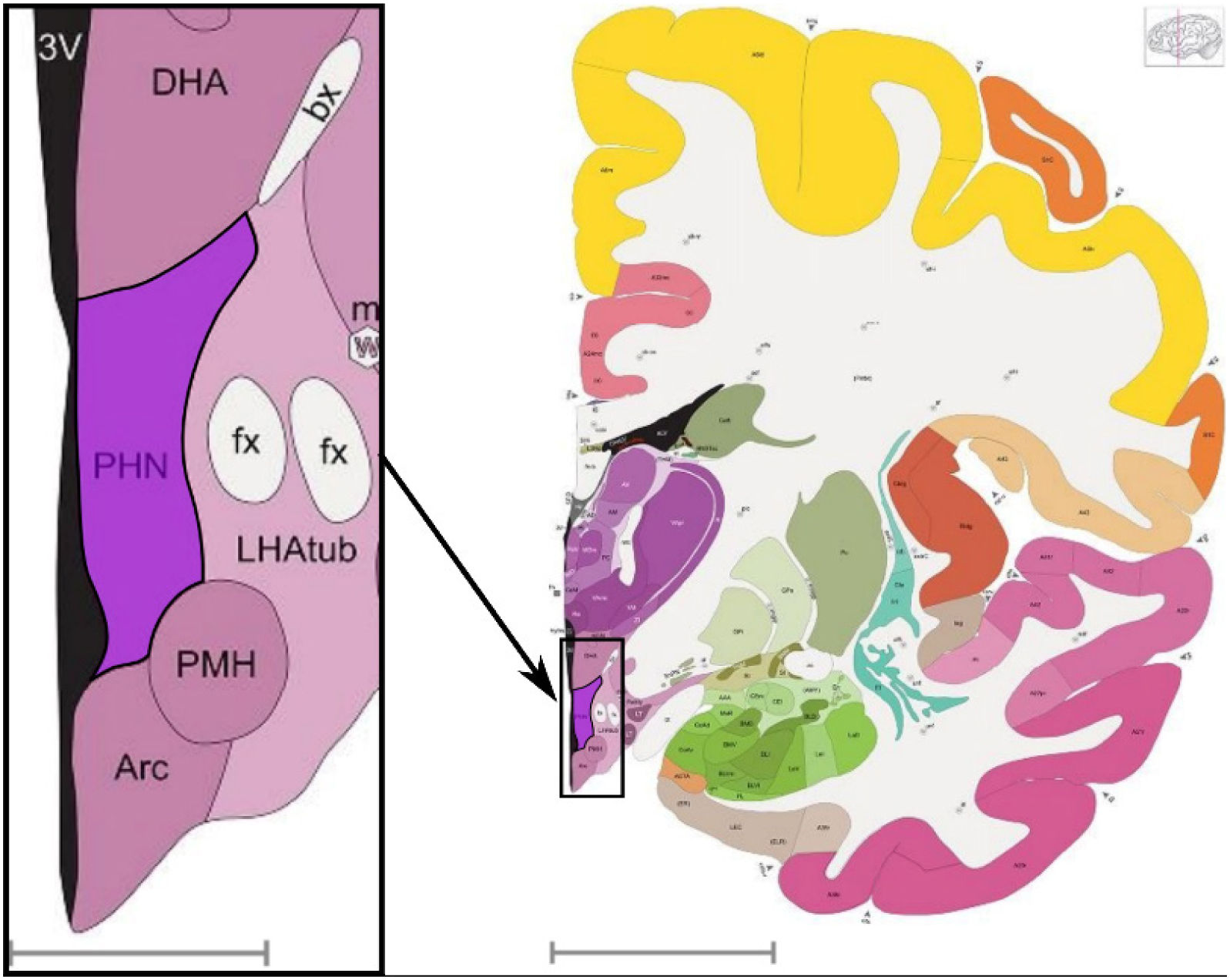
Sitio de estimulaciónSe advierte que el blanco más frecuente para la DBS sobre la agresividad refractaria es la porción medial del hipotálamo posterior1,2,16,18,22–27 (figura 4). Con excepción de Hernando, Kuhn y Torres13,14,17 que utilizan ubicaciones ligeramente diferentes, la mayoría replicaron las coordenadas utilizadas por Franzini (2005)1, lo cual puede constatarse en la tabla 1. Destaca además que todos estos trabajos se basan en las coordenadas utilizadas originalmente por Sano28 para producir lesiones irreversibles en el hipotálamo; tales ubicaciones en su región posteromedial, comprenden un área que incluye el punto medio entre la línea desde la comisura anterior a la comisura posterior, el borde anterior de los cuerpos mamilares y el inicio del acueducto, zona denominada el Triángulo de Sano. En su conjunto, los estudios hacen patente que la DBS sobre la porción medial del hipotálamo posterior trae consigo efectos beneficiosos que disminuyen el comportamiento agresivo en la mayoría de los pacientes. Este resultado probablemente guarda relación con el papel que cumple el hipotálamo en el circuito central de la agresión6.
Vista sagital del hipotálamo posterior, cuya porción posteromedial es el blanco de estimulación más utilizado para el tratamiento de la agresividad refractaria.
Hipotálamo posterior (PHN) y estructuras circundantes (fx: fórnix; LHAtub: área hipotalámica lateral; PMH: hipotálamo posteromedial; Arc: núcleo arqueado del hipotálamo; 3V: tercer ventrículo; DHA: área hipotalámica dorsal). El trazo gris abajo representa una longitud de 3,9 milímetros. Derecha: se muestra la localización de la imagen de la izquierda en el contexto del cerebro adulto completo (corte sagital). El trazo gris abajo representa una longitud de 20,66 milímetros. Figuras obtenidas del atlas interactivo Allen Reference Atlas – Adult Human27.
El estudio de Cif12 fue el primero en utilizar coordenadas diferentes a las de Sano28, en el globo pálido interno. Posteriormente, Maley y Harat15,19 seleccionaron el NAc como blanco, este último grupo tras el cese de respuesta a la tercera semana desde la intervención en el hipotálamo posterior; debido a los resultados observados en otros pacientes con psicopatología y comportamiento agresivo concomitante, obteniendo como consecuencia total desaparición de la agresividad. Sin embargo, no fue posible asegurar que este resultado se debió en su totalidad a la estimulación en este segundo blanco, puesto que los electrodos iniciales no fueron apagados. Años posteriores, un estudio de Harat et al29 (excluido de esta revisión por no informar los parámetros de estimulación), reportó una serie de 6 pacientes con comportamiento agresivo y conductas autodestructivas tratados con DBS en el NAc; obteniendo una reducción promedio de 74,5% de estos comportamientos. Dichos resultados sugieren un efecto terapéutico de la DBS del NAc para comportamientos agresivos y autodestructivos, sin importar la etiología.
DiscusiónLa explicación neuroanatómica detrás del funcionamiento de la DBS en las zonas previamente mencionadas puede ser explicada mediante modelos de circuitos centrales de agresividad6, postulándose que existe una regulación inhibitoria desde la corteza prefrontal, orbitofrontal y cingulada anterior hacia estructuras límbicas como la amígdala y la formación hipocampal, las que a su vez poseen conexiones regulatorias hacia el hipotálamo medial y lateral y el cuerpo estriado (incluyendo el NAc)5. El hipotálamo posee conexiones hacia la sustancia gris periacueductal, generando activación de neuronas motoras en la médula espinal que efectúan la respuesta agresiva innata en animales, mientras que las conexiones hacia el área tegmental ventral se comunican con el cuerpo estriado para actuar mediante una respuesta aprendida de agresividad, elemento que se cree tendría un papel más relevante en humanos6. En conjunto, estas propuestas de funcionamiento del circuito central de la agresión explicarían por qué intervenir el hipotálamo o el NAc tiene efectos en la regulación de conductas agresivas.
En la publicación de Benedetti-Isaac18, la mejoría reportada en las primeras horas y días fue asociada a un mecanismo lesional y de edema tisular posquirúrgico, y no con el funcionamiento mismo del DBS que aún no había sido encendido. Maley, sin embargo, no reporta resultados positivos clínicos en el postoperatorio15. Pese a que el efecto microlesional está bien descrito para DBS en EP30–32, creemos que se requieren más estudios para demostrar lo propuesto por Benedetti-Isaac18. Este posible sesgo de microlesión quirúrgica no fue observado en otros estudios en los que la DBS se inició inmediatamente post cirugía.
En algunos estudios18,23,25, se observa que, a partir del agotamiento de la batería, o apagados del dispositivo16,20, se comprometen los efectos del DBS, aumentando la sintomatología atenuada previamente. Los beneficios fueron recuperados en cuanto se reinició el dispositivo con los parámetros definidos para cada caso. Considerando que Benedetti-Isaac y Gouveia18,23 reportan este desperfecto a los 4 años postoperatorio, se podría plantear que los mecanismos de remodelación cerebral y neuroplasticidad asociados son insuficientes para otorgar mejoría clínica, y es la acción del DBS el gran aporte del beneficio terapéutico.
Las neuronas hipotalámicas tienen frecuencias de descarga descritas como irregulares, y se dividen en dos subgrupos: uno con un patrón de descarga lenta de 4,5Hz y otro grupo con frecuencias un poco más altas de 16,5-25Hz33,34. Se ha demostrado que impulsos eléctricos de 500μs, 8μA y 200Hz pueden inhibir el disparo de neuronas del hipotálamo posterior durante 8,9 segundos33, cuestión que resulta interesante, pues las configuraciones descritas en los trabajos revisados muestran frecuencias similares utilizadas durante la DBS. Esto nos lleva a pensar que existe un mecanismo inhibitorio, análogo a una lesión, subyacente a la utilización de este método en el tratamiento de la agresividad. Los parámetros de estimulación fueron definidos de acuerdo a la mejoría clínica, siempre tomando en cuenta minimizar efectos deletéreos para los pacientes; por ejemplo, el aumento del tono simpático que limitó la amplitud aplicada en Hernando13.
Las principales limitaciones consisten en el pequeño tamaño de las cohortes, lo que impide generalizar resultados24; además, dadas las particularidades de cada paciente, no fue posible determinar parámetros universales de estimulación. Se plantea la imposibilidad de descartar tajantemente el rol del efecto placebo, ya que para este fin debería practicarse una estimulación simulada, estudio doble ciego y controlado24. No obstante, es improbable debido a la duración de la respuesta clínica y su asociación con el funcionamiento de los electrodos, además de que, en su mayoría, los pacientes presentan algún grado de DI12,13,15,16,20,22–26. En cuanto al presente trabajo, se descartaron estudios debido a la no declaración de parámetros de estimulación, lo cual dificulta delimitar detalladamente el estado del arte respecto a esta técnica quirúrgica y sus efectos adversos derivados de una u otra configuración.
ConclusionesSe observa que la DBS tiene resultados favorables para el tratamiento de agresividad refractaria a tratamiento en pacientes seleccionados. Si bien la mayoría de los estudios utilizaron como objetivo de estimulación el hipotálamo posteromedial, se han sumado casos exitosos de pacientes tratados con estimulación del NAc que permiten posicionarlo como un nuevo blanco terapéutico.
Los parámetros de estimulación deben ser individualizados y determinados por el beneficio clínico que minimice efectos deletéreos para los pacientes. Si bien no ha sido posible generalizar protocolos de estos parámetros, en la mayoría de los casos se utilizaron altas frecuencias [113-250Hz] y anchos de pulso relativamente bajos [60-90Hz]. Aunque se ha propuesto un mecanismo inhibitorio/lesional o de remodelación mediante neuroplasticidad para explicar los efectos antiagresivos de la DBS en el hipotálamo, aún se desconocen los mecanismos neurofisiológicos mediante los cuales opera la DBS, siendo necesarias más investigaciones para esclarecerlos; y, de esta forma, proponer de manera contundente y sistemática parámetros seguros y óptimos para todos los pacientes.
Consideraciones éticasLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
FinanciaciónLa presente investigación no ha recibido financiamiento de agencias del sector público, sector comercial o entidades con o sin ánimo de lucro.
Declaración de conflicto de interésLos autores no declaran ningún conflicto de interés.