Desde la primera descripción de la asociación entre enfermedad renal crónica y enfermedad cardiaca, los estudios epidemiológicos han confirmado y extendido el conocimiento acerca de esta relación. El riesgo de enfermedad cardiovascular se incrementa al progresar la falla renal, probablemente por la suma de los factores de riesgo no tradicionales propios de la insuficiencia renal. No solamente es la patología cardiovascular más frecuente en esta población, sino que además es sub diagnosticada y sub tratada. Los pacientes y los miembros del equipo mèc)dico deben ser educados acerca de este mayor riesgo cardiovascular y de las implicancias que esto tiene en el cuidado.
Since the first description of the association between chronic kidney disease and heart disease, epidemiological studies have confirmed and extended the knowledge about this association. The risk of cardiovascular disease increases with progression of renal failure, probably by the sum of nontraditional risk factors own of renal failure. Not only cardiovascular disease is more common in this population, it is also underdiagnosed and undertreated. Patients and medical staff members should be educated about the increased cardiovascular risk and the implications for the care that entails.
La enfermedad renal crónica (ERC) se clasifica según la disminución de la velocidad de filtración glomerular estimada (VFGe) y el daño renal estructural1. Cabe destacar que puede existir una ERC con VFGe normal, si existe albuminuria. De hecho existen tres categorías de albuminuria definidas (Tabla 1).
CLASIFICACIÓN DE LA ENFERMEDAD RENAL CRÓNICA SEGÚN A) EL NIVEL DE LA VELOCIDAD DE FILTRACIÓN GLOMERULAR ESTIMADA (VFGe) Y SU PREVALENCIA DE LAS DISTINTAS ETAPAS EN LA POBLACIÓN DE EE.UU. (ENCUESTA NHANES) Y B) SEGÚN NIVELES DE ALBUMINURIA
| A | |||
|---|---|---|---|
| ETAPAS | DESCRIPCIÓN | VFGe (ML/MIN/1.73M2) | PREVALENCIA EN EE.UU. (% POBLACIÓN) |
| 1 | Daño renal estructural con una filtración glomerular normal o elevada | 90 ml/min | 3.3% |
| 2 | Daño renal estructural con una filtración glomerular levemente reducida | 60-89 ml/min | 3.0% |
| 3 | Daño renal con una filtración glomerular moderadamente reducida | 30-59 ml/min | 6.2% |
| 4 | Daño renal con una filtración glomerular severamente reducida | 15-29 ml/min | 0.4% |
| 5 | Falla renal | 15 ml/min | 0.1% |
| B | |||
| CATEGORÍAS | TÉRMINOS | ALBUMINURIA EN ORINA DE 24 HORAS | RELACIÓN EN ORINA ALBÚMINA/CREATININA |
| A1 | Normal a levemente elevada | 30 mg | 30 mg/gr |
| A2 | Moderadamente elevada | 30-300 mg | 30-300 mg/gr |
| A3 | Muy elevada (incluye síndrome nefrótico) | 300 mg | 300 mg/gr |
Ref1
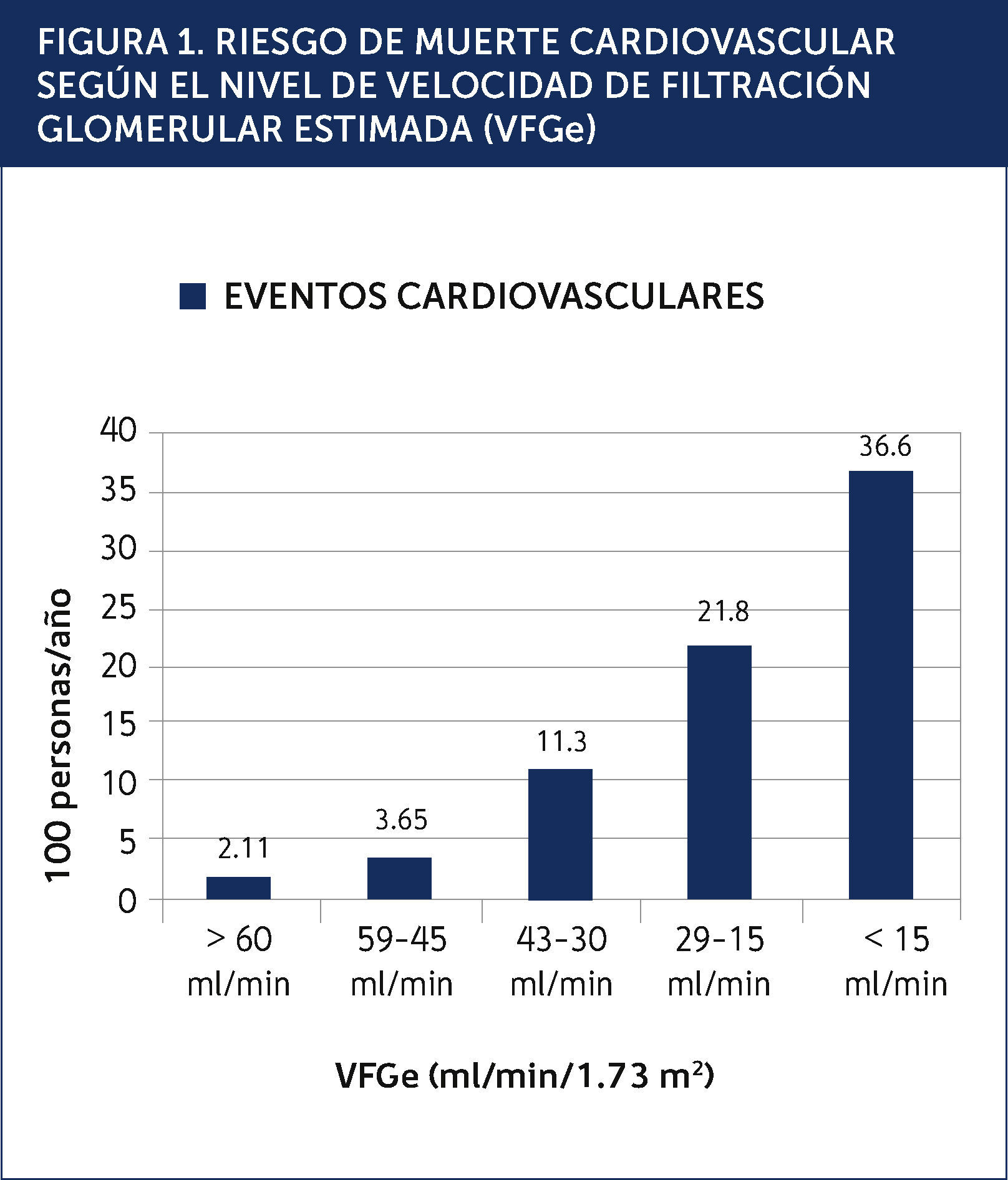
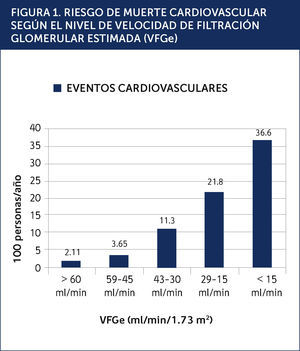
La enfermedad cardiovascular (ECV) es la principal causa de morbilidad y mortalidad en los pacientes con ERC. Este riesgo cardiovascular elevado comienza en etapas iniciales de ERC, antes de que se desarrolle la insuficiencia renal avanzada. La reducción de la VFGe es un predictor independiente, potente y graduado, de morbi-mortalidad cardiovascular y mortalidad de cualquier causa (Figura 1)2. Aún grados leves de disfunción renal, indicados por la albuminuria, aumentan el riesgo cardiovascular, porque reflejan la salud micro vascular, incluyendo la función endotelial3. Existe además una asociación potente entre la albuminuria y los otros factores tradicionales de riesgo cardiovascular4. Es conocido que los pacientes con una ERC etapa 5 tienen una elevada probabilidad de muerte prematura, principalmente debida a complicaciones cardiovasculares. Sin embargo no debemos olvidar que la mayoría de los pacientes con ERC no se encuentra en diálisis. Los pacientes con una VFGe entre 15 y 60ml/min/1.73 m2 tienen una probabilidad de morir mucho mayor a la de progresar a una ERC etapa 5, reflejando la carga de la enfermedad cardiovascular en esta población5. Por este motivo la estrategia más eficaz para reducir la morbi-mortalidad cardiovascular en ERC es apuntar las medidas terapèc)uticas y preventivas a los pacientes con una ERC inicial, antes de que la enfermedad renal progrese a etapas más avanzadas. Al igual que en la enfermedad vascular oclusiva ateromatosa, los pacientes con ERC tienen una vasculopatía generalizada, con otras características asociadas como hipertrofia ventricular izquierda (HVI), calcificaciones vasculares y rigidez arterial. En la ERC existen factores de riesgo específicos a esta población, que operan en suma con los factores de riesgo tradicionales. Desafortunadamente los pacientes con ERC son excluidos de los grandes estudios de ECV, o la función renal no es bien descrita, lo que impide aplicar en forma correcta las terapias basadas en la evidencia y fomenta cierto nihilismo terapèc)utico en los mèc)dicos que tratan a esta población6.
RIESGO DE MUERTE CARDIOVASCULAR SEGÚN EL NIVEL DE VELOCIDAD DE FILTRACIÓN GLOMERULAR ESTIMADA (VFGe).
Ref1
Esta monografía pretende describir la epidemiología, fisiopatología, elementos clínicos y diagnósticos relevantes y finalmente aspectos terapèc)uticos y preventivos de la patología cardiovascular en esta población.
EPIDEMIOLOGÍAPrevalencia de las complicaciones cardiovasculares en ERC:La interpretación de los estudios epidemiológicos en ERC es problemática, debido a la dificultad en definir la causa de muerte, la menor especificidad de los síntomas (Ej. angina) y la distinta patogenia de la muerte súbita entre otros factores. Se estima que la mortalidad cardiovascular es dos veces superior en sujetos con ERC etapa 3 (VFGe entre 30 y 60ml/min) y tres veces superior en etapa 4 (VFGe entre 15 y 30ml/min), en comparación con la población con función renal normal. En el caso de la albuminuria, no existe un umbral que prediga un mayor riesgo cardiovascular, ya que la curva es lineal desde valores en el rango normal. Una amplia variedad de complicaciones cardiovasculares específicas se asocian al deterioro de la función renal. El riesgo de insuficiencia cardiaca es el doble cuando la VFGe es de 60ml/min, así de igual forma aumentan el riesgo de cardiopatía coronaria, fibrilación auricular, accidente vascular encefálico y enfermedad vascular perifèc)rica. Este riesgo elevado es independiente de la edad, la etnia y el sexo de los sujetos. Inicialmente se pensaba que este riesgo cardiovascular aumentado se debía a que la ERC era causada principalmente por hipertensión arterial y diabetes mellitus. Sin embargo los meta-análisis demostraron que la VFGe reducida y la albuminuria son factores de riesgo independientes de la hipertensión y la diabetes. La prevalencia de hipertensión arterial (HTA) aumenta al caer la VFGe, estimándose que el 80% de los pacientes con ERC etapa 5 son hipertensos y el 75% tiene una HVI. Los factores que contribuyen a la HVI son la HTA, la anemia, la rigidez arterial y la hipervolemia. Los episodios de insuficiencia cardiaca congestiva son frecuentes y se asocian a una disfunción diastólica más que sistólica y a congestión circulatoria. Aunque la cardiopatía coronaria es frecuente en estos pacientes, causa solamente un 13% de las muertes en pacientes con ERC etapa 5, siendo el 69% de las muertes cardiovasculares atribuidas a episodios de arritmia7. La fibrilación auricular “de novo” aparece en los pacientes ancianos en diálisis a una tasa de 15% por año, con una mortalidad de 59% en el primer año post episodio8.
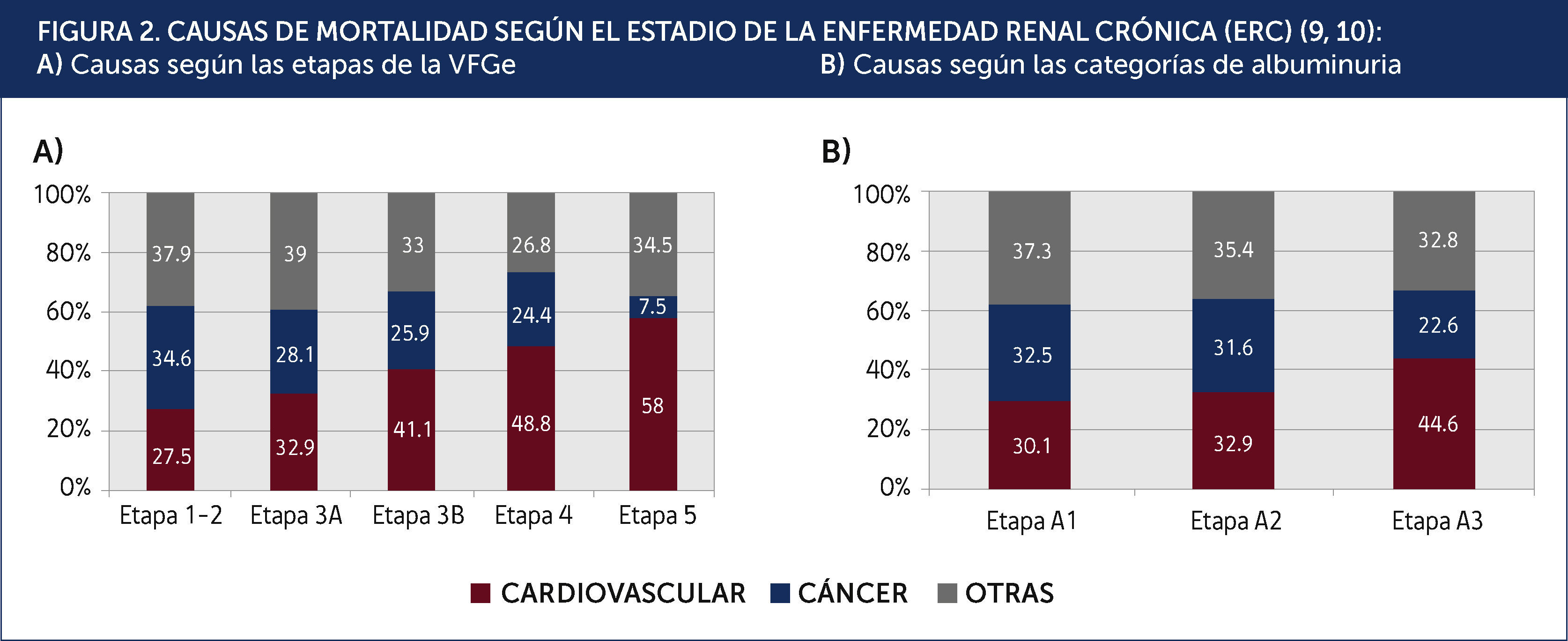
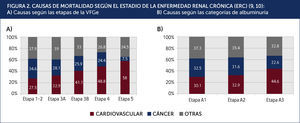
Carga de enfermedad cardiovascular:Los estudios epidemiológicos hechos en Taiwán y Canadá mostraron una significativa menor expectativa de vida en los pacientes con ERC9,10. Por ejemplo, un sujeto de 30 años, con una ERC etapa 3 o 4, tiene una menor expectativa de vida de entre 17 a 25 años, comparado con sujetos con una función renal normal. De la misma forma, un sujeto de 30 años con albuminuria entre 30-300mg/día o 300mg/día tiene una menor expectativa de vida entre 10 a 18 años, comparado con un sujeto sin albuminuria. La principal causa de muerte es cardiovascular y esta proporción aumenta al caer la VFGe (Figura 2). Los estudios citados evidencian que entre el 60 a 70% de las muertes son por causa cardiovascular en sujetos con una VFGe reducida, comparado al 22-28% cuando la función renal es normal. Es importante destacar que en pacientes con una VFGe reducida en forma moderada (etapa 3), el riesgo de muerte cardiovascular es mayor al de progresar a la insuficiencia renal terminal. Solo cuando la VFG es 30ml/min (etapa 4) estos riesgos se equiparan. Estos datos indican que la verdadera carga de enfermedad en pacientes con ERC está relacionada con el aumento del riesgo de enfermedad cardiovascular y no con el riesgo de llegar a la insuficiencia renal que requiera de una terapia de reemplazo renal.
CAUSAS DE MORTALIDAD SEGÚN EL ESTADIO DE LA ENFERMEDAD RENAL CRÓNICA (ERC)9,10: A) Causas según las etapas de la VFGe B) Causas según las categorías de albuminuria.
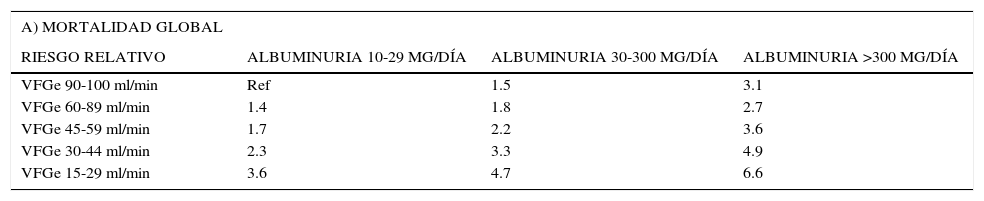
El propósito de una escala de predicción de riesgo CV es identificar una población de alto riesgo CV, que se beneficie de intervenciones preventivas. La tradicional escala de predicción de Framingham no es precisa en estos pacientes, ya que subestima el riesgo de ECV en esta población. Las guías clínicas (KDIGO) basadas en meta-análisis colaborativos han desarrollado una escala de riesgo cardiovascular estratificada según VFGe y albuminuria (Tabla 2)1.
RIESGOS RELATIVOS DE MORTALIDAD GLOBAL (A) Y CARDIOVASCULAR (B) BASADOS EN LA VELOCIDAD DE FILTRACIÓN GLOMERULAR ESTIMADA (VFGe) Y LA ALBUMINURIA1
| A) MORTALIDAD GLOBAL | |||
|---|---|---|---|
| RIESGO RELATIVO | ALBUMINURIA 10-29 MG/DÍA | ALBUMINURIA 30-300 MG/DÍA | ALBUMINURIA >300 MG/DÍA |
| VFGe 90-100 ml/min | Ref | 1.5 | 3.1 |
| VFGe 60-89 ml/min | 1.4 | 1.8 | 2.7 |
| VFGe 45-59 ml/min | 1.7 | 2.2 | 3.6 |
| VFGe 30-44 ml/min | 2.3 | 3.3 | 4.9 |
| VFGe 15-29 ml/min | 3.6 | 4.7 | 6.6 |
| B) MORTALIDAD CARDIOVASCULAR | |||
| RIESGO RELATIVO | ALBUMINURIA 10-29 MG/DÍA | ALBUMINURIA 30-300 MG/DÍA | ALBUMINURIA >300 MG/DÍA |
| VFGe 90-100 ml/min | Ref | 1.6 | 3.7 |
| VFGe 60-89 ml/min | 1.4 | 2.0 | 4.1 |
| VFGe 45-59 ml/min | 2.2 | 2.8 | 4.3 |
| VFGe 30-44 ml/min | 2.7 | 3.4 | 5.2 |
| VFGe 15-29 ml/min | 7.9 | 4.8 | 8.1 |
Ref1
El concepto de “epidemiología reversa” se basa en la observación paradójica de que la asociación entre los factores tradicionales (hipercolesterolemia, hipertensión y obesidad) con el pronóstico, incluida mortalidad cardiovascular, no existe o puede ser incluso opuesta en la población con ERC11. Sin embargo, este es un mal tèc)rmino y se prefiere el de “epidemiología confundida”, ya que no se debe confundir causalidad con asociación. Se piensa que este fenómeno epidemiológico se puede explicar por la subpoblación de pacientes con inflamación y/o desnutrición, que presentan un mal pronóstico de sobrevida.
TIPOS DE ENFERMEDAD CARDIOVASCULARLa enfermedad cardiovascular en esta población tiene una variedad de expresiones clínicas, como la arterioesclerosis, la miocardiopatía y las valvulopatías, entre otras. Las manifestaciones clínicas en estos pacientes son muchas veces una interacción de estas distintas patologías cardiovasculares. Podemos dividir estas patologías en dos: el compromiso arterial y el compromiso cardiaco. El compromiso arterial se caracteriza por aumento del grosor de la pared arterial, rigidez arterial, disfunción endotelial y calcificación arterial. Las alteraciones cardiacas son las siguientes: alteraciones estructurales cardiacas (cambios en la geometría del ventrículo izquierdo), alteraciones ultraestructurales, cambios en la función del ventrículo izquierdo, enfermedad valvular y defectos en la conducción. Cabe destacar la diferencia entre la ateroesclerosis y la arteriosclerosis. La ateroesclerosis es una enfermedad oclusiva de la vasculatura, que ocurre por la formación de placas ricas en lípidos en la capa íntima, con o sin calcificación. La arteriosclerosis es un remodelamiento no oclusivo de la vasculatura, con pèc)rdida de las propiedades elásticas de la arteria. Ambas condiciones pueden manifestarse por cardiopatía isquèc)mica e insuficiencia cardiaca. Los pacientes con ERC desarrollan ambos tipos de daño arterial.
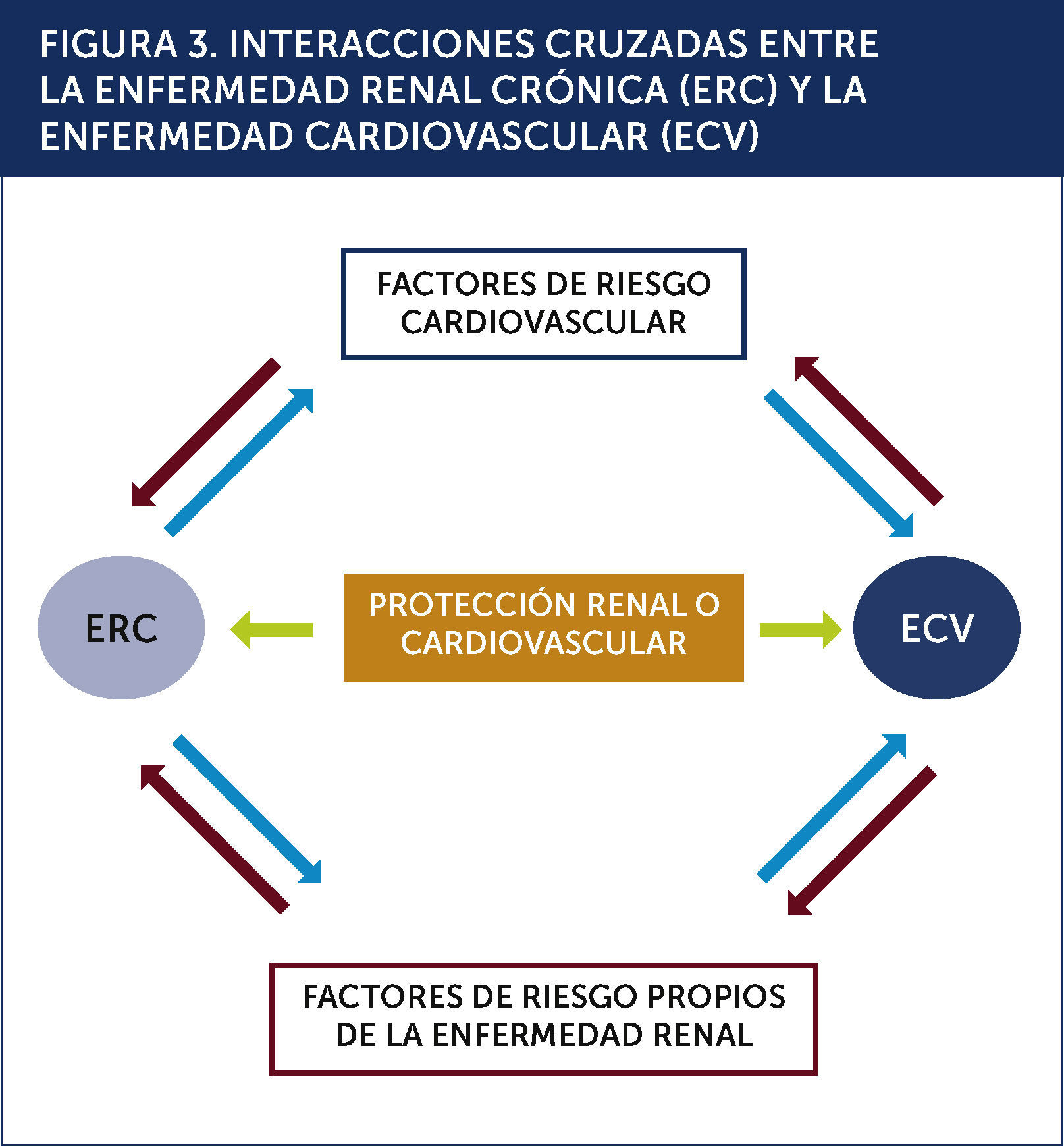
ETIOLOGÍA Y FACTORES DE RIESGOLos factores de riesgo tradicionales son los principales causantes de la mortalidad cardiovascular en pacientes ancianos con ERC etapa 2 o 3. En pacientes con ERC etapa 4 se suman factores de riesgo cardiovasculares específicos y relacionados a la uremia. A su vez los factores de riesgo tradicionales pueden causar y/o acelerar la progresión de la ERC. La relación de estos factores causa múltiples interacciones entre la ERC y la ECV, así como con los factores de protección cardiovascular (Figura 3).
1) Factores de riesgo tradicionales:Edad, sexo y tabacoLa edad promedio de inicio de la diálisis en USA es de 63 años, cuando la ECV es frecuente. El aumento de la mortalidad cardiovascular depende de la reducción de la VFGe y la presencia de albuminuria, factores que fueron independientes de la edad. Cabe destacar que el tabaco aumenta un 52% el riesgo de muerte en los pacientes en diálisis, así como los riesgos de insuficiencia cardiaca y enfermedad vascular oclusiva12.
Diabetes Mellitus (DM):La diabetes es la causa principal (40-45% de los casos) de ERC etapa 5 en EE.UU. y Chile. La mayoría de estos pacientes presenta múltiples factores de riesgo cardiovascular y una elevada mortalidad. En la población de dializados la DM es un factor de riesgo independiente de cardiopatía coronaria, insuficiencia cardiaca y mortalidad global. En etapas iniciales de ERC, la diabetes es tambièc)n un factor de riesgo CV y además de riesgo de albuminuria y deterioro de la función renal.
Hipertensión arterial (HTA):A pesar de que la HTA es muy frecuente en ERC (80% en etapas 3-4), solamente una minoría de los sujetos es consciente de ella y logra un control adecuado de las cifras de presión arterial. Los estudios clínicos se han centrado más en retardar la progresión de la ERC y menos en reducir las complicaciones cardiovasculares. Cabe destacar que la progresión de la ERC por una HTA no bien controlada acarreará el consiguiente mayor riesgo CV al disminuir la VFGe y aumentar la albuminuria. La HTA sistólica aislada con una presión de pulso elevada es el fenotipo más común de la población en diálisis, relacionado con la esclerosis de la capa media y la consecuente rigidez arterial. Estas alteraciones se acompañan de disfunción progresiva del ventrículo izquierdo, insuficiencia cardiaca congestiva, reducción de la presión arterial diastólica y mayor mortalidad CV. En los pacientes en diálisis, la relación entre la presión arterial y mortalidad es una curva en forma de U. El riesgo de eventos y mortalidad CV aumentan cuando la presión arterial sistólica es 180mmHg y tambièc)n cuando es 110mmHg. En el rango entre estas dos cifras no existen diferencias pronosticas, a diferencia de la población general. Existen varias explicaciones posibles a esta observación: la presión arterial sistólica en rango bajo identifica pacientes con miocardiopatía, insuficiencia cardiaca y desnutrición o se asocia a mayor probabilidad de eventos de hipotensión durante la sesión de diálisis y el consecuente riesgo de isquemia. La presión arterial media y diastólica bajas predicen un mayor riesgo de mortalidad temprana, mientras que la HTA sistólica y la presión de pulso elevada representan un mayor riesgo a mediano y largo plazo. Un riesgo oculto de la HTA en la ERC es la alta frecuencia de pacientes sin “dip” nocturno, especialmente cuando se asocia a la apnea obstructiva del sueño (SAHOS).
Hipertrofia ventricular izquierda (HVI):La HVI es frecuente en la ERC, con una prevalencia de un 30% en etapa 3 hasta un 70% en etapa 513. Tienen un papel fundamental en el desarrollo de la hipertrofia ventricular izquierda, que conduce a una reserva coronaria reducida, además de la hipertensión arterial, la anemia renal y el aumento de la rigidez vascular. Esto último podría agravarse por la reducción de la densidad de los capilares cardíacos y la deficiente respuesta vasodilatadora coronaria en la ERC. La expresión de la óxido nítrico sintetasa endotelial está inhibida, lo que sugiere un posible mecanismo para explicar la disfunción endotelial coronaria en las primeras etapas de la ERC. Histológicamente, la hipertrofia ventricular izquierda en la ERC se caracteriza por fibrosis miocárdica, que se piensa afecta la contractilidad. La alta prevalencia de hipertrofia ventricular izquierda, con su riesgo asociado de alteraciones del ritmo cardíaco, podría explicar en parte por quèc) la prevalencia de muerte súbita cardíaca es mayor en estos pacientes.
Dislipidemia:En los sujetos con ERC la relación entre hipercolesterolemia y ECV es más dèc)bil, porque algunas alteraciones cardiovasculares mayores, como la miocardiopatía y la arterioesclerosis, son menos dependientes de la dislipidemia que de otros factores propios de la ERC. Paradójicamente en los dializados los niveles bajos de colesterol se asocian a un peor pronóstico, explicado por la inflamación y desnutrición de estos sujetos. Esto se evidencia al ajustar la curva de mortalidad por los niveles de proteína C reactiva (PCR): se observa que los dializados sin inflamación tienen una curva de colesterol-mortalidad similar a la población general. La ERC se acompaña de alteraciones de los lípidos sanguíneos, adquiriendo los pacientes un perfil más aterogèc)nico (Tabla 3). El colesterol HDL además de estar reducido, en el medio urèc)mico sufre cambios moleculares que lo hacen perder su acción anti-inflamatoria.
ANORMALIDADES LIPÍDICAS EN LAS DI STINTAS PRESENTACIONES DE LA ENFERMEDA D RENAL CRÓNICA
| ESTADIO DE LA ENFERMEDAD RENAL | Colesterol total | HDL | LDL | Triglicèc)ridos |
|---|---|---|---|---|
| Sd. nefrótico | ↧↧↧ | ↢ | ↧↧ | ↧ |
| ERC etapa 3-4 | sin cambio | ↢ | sin cambio | ↧ ↧ |
| Hemodiálisis | sin cambio | ↢ | sin cambio | ↧ ↧ |
| Peritoneodiálisis | ↧ | ↢ | ↧ | ↧ |
| Trasplante | ↧↧ | sin cambio | ↧ | ↧ |
Los pacientes con ERC presentan con mucha frecuencia las características del síndrome metabólico (dislipidemia, HTA, disfunción endotelial). La resistencia a la insulina es un factor demostrado de riesgo cardiovascular en pacientes dializados, pero su contribución en la ERC pre diálisis es incierta.
2) Factores de riesgo no tradicionales:Varios estudios poblacionales han mostrado que la ERC, aún en grados leves, es un factor de riesgo independiente de ECV, y similar en magnitud a la HTA o DM14,15. El ambiente urèc)mico puede afectar tanto la calidad como la cantidad de las placas ateroescleróticas. Las lesiones coronarias en pacientes nefrópatas, comparadas con los controles sin enfermedad renal, se caracterizan por aumento de la capa media, infiltración y activación de los macrófagos y marcada calcificación vascular. Los mecanismos por los cuales esto se produce se desconocen, sin embrago es posible relacionarlo a factores no tradicionales presentes en la falla renal, como el estrèc)s oxidativo, inflamación, calcificación vascular y productos avanzados de glicosilación. Por otra parte, cabe destacar que el riñón normal produce sustancias anti-aterogèc)nicas, como la renalasa, que regula la presión arterial y la función cardiaca.
Estrèc)s oxidativo:El estrèc)s oxidativo ha sido propuesto como un mecanismo que unifica los factores de riesgo tradicionales con los propios de la ERC16. La producción aumentada de especies reactivas del oxígeno en la pared vascular, es una característica distintiva de la ateroesclerosis. La ERC, especialmente en etapas avanzadas, es un estado pro-oxidativo, por la menor actividad de los sistemas antioxidantes y la mayor actividad de las vías pro-oxidantes. Se describen varias potenciales vías de estrèc)s oxidativo en la ERC: desnutrición, productos bacterianos en el líquido de diálisis, interacción con la membrana de diálisis y pèc)rdida de antioxidantes. Esta combinación de mayor estrèc)s oxidativo y menor actividad anti-oxidante hace a esta población especialmente vulnerable a las secuelas del daño oxidativo.
Inflamación:Los pacientes en diálisis mantienen un estado de inflamación crónica. Los biomarcadores clásicos de inflamación, como PCR o IL-6 elevadas, son predictores de mortalidad en estos pacientes. Al igual que en la población general, se desconoce si la respuesta de fase aguda refleja solamente una enfermedad ateroesclerótica ya establecida o se relaciona a la iniciación y progresión de la ateroesclerosis. Algunos de los biomarcadores descritos, como IL-6 y TNF, tienen propiedades pro-aterogèc)nicas.
Óxido nítrico y disfunción endotelial:La disfunción endotelial es una característica prominente de la ERC y los biomarcadores de esta se asocian a mayor mortalidad en esta población. Las razones para esta disfunción son varias: estrèc)s oxidativo, inflamación, elevación de ADMA, hipertensión, dislipidemia e hiperglicemia. La producción adecuada de óxido nítrico (NO) es vital para mantener la regulación vascular local y la función endotelial. En sujetos con ERC la producción de NO está reducida, en parte por la inhibición de la óxido nítrico sintetasa (NOS) causada por los niveles elevados de la dimetilarginina asimèc)trica (ADMA). Este aumento en los niveles de ADMA se debe a una menor actividad de la enzima que la degrada cuando existe falla renal17. El aumento del ADMA inhibe la producción de óxido nítrico, reduce el gasto cardiaco, aumenta la resistencia vascular perifèc)rica, aumenta la proteinuria y la presión arterial sistèc)mica y glomerular. Estas alteraciones llevan a su vez a mayor falla renal y menor biodisponibilidad de NO, formándose un círculo vicioso de gran relevancia fisiopatológica. Cabe destacar que además los pacientes nefrópatas poseen menor capacidad de reparación endotelial, al tener menor número o función de las cèc)lulas progenitoras endoteliales en la medula ósea.
Anemia:En la ERC, la anemia es una causa principal de HVI y dilatación del ventrículo izquierdo. Aunque la corrección de la anemia con el uso de eritropoyetina ayuda a la regresión de la HVI, la normalización de la hemoglobina con estos agentes puede asociarse a mayor riesgo cardiovascular.
Hiperparatiroidismo 2° y metabolismo mineral:Las alteraciones en el metabolismo del calcio y fósforo, producidas ya desde la etapa 3 de ERC, aceleran la ateroesclerosis calcificante de estos sujetos. Los niveles elevados de fosfemia se asocian a mayor riesgo de mortalidad en forma mucho más significativa que los niveles de calcio u hormona paratiroidea18. Cabe destacar, que al igual que ocurre con otros factores de riesgo no tradicionales, los estudios no han logrado mostrar causalidad.
Calcificaciones vasculares:La calcificación arterial, especialmente de la túnica media, es mucho más común en sujetos con ERC que en la población general. Las calcificaciones vasculares pueden afectar cualquier estructura del árbol vascular. La calcificación de la túnica media arterial causa rigidez y aumento de la presión de pulso. En los pacientes en diálisis, la calcificación valvular afecta preferentemente a las válvulas aorta y mitral. La calcificación arterial puede ser extensa y precoz en esta población19. Los factores fisiopatológicos relacionados a estas calcificaciones no han sido dilucidados en los estudios clínicos, pero probablemente incluyen una menor actividad de factores inhibidores de calcificación (Ej. Fetuina-A, proteína de matriz Gla), aumento de promotores (Ej. Hiperfosfemia), producto calcio x fósforo elevado, hormona paratiroidea y leptina.
Productos avanzados de glicosilación:Los productos avanzados de glicosilación se acumulan en falla renal por estrèc)s oxidativo, glicosilación no enzimática y menor aclaramiento de sus precursores. Son responsables del estrèc)s oxidativo, inflamatorio y metabólico. Se desconoce si su inhibición pudiera reducir los eventos cardiovasculares, progresión o mortalidad en ERC.
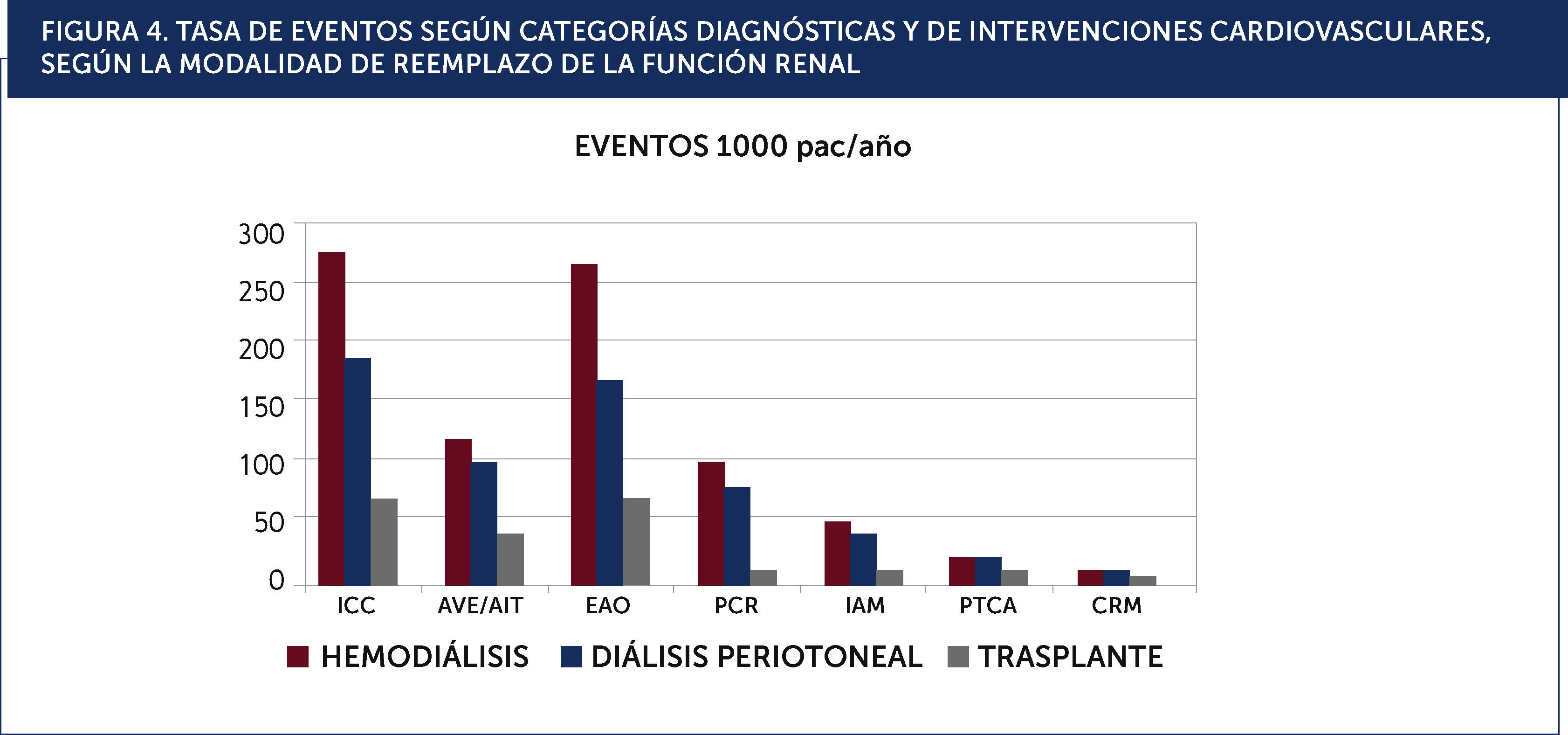
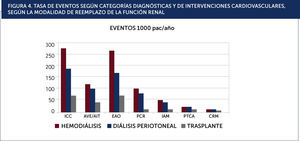
Modalidad de diálisisSe desconoce si existe una real diferencia en el pronóstico cardiovascular entre las modalidades de diálisis (hemodiálisis vs. peritoneo diálisis)20. En la Figura 4 se grafican la frecuencia de las distintas presentaciones clínicas, los estudios diagnósticos y las intervenciones terapèc)uticas según las distintas modalidades de tratamiento de la ERC avanzada (hemodiálisis, peritoneo-diálisis y trasplante).
TASA DE EVENTOS SEGÚN CATEGORÍAS DIAGNÓSTICAS Y DE INTERVENCIONES CARDIOVASCULARES, SEGÚN LA MODALIDAD DE REEMPLAZO DE LA FUNCIÓN RENAL.ICC: insuficiencia cardiaca congestiva, AVE/AIT: accidente vascular encefálico y accidente isquèc)mico transitorio, EAO: enfermedad arterial oclusiva, PCR: paro cardiaco, IAM: infarto agudo al miocardio, PTCA: angioplastia coronaria percutánea, CRM: cirugía de revascularización miocárdica.
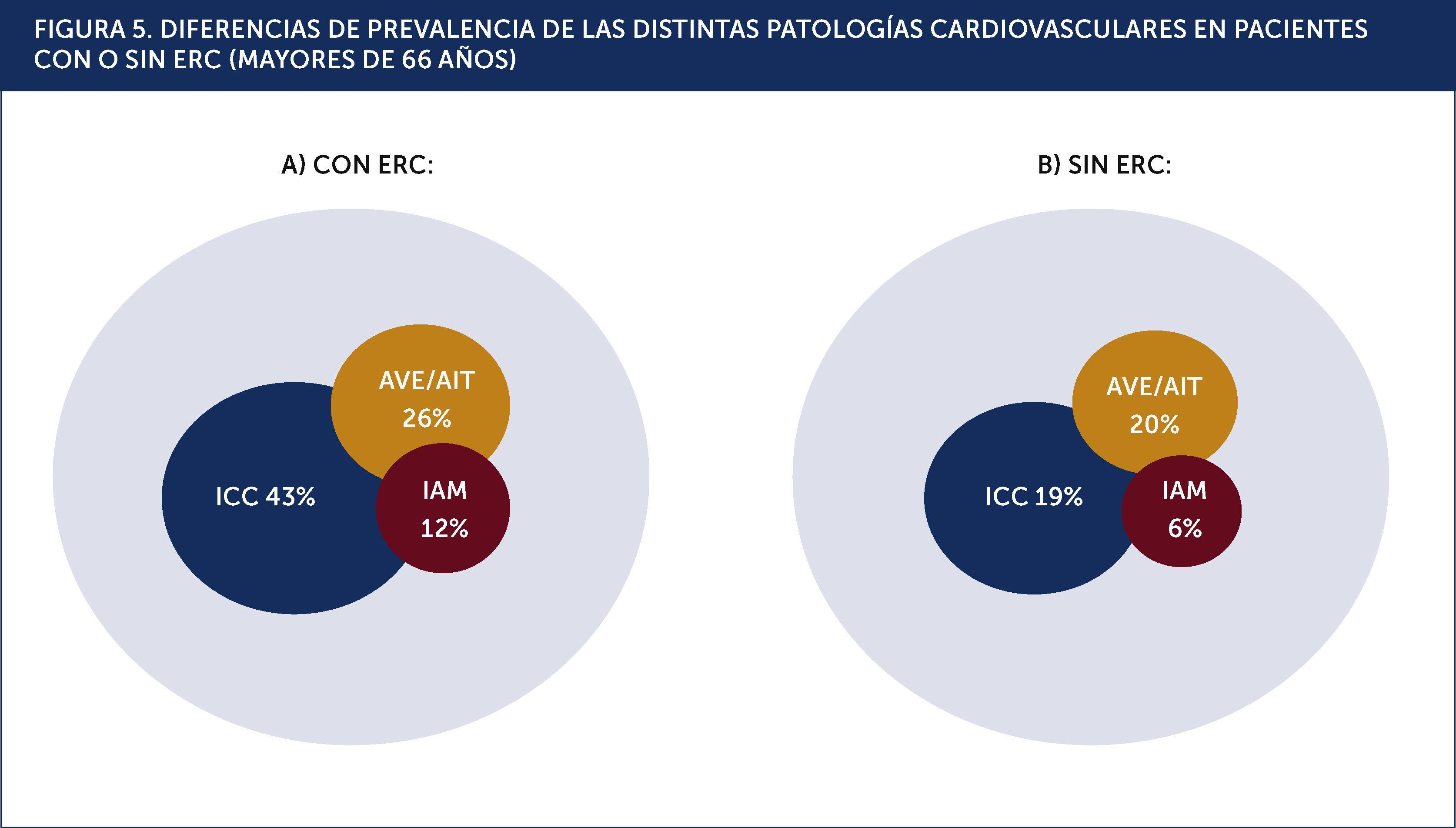
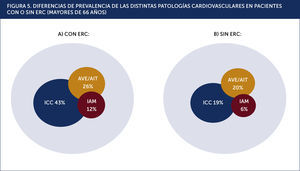
En la Figura 5 podemos apreciar la elevada frecuencia de las complicaciones cardiovasculares principales, en los pacientes adultos mayores, con y sin ERC.
El pronóstico de un paciente con ERC, especialmente en diálisis, que sufre un infarto es mucho peor que en la población general. Se plantea que esto se debe a un sub-diagnóstico, por las presentaciones clínicas atípicas, y el menor uso de exámenes diagnósticos e intervenciones terapèc)uticas, por el temor a los efectos adversos en esta población. Un estudio colaborativo de infarto miocárdico en pacientes en diálisis demostró: mayor probabilidad de un diagnóstico incorrecto de su síndrome coronario agudo, menor prevalencia de dolor torácico, menor frecuencia de elevación del segmento ST, menor probabilidad de ser elegidos y de recibir terapias de reperfusión coronaria y mayor posibilidad de muerte intrahospitalaria, especialmente de muerte súbita21. Estos hallazgos son similares en etapas más leves de la ERC y se correlacionan al nivel de la VFGe.
Los clínicos deben ser plenamente conscientes de las presentaciones atípicas del síndrome coronario agudo en pacientes con ERC, para evitar el sub-diagnóstico de eventos cardiovasculares potencialmente mortales. Esta consideración es especialmente relevante, ya que los pacientes con estadios 3-5 de ERC tienen tasas notablemente superiores y un peor pronóstico, que los individuos sin ERC, derivado de las comorbilidades, de los trastornos de conducción y de los infartos anteriores.
Enfermedad arterial oclusiva:Se estima que un 25% de los pacientes con ERC etapa 3-4 y un 50% de los dializados tienen una enfermedad arterial oclusiva. El riesgo de enfermedad arterial perifèc)rica en dializados, es mayor en pacientes diabèc)ticos y con enfermedad ateroesclerótica preexistente. Se relaciona al tiempo en diálisis, hipoalbuminemia, nivel bajo de hormona paratiroidea y presión arterial diastólica pre-diálisis baja. Existen al igual que en el infarto miocárdico un sub diagnóstico y tratamiento22. Esta población tiene un alto riesgo de amputaciones, llegando a un 13% de los pacientes incidentes en diálisis. No existen estudios clínicos randomizados en esta población, por lo que las decisiones acerca del estudio y tratamiento deben ser individualizadas y efectuadas por un equipo multidisciplinario.
Enfermedad cerebrovascular y fibrilación auricular:Las alteraciones cognitivas son muy frecuentes en la ERC, y se estima que su prevalencia aumenta 10% cada 10ml de filtración que cae la VFGe por debajo de los 60ml/min23. Los pacientes en diálisis tienen un riesgo, ajustado por edad, 6 veces superior de accidente vascular encefálico (AVE) que la población general.
La tasa de hospitalización es de 48/1000 pacientes/año, siendo el 11% de estas por accidentes vasculares encefálicos de tipo hemorrágico. Este riesgo es especialmente elevado durante los primeros 12 meses de iniciada la diálisis24. La fibrilación auricular (FA) es la arritmia más frecuente en pacientes con ERC. Su prevalencia llega al 15-20% en los pacientes dializados y se asocia a una alta tasa de accidente vascular encefálico. La incidencia de FA es alta en pacientes adultos mayores que inician diálisis. Los pacientes con FA y ERC etapa 3 tratados con warfarina tienen un menor riesgo de embolia y accidente vascular isquèc)mico. En cambio, la prevención primaria de AVE con warfarina en pacientes con ERC etapa 5 y FA es controversial, dado los estudios observacionales que han sugerido daño25. Si está indicada en estos pacientes la prevención secundaria de AVE con warfarina.
Remodelamiento e hipertrofia ventricular izquierda (HVI):La HVI es un factor de riesgo potente de mortalidad en ERC etapa 5, dado que se asocia a un mayor riesgo de muerte súbita (60%) y de AVE (2 veces). Esta HVI se produce en etapas iniciales de la ERC. La hipertensión y rigidez arterial causan HVI concèc)ntrica y la sobrecarga de volumen causa HVI excèc)ntrica. La dilatación ventricular es de muy mal pronóstico y se relaciona a una HVI severa, daño isquèc)mico difuso, sobrecarga de volumen recurrente y en ocasiones a una fistula arterio-venosa hiperdinámica. El tèc)rmino de “miocardiopatía urèc)mica” es equívoco y es mejor el de “miocardiopatía de la ERC avanzada”. Esto porque los estudios han mostrado que la HVI es frecuente aún en pacientes con ERC pre-diálisis (etapas 3 y 4)26. El inicio de la hemodiálisis se puede acompañar de injurias miocárdicas repetidas, que se traducen en una reducción global o segmentaria de la función ventricular. Este “atontamiento” miocárdico se puede producir aún en pacientes pediátricos, los que nos demuestra que no se requiere de la obstrucción de las arterias coronarias principales para que se produzca esta complicación.
Sobrecarga de volumen:La hipervolemia persistente de estos sujetos causa hipertensión arterial, HVI, dilatación ventricular, congestión y edema pulmonar agudo, entre otras complicaciones27. Aunque tambièc)n puede ser asintomática. Cuando el paciente logra alcanzar su “peso seco”, estas complicaciones disminuyen, aunque puede existir un periodo de desfase antes de la mejoría, llamado fase de latencia.
Pericarditis:La pericarditis asociada a un síndrome urèc)mico no tratado es rara en la actualidad y responde al inicio de la diálisis. La pericarditis asociada a diálisis se relaciona a enfermedades intercurrentes (Ej. infecciones virales), sub-diálisis (Ej. acceso vascular disfuncional) y enfermedades sistèc)micas (Ej. Lupus eritematoso). Las manifestaciones clínicas pueden ser variadas: dolor torácico, fiebre, tos, frotes pericárdicos, cardiomegalia en la radiografía de tórax e inestabilidad hemodinámica durante la sesión de diálisis. Por otro lado, las alteraciones elèc)ctricas son menos prevalentes dado que la inflamación epicárdica es mínima o ausente. La sospecha clínica debe motivar la realización urgente de un ecocardiograma. En caso de derrames que causen compromiso hemodinámico (taponamiento) o sean de gran magnitud, se indica la punción pericárdica o el drenaje quirúrgico. La hemodiálisis intensiva es útil en casos de pericarditis urèc)mica o sub-diálisis28.
Cardiopatía valvular y endocarditis infecciosa:La tasa de progresión de la estenosis cálcica de la válvula aórtica es 3 veces superior en los dializados comparados con la población general29. Aunque la prevalencia global es similar a la población general, la cardiopatía valvular ocurre 10 a 20 años antes. El seguimiento ecocardiográfico debe ser anual en aquellos pacientes en diálisis que sean asintomáticos, pero con un área valvular a 1cm2. Las manifestaciones clínicas son angina, hipotensión en diálisis, insuficiencia cardiaca y sincope. Si bien la cirugía valvular es de alto riesgo en esta población, el pronóstico es mucho peor si una cirugía indicada no se realiza o si se hace de emergencia. El reemplazo valvular en dializados ya sea con válvulas mecánicas o biológicas, no ofrece diferencias en cuanto a sobrevida30.
La presencia de catèc)teres para hemodiálisis, sean temporales o semi-permanentes, es una fuente de infección, con bacteremias y endocarditis secundarias. La mayoría de las endocarditis en diálisis son causadas por bacterias gram positivas, especialmente estafilococo aureus. La válvulas más afectadas son primero la mitral y luego la válvula aórtica. A pesar de la terapia, el pronóstico de un paciente en diálisis con endocarditis es malo, por una alta mortalidad intrahospitalaria y una baja sobrevida a un año. Las indicaciones de cirugía son las mismas a las de la población general.
Muerte súbita:Los registros de diálisis muestran que un 25% de todas las muertes y 2/3 de las muertes cardiovasculares son atribuibles a arritmias. A diferencia de la población general estas muertes súbitas no se asocian a la cardiopatía coronaria como factor principal. Esto queda demostrado al observar el nulo efecto de las estatinas y el menor efecto de la revascularización miocárdica en reducir esta complicación. Los factores que probablemente influyen en ERC son: la HVI, las variaciones rápidas en los niveles de electrolitos (especialmente la hipokalemia), disfunción autonómica e hiperactividad simpática, apnea del sueño y las alteraciones miocárdicas estructurales y funcionales (disfunción endotelial, fibrosis intersticial, menor reserva de perfusión y reducida tolerancia a la isquemia)31. Un factor modificable asociado a este mayor riesgo es un potasio a 2.0 meq/L en el baño de hemodiálisis. Cabe destacar sin embargo que los pacientes en diálisis peritoneal tienen una prevalencia similar a los en hemodiálisis. La fracción de eyección reducida (50%) es otro factor relevante. Un estudio de paro cardiaco en centros de hemodiálisis demostró que el ritmo predomínate era la fibrilación ventricular (66%), luego la actividad elèc)ctrica sin pulso (23%) y tercero la asistolia (10%)32. Esta complicación es tambièc)n frecuente en etapas menores de ERC (3 y 4), pero en una magnitud mucho menor que en los dializados. El rol de los desfibriladores implantables en reducir la mortalidad en esta población es controversial, especialmente en la prevención primaria de muerte súbita en el grupo con una fracción de eyección menor de 35%. La ERC puede atenuar los efectos favorables en la sobrevida de estos dispositivos. Sin embargo no se debe excluir “a priori” a estos pacientes de recibir un desfibrilador solo por su edad avanzada o las comorbilidades asociadas33.
DIAGNÓSTICO Y DIAGNÓSTICO DIFERENCIALMedición de la presión arterial:El diagnóstico de hipertensión arterial en los pacientes en hemodiálisis no debe basarse solamente en las presiones arteriales pre y post procedimiento. Está descrito que la presión arterial sistólica (PAS) pre diálisis sobrestima la PAS inter-diálisis en 10mmHg y la PAS post diálisis subestima la PAS inter-diálisis en 7mmHg. El monitoreo ambulatorio de presión arterial (MAPA) está indicado en aquellos sujetos con sospecha de un mal control de su hipertensión arterial (Ej. ganancia de peso significativa inter-diálisis) y en el diagnóstico de la hipertensión nocturna. Además nos permite conocer la carga de presiones sistólicas, que se relacionan con el desarrollo de HVI. Otra alternativa en estos pacientes es el control domiciliario de su presión arterial, que tambièc)n ha demostrado su valor como mèc)todo diagnóstico y en estimar pronóstico.
Electrocardiograma y ecocardiograma:El electrocardiograma es útil, ya que la pesquisa de sujetos que no están en ritmo sinusal nos permite identificar un grupo de mayor riesgo de mortalidad y morbilidad (ejemplo AVE). La mayor duración del QRS se asocia tambièc)n a mayor tasa de complicaciones cardiovasculares. Los hallazgos electrocardiográficos en los síndromes coronarios agudos pueden ser menos específicos y de menor sensibilidad en pacientes con ERC, comparados con sujetos con función renal normal34. Los resultados electrocardiográficos dudosos deben conducir a un elevado nivel de sospecha de un síndrome coronario agudo y motivar el uso de otros procedimientos diagnósticos.
Se recomienda realizar un ecocardiograma en todos los pacientes que ingresan a diálisis luego de que logran su “peso seco”, en promedio de 1 a 3 meses de iniciada la terapia. Luego debe repetirse cada 3 años al menos. En estos pacientes la historia clínica, el examen físico o la radiografía de tórax no diagnostican en forma acertada la menor función ventricular izquierda. La pesquisa de una fracción de eyección reducida nos señala un grupo de alto riesgo de insuficiencia cardiaca, cardiopatía coronaria y mortalidad cardiovascular. Este grupo de pacientes debe ser sometido a estudios para descartar isquemia miocárdica y recibir las terapias de eficacia probada (Ej. Carvedilol).
Test de isquemia:Los pacientes con ERC etapa 5 son malos candidatos para ser sometidos al test de esfuerzo, debido a su pobre capacidad de ejercicio y las frecuentes alteraciones electrocardiográficas basales. La cintigrafía nuclear cardiaca y el ecocardiograma con estrèc)s farmacológico son exámenes con mucha variabilidad de resultados, dependientes del operador y del centro. En pacientes con ERC avanzada, el eco-dobutamina es un predictor independiente de mortalidad a largo plazo35. En la evaluación de pacientes, antes de ser sometidos a trasplante renal, se recomienda el empleo del eco-dobutamina en aquellos de alto riesgo cardiovascular (Ej. diabèc)ticos, 45 años o presencia de factores de riesgo cardiovascular)36.
Coronariografía:Las indicaciones de coronariografía son similares a la población sin ERC. Muchas veces no se emplea este examen diagnóstico en pacientes con ERC pre-diálisis por el temor de causar una insuficiencia renal aguda (IRA) por medio de contraste. Este menor uso ha llevado al sub-diagnóstico de las lesiones ateroscleróticas en estos pacientes. Aunque el riesgo de pèc)rdida irreversible de la función renal asociado a la inyección de contraste está poco estudiado, es probable que sea muy bajo y en ningún caso supera los beneficios terapèc)uticos obtenidos por un correcto diagnóstico. Por ejemplo un estudio retrospectivo, en pacientes con una VFGe promedio de 12ml/min, no mostró deterioro post-angiográfico de la velocidad de filtración glomerular37. Si cabe destacar que en caso de producirse un episodio de IRA post coronariografía, aumentan significativamente los riesgos de ERC progresiva, hospitalización y mortalidad. La posibilidad de emplear un estudio coronariográfico no invasivo, como el angio-TAC coronario, es problemático en estos pacientes por la necesidad de usar medio de contraste yodado y la interpretación equivoca causada por la calcificación arterial medial.
Calcificaciones vasculares:En los dializados, la detección de cualquier calcificación vascular predice un peor pronóstico. La utilidad del empleo rutinario de tèc)cnicas de imágenes para detectar calcificaciones vasculares, no está definida en los pacientes con ERC. El hallazgo de calcificaciones coronarias en los pacientes dializados no es un equivalente del compromiso coronario38.
Biomarcadores:Los biomarcadores utilizados normalmente en estas patologías pueden tener problemas de interpretación en estos sujetos. Aunque las troponinas cardíacas (I y T) son más sensibles que la CK-MB para la detección de infarto agudo de miocardio en la población general, la sensibilidad podría verse reducida en pacientes con ERC. Por ejemplo, el frecuente hallazgo de una troponina elevada en plasma no es siempre un falso positivo, ya que el origen de esta troponina es realmente el miocardio39. Sin embargo, esta interpretación es incorrecta, ya que la causa muchas veces no es una isquemia aguda por lesiones coronarias obstructivas, sino que se relaciona al “atontamiento” miocárdico propio de los dializados. Por lo tanto podemos señalar algunos hechos a considerar cuando se interpretan estos marcadores:
- -
La elevación de troponina T o I debe ser interpretada con precaución en presencia de ERC.
- -
No se puede utilizar una sola medición para estratificar el riesgo del paciente, a diferencia de los sujetos con función renal normal.
- -
La elevación de troponinas predice un peor pronóstico, incluido un mayor riesgo de muerte CV, en sujetos con ERC. A mayor nivel, mayor el riesgo de muerte.
- -
Un alza aguda de troponinas (20% del valor basal) probablemente refleja una injuria miocárdica aguda.
- -
La sesión de hemodiálisis puede influenciar el nivel de troponinas, dependiendo además del tipo de membrana utilizada.
La prevención de la ECV en los pacientes de ERC, se basa en lograr el mejor control posible de los factores de riesgo tradicionales. En vista de que el riesgo cardiovascular aumenta al disminuir la VFGe, la prevención de la progresión de la ERC es un objetivo terapèc)utico en sí. Las estrategias terapèc)uticas que reducen o detienen la progresión de la ERC, no solamente reducen el riesgo de requerir diálisis o trasplante, sino que tambièc)n pueden reducir el riesgo cardiovascular.
Cese del tabaco y actividad física regular:La evidencia que relaciona ERC y tabaquismo está creciendo, los estudios epidemiológicos muestran que el hábito tabáquico se asocia al desarrollo y progresión de ERC. Además probablemente incrementa en forma importante el riesgo cardiovascular, ya elevado en esta población. Por tanto se debe recomendar a todo paciente con ERC, incluido los pacientes trasplantados, el cese del tabaquismo. La actividad física debe ser recomendada a estos pacientes, en la medida de sus capacidades, ya que se ha observado una reducción de la albuminuria y mortalidad en aquellos que logran una meta mínima de ejercicio40.
Peso y dieta:Un alto contenido de sodio en la dieta es determinante en la hipertensión sal-sensible de estos pacientes y en la retención de volumen en aquellos con ERC avanzada. En estos pacientes la restricción de sodio se acompaña de beneficios, como el potenciar el bloqueo del sistema renina-angiotensina-aldosterona, reducir la albuminuria y mejorar la declinación de la función renal. Se recomienda una restricción de sal en la dieta de 5 gramos al día. Esta reducción de la ingesta de sodio puede mejorar el control de la hipertensión arterial, reducir la retención de líquido, disminuir la albuminuria, reducir la caída de la VFGe y probablemente ofrecer un mejor pronóstico cardiovascular41. La obesidad se asocia al desarrollo y progresión de ERC, así como a riesgo de ECV. Los estudios muestran que la baja de peso inducida reduce la albuminuria, independiente del control de la hipertensión arterial. Las guías internacionales recomiendan mantener un peso ideal (IMC 20-25kg/m2) en los sujetos con ERC. La restricción proteica en estos pacientes es segura y se acompaña de una menor probabilidad de falla renal progresiva y una menor mortalidad general. Sus efectos en el riesgo y la patología cardiovascular se desconocen. Se recomienda evitar una dieta con a 1.3 gr de proteínas/kg de peso ideal. En sujetos con una VFGe 30ml/min, se recomienda una ingesta de proteínas de 0.8 gr/kg de peso ideal.
Hipertensión arterial:El tratamiento de la hipertensión arterial en pacientes con ERC, en cualquiera de sus etapas, es vital para prevenir la progresión de la enfermedad renal y es un pilar de la protección cardiovascular. Cualquier clase de antihipertensivo puede utilizarse, pero aquellos que bloquean el sistema renina-angiotensina-aldosterona ofrecen beneficios adicionales a la sola reducción de la presión arterial. En un meta-análisis de hipertensión arterial, se observó que el aumento del riesgo cardiovascular era más evidente en personas con ERC que en los con función renal normal42. Estos datos sugieren que la terapia antihipertensiva reduciría de manera más eficaz el riesgo cardiovascular en pacientes con ERC que en aquellos sin este trastorno. Pocos estudios, sin embargo, apoyan esta hipótesis. Un objetivo de presión arterial de menos de 140/90mmHg se considera apropiado para prevenir eventos cardiovasculares en pacientes con ERC. Se recomienda un objetivo de presión arterial más bajo, de 130/80mmHg, sólo en pacientes con albuminuria (a 30mg/día).
Dislipidemia:Los estudios clínicos muestran beneficios en el uso de estatinas en estos pacientes, que se ven atenuados al reducirse la VFGe y muy limitados o ausentes en los dializados. Existen escasos datos que apoyen la idea de que las estatinas reducen la progresión de la ERC43. Los agentes preferidos son las estatinas, los fibratos requieren de un ajuste de dosis porque se metabolizan y excretan por el riñón. No existen objetivos terapèc)uticos definidos en esta población y se sugiere utilizar las recomendaciones de las guías clínicas sobre otras poblaciones de alto riesgo cardiovascular.
Diabetes:El óptimo control glicèc)mico reduce las complicaciones microvasculares. Se recomienda mantener un objetivo de hemoglobina glicosilada (HbA1C) de alrededor de 7.0%. En pacientes con riesgo de hipoglicemia, comorbilidades o con una expectativa de vida limitada, se recomienda elevar el objetivo de HbA1C.
Terapia anti-plaquetaria:Los pacientes con ERC presentan alto riesgo cardiovascular y por tanto pueden beneficiarse del uso de terapias anti-plaquetarias, pero por otra parte presentan disfunción plaquetaria lo que aumenta el riesgo de complicaciones hemorrágicas44. Un meta-análisis del uso de agentes anti-plaquetarios en pacientes con ERC mostró que eran efectivos en la prevención de infarto, pero su efecto en la mortalidad era incierto y aumentaban los episodios de hemorragia leve45. En el mismo sentido, en un estudio en pacientes con síndrome coronaria agudo y ERC, estos agentes no tenían efecto en la mortalidad global y sí aumentaban el riesgo de hemorragia. Otra observación sorprendente fue la de la terapia anticoagulante en pacientes con fibrilación auricular y ERC, dónde la warfarina no reducía el riesgo de accidente vascular encefálico, sino que lo aumentaba46. Se recomienda ofrecer el uso de anti-plaquetarios a los pacientes con ERC que tengan riesgo de eventos ateroescleróticos y en los cuales el riesgo de hemorragia no supere los posibles beneficios.
Factores de riesgo relacionados a la falla renal:Los ensayos clínicos randomizados no han mostrado hasta ahora evidencia sobre intervenciones específicas capaces de reducir el riesgo de eventos cardiovasculares. Por ejemplo no se han observado beneficios en aumentar la hemoglobina, con el uso de eritropoyetina, a valores sobre los 12.0 gr/dl. Tampoco se han observado beneficios cardiovasculares, en los estudios clínicos, con análogos de vitamina D (Paricalcitol) o calcimimèc)ticos (Cinacalcet).
2) Prevención secundaria:La presencia de ERC a menudo conduce al nihilismo terapèc)utico en relación con el tratamiento preventivo secundario. Por ejemplo, en un estudio de individuos con ERC e infarto de miocardio se observó que recibieron una menor prescripción de estatinas, beta-bloqueadores y agentes antiplaquetarios, comparado con los sujetos de función renal normal47. Además estos pacientes tenían una menor probabilidad de recibir consejos acerca de dejar de fumar, bajar de peso, realizar ejercicio y seguir rehabilitación cardiaca. Esta renuencia a utilizar el enfoque preventivo secundario se incrementaba con la mayor severidad de la enfermedad renal crónica.
3) RevascularizaciónAl ser realizados menos estudios coronarios en esta población, se observa que con menor frecuencia se indican la angioplastia coronaria percutánea o la cirugía de revascularización miocárdica, a pesar de ser tratamientos probadamente eficaces. En el infarto al miocardio la trombolisis tambièc)n es usada con menor frecuencia en los pacientes con ERC, a pesar de haber demostrado ser eficaz. Cabe destacar que la presencia de ERC determina un factor de riesgo de mortalidad al utilizar las terapias de revascularización miocárdica como angioplastia o bypass coronario. A su vez, si la cirugía de revascularización se complica de insuficiencia renal aguda que requiere diálisis, la mortalidad se eleva en forma significativa.
En pacientes con ERC la comparación de los resultados entre la terapia mèc)dica y la revascularización coronaria es limitada, dado que existen datos retrospectivos u observacionales y por la falta de una terapia mèc)dica validada. Lo mismo sucede al comparar los distintos mèc)todos de revascularización en esta población. Las recomendaciones basadas en los estudios observacionales señalan lo siguiente48,49:
- -
En los pacientes con enfermedad coronaria de múltiples vasos, que tengan una anatomía favorable para un puente mamario, se debe preferir una revascularización quirúrgica.
- -
La ventaja en la sobrevida de la cirugía vs. la angioplastia ocurre luego de los 6 meses de la cirugía. A los pacientes con una expectativa de vida limitada o preocupados de la morbilidad peri-operatoria, se les debe recomendar una angioplastia coronaria percutánea.
- -
Si el puente mamario a la arteria descendente anterior no es quirúrgicamente factible, la cirugía probablemente no ofrece ventajas sobre la angioplastía.
Las recomendaciones de prevención y tratamiento en pacientes con ERC, sólo se fundan en un pequeño número de ensayos clínicos, que han investigado las enfermedades cardiovasculares específicamente en las poblaciones de pacientes con VFGe reducida. Lamentablemente la mayoría de estos estudios no tiene el poder para sacar conclusiones válidas sobre pronóstico y sobrevida. Aunque es tentador extrapolar los resultados, en población general, de prevención y tratamiento cardiovascular, estos datos no son necesariamente ciertos en sujetos con ERC. La prevención de eventos cardiovasculares, en esta población, debe basarse en dos premisas fundamentales. La primera es iniciar el tratamiento cardiovascular en etapas tempranas de ERC. De allí la importancia en pesquisar la ERC en pacientes de riesgo, mediante la estimación de la VFGe y la medición de la albuminuria. Lo segundo es, en pacientes ya con una ERC más avanzada, implementar un abordaje multifactorial. Este enfoque terapèc)utico multimodal debe incluir educación, cambios en el estilo de vida, control de la glicemia, tratamiento de la hipertensión arterial, control de los lípidos y uso de fármacos específicos entre otras medidas.
CONCLUSIONESEn los pacientes con ERC, comparados con la población general, la enfermedad CV es más frecuente y severa y generalmente es sub-diagnosticada y sub-tratada. Los pacientes con ERC deben ser vistos como un grupo de alto riesgo cardiovascular, similar a la diabetes y requieren de una atención clínica especial a nivel individual, en el desarrollo de guías clínicas y en el impulso de estudios clínicos específicos a esta población. La potente asociación causal entre ERC y enfermedad CV hace imperativo prevenir el progreso de la ERC, ya que con ello se reduce el riesgo cardiovascular. En los pacientes con ERC la causa de este riesgo cardiovascular elevado es multifactorial, explicada en parte por procesos fisiopatológicos propios. Por este motivo la estrategia estándar, dirigida a controlar los factores de riesgo tradicionales, no tiene la misma efectividad. Por lo tanto se deben explorar estrategias innovadoras, centradas en los mecanismos fisiopatológicos propios de esta población, sin olvidar que es vital iniciar la prevención en forma precoz y enfocar el tratamiento de estos pacientes de forma multifactorial y bajo un equipo multidisciplinario.
El autor declara no tener conflictos de interèc)s, en relación a este artículo.