La diarrea asociada a antibióticos es una entidad clínica que ha aumentado de manera considerable los últimos años a nivel mundial.
Lo anterior se ha visto favorecido por el incremento en el uso de antibióticos de amplio espectro, los que fundamentalmente alteran la flora intestinal habitual, actuando también por otros mecanismos como la alteración de la motilidad intestinal y acción tóxica directa sobre la mucosa intestinal.
La presentación clínica varía desde un cuadro leve hasta de mayor gravedad, llegando incluso a la muerte. Lo anterior dependerá de algunas variables, siendo fundamental el estado inmunitario del paciente. La diarrea asociada a antibióticos por Clostridium Difficile tiene mayor relevancia dado su mayor morbimortalidad.
Se han utilizado diversos métodos diagnósticos para evaluar esta patología como así también, diferentes estrategias terapéuticas de enfrentamiento, las que se exponen en la presente revisión.
Antibiotic-associated diarrhea is a clinical entity showing a significantly greater presence in past years worldwide.
These has been favored by the intensification of treatments based on the use of broad-spectrum antibiotics, which alter intestinal flora and act through other mechanisms like alteration of intestinal motility and direct toxic action on the intestinal mucosa.
Clinical symptoms vary from mild to severe and may even cause death. The severity of this condition depends on different variables, mainly the immune status of the patient. Clostridum difficile antibiotic-associated diarrhea is the most relevant since it causes greater mobility and mortality.
This article is a review of various diagnostic methods used to evaluate this pathology and multiple therapeutical strategies for management of same.
La aparición de diarrea asociada a la administración de antibióticos se presenta entre un 5 y un 25% de los pacientes 1. En este contexto, existen dos entidades. Una de ellas es la diarrea asociada a Clostridium Difficile (CD), que constituye el 20 a 30% de los casos 2, 3, pero que por su evolución y consecuencias es la que tiene mayor trascendencia clínica. Dado lo anterior y por la importancia que ha adquirido en la última década la diarrea asociada a CD, en esta revisión nos referiremos a este tema, poniendo énfasis en los aspectos gastroenterológicos actuales de enfrentamiento (Figura 1).
El segundo tipo, es la diarrea simple asociada a antibióticos, que se produce mediante mecanismos tales como: alteraciones inducidas en el metabolismo luminal de carbohidratos y sales biliares como efecto de la alteración de la población bacteriana intestinal, efectos tóxicos y/o alérgicos sobre la mucosa intestinal, acciones farmacológicas sobre la motilidad del tubo digestivo y origen infeccioso, en el que se ha involucrado a microorganismos como Clostridium Perfringens, Klebsiella Oxytoca, especies de Candida y especies de Salmonella. La mayoría de las veces este tipo de diarrea es leve a moderada, se presenta durante el curso de la terapia antibiótica, se asocia a la dosis empleada del respectivo fármaco, es de curso benigno y cede al discontinuar el medicamento.
DIARREA ASOCIADA A CLOSTRIDIUM DIFFICILE (DACD)DEFINICIÓNEs la diarrea producida por las toxinas del CD, que es un bacilo gram positivo anaerobio estricto, formador de esporas, aislada en 1935 por primera vez por Hall y O Toole 4. La mayor parte de las veces está asociada al uso previo de antibióticos.
EPIDEMIOLOGÍALa DACD es fundamentalmente una infección nosocomial y constituye la primera causa de diarrea que se presenta en un paciente hospitalizado. Su incidencia varía entre 0,6 y 2,1% del total de pacientes hospitalizados, con una mortalidad 1 a 5% 5. Es poco frecuente en pacientes ambulatorios, aunque su incidencia extrahospitalaria ha ido en aumento.
Varios factores han dificultado la comprensión de la epidemiología de la DACD. En primer lugar, aunque ha habido una mejoría en la vigilancia de la DACD derivada de la identificación de infecciones graves y brotes epidémicos, la medición de su frecuencia es aún variable y ello dificulta la obtención de indicadores fiables en los países y en las comparaciones entre ellos.
Se trata de una infección poco habitual en pacientes ambulatorios, a pesar de que en los últimos años se ha visto un aumento de la infección por CD en pacientes sin antecedentes previos de hospitalización.
En los pacientes que desarrollan como complicación una colitis pseudomembranosa, el CD sería el agente etiológico en 90-100% de los casos.
Hasta un 40% de los pacientes con infección adquirida en la comunidad requiere hospitalización y las tasas de recurrencia son similares a las de infección nosocomial 6.
Se ha detectado la presencia de CD en más del 25% de los pacientes adultos internados en un hospital general. Sólo un tercio desarrolla diarrea y los otros son portadores asintomáticos (1). Todos ellos forman el reservorio del agente infeccioso. Esta bacteria sobrevive en el ambiente hospitalario mediante sus esporas, las que pueden ser transmitidas fácilmente mediante el contacto del paciente infectado con el personal de salud, el que las transporta hacia superficies no contaminadas y hacia otros pacientes. Se ha demostrado la presencia de esporas viables durante meses en baños, pisos, teléfonos, estetoscopios, etc.
En la última década se han reportado numerosos brotes epidémicos nosocomiales. Estos brotes se han asociado a una cepa de CD hipervirulenta, conocida como NAP1/BI/027 (presente ya en Chile).
PATOGENIACuando se asocian algunas situaciones como enfermedades que favorecen la inmunosupresión, junto al uso de terapia antibiótica, se puede producir una alteración de la flora del colon, creando condiciones propicias para la adquisición y/o proliferación del CD.
Al colonizar el intestino grueso, el CD libera dos exotoxinas proteicas (TcdA y B) que causarán colitis en aquellas personas más susceptibles, a través de la inactivación de Rho GTPasa 7 y que finalmente se manifestará en una pérdida de la función de la barrera intestinal.
Las esporas del CD que se transmiten (feco-oral), son resistentes a la acidez gástrica, germinan en su forma vegetativa en el intestino delgado y avanzan posteriormente al intestino grueso.
La toxina A (enterotoxina) produce una inflamación del intestino y secreción de fluidos. La toxina B a su vez produce daño celular (citotoxina) siendo su presencia más frecuente y dañina.
Los genes que codifican estas toxinas (tcdA y tcdB) pueden estar regulados por el gen tcdC en forma negativa y por tcdD en forma positiva, como también la presencia del gen tcdE que favorecería la liberación de toxinas. Lo anterior produce que las mutaciones de estos genes, son de mucha importancia en el desarrollo clínico de la enfermedad.
La formación de pseudomembranas en la DACD se debe a la alteración del epitelio intestinal, lo que favorece la migración de neutrófilos al lumen y formación de pseudomembranas que contienen detritus celulares 8–10. La colitis pseudomembranosa se puede clasificar según gravedad (Tabla 1).
CLASIFICACIÓN HISTOLÓGICA DE COLITIS PSEUDOMEMBRANOSA
| ESTADO | HALLAZGOS |
|---|---|
| TIPO I | Epitelio irregular, exhudado fibrinoso y neutrófilos dentro del lúmen del colon. |
| TIPO II | Lesión eruptiva desde un foco de ulceración epitelial. |
| TIPO III | Necrosis epitelial difusa y ulceración de la superficie, con formación de pseudomembranas. |
Se han identificado algunos factores de riesgo que se nombran a continuación, que aumentan la posibilidad de adquirir una diarrea asociada a CD (7, 11, 12):
- a)
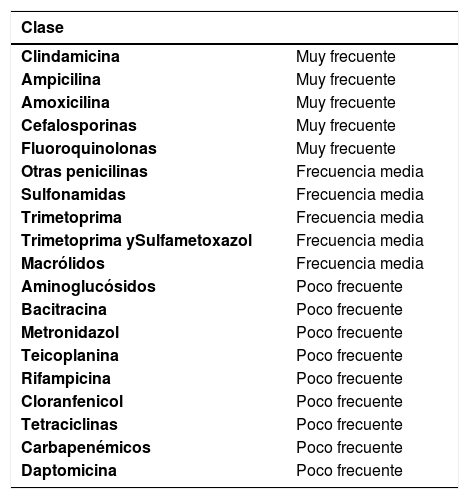
Uso reciente de antibióticos que alteran la flora normal habitual intestinal (incluso hasta 10 semanas luego de suspendido éste) (Tabla 2).
Tabla 2.TIPOS DE ANTIBIÓTICOS Y SU ASOCIACIÓN CON INFECCIÓN POR CLOSTRIDIUM DIFFICILE
Clase Clindamicina Muy frecuente Ampicilina Muy frecuente Amoxicilina Muy frecuente Cefalosporinas Muy frecuente Fluoroquinolonas Muy frecuente Otras penicilinas Frecuencia media Sulfonamidas Frecuencia media Trimetoprima Frecuencia media Trimetoprima ySulfametoxazol Frecuencia media Macrólidos Frecuencia media Aminoglucósidos Poco frecuente Bacitracina Poco frecuente Metronidazol Poco frecuente Teicoplanina Poco frecuente Rifampicina Poco frecuente Cloranfenicol Poco frecuente Tetraciclinas Poco frecuente Carbapenémicos Poco frecuente Daptomicina Poco frecuente Adaptación y traducción Ref (7):
- b)
Edad mayor de 65 años.
- c)
Hospitalización reciente.
- d)
Comorbilidad múltiple.
- e)
Estados de inmunosupresión (cáncer, quimioterapia, esteroides, trasplantados).
- f)
Portador de enfermedad inflamatoria intestinal: Colitis ulcerosa - Enfermedad de Crohn (fundamentalmente por alteración de la flora intestinal, mecanismos de barrera intestinal, uso de inmunosupresores) 13.
- g)
Procedimientos que alteran la flora comensal intestinal (Ej; sondas, enemas, cirugía del tracto gastrointestinal).
- h)
Supresión de ácido gástrico: (Ej, uso de inhibidores de bomba de protones). Es un tema aún incierto, dado que algunos trabajos iniciales mostraron mayor porcentaje de infección por CD en aquellos pacientes usuarios de inhibidores de bomba de protones, basado que la supresión de ácido a nivel gástrico permitiría que más formas vegetativas, alcanzaran el colon. Dicha teoría últimamente se encuentra en discusión y no se ha confirmado debido a que las esporas del CD y los vectores de la infección, son resistentes al ácido.
La DACD presenta un amplio espectro de manifestaciones clínicas, que va desde una diarrea leve de curso benigno hasta una colitis intensa con desarrollo de megacolon tóxico y complicaciones intraabdominales y sistémicas que pueden llevar a la muerte del paciente.
En un tercio de los casos, la diarrea se inicia después de que ha concluido la terapia antibiótica y, a veces, alejado de ella hasta por un par de meses. Las deposiciones son abundantes, acuosas o mucosas, pueden contener sangre y se acompañan de dolor abdominal, fiebre y compromiso del estado general. En casos más prolongados o intensos puede aparecer deshidratación, depleción de electrolitos e hipoproteinemia (por colopatía perdedora de proteínas). Unos pocos casos evolucionan en forma fulminante, con pancolitis, hemorragia o megacolon tóxico, con todas sus consecuencias. En algunos pacientes, la colitis está confinada al colon derecho y se pueden presentar como abdomen agudo, con signo de blumberg, sin diarrea.
El compromiso colónico es de grado variable. En la mayoría de los casos existe una colitis de aspecto inespecífico. Menos frecuente es la colitis pseudomembranosa, que es muy específica de esta etiología, en la cual la mucosa se presenta enrojecida y con la presencia de placas elevadas amarillentas de 3 a 9mm, que pueden unirse. Habitualmente existe afección rectosigmoídea, pero hasta un tercio de los pacientes presentan la lesión sólo en el colon derecho, como se mencionó anteriomente.
De acuerdo a la gravedad, la DACD se clasifica en la Tabla 3.
CLASIFICACIÓN SEGÚN SEVERIDAD DE LA INFECCIÓN POR CLOSTRIDIUM DIFFICILE
| Leve - moderado | Menos de 6 deposiciones al díaLeucocitosis <15.000/mm3 |
|---|---|
| Severo | Diarrea Profusa (> 6 deposiciones al día)Que desarrolle en el curso de la diarrea:-Leucocitos > 15.000/mm3-Dolor abdominal (no abdomen agudo)-Hipoalbuminemia (albumina < 3gr/dl |
| Severo complicado | ICD severa asociada a: (7)-Ingreso a unidad de paciente crítico-Hipotensión con o sin DVA-Fiebre > 38,5°C-Ileo-Compromiso de conciencia-Leucocitosis >35.000/mm3 o <2.000/mm3-Lactato > 2,2mmol/lt-Cualquier evidencia de falla de órgano |
Se debe plantear en personas en tratamientos antibióticos actuales o recientes, aunque también puede aparecer este cuadro en condiciones tales como la terapia con antineoplásicos. Debe sospecharse en todo paciente hospitalizado que inicie un cuadro diarreico. Es fundamental que el clínico tenga un alto índice de sospecha según características clínicas del paciente.
El diagnóstico se basa en el cuadro clínico, los exámenes de laboratorio y a veces, en el estudio endoscópico del colon (esta última en pocas ocasiones). En los exámenes generales se puede encontrar anemia, leucocitosis, aumento de la creatininemia, elevación de la velocidad de sedimentación según el grado de gravedad.
Es importante recalcar que sólo se debe buscar CD o sus toxinas, en pacientes sintomáticos.
La búsqueda de colitis pseudomembranosa, mediante rectosigmoidoscopia flexible, es menos utilizada. En los casos que se sospeche compromiso de colon derecho, podría ser necesario una colonoscopia larga. Se sugiere efectuar exploración endoscópica si no hay disponibilidad de los exámenes en deposiciones, cuando hay íleo (ausencia de deposiciones) o cuando se pretende descartar otro diagnóstico. Es necesario tener presente que la colonoscopía está contraindicada en el megacolon tóxico.
MÉTODOS DIAGNÓSTICOS DE LABORATORIOEl diagnóstico de la DACD se puede hacer en función al cuadro clínico y al estudio de deposiciones positivo o menos frecuente, en relación a los hallazgos de la colonoscopía (por ejemplo visualización de pseudomembranas en la colitis pseudomembranosa).
El tratamiento empírico sin pruebas de diagnóstico es inapropiado si existen pruebas de diagnóstico disponibles. Esta sugerencia se basa en que incluso en un ambiente epidémico, no más de un 30% de los pacientes hospitalizados que tengan diarrea asociada a antibióticos será secundaria a CD 11.
El diagnóstico de una DACD en un tiempo corto y de manera certera es fundamental, tanto en el manejo del paciente como en la toma de medidas de aislamiento, limitando el riesgo de un brote nosocomial 2,14,15.
El diagnóstico de laboratorio se realiza habitualmente por pruebas de Inmunoensayo Enzimático (EIA) toxinas A y B, que es el examen disponible en la mayoría de los centros de salud chilenos, con el inconveniente que su sensibilidad no supera el 60% 12,16. Se ha complementado en algunos centros con pruebas para antígeno común de CD (Glutamato deshidrogenada-GDH), antígeno producido por el CD.
Este examen se debe utilizar siempre con un método confirmatorio de toxinas de CD.
En los últimos años el Ensayo molecular por Reacción de la Polimerasa en Cadena (PCR) para detección de toxinas se ha propuesto como el método de elección en aquellos centros que lo han implementado, dado lo fácil y rápido de la técnica, junto a la alta sensibilidad (91,7-95%) y especificidad (94-95,5%) (10) para la detección de toxinas del CD.
Los exámenes anteriores, se recomiendan procesar en heces líquidas.
Los métodos de cultivo celular no se recomiendan como examen diagnóstico, dado que requieren de cultivos anaerobios, lo que hace más dificultoso el estudio.
No es recomendable solicitar exámenes de laboratorio confirmatorios de erradicación del CD, bastando sólo la resolución del cuadro clínico, dado que se ha demostrado que las toxinas pueden dar positivo luego de semanas o meses luego de resuelto el cuadro clínico 2,13.
Se sugiere solicitar alguna imagen del abdomen y pelvis (Ej. tomografía axial computada-TAC) sólo cuando se sospecha una complicación como por ejemplo perforación o megacolon tóxico.
TRATAMIENTODebe incluir la suspensión o cambio del antibiótico asociado, dependiendo de la situación clínica del paciente. Si no es recomendable suspender la terapia antibiótica, en lo posible se debe optar por alguno menos asociado al desarrollo de DACD. Además de ello se emplean medidas dietéticas, de apoyo general e hidratación, en concordancia con la gravedad del cuadro clínico.
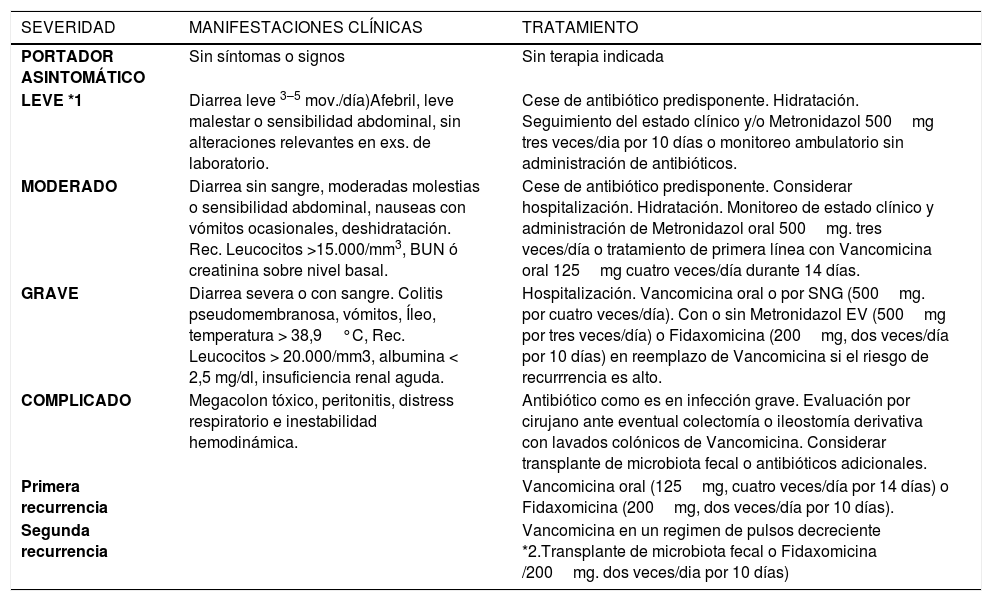
El tratamiento dependerá de la severidad del cuadro de la DACD (Tabla 4).
| SEVERIDAD | MANIFESTACIONES CLÍNICAS | TRATAMIENTO |
|---|---|---|
| PORTADOR ASINTOMÁTICO | Sin síntomas o signos | Sin terapia indicada |
| LEVE *1 | Diarrea leve 3–5 mov./día)Afebril, leve malestar o sensibilidad abdominal, sin alteraciones relevantes en exs. de laboratorio. | Cese de antibiótico predisponente. Hidratación. Seguimiento del estado clínico y/o Metronidazol 500mg tres veces/dia por 10 días o monitoreo ambulatorio sin administración de antibióticos. |
| MODERADO | Diarrea sin sangre, moderadas molestias o sensibilidad abdominal, nauseas con vómitos ocasionales, deshidratación. Rec. Leucocitos >15.000/mm3, BUN ó creatinina sobre nivel basal. | Cese de antibiótico predisponente. Considerar hospitalización. Hidratación. Monitoreo de estado clínico y administración de Metronidazol oral 500mg. tres veces/día o tratamiento de primera línea con Vancomicina oral 125mg cuatro veces/día durante 14 días. |
| GRAVE | Diarrea severa o con sangre. Colitis pseudomembranosa, vómitos, Íleo, temperatura > 38,9°C, Rec. Leucocitos > 20.000/mm3, albumina < 2,5 mg/dl, insuficiencia renal aguda. | Hospitalización. Vancomicina oral o por SNG (500mg. por cuatro veces/día). Con o sin Metronidazol EV (500mg por tres veces/día) o Fidaxomicina (200mg, dos veces/día por 10 días) en reemplazo de Vancomicina si el riesgo de recurrrencia es alto. |
| COMPLICADO | Megacolon tóxico, peritonitis, distress respiratorio e inestabilidad hemodinámica. | Antibiótico como es en infección grave. Evaluación por cirujano ante eventual colectomía o ileostomía derivativa con lavados colónicos de Vancomicina. Considerar transplante de microbiota fecal o antibióticos adicionales. |
| Primera recurrencia | Vancomicina oral (125mg, cuatro veces/día por 14 días) o Fidaxomicina (200mg, dos veces/día por 10 días). | |
| Segunda recurrencia | Vancomicina en un regimen de pulsos decreciente *2.Transplante de microbiota fecal o Fidaxomicina /200mg. dos veces/dia por 10 días) |
*1 leve se considera sólo si se produce em pacientes ambulatórios.
*2 Regimen de pulsos decrecientes:
Vancomicina 125mg., cuatro veces/día por 1 semana.
Vancomicina 125mg., tres veces/día por 1 semana.
Vancomicina 125mg., dos veces/día por 1 semana.
Vancomicina 125mg., una vez/día por 1 semana.
Vancomicina 125mg., una vez/día por medio por 1 semana.
Vancomicina 125mg., cada tres días por 1 semana.
En los cuadros catalogados como leve a moderado, se recomienda el uso del Metronidazol oral durante 10 días. En la DACD severa, se ha visto significativamente una mejor respuesta al uso de Vancomicina oral por 14 días (7). En los casos graves o complicados se recomienda uso de Vancomicina oral por 14 días con o sin Metronidazol iv. o Fidaxomicina oral por 10 días (7). Si esto fracasa, se planteará la cirugía en los casos que se señalan más adelante. Sólo en caso de presentar íleo, se ha recomendado uso de Vancomicina por vía nasoenteral o enemas, junto con Metronidazol iv. (2, 9, 12). En los casos de contraindicación al uso de Metronidazol como en la embarazada, se deberá usar Vancomicina.
CIRUGÍAEs una terapia de excepción en los pacientes con DACD y sólo se plantea en aquellos casos graves que no responden a la terapia médica, (Ej. desarrollo de megacolon tóxico, signos de perforación intestinal, colitis fulminante, shock refractario con lactato elevado), sugiriéndose en estos pacientes la colectomía total con ileostomía terminal. 18,19.
RECURRENCIAEl tratamiento de un primer episodio de recurrencia puede realizarse con Metronidazol o Vancomicina oral según severidad por 10-14 días (7). Una segunda recurrencia es más complejo de tratar por la persistencia de esporas en el intestino, o en el medio ambiente y la incapacidad además del huésped, de entregar una respuesta inmunológica adecuada.
En segundas recurrencias se ha utilizado con éxito la Fidaxomicina, la cual se ha demostrado tendría menores tasas de recurrencia en comparación con la Vancomicina, siendo limitado su uso actualmente en Chile, por no encontrarse disponible, siendo además, un antibiótico de alto costo.
Se presenta en Tabla 4 y 5 un resumen de dos esquemas de terapias farmacológicas sugeridas
TRATAMIENTO DE LA INFECCIÓN POR CLOSTRIDIUM DIFFICILE
| PRIMER EPISODIO | |
|---|---|
| Infección leve a moderada | Metronidazol 500mg 3 veces al día VO por un periodod de 10 días. |
| Infección severa | Vancomicina 125-500mg 4 veces al día VO 14 días o Fidaxomicina 200mg 2 veces al día VO por 10 días. |
| Infección severa y complicada | Vancomicina 125-500mg 4 veces al día VO o por sonda nasoenteral o 500mg en 500ml de suero fisiológico 4 veces al día vía rectal como enema de retención en caso de íleo o distención abdominal significativa junto con Metronidazol 500mg 3 veces al día EV por 14 días. |
| Primera recurrencia | Mismo esquema que primer episodio, estratificando al paciente según severidad de la diarrea. |
| Segunda recurrencia | Vancomicina 125mg 4 veces al día VO 14 días, seguido de 125mg dos veces al día VO por 7 días, seguido de 125mg cada 48 horas VO por 7 días, seguido de 125mg cada 72 horas al día VO por 14 días, o Vancomicina 125mg 4 veces al día VO por 10 días seguidos por pulsos de Vancomicina 125mg cada 3 días por 10 veces. |
| Tercera o más recurrencias | Transplante de Microbiota fecal. |
VO: Vía oral. VE: Vía endovenosa.
Ref 28 Propuesta publicada por Meyer y colab. Rev. Med. Clin. Condes-2014;25(3)473-484.
Otras alternativas que se han estudiado son la Rifaximina, Nitazoxanida, Teicoplanina, Tigeciclina, Ramoplanina, pero que dado los pocos trabajos de investigación, alto costo, desarrollo de resistencia y reacciones adversas, no se recomiendan de rutina en la actualidad.
El uso de Inmunoglobulina intravenosa, sólo tendría un rol en los pacientes portadores de hipogamaglobulinemia (13).
Los anticuerpos monoclonales se han estudiado fundamentalmente en el desarrollo de vacunas para prevenir la infección por CD 13,16,20.
El uso de colesteramina disminuye sintomáticamente la intensidad de la diarrea, pero hay que tener la precaución de administrarla alejado de la Vancomicina, para no alterar su absorción. No se ha visto que su administración disminuya las recurrencias de la infección 8,13.
No se ha podido demostrar la utilidad del uso de probióticos como terapia adicional de la DACD en todas sus formas de presentación 13,21–23. En el caso de la prevención de DACD, los estudios aún son inciertos respecto al probable beneficio. No se recomienda su uso en caso de inmunosupresión, habiendo publicados algunos casos de fungemia por S. boulardii en esta condición inmunológica.
TRANSPLANTE DE MICROBIOTA FECAL (TMF):Se sabe que la microbiota colónica humana, ofrece protección contra la colonización de bacterias patógenas, lo cual es clave al entender el mecanismo de patogénesis de la CACD. El TMF fue reportado por primera vez en 1958 y actualmente surge como un procedimiento aceptado, seguro y eficaz para la CACD recurrente. Los efectos adversos descritos son mínimos 24 (Ej. fiebre post procedimiento, dolor abdominal o propios del procedimiento como complicación de una colonoscopía). Siempre está la inquietud de una eventual transmisión de algún agente infeccioso, si no se cumplen los protocolos adecuados de estudio previo del donante. Este procedimiento terapéutico se basa en la normalización de la microbiota del paciente afectado por transferencia directa de un donante sano, lo que provee de un mecanismo efectivo de defensa contra el CD infectante.
En los casos de recurrencia severa, como así también luego de la tercera recurrencia se ha visto que el TMF ha tenido prometedores resultados 25,26.
Se ha utilizado como vía de administración del TMF, la colonoscopía –enema y por vía alta (sonda nasogástrica o nasoyeyunal). Sería más útil y cómodo para el paciente, la administración por colonoscopía (26).
Esta terapia está en pleno desarrollo y ya hay algunos trabajos iniciales que han estudiado el uso de cápsulas orales que contienen la esporas de bacterias fecales (44).
La elección del donante debe ser muy cuidadosa. En la Tabla 6 se resume el estudio propuesto por Espinoza R y colab. Publicado en Rev. Chilena Infectol. 2014;31(4):477-482 27.
Exámenes a solicitar al donante TMF
| Sangre | Recuento de leucocitos, pruebas de función hepática |
| IgM CHA | |
| HBsAgAnticuerpo anti-core VHB | |
| Anticuerpo anti-antígeno de superficie VHB | |
| Serología VHC | |
| Serología VIH | |
| Serología HTLV I/II | |
| Serología CMV | |
| Serología VEB | |
| Pruebas no treponémicas (VDRL o RPR) | |
| Deposición | Coprocultivo para bacterias enteropatógenas |
| Toxina A y B de Clostridium difficile por EIA (por RPC) | |
| Antígeno Giarda lamblia | |
| Antígeno Crystosporidium | |
| Tinción para Cyclospora e Isospora | |
| Párasitos, quistes y huevos | |
| Antígeno Helicobacter pylori |
Igm= Inmunolobulina M, VHA= virus de hepatitis A; HBsAG= antígeno de superficie de hepatitis B; VHB= virus de hepatitis B; VHC= virus de hepatitis C; VIH= virus de inmunodeficiencia humana; HTLV= virus linfotrópico de células T humanas; CMV= citomegalovirus; VEB= virus de Epstein Barr, VDRL= veneral disease research laboratory; RPR= reagina plasmática rápida; EIA= ensayo inmunoanálisis; RPC= reacción de polimerasa en cadena.
Es tarea de todo el equipo de salud junto al paciente y sus cercanos, cumplir con los protocolos adecuados, como es el lavado correcto de manos, aislamiento de contacto, por lo menos hasta que ceda el cuadro clínico (la diarrea).
Se recomienda el uso de solución en base al hipoclorito para limpiar superficies, que se ha visto ser efectivo contra las esporas del CD.
En resumen, el pilar del control de esta infección, está en el uso adecuado y racional de antibióticos, diagnóstico oportuno y precoz, educación al paciente y familiares respecto al mecanismo de contagio, implementar medidas de control de la infección disponiendo de la infraestructura que esto requiera, como por ejemplo contar en los centros de salud con: áreas de lavado de manos, normas de precaución de contacto, habitaciones privadas, limpieza y desinfección ambiental. Para lo anterior, es fundamental el trabajo en equipo, involucrando a todo el personal de salud, sugiriéndose que cada centro u hospital, cuente con un sistema de control de infecciones asociadas a la atención de salud (IAAS), siendo esto parte de la gestión de calidad y seguridad de la atención de los pacientes. También el desarrollo futuro de vacunas (no disponible en la actualidad), será de gran utilidad.
El autor declara no tener conflictos de interés, en relación a este artículo.