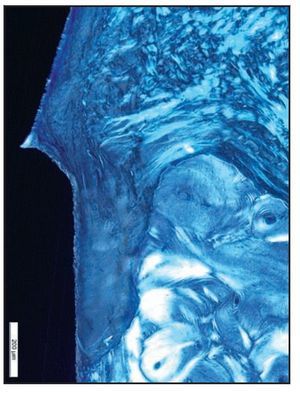
La preservación de una relación estable entre los tejidos blandos suprayacentes y el soporte subyacente del hueso crestal es crítica para lograr una función y una forma óptimas en las restauraciones implantosoportadas. Esta estabilidad morfológica es especialmente importante en la zona estética anterior del maxilar superior, donde la integridad anatómica de los tejidos papilares y marginales con compromiso estético depende íntimamente de niveles estables del hueso crestal. Desgraciadamente se observa con frecuencia la pérdida de hueso crestal «secado» hasta la primera rosca coronal del implante tras la inserción del pilar, lo que provoca una pérdida ósea promedio de 1,5 a 2,0 mm tras el primer año de funcionamiento, a menudo seguida posteriormente de una pérdida continuada de 0,1 mm/año1-7.
La relación entre la unión implante-pilar (UIP) y la pérdida de hueso crestal relacionada con el implante preocupa cada vez más y se le presta más atención1,4,8-11. Los ensayos preclínicos en un modelo canino han confirmado la dimensión de 3 mm de los tejidos blandos periimplantarios1-4. La microgrieta creada en la UIP provocó en todos los casos un infiltrado inflamatorio que condujo el componente sano del tejido conjuntivo periimplantario en dirección apical, provocando una pérdida de hueso crestal de como mínimo 1,5 a 2,0 mm1,12.
Se han realizado estudios clínicos y preclínicos para reducir o minimizar el secado crestal examinando el papel que desempeñarían los microcanales, con una forma y profundidad tridimensional definida, en el control del comportamiento de los fibroblastos y osteoblastos al limitar la migración apical del epitelio de unión13,14. Los resultados significativos de un estudio prospectivo histológico preliminar realizado en seres humanos demostraron la presencia de una inserción directa del tejido conjuntivo en microespiras generadas de forma precisa mediante Laser-Lok en el cuello del implante15. Esto plantea la cuestión de si se producirían resultados similares si las microespiras talladas por láser se colocasen en la superficie del pilar. Esta alteración de la superficie, a diferencia de los pilares tradicionales de superficie mecanizada, proporcionaría una oportunidad para una inserción fibrocolagenosa directa y, por tanto, limitaría la migración del epitelio apical frecuente en los complejos tradicionales pilar-implante. Además, la inserción directa del tejido conjuntivo a la superficie del pilar podría mitigar o eliminar por completo las secuelas negativas secundarias a la filtración microbiana de la microgrieta de la UIP, reduciendo así la potencial pérdida periimplantaria de hueso crestal.
El objetivo de este estudio preclínico demostrativo fue determinar si las microespiras configuradas de forma precisa mediante Laser-Lok colocadas en una región definida del pilar de cicatrización prevenían o reducían la pérdida de hueso crestal en comparación con un pilar mecanizado, y determinar la inserción tisular producida en la superficie del pilar con microespiras durante la cicatrización mediante análisis histológicos, de tomografía microcomputarizada (micro-TC), y microscopio electrónico de barrido (MEB).
Materiales y métodos
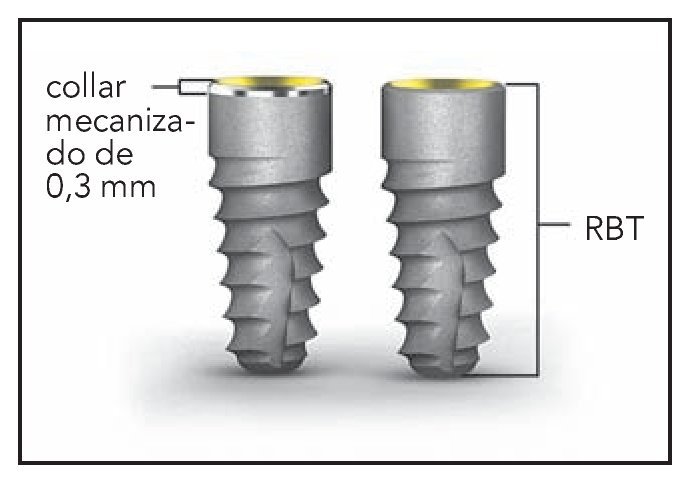
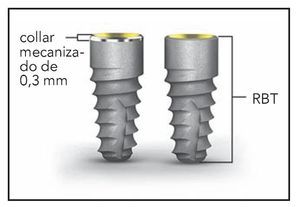
Este estudio, que fue autorizado por el protocolo del Institutional Animal Care and Use Commitee, se diseñó para examinar los efectos de dos superficies diferentes de implantes y pilares sobre la inserción epitelial y el tejido conjuntivo, así como los niveles de hueso periimplantario. Las zonas fueron distribuidas al azar para recibir implantes internos cónicos (BioHorizons) con un texturizado reabsorbible a presión (RBT) o RBT con un cuello mecanizado de 0,3 mm (figura 1a). Cada implante medía 3,8 mm de diámetro y 9,0 mm de longitud. Además, a cada implante se le asignaron de forma aleatoria pilares de cicatrización con superficie mecanizada o con microcanales Laser-Lok de 8 mm aplicados en una banda de 0,7 mm de alto localizada inmediatamente coronal a la UIP o microgrieta (figura 1b). La anchura de la banda evaluada medía lo mismo que la porción de la banda del implante Laser-Lok que contactó con el tejido blando. Los pilares se colocaron en el momento de la cirugía.
Figura 1a (izquierda) Implante con texturizado reabsorbible a presión (RBT) con un cuello mecanizado de 0,3 mm (izquierda) e implante RBT sin cuello mecanizado (derecha).
Figura 1b (derecha) Pilar de cicatrización con una zona de 0,7 mm con microespiras Laser-Lok (izquierda) y un pilar totalmente mecanizado sin las microespiras talladas con láser (derecha).
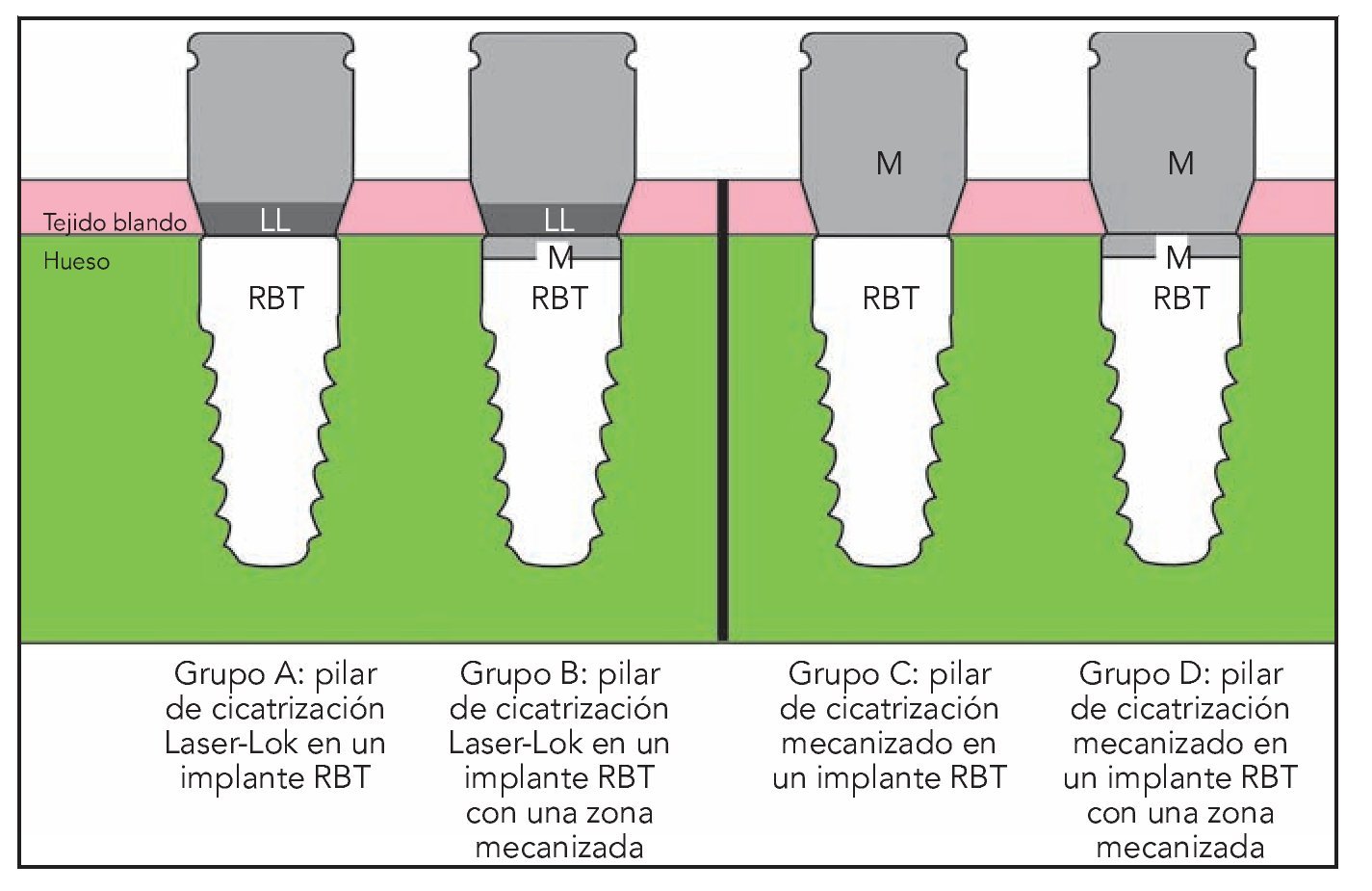
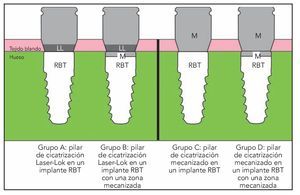
Para este estudio se seleccionaron 6 foxhounds de un peso mínimo de 25 kg. Cada uno recibió 6 implantes en las zonas de extracción de los premolares y primer molar bilaterales inferiores, lo que hizo un total de 36 implantes en 6 perros. La figura 2 describe las 4 cohortes (grupos A, B, C y D) incluidas en este estudio. Cada grupo recibió 9 implantes.
Figura 2 (derecha) Las cuatro cohortes. LL = Laser-Lok; RBT = texturizado reabsorbible a presión; M = superficie mecanizada.
Fase de extracción quirúrgica
Se realizaron colgajos de espesor total con los animales sometidos a anestesia general con 10 a 12 ml de tiopental sódico (Penthotal, Hospira) y anestesia local mediante lidocaína al 2 % con adrenalina 1:100.000 para la extirpación bilateral de los 4 premolares y primeros molares inferiores. Los colgajos se coaptaron y se suturaron sin tensión con puntos sueltos de catgut crómico 4.0 (Ethicon).
Cada perro recibió 1 g de cefazolina (Apotex) por vía intravenosa o intramuscular cada 3 días durante la primera semana del postperatorio. El dolor postoperatorio se trató mediante la administración de 0,3 mg de hidrocloruro de buprenorfina (Reckitt Benckiser Healthcare) por vía intramuscular cada 12 h durante las primeras 48 h.
Colocación quirúrgica de los implantes
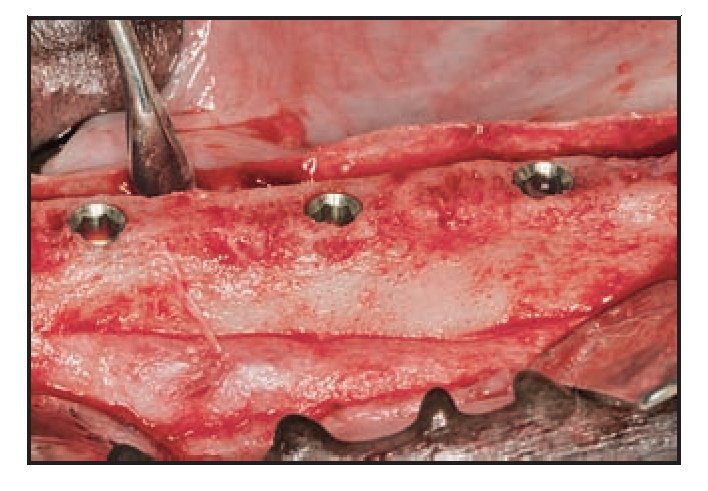
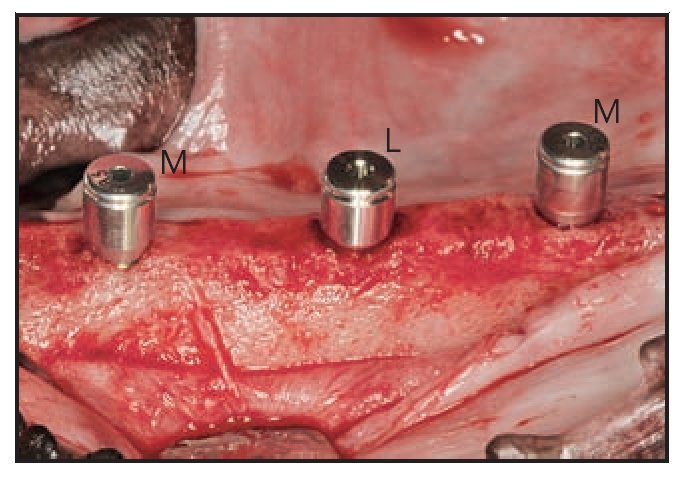
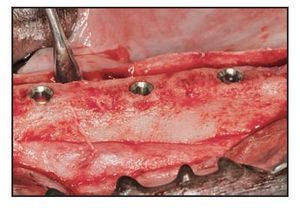
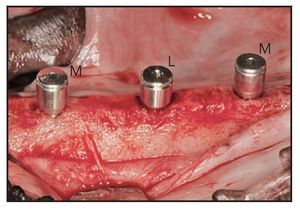
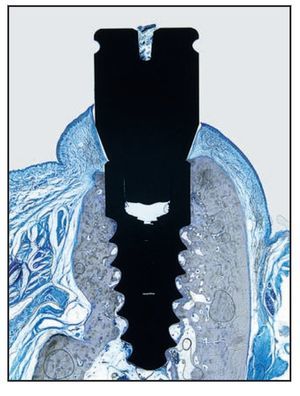
Se realizaron incisiones crestales y se elevaron colgajos mucoperiósticos de espesor total a los 45 días de la extracción. Se colocaron 3 implantes por lado en cada animal según un patrón de distribución aleatoria generado con anterioridad a la cirugía. Dos implantes adyacentes no podían ser del mismo tipo. Se realizaron osteotomías implantarias con instrumentos de reducción de torque a 500 rpm utilizando solución salina estéril. Todos los implantes se colocaron según las directrices del fabricante. Se intentó por todos los medios colocar la plataforma implantaria al nivel de la cresta ósea para permitir una evaluación histológica y mediante micro-TC de los niveles de hueso crestal (figura 3). Los pilares de cicatrización microcanalizados Laser-Lok y los pilares de cicatrización con superficie mecanizada estándar se conectaron a los implantes (figura 4) siguiendo un patrón de distribución aleatorio. Los colgajos mucoperiósticos se cerraron sin tensión y se suturaron con puntos sueltos y puntos en colchonero horizontal de politetrafluoroetileno expandido (Gore-Tex, W.L. Gore). Todos los puntos se retiraron a las 2 semanas.
Figura 3 (izquierda) Las plataformas implantarias se colocaron lo más niveladas posible con la cresta ósea para permitir una evaluación histológica y micro-TC precisa de los niveles de hueso crestal.
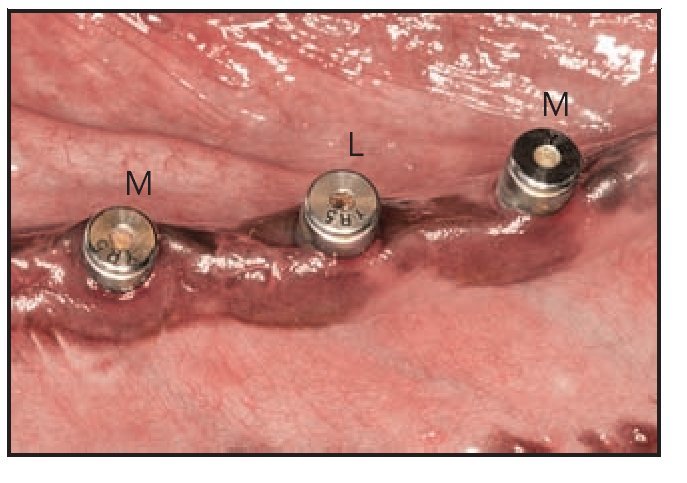
Figura 4 (derecha) Durante la colocación de los implantes se colocó un pilar de cicatrización Laser-Lok con microespiras (L) y pilares de cicatrización con superficie mecanizada estándar (M) en los implantes.
Los 6 perros recibieron una dieta blanda durante el período de cicatrización de 3 meses, tras el cual fueron sacrificados. Se extirparon los maxilares inferiores en bloque y se fijaron inmediatamente para su preparación y evaluación histológica.
Preparación y análisis de las muestras
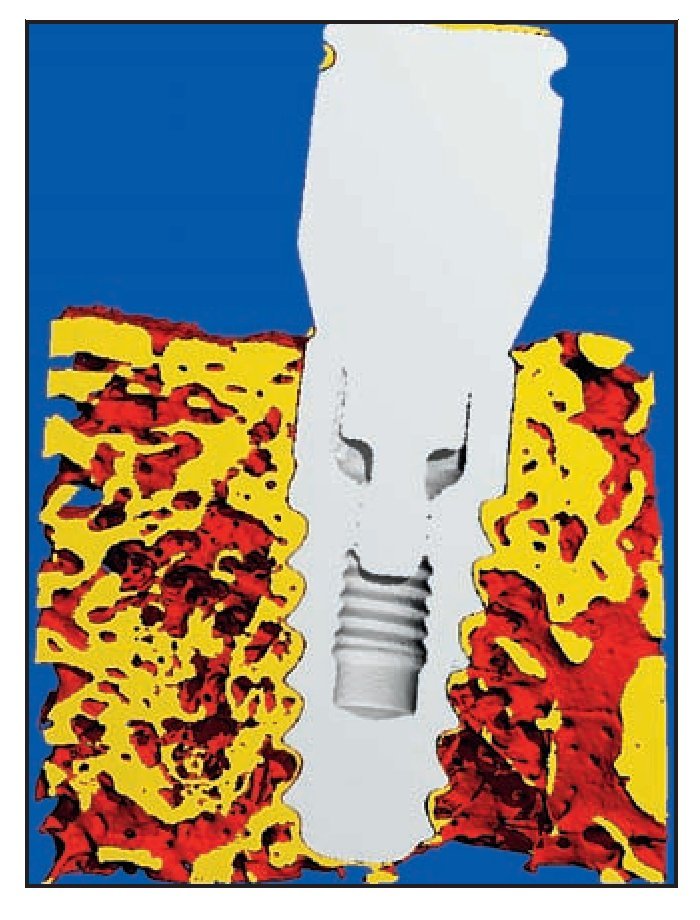
Microtomografía computarizada Las muestras se evaluaron utilizando un sistema de micro-TC de alta resolución (mCT 40, Scanco Medical) en modo multicorte. Cada grupo de datos de imágenes consistió aproximadamente en 600 cortes. Las muestras se escanearon en alta resolución con una resolución x-, y- y z- de 16 mm. Los grupos de datos de imágenes se utilizaron para obtener vistas tridimensionales de las muestras utilizando un software especial (Scanco Medical), creando imágenes de alta resolución del contacto hueso-implante.
Microscopía óptica
Las muestras fijadas se deshidrataron en una serie graduada de etanol utilizando un sistema de deshidratación mediante agitación y vacío. Los bloques se infiltraron con resina Kulzer Technovit 7200 VLC. Las muestras infiltradas se colocaron en moldes de incrustación y se realizó la polimerización bajo luz ultravioleta. Los bloques polimerizados se seccionaron en dirección mesodistal paralela al eje de cada implante. Los cortes se redujeron mediante microfresado y pulido en una unidad Exakt hasta alcanzar un grosor uniforme de 30 a 40 mm. Los cortes se tiñeron con azul de toluidina-Azure II y se examinaron en un estereomicroscopio Leica MZ16 y un microcopio óptico Leica 6000DRB.
Microscopía electrónica de barrido
Las muestras destinadas a MEB se deshidrataron en una serie graduada de acetonas y se desecaron según el método del punto crítico16 utilizando dióxido de carbono como fluido transitorio. La muestras se examinaron al microscopio electrónico de barrido.
Resultados
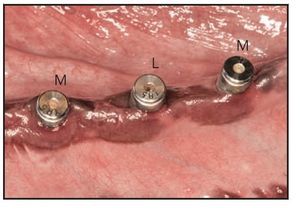
Todos los implantes de prueba y control se habían osteointegrado de forma satisfactoria en el momento del sacrificio a los 3 meses. La cicatrización del tejido blando mucoso periimplantario se produjo sin problemas ni apenas indicios de inflamación (figura 5). No existieron indicios de infección localizada a lo largo del período de cicatrización de 3 meses en ninguna de las zonas implantadas. La pérdida no intencionada de 11 pilares como consecuencia de las mordeduras en las jaulas de los animales redujo el número de pilares disponibles para su estudio. El bajo número resultante imposibilitó un análisis cuantitativo significativo.
Figura 5 Aspecto normal de la mucosa periimplantaria después de 3 meses sin apenas indicios de inflamación alrededor de los pilares de cicatrización Laser-Lok con microespiras (L) y de superficie mecanizada estándar (M).
Grupo A
Observaciones histológicas
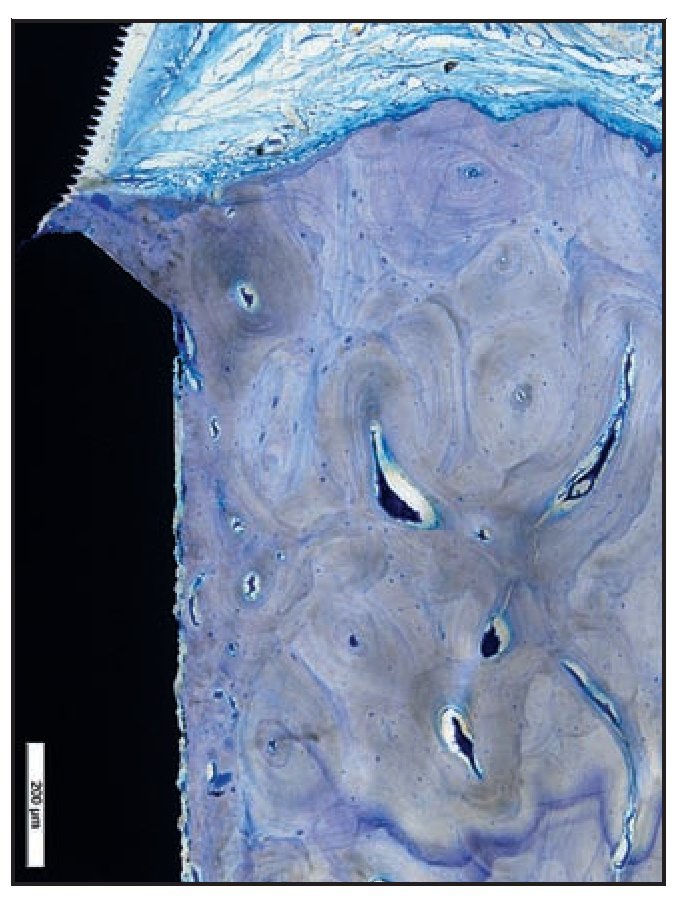
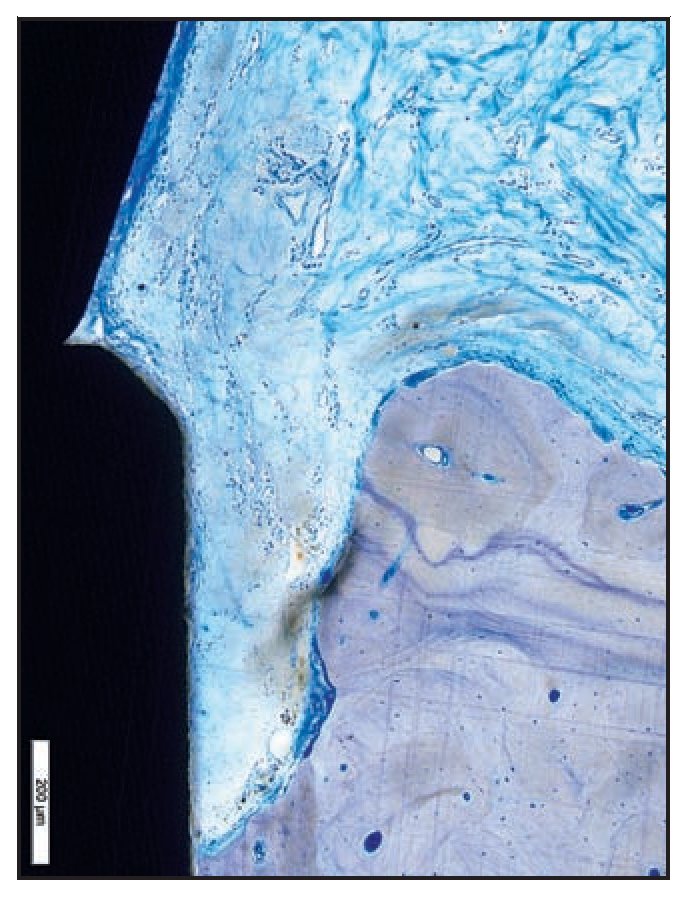
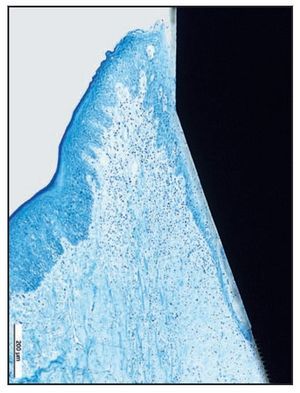
Los tejidos blandos periimplantarios consistieron en una barrera epitelial formada por el epitelio sulcular fusionado con epitelio de la unión (EU). En todas las zonas del grupo A apicales a la UE se apreció una barrera supracrestal discreta de tejido conjuntivo (figura 6a).
Figura 6a En las zonas del grupo A, el EU finalizó en la zona más coronal de las espiras Laser-Lok. Apical al EU se observan fibras de tejido conjuntivo sano insertadas perpendicularmente a los canales tallados con láser.
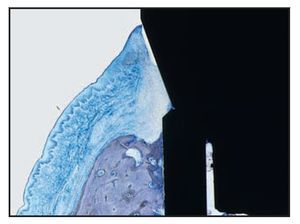
La UE finalizó en la posición más coronal de los microcanales Laser-Lok del pilar, donde se observó una zona de fibras de tejido conjuntivo perpendicular a la banda de las microespiras. En dos muestras del grupo A (figuras 6b y 6c) se apreció una inserción de hueso coronal a la superficie del pilar con microcanales apical a las fibras de TC orientadas perpendicularmente. De esa forma, la microgrieta mediada por la UIP fue eliminada por el contacto huesoimplante cornal a la UIP (figuras 6b a 6e). Es importante destacar que no se observó un EU largo en los cortes histológicos del grupo A.
Figura 6b En esta muestra del grupo A se observa hueso regenerado insertado en la superficie del pilar Laser-Lok y la ausencia de la microgrieta de la UIP.
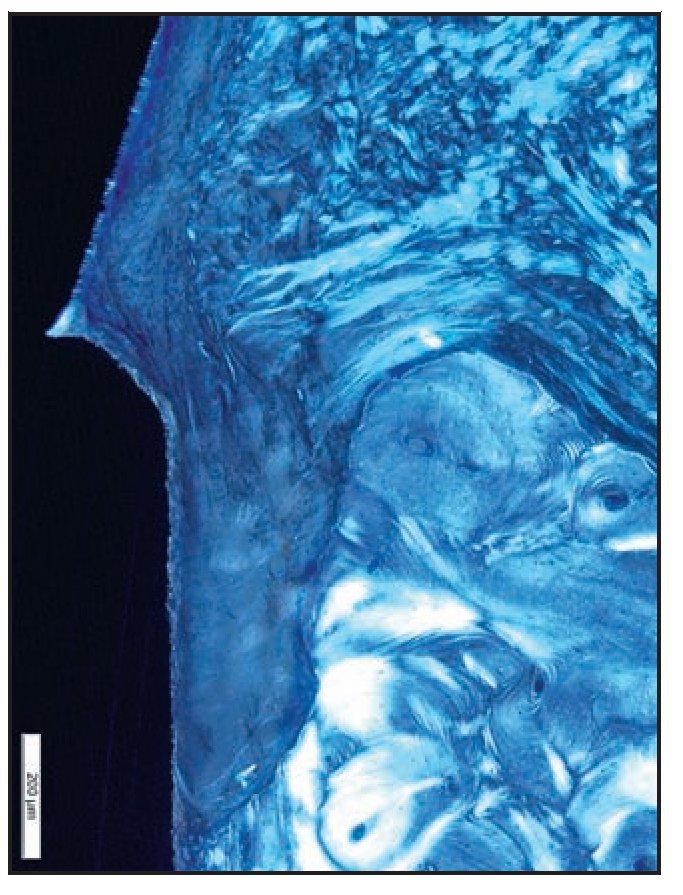
Figura 6c Imagen con luz polarizada que muestra las fibras de tejido conjuntivo insertadas perpendicularmente en la superficie del pilar con microespiras.
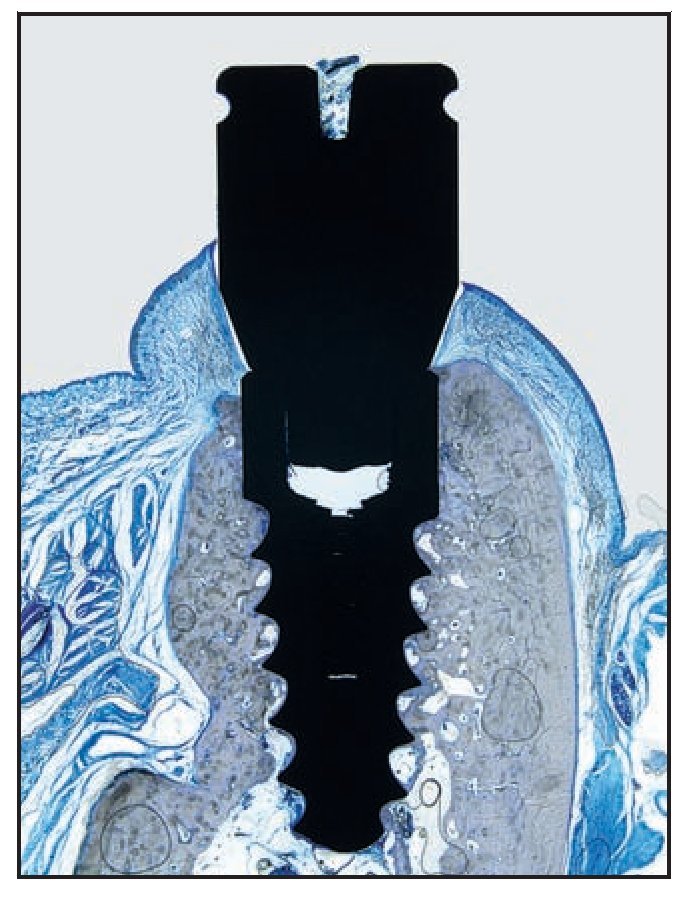
Figura 6d (izquierda) Imagen al microscopio óptico de una muestra del grupo A. Obsérvese el contacto hueso-implante.
Figura 6e (derecha) Imagen a grandes aumentos de la figura 6d que muestra la regeneración ósea en la interfaz de la UIP, eliminando de forma eficaz la microgrieta de la UIP.
Observaciones micro-TC y MEB
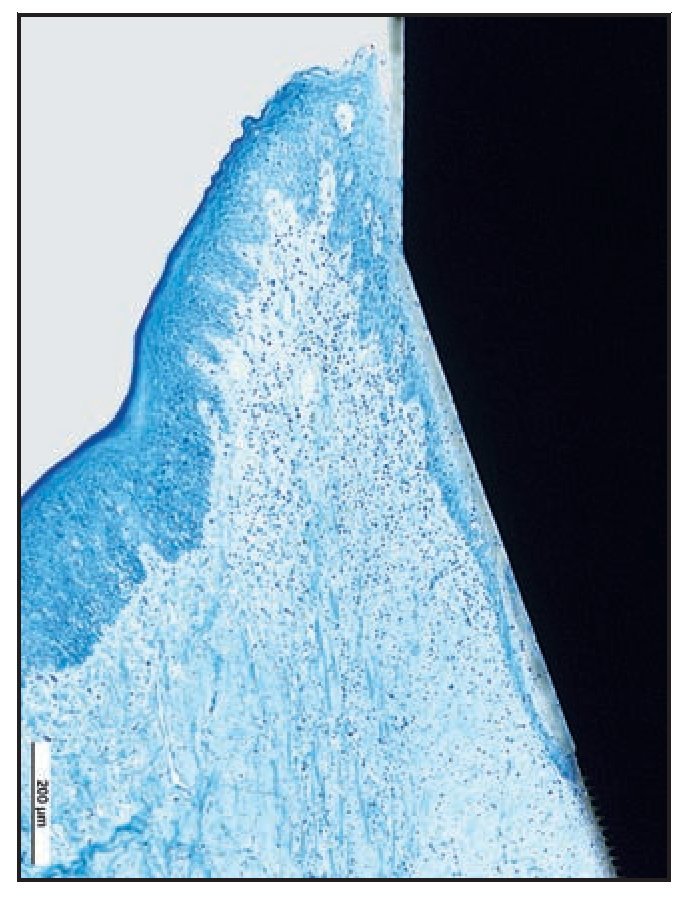
El examen micro-TC corroboró los resultados histológicos. Se apreció contacto íntimo entre el hueso y el implante extendiéndose hacia el cuello del implante RBT (figura 6f).
Figura 6f (izquierda) Micro-TC de una muestra del grupo A que corrobora los resultados de la microscopía óptica, como el excelente contacto hueso-implante hasta la UIP. No se produjo reabsorción de hueso crestal.
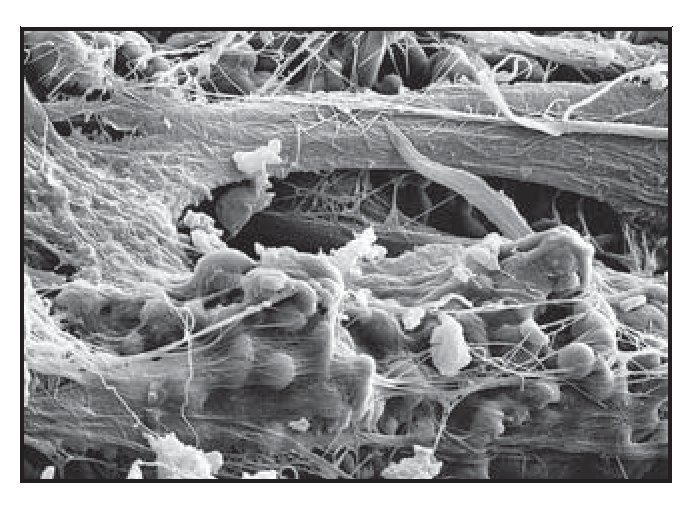
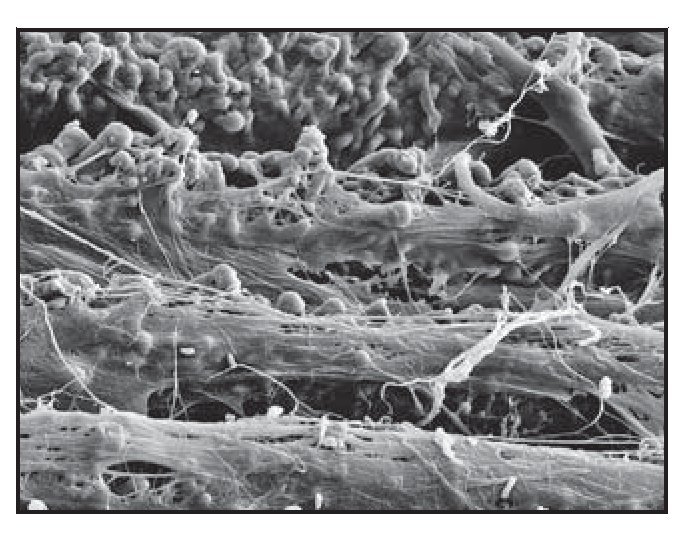
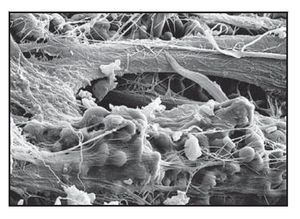
El análisis al MEB demostró redes densas de tejido conjuntivo insertadas en la totalidad de la superficie de los pilares tallada con láser (figura 6g). Esto pareció actuar como una barrera impenetrable a la migración apical del EU. Se observó que las fibras de colágeno normalmente orientadas de forma circunferencial se entrelazaban con las fibras de tejido conjuntivo mencionadas anteriormente orientadas de forma perpendicular.
Figura 6g (derecha) Intensa actividad celular fibroblástica en las zonas de las microespiras Laser-Lok de las muestras del grupo A. Se observan redes densas de fibras de tejido conjuntivo insertadas en los microcanales tallados con láser.
Grupo B
Observaciones histológicas
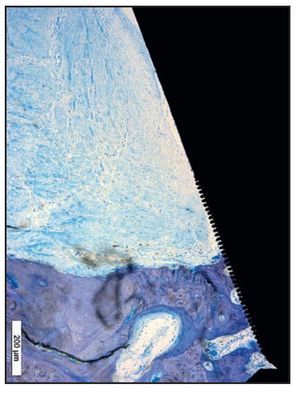
Los tejidos blandos periimplantarios epiteliales fueron idénticos a los observados en el grupo A. El EU finalizó en la posición más coronal de las microespiras del pilar Laser-Lok (figura 7a). Orientadas de forma funcional, las fibras de tejido conjuntivo dirigidas perpendicularmente se yuxtapusieron íntimamente contra la banda de microcanales Laser-Lok (figura 7b). Apical a esta banda de fibras de tejido conjuntivo se observó hueso regenerado osteointegrándose con el cuello mecanizado de los implantes RBT. Ninguna zona del grup B mostró migración apical del EU.
Figura 7a Las muestras del grupo B mostraron hueso nativo y de nueva formación (mancha más oscura) en la superficie del implante. Esto probablemente sea resultado de la corrección de la disparidad del fresado, pero se evidencia que las fibras de tejido conjuntivo supracrestal impiden la migración apical del epitelio, lo que permite que el hueso responda en un entorno aséptico.
Figura 7b Muestra del grupo B con fibras de tejido conjuntivo orientadas perpendicularmente contra toda la superficie de la zona Laser-Lok espirada.
Observaciones MEB
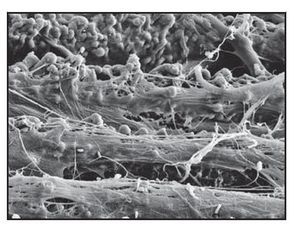
El examen ultraestructural de las muestras del grupo B arrojó resultados idénticos al de las muestras del grupo A. Masas densas de fibras de tejido conjuntivo entrelazado ocuparon todas las superficies de los microcanales Laser-Lok (figura 7c).
Figura 7c Imagen al MEB de una muestra del grupo B que presenta una intensa actividad fibroblástica en las superficies espiradas por el láser, lo que da lugar a una densa red de fibras de tejido conjuntivo entrelazadas que actúan como barrera natural para la migración apical del epitelio.
Grupo C
Observaciones histológicas
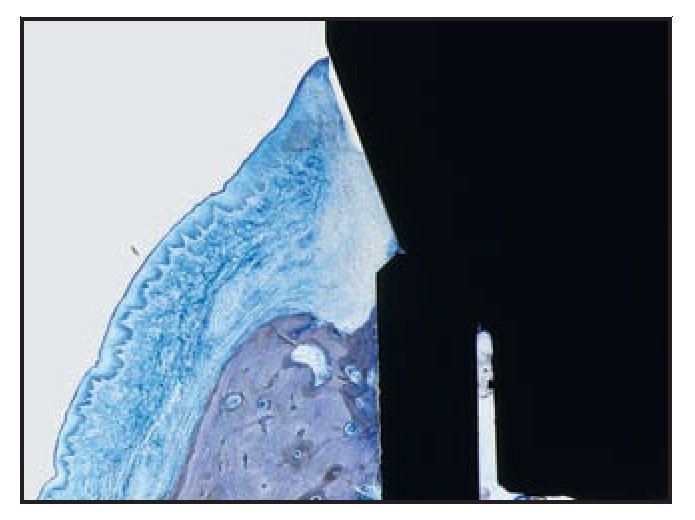
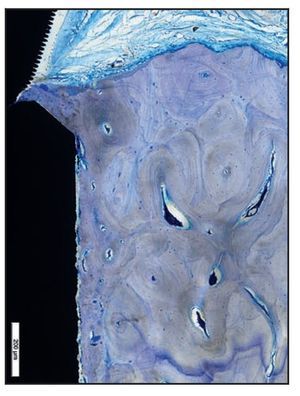
En algunas zonas del grupo C se demostró la migración apical del EU (figura 8a). La imposición de un EU largo en toda la superficie del pilar y el cuello del implante (figura 8b) evitó que las fibras de tejido conjuntivo formasen la barrera protectora y fueran responsables de un nivel óseo más apical.
Figura 8a Se observa un EU largo en toda la superficie del cuello del implante y el pilar, impidiendo que las fibras de tejido conjuntivo formen la barrera protectora observada en los grupos A y B.
Figura 8b Imagen de luz polarizada de una zona del grupo C que muestra las fibras de tejido conjuntivo paralelas al pilar de cicatrización mecanizado sin indicios de fibras de tejido conjuntivo insertadas perpendicularmente.
Observaciones MEB
Las imágenes ultraestructurales del grupo C demostraron una ausencia prácticamente completa de inserción de fibras de tejido conjuntivo en las superficies del pilar o del implante (figura 8c). No se observó regeneración ósea en aposición a las superficies del pilar o del cuello del implante. La microgrieta de la UIP permaneció expuesta significativamente al entorno circundante.
Figura 8c Imagen al MEB de una muestra del grupo C que no muestra fibras de tejido conjuntivo insertadas en las superficies del pilar ni del implante. La microgrieta de la UIP permanece expuesta al lecho tisular circundante.
Grupo D
Observaciones histológicas
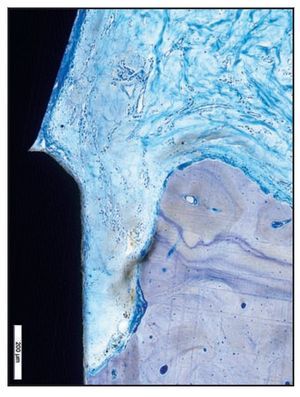
La ausencia de microcanales Laser-Lok provocó la migración apical del EU y una cierta pérdida de hueso crestal (figura 9a). La imposición de un EU largo extendiéndose a la cresta alveolar dio lugar a fibras de tejido conjuntivo paralelas a las superficies del pilar y del implante (figura 9b).
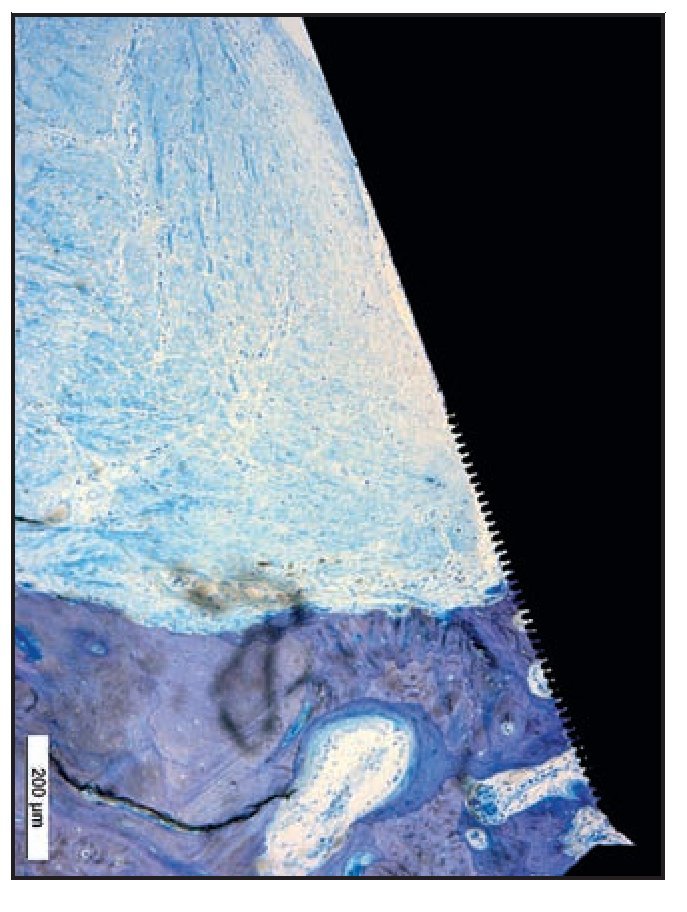
Figura 9a Imagen a grandes aumentos de una muestra del grupo D que presenta migración apical del EU, lo que provoca una reabsorción significativa del hueso crestal.
Figura 9b En la imagen de luz polarizada esta zona del grupo D presenta claramente fibras de tejido conjuntivo que corren paralelas contra las superficies del pilar y del cuello del implante. Además, se aprecia una pérdida significativa de hueso crestal.
Observaciones MEB
Los hallazgos ultraestructurales observados en las muestras del grupo D fueron similares a los observados en el grupo C. Se demostró la presencia mínima de inserción de tejido conjuntivo en las superficies del pilar o del implante. Las imágenes al MEB revelaron una UIP sin cubrir con fibras de tejido conjuntivo o hueso, exponiendo las microgrietas importantes al entorno circundante (figura 9c).
Figura 9c Al igual que en el grupo C, la imagen al MEB muestra la casi total ausencia de fibras de tejido conjuntivo cubriendo las superficies del pilar de cicatrización o del cuello del implante. La microgrieta de la UIP permaneció expuesta al lecho tisular circundante.
Discusión
La reabsorción o «secado» del hueso crestal observada comúnmente hasta la primera rosca del implante situada coronalmente después de conectar el pilar amenaza el equilibrio necesario entre el hueso subyacente estable y los tejidos blandos suprayacentes. Se han sugerido múltiples causas para esta reabsorción no deseable del hueso crestal, como la necesidad inherente de una anchura biológica mínima (del mismo modo que se observa en la dentición natural), y el infiltrado de bacterias y células inflamatorias presentes en la microgrieta de la UIP1,6,7. Este tejido conjuntivo inflamatorio repleto de células adyacentes a la microgrieta de la UIP fuerza el reposicionamiento del tejido conjuntivo periimplantario no inflamado y del hueso crestal en dirección apical. La relación espacial relativamente constante entre la UIP y la cresta alveolar confirma la posición aproximada de 1,5 a 2 mm apical a la cresta ósea en relación con la interfaz del implante3,17,18.
Una profundidad y anchura entre 8 y 12 mm de las microespiras talladas con láser en la superficie del implante parecen regular la migración y la orientación de las células epiteliales, fibroblásticas y osteoblásticas en la superficie alterada topográficamente13,15,16,19-22. Un estudio demostrativo reciente realizado de forma prospectiva en seres humanos demostró que la configuración de 8 a 12 mm de estas microespiras en el cuello de los implantes dentales permitió que el tejido conjuntivo supracrestal se insertase directamente en el cuello del implante15. Las modificaciones de la superficie del pilar también pueden ser eficaces para prevenir la pérdida de hueso crestal observada habitualmente, de modo muy similar a lo que se ha demostrado con las modificaciones de la superficie del implante22. Investigaciones anteriores examinaron múltiples variables relacionadas con el pilar que afectan a las inserciones alrededor del implante y del pilar importantes para determinar los niveles posteriores de hueso periimplantario12,23-29. Los resultados sugieren que las características de la superficie de los componentes del pilar influyen en el comportamiento de las células epiteliales, fibroblásticas y osteoblásticas en la interfaz implante-pilar.
El estudio aquí descrito subraya de forma espectacular los efectos que la geometría de la superficie tridimensional tiene en el comportamiento celular de la interfaz pilar-tejido. La presencia de una zona microcanalizada de 0,7 mm tallada con láser favoreció una intensa actividad fibroblástica constante en la superficie espirada del pilar, lo que provocó un complejo entrelazado denso de fibras de tejido conjuntivo orientadas perpendicularmente a la superficie del implante que actuaron como barrera física frente a la migración apical del EU. La inhibición de la migración apical del EU previno la reabsorción del hueso crestal en los grupos A y B. Es significativo que en dos casos se produjera la regeneración ósea coronal a la UIP y en la superficie del pilar, eliminando por completo las secuelas negativas de la microgrieta en la UIP.
Por el contrario, los pilares de los grupos C y D, que no disponían de superficies con microespiras talladas con láser, apenas presentaron indicios de actividad fibroblástica sólida en la interfaz pilar-tejido. Un EU largo se extendió por las superficies del pilar y el cuello del implante, evitando la formación de la barrera de tejido conjuntivo fisiológico y provocando la reabsorción del hueso crestal. Se observó la aposición de las fibras de tejido conjuntivo orientadas de forma paralela en lugar de perpendicular en la superficie implante-pilar.
Conclusiones
Este estudio preclínico demostrativo sugiere que las modificaciones de la superficie implantaria cuidosamente diseñadas pueden prevenir de forma eficaz lo que a menudo se percibe como el retroceso fisiológico o inevitable de la cresta ósea tras la conexión del pilar. Los resultados sugieren que la pérdida de 1,5 a 2 mm de hueso crestal tras la conexión del pilar que permite acomodar el espacio necesario para el componente del tejido conjuntivo de la anchura biológica puede, en realidad, no ser un suceso inevitable desde el punto de vista fisiológico. El estudio también sugiere que puede ser necesario un cambio en la percepción y el manejo clínico de los pilares. Sin embargo, los pilares con microespiras en su superficie, si bien arrojan resultados y perspectivas fascinantes que invitan a la reflexión, deben evaluarse en un estudio en seres humanos para verificar los resultados actuales. Adicionalmente, debe evaluarse también la cuestión de si los efectos beneficiosos sobre los tejidos duros y blandos pueden mantenerse mediante la manipulación repetida de la interfaz implante-pilar.
N.T.: La comercialización y el uso de suturas de catgut están prohibidos en España (y en otros países europeos) desde el 7 de febrero de 2001 como medida de precaución ante el riesgo de transmisión de la encefalopatía espongiforme bovina (EEB).
Agradecimientos
Los autores desean agradecer la ayuda del Dr. Stuart Kay (Huntington, Nueva York) en la organización y producción de este manuscrito. Este estudio fue financiado mediante una beca de BioHorizons.
Correspondencia: Dr Myron Nevins,
Harvard School of Dental Medicine, 188 Longwood Avenue, Boston, Massachusetts 02115;
e-mail: nevinsperimp@aol.com.