El blanqueamiento dental domiciliario constituye una alternativa simple y económica de entre las opciones de tratamiento estético con resina adhesiva. La técnica descrita por Haywood y Heymann1 en 1989 sigue siendo excelente en cuanto a la seguridad que ofrece el uso de agentes blanqueadores aplicados, a concentraciones bajas, sobre moldes individuales. Actualmente, y con la finalidad de llevar a cabo un blanqueamiento dental en un período de tiempo inferior, se dispone de nuevos sistemas de blanqueamiento que ya no utilizan moldes y contienen agentes blanqueadores a concentraciones más altas de peróxido de carbamida, oscilando del 16 al 22 %, y de peróxido de hidrógeno, cuya concentración oscila entre el 6,5 y el 14 %2-4.
Para aumentar la acción y el efecto del peróxido de carbamida se sugirió el uso de agentes espesantes. El agente espesante utilizado más habitualmente es el carbopol, un polímero sintético a base de ácido acrílico que transforma el agente blanqueador en gel, lo que permite colocarlo en un molde individual o su fabricación en tiras de plástico. Una concentración elevada de carbopol torna el agente blanqueador más espeso y mejora su adherencia a la estructura de la superficie dental, lo que a su vez permite que el peróxido de carbamida tenga una liberación constante y prolongada, de forma exponencial tras la primera hora, a un ritmo del 10 % por hora en una evaluación de 10 horas de duración5,6. Por otro lado, la ausencia de carbopol comprometería el efecto blanqueador debido a la excesiva rapidez de liberación y causaría la descomposición del peróxido en el interior de la cavidad oral5.
Puesto que el propósito de incorporar carbopol consiste simplemente en aumentar la consistencia de los agentes blanqueadores, no debería producir efectos adversos de ningún tipo en los dientes. No obstante, el carbopol es una sustancia ácida y si por un lado su pH bajo constituye una ventaja para aumentar su vida media, dado que los peróxidos son más estables en soluciones ácidas,7 por otro lado puede contribuir a desmineralizar el esmalte dental durante su tiempo de acción.
En algunos estudios se sugiere que las alteraciones en el contenido mineral del esmalte tras un tratamiento de blanqueamiento están relacionadas con los peróxidos. Rodrigues y cols.8 demostraron una reducción de la microdureza del esmalte dental en humanos tras un tratamiento con geles blanqueadores o con el agente espesante carbopol in vitro. Basting y cols.9 no hallaron diferencias significativas en términos de microdureza del esmalte dental tras aplicar un tratamiento con peróxido de carbamida al 10 % como agente blanqueador y un placebo que contenía carbopol y glicerina. Los mismos autores demostraron que un tratamiento aislado con peróxido de carbamida al 10 %, carbopol, glicerina y sus asociados in vitro redujeron la microdureza del esmalte9. Rodrigues y cols.8 también observaron diferencias significativas en la microdureza del esmalte tras llevar a cabo un tratamiento in situ con un sistema de blanqueamiento que incluía peróxido de carbamida al 10 % o carbopol8.
Así pues, cabe la posibilidad de que el carbopol contribuya a las alteraciones observadas en el esmalte dental durante un tratamiento blanqueador. A pesar de que el carbopol es el agente espesante más comúnmente empleado en los sistemas de blanqueamiento, determinados sistemas emplean otros agentes espesantes, como el poloxámero. Sin embargo, no existe información acerca del uso de estos sistemas que no emplean carbopol, sobre el tejido dental. Por ello es importante valorar los efectos de estos agentes espesantes sobre el esmalte dental. El objetivo de este estudio consistió en evaluar los efectos sobre la microdureza del esmalte dental in situ en humanos causados por los tratamientos llevados a cabo con distintos sistemas de blanqueamiento y con sus agentes espesantes.
Método y materiales
Aspectos éticos
Dado que este estudio se llevó a cabo utilizando dientes humanos adheridos a los primeros molares superiores de voluntarios humanos, el protocolo tuvo que ser sometido al Research Ethics Committee de la Universidad de Guarulhos, Guarulhos, Brasil, y fue aprobado de acuerdo con la resolución CNS nº 196/96 del Comité Nacional de Salud/Departamento de Sanidad (Brasil). Los voluntarios firmaron un consentimiento informado conforme estaban de acuerdo con la metodología y el protocolo de la investigación.
Diseño del experimento
Las unidades experimentales consistieron en 90 láminas de esmalte dental asignadas de forma aleatoria entre los 45 individuos, que fueron divididos en 5 grupos con dos planchas por cada individuo (n = 18 láminas por grupo). Las variables específicamente evaluadas fueron el tratamiento experimental y el tiempo. Se determinaron 5 grupos experimentales: grupo 1, tratamiento en el propio domicilio con peróxido de carbamida al 10 % y carbopol; grupo 2, tratamiento domiciliario con carbopol; grupo 3, tratamiento domiciliario con peróxido de carbamida al 10 % y sin carbopol; grupo 4, tratamiento domiciliario con poloxámero, y grupo 5, tratamiento domiciliario con peróxido de hidrógeno al 6,5 %. El factor tiempo se consideró antes (control) y después del tratamiento experimental (tabla 1).
Preparación de las láminas dentales
Tras la extracción de 27 terceros molares no erupcionados originarios de especímenes humanos, éstos se sumergieron en una solución al 0,1 % de timol (pH = 7,0) durante menos de 30 días. Se eliminaron los tejidos blandos mediante curetas periodontales (Hu-Friedy) y se limpiaron con una pasta a base de piedra pómez aplicada con una copa de goma de pulir accionada con un pieza de mano de bajas revoluciones (KaVo). Se eliminaron las raíces y las coronas se seccionaron longitudinal y transversalmente mediante discos de diamante de doble corte (Nº 7020, KG Sorensen) para obtener 90 láminas con un tamaño de 3 x 3 x 2 mm.
Las láminas dentales se alisaron con un esmerilador mecánico refrigerado por agua (Teclado PL 02,RB LAB Com e Técnica), puliendo las superficies en serie empleando un disco de papel abrasivo a base de óxido de aluminio en una progresión del tamaño del grano de 400, 600 y 1.200 (Carborundum, 3M), para obtener unas superficies del esmalte planas. Subsecuentemente, se pulieron con pastas de pulir a base de diamante de 6, 3 y 1 m y paños pulidores con aceite mineral lubricante (Gold and Ram, Arotec) que facilitará la visualización a la hora de comprobar la microdureza.
Finalmente, las láminas se sumergieron en contenedores con agua destilada y desionizada y esterilizada mediante autoclave (Vitale 12L, Cristófoli Equipamentos de Biossegurança) a 121ºC durante 20 minutos.
Selección de los individuos y preparación de una cubeta domiciliaria
Antes de participar en el estudio, los individuos recibieron información acerca de los objetivos, los efectos beneficiosos y los posibles riesgos derivados de este estudio y únicamente fueron aceptados para participar en el mismo una vez hubieron firmado el formulario de consentimiento informado. Los voluntarios fueron clínicamente evaluados, siendo un requisito imprescindible disponer de todos los dientes superiores libres de caries. Los criterios de exclusión incluían la presencia de prótesis fija o removibles, de aparatos de ortodoncia, estar embarazada o estar en período de lactancia, ser fumador y tener sensibilidad dentinaria. Los individuos sumaron un total de 45 (30 mujeres y 15 hombres) de edades comprendidas entre los 18 y los 44 años, con una media de edad de 27 años.
Cada participante recibió instrucciones de cómo llevar a cabo la técnica de cepillado dental de Bass, con la ayuda de un cepillo profesional (Colgate Professional, Colgate Palmolive). Todos los participantes emplearon una pasta dentífrica sin flúor (Angel Form, F & A Laboratório) durante el período de estudio. Todos ellos recibieron un tratamiento profiláctico completo una semana antes de empezar con el tratamiento blanqueador.
A excepción del quinto grupo, para cada participante se elaboró una cubeta de blanqueamiento flexible individualizada de 0,8 mm de grosor, a base de una capa de polímero de acetato de etilvinilo, en una máquina formadora al vacío (Nitewhite, Vacuum Former Pro Form).
Sobre los modelos empleados para fabricar las cubetas, se elaboraron unos reservorios aplicando dos capas de barniz de uñas (Colorama/CEIL) sobre la superficie facial de los dientes que se deseaba blanquear, a excepción de los primeros molares superiores, para los que se prepararon unos depósitos con un tamaño de 3 x 3 x 2 mm con resina de composite (Z 100, 3M ESPE), que se correspondían con las láminas dentales que se unirían a los dientes de los voluntarios.
Fase experimental
Los primeros molares superiores se aislaron mediante un dique de goma para evitar contaminar la zona con saliva durante la adhesión de las láminas sobre los dientes. Las superficies faciales de los primeros molares superiores de los voluntarios se grabaron con ácido fosfórico (35 %) durante 15 segundos, se enjuagaron durante 10 segundos y se secaron cuidadosamente. Siguiendo las instrucciones del fabricante se aplicó Single Bond (3M ESPE) y se fotopolimerizó durante 10 segundos con la ayuda de una unidad de fotopolimerización (Optlight Plus, Gnatus Equipamentos Médico-Odontológicos). Se mezcló Rely X (ARC cement, 3M ESPE) y se aplicó a la cara opuesta de la superficie del esmalte pulida de la lámina. A continuación, la plancha se posicionó sobre la superficie facial del primer molar superior derecho y el cemento se fotopolimerizó durante 40 segundos. Siguiendo el mismo procedimiento se unió otra plancha a la superficie facial del primer molar superior izquierdo8.
Cada participante recibió una cubeta de blanqueamiento a medida para los dientes superiores, para llevar a cabo el tratamiento de blanqueamiento domiciliario, a excepción del quinto grupo, cuyos participantes recibieron 84 tiras de peróxido de hidrógeno al 6,5 % (Crest Whitestrips) que deberían utilizar durante 30 minutos cada día (por la mañana y por la tarde). Con objeto de garantizar el blanqueamiento de la lámina, los participantes utilizaron dos tiras por cada tratamiento, una para cada hemiarcada. Para los participantes de los grupos primero al cuarto se eligió un tratamiento nocturno con la esperanza de que el tratamiento se acercara más a las expectativas o conveniencias de los pacientes, y con objeto de mejorar la retención del material como resultado de la menor salivación y de la menor cantidad de interferencias posibles entre la cubeta de blanqueamiento y el paciente durante la noche.
Se pidió a los participantes de los grupos 1 al 4 que cepillaran sus dientes y utilizaran el hilo de seda dental con regularidad. Tras ello, se les pidió que pusieran una gota de gel para cada diente en la cubeta de blanqueamiento maxilar y que la llevaran durante un mínimo de 8 horas, mientras dormían8.
Tras el período de blanqueamiento, las láminas se retiraron con sumo cuidado con la ayuda de unas pinzas ortodóncicas y el cemento residual se eliminó con la ayuda de discos de óxido de aluminio (Sof-Lex, 3M ESPE). Se instó a los participantes a que continuaran el tratamiento de blanqueamiento, tanto en los dientes superiores como en los inferiores, y a que cambiaran las restauraciones estéticas allí donde se considerara necesario.
Pruebas de microdureza
Las pruebas de microdureza se llevaron a cabo por parte de un único evaluador antes de iniciar el tratamiento de blanqueamiento, como control, y justo después de haber retirado las láminas, según Rodrigues y cols.8 Tal como recomienda Sien10, en ambos puntos temporales se evaluaron 5 indentaciones. Las medidas de inicio se tomaron tras la esterilización de las planchas. Las indentaciones se realizaron en el centro de cada espécimen con una distancia de 30 µm entre cada medición6. Desde la esquina superior derecha de las planchas se midió una distancia de 1,5 µm sobre le eje horizontal y 1,5 µm sobre el eje vertical, para localizar y situar el centro de la plancha. Seguidamente se procedió a realizar una indentación. Se realizaron dos indentaciones adicionales más por encima de la marca y dos por debajo de la misma, manteniendo una distancia entre sí de 30 µm8. Las indentaciones se realizaron manteniendo el eje vertical largo del instrumento adiamantado en paralelo respecto a la superficie del esmalte que sobresalía y utilizando un comprobador de microdureza (Pan Tec Panambra) y un indentador Knoop. Durante 5 segundos se aplicó una fuerza de 25 g y se midió el valor de la diagonal más elevada. Las mediciones finales siguieron el mismo protocolo que las empleadas al inicio, a excepción de la posición horizontal. Para determinar la posición final de las cinco indentaciones se incluyeron 100 µm adicionales hasta un total de 1.600 µm8.
Análisis estadístico
Se analizaron estadísticamente las medias de las medidas de dureza de Knoop obtenidas para cada espécimen al inicio y al final del tratamiento. Los datos se cambiaron a log10(x) y estuvieron sujetos a un análisis de variancia split-plot (análisis de variancia factorial mixto, con un factor intersujetos y otro intrasujetos), que mostró diferencias estadísticamente significativas, seguidas de la prueba de Tukey (α= 0,05).
Resultados
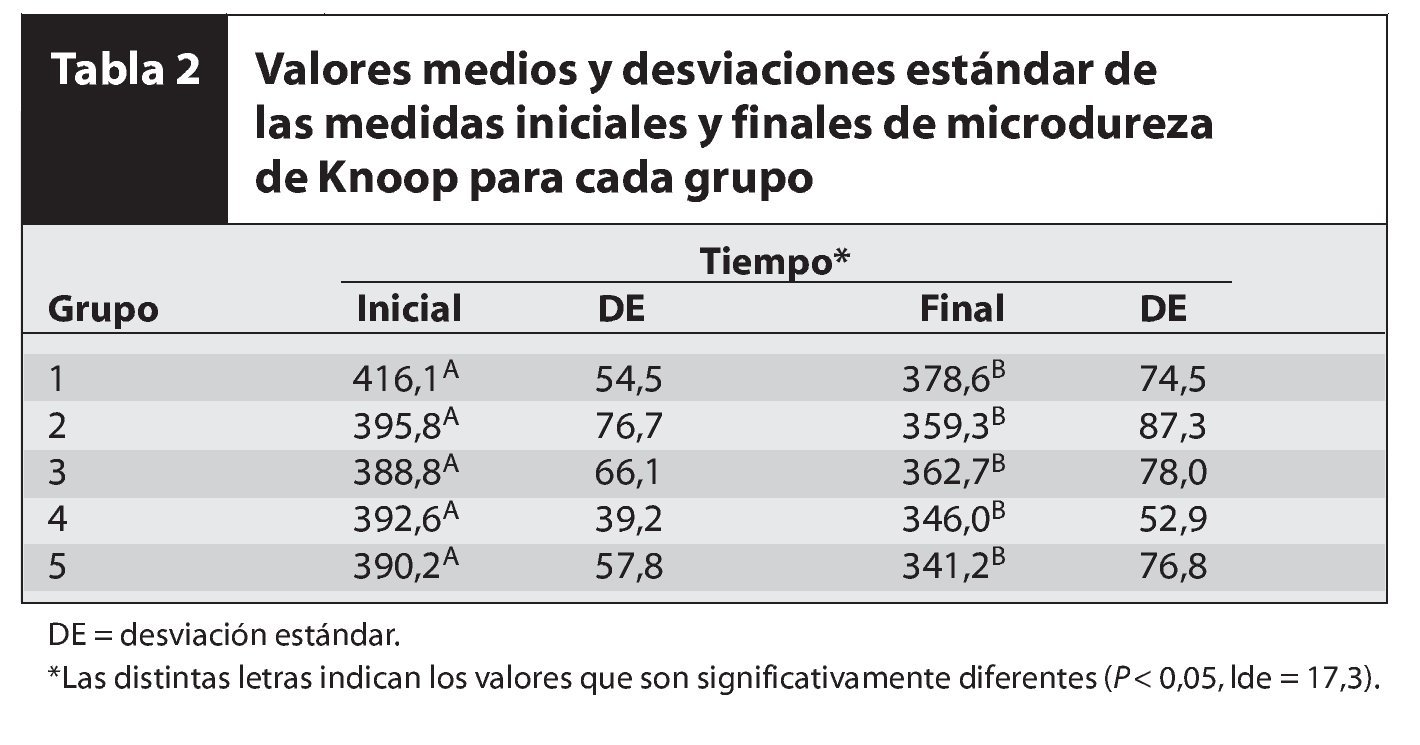
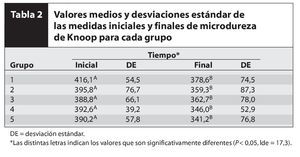
La tabla 2 muestra los valores medios de la microdureza del esmalte antes y después del tratamiento experimental, junto con sus respectivas desviaciones estándar y sus coeficientes de variación. El análisis de variancia y las pruebas de Tukey revelaron diferencias estadísticamente significativas en cuanto al tiempo -inicio y final (F = 20,6; P > 0,0001). No se registraron diferencias estadísticamente significativas en los tratamientos experimentales (F = 0,9; P = 0,5826) en cuanto tanto al tratamiento experimental como al tiempo (F = 0,2; P = 0,9016).
Comentarios
Sigue sin existir una explicación fiable acerca de los mecanismos por los que se rige el blanqueamiento dental. Se sabe que en la reacción de reducción del óxido de los peróxidos se liberan radicales libres que favorecen la rotura de las moléculas de pigmento2. Se especula si esta reacción, ante la presencia constante de un peróxido, podría conllevar la disolución de la matriz orgánica e inorgánica del diente hasta que queden exclusivamente dióxido de carbono y agua. Además, es importante determinar el punto de saturación del blanqueamiento dental, punto en el que debería interrumpirse el tratamiento dado que el diente deja de blanquearse y la aplicación adicional de la pasta de peróxido podría llegar a ser perjudicial11. No obstante, la reacción blanqueadora no es específica y ya desde el primer contacto del agente blanqueador con el esmalte dental se podría esperar que se experimentasen efectos adversos, tal como se ha demostrado a partir de varios estudios in vitro12-15.
Este estudio evaluó los efectos de los agentes blanqueadores y sus agentes espesantes sobre la superficie del esmalte dental en humanos, por medio de la prueba de Knoop para la microdureza de la superficie. El análisis de la microdureza del esmalte aporta pruebas indirectas sobre la pérdida y la ganancia mineral en los dientes humanos y tiene la ventaja de tratarse de una prueba que no es invasiva. Es decir, las pruebas pueden llevarse a cabo tanto antes como después del tratamiento en la misma muestra del experimento in vitro. Con este estudio se comprobó que tras haber aplicado un tratamiento con todos los sistemas de blanqueamiento se había producido pérdida de la microdureza, resultado que concordaba con otros estudios in vitro en los que se había registrado una reducción progresiva de la microdureza estadísticamente significativa como resultado de la aplicación del blanqueamiento dental. A pesar de la adición de calcio o flúor a los diferentes sistemas blanqueadores, se obtuvieron resultados similares tras realizar el blanqueamiento15-17.
Por otro lado, algunos estudios valoraron la microdureza del esmalte dental en humanos a partir de las pruebas de dureza Vickers y no observaron diferencias estadísticamente significativas respecto al esmalte sin blanquear2,3,18-20. Sin embargo, Attin y cols.21 utilizaron dos pruebas diferentes para evaluar la microdureza en las mismas muestras en las que se había llevado a cabo el tratamiento blanqueador con los distintos sistemas de blanqueamiento: midieron la microdureza con la prueba de Knoop y con la de Vickers a una distancia de 500 µm. Según la prueba de Knoop, se registró una reducción estadísticamente significativa de la microdureza final respecto a la inicial. Con la prueba de Vickers para la microdureza, únicamente el grupo que había sido tratado con ácido cítrico (pH = 3,7) presentó una reducción significativa de la misma comparada con la obtenida al inicio. Esto sugería que la evaluación de la microdureza mediante las pruebas de Knoop utilizadas en el presente estudio era más favorable, por ser éstas más sensibles a las alteraciones del contenido mineral.
Existen algunos estudios similares a éste, aunque escasos, que valoran el efecto del blanqueamiento sobre el esmalte dental en condiciones clínicas8,22,23. No obstante, únicamente Shannon y cols.22, a partir de la valoración de la microdureza del esmalte tratado in vitro con peróxido de carbamida al 10 % e in situ en saliva, constataron que no habían hallado diferencias estadísticamente significativas tras el blanqueamiento, aunque sí observaron alteraciones morfológicas a través del microscopio electrónico de barrido.
Los estudios realizados por Basting y cols.23 y Rodrigues y cols.8 empleando metodologías in situ por las que los voluntarios llevaban, además, fragmentos de esmalte fijados a la cavidad oral durante tres semanas, señalan que el tratamiento con peróxido de carbamida al 10 % aplicado durante 8 horas obtuvo valores de menor microdureza, hecho que concuerda con los resultados obtenidos en el presente estudio. Además, Türkun y cols.24 afirmaron que la aplicación de peróxido de carbamida al 10 % in vivo durante sólo 2 horas había provocado la formación de microporosidades, lo que sugiere que hubo una cierta pérdida mineral tras el blanqueamiento dental.
En la presente valoración in situ, y tras 21 días de tratamiento, todos los grupos mostraron pérdida de la microdureza, con independencia del sistema de blanqueamiento y del agente espesante empleado, incluso en la cavidad oral en presencia de saliva y su capacidad tamponadora, que favorece la remineralización del esmalte blanqueado. No obstante, debe considerarse que los fragmentos dentales incurrieron en otros problemas en la cavidad oral, como son los efectos de las dietas de cada voluntario, que pudieran haber favorecido la desmineralización.
Durante la fase de cepillado se procuró incentivar el cumplimiento terapéutico y la buena predisposición del paciente, y se pidió a los voluntarios que utilizaran un dentífrico sin flúor y que no emplearan colutorios fluorados durante el período del estudio. Para ello, la principal fuente de flúor durante ese tiempo fue la que aportaba la propia agua que bebían. En la cavidad oral, el flúor puede prevenir y revertir la desmineralización del esmalte. Puesto que se restringió el uso del flúor para el presente experimento su acción como factor de confusión era esperable.
El pH del sistema de blanqueamiento puede afectar el equilibrio mineral del esmalte25,26, pero a los pocos minutos de haber empezado a aplicar el peróxido de carbamida el pH de la cavidad oral se habrá estabilizado por la liberación de urea27, y el riesgo de alterar el esmalte probablemente ocurra por la liberación de radicales libres durante el proceso de blanqueamiento. Los estudios sugieren que la pérdida mineral no se debe únicamente al pH del sistema blanqueador, sino también a la concentración y al tiempo de exposición al peróxido y a otros constituyentes8,14,23.
Esta investigación valoró el efecto de los agentes espesantes carbopol y poloxámero sobre el esmalte dental, y según un estudio realizado por Basting y cols.15, el agente espesante carbopol provocó la pérdida de microdureza tras su aplicación en un tratamiento in vitro sobre el esmalte dental. Rodrigues y cols.8 también observaron una reducción en la microdureza del esmalte tras la aplicación de carbopol como tratamiento diario in situ8.
El mecanismo por el cual los agentes espesantes carbopol y poloxámero promueven la desmineralización del esmalte sigue sin conocerse. No obstante, puede considerarse que los agentes espesantes poseen un pH ácido que, en vez de favorecer la conservación del sistema blanqueador reduciendo su descomposición, favorecen la desmineralización. Otra hipótesis plantea el hecho de que se produce una difusión de iones de calcio y fósforo del esmalte dental hacia el gel blanqueador o el agente espesante, que no presentan mineral alguno, y pueden considerarse sustancias minerales hiposaturadas. Potocnik y cols.18 hallaron iones de calcio y fósforo en el gel blanqueador tras su uso, en una cantidad que abarca de 1,5 a 13 µm/10 ml y 4,0 a 20 µm/10 ml, respectivamente.
Más aún, supusieron que tras la desmineralización inicial, los agentes espesantes podían haber actuado como una capa de barrera absorbente frente a la saliva, es decir, previniendo así la mineralización del esmalte18. Van der Reijden y cols.28 afirmaron que el carbopol podía inhibir la formación de cristales de hidroxiapatita tras la desmineralización del esmalte. De esta manera, el fenómeno de la remineralización en el que debería intervenir la saliva, se hallaba supuestamente comprometido.
Este estudio demostró que el uso de peróxido de carbamida al 10 % en el tratamiento blanqueador domiciliario y el peróxido de hidrógeno al 6,5 % en tiras de plástico podrían causar pérdida mineral. Por ello, su uso debe estar cuidadosamente indicado y, preferentemente, deberían emplearse bajo la supervisión de un especialista para evitar la excesiva pérdida mineral y el desarrollo de sensibilidad dental o la formación de cavidades clínicamente visibles, que podrían derivar en la necesidad de recurrir a un tratamiento restaurador. Además, los agentes espesantes también pueden causar una disminución de la microdureza del esmalte. Por este motivo, y a pesar de que se precisan más estudios para determinar el efecto de los agentes espesantes sobre el esmalte tras una exposición prolongada, los fabricantes deberían ofrecer más opciones de agentes espesantes que provoquen menos efectos adversos sobre el esmalte.
Conclusión
Los sistemas blanqueadores basados en peróxido de carbamida al 10 % o en peróxido de hidrógeno al 6,5 % aplicados con agentes espesantes evaluados en el presente estudio in situ provocaron una disminución de la microdureza del esmalte.
Agradecimientos
Los autores agradecen el apoyo económico recibido de la Fundación para el Apoyo a la Investigación del Estado de São Paulo, beca n.º 2004/01175-0.
Correspondencia: Dr José Augusto Rodrigues,
Pca Tereza Cristina, 229, Centro-Guarulhos, Brasil CEP 07023-070-SP;
fax: ++ 55 11 64641758;
e-mail: jrodrigues@prof.ung.br.