Es posible fomentar la regeneración de una nueva inserción de tejido conectivo a la superficie radicular permitiendo el recrecimiento coronal selectivo de las células del ligamento periodontal y excluir el contacto de los tejidos gingivales con la raíz durante la cicatrización de la herida1. Este procedimiento se denomina regeneración tisular guiada (RTG) y se logra mediante cirugía periodontal a colgajo, que incluye la colocación de una membrana barrera entre las superficies gingivales y las superficies radiculares2,3.
Numerosos estudios han demostrado la utilidad de emplear membranas de colágeno en el tratamiento con RTG4-8. Las razones para seleccionar colágeno como membrana barrera9 incluyen: (1) el colágeno es la macromolécula extracelular principal del tejido conectivo periodontal y es metabolizado fisiológicamente por estos tejidos, (2) el colágeno es quimiotáctico para los fibroblastos, y (3) la membrana de colágeno actúa como una barrera frente a las células migratorias epiteliales. Las membranas de colágeno (Bio-Mend, Sulzer Calcitek) poseen la capacidad de soportar la regeneración del tejido periodontal y, ocasionalmente, la membrana de colágeno tanto se incorpora a los tejidos cicatrizados como se degrada durante el proceso de cicatrización5.
También se ha empleado una barrera de ácido poliláctico bioabsorbible, Atrisorb (Atrix Laboratorios) para el tratamiento con RTG que ha arrojado resultados clínicos satisfactorios10. Es un polímero en forma de gel de 37 % poli(DL-láctido) y 63 % de N-metil-2-pirrolidona. Atendiendo a la liquidez del producto, Atrisorb suele utilizarse junto con un rellenador de espacio o material de injerto óseo en las aplicaciones clínicas. En los estudios realizados con animales se ha demostrado que ofrece una respuesta tisular satisfactoria y una biocompatibilidad y seguridad óptimas10,11. En el ámbito de la aplicación clínica, Atrisorb ha demostrado que fomenta un relleno óseo óptimo e incrementa la inserción clínica en pacientes con periodontitis y con afectación de la furca de clase II10,12-14.
El objetivo de este ensayo clínico consistió en comparar los resultados terapéuticos de la RTG que utilizaba tanto la barrera de ácido poliláctico (Atrisorb) como la membrana de colágeno (BioMend). Esto aportará las pruebas científicas necesarias para los clínicos, de modo que les ayudará a seleccionar la membrana apropiada para utilizar en el tratamiento periodontal.
Método y materiales
Selección de los sujetos
Se reclutaron 30 participantes (edad: 33 a 63 años) con periodontitis crónica de la sección de periodoncia del Hospital General de Veteranos de Taipei. Los criterios de inclusión fueron los siguientes: (1) pruebas radiográficas que demostraban al menos un defecto óseo intraóseo de 4 mm como mínimo en los dientes posteriores inferiores con una profundidad de sondaje periodontal (PSP) en los defectos de como mínimo 6 mm; (2) ausencia de toda enfermedad sistémica que pudiera afectar la cicatrización periodontal; (3) ninguna cirugía periodontal en los 12 meses previos, y (4) que no hubieran tomado antibióticos ni esteroides en los 6 meses previos a este estudio. Esta propuesta de investigación fue aprobada por el Review Board (Equipo de Revisión) del Hospital General de Veteranos de Taipei. Cada participante fue informado del propósito y de los procedimientos de este estudio, así como de los posibles riesgos asociados al mismo. Se obtuvo por escrito su consentimiento informado.
Exploraciones clínicas periodontales
Una semana antes de la cirugía y seis meses después de ella se registraron los siguientes parámetros: índice de placa (IP)15, índice gingival (IG)16, PSP, nivel de inserción clínica (NIC) y la recesión. Se localizó el punto más profundo de cada defecto, y se utilizó como punto de partida para las mediciones. Se utilizó una cubeta individual con un surco de 1 mm de profundidad para alinear la sonda periodontal (Hu-Friedy) y asegurar así una toma de medidas exacta. Para todas las mediciones se utilizó la misma sonda periodontal que fueron registradas al milímetro. La PSP se midió desde el margen gingival hasta el vértice de la sonda. La recesión se midió desde la unión amelocementaria (UAC) hasta el margen gingival. La diferencia desde la PSP hasta la recesión se calculó como el NIC. La variabilidad interexaminador se evaluó mediante repetidas mediciones.
Procedimientos quirúrgicos
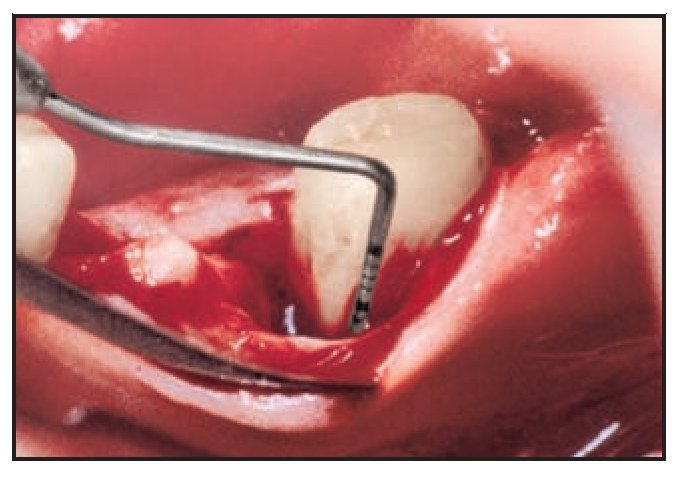
Tras los tratamientos periodontales iniciales que incluían el control de la placa, el raspado y el alisado radicular se asignaron dos grupos de forma aleatoria con 10 participantes en cada uno de ellos para recibir RTG con Atrisorb o RTG con Bio-Mend. Los 10 participantes restantes recibieron cirugía a colgajo sin membrana de RTG ni material de injerto, y sirvieron de sujetos control. Todas las exploraciones y los tratamientos fueron realizados por el mismo investigador.
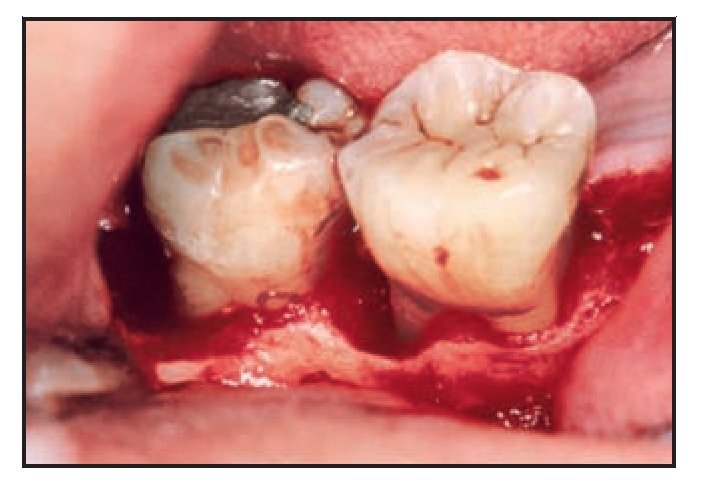
El área seleccionada se anestesió con Xylestesin-S al 0,2 % (Showa Yakuhis Kakon) que contenía epinefrina 1/50.000 (0,1 mg/5 ml). Una vez elevado un colgajo mucoperióstico de espesor total, se llevaron a cabo el raspado y el alisado radicular. En el grupo de Atrisorb, en primer lugar se obturaron los defectos con un aloinjerto de hueso desmineralizado y liofilizado (Pacific Coast Tissue Bank). A continuación se aplicó Atrisorb para cubrir los defectos y extenderse unos 3 a 4 mm por debajo de los mismos. Para facilitar el endurecimiento de la barrera se utilizó una solución salina esterilizada. Los colgajos se posicionaron coronalmente para cubrir la barrera y se aseguraron en su sitio con material de suturación con ácido poliglicólico (Unik Surgical Sutures Manufacturing) empleando puntos de sutura de colchonero vertical modificados. Se realizó una incisión perióstica de descarga para lograr un cierre primario libre de tensiones, siempre que se considerara necesario. Los procedimientos empleados en el grupo BioMend fueron los mismos a excepción de que se utilizaron membranas de BioMend y se mantuvieron en su sitio con una sutura alrededor de los dientes.
También se prescribieron analgésicos orales (diclofenaco, 25 mg, siempre que fuera necesario) y antibióticos (amoxicilina 500 mg) cada ocho horas durante siete días. Los pacientes recibieron instrucciones de que debían utilizar una torunda de algodón impregnada de clorhexidina al 0,12 % dos veces al día aplicada sobre el área que había sido operada y se les pidió que no pasaran el hilo de seda dental sobre el área de RTG durante seis semanas.
Evaluación radiográfica
Con la ayuda de un posicionador individualizado se tomaron radiografías estandarizadas una semana antes y seis meses después de la cirugía. Con objeto de poderlas analizar, las radiografías se escanearon y digitalizaron con la ayuda de un escáner (Mikrotek Scanmaker, 4.700 a 3.000 dpi). Mediante un programa de software analítico se realizaron las mediciones lineales (Emago, versión 3.42). Se midieron las distancias desde la UAC hasta el suelo del defecto y desde la UAC hasta la cresta ósea. Se calcularon las diferencias, así como la altura del relleno óseo y la reabsorción de la cresta ósea.
Análisis estadístico
En los tres grupos se compararon los valores iniciales de IP, IG y la profundidad de los defectos intraóseos usando para ello las pruebas de Kruskal-Wallis. Por medio del análisis de varianza de una única variable se compararon la edad, la PSP, el NIC, la recesión y la anchura y el nivel de la cresta ósea de los defectos intraóseos. Se realizó una comparación entre grupos con las mediciones obtenidas al inicio, una semana antes de la cirugía, y al final, las obtenidas a las seis semanas, utilizando la prueba de los signos de Wilcoxon para IP y IG, y la prueba de la t de Student emparejada para la PSP, el NIC, la recesión, el relleno radicular y la reabsorción de la cresta ósea. El análisis estadístico se llevó a cabo con un programa informático (SPSS 8.0, SPSS Inc.). Todos los valores P < 0,05 se consideraron estadísticamente significativos.
Resultados
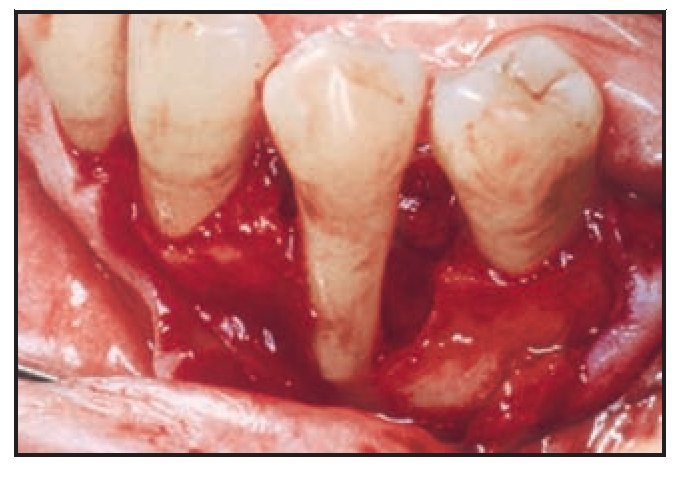
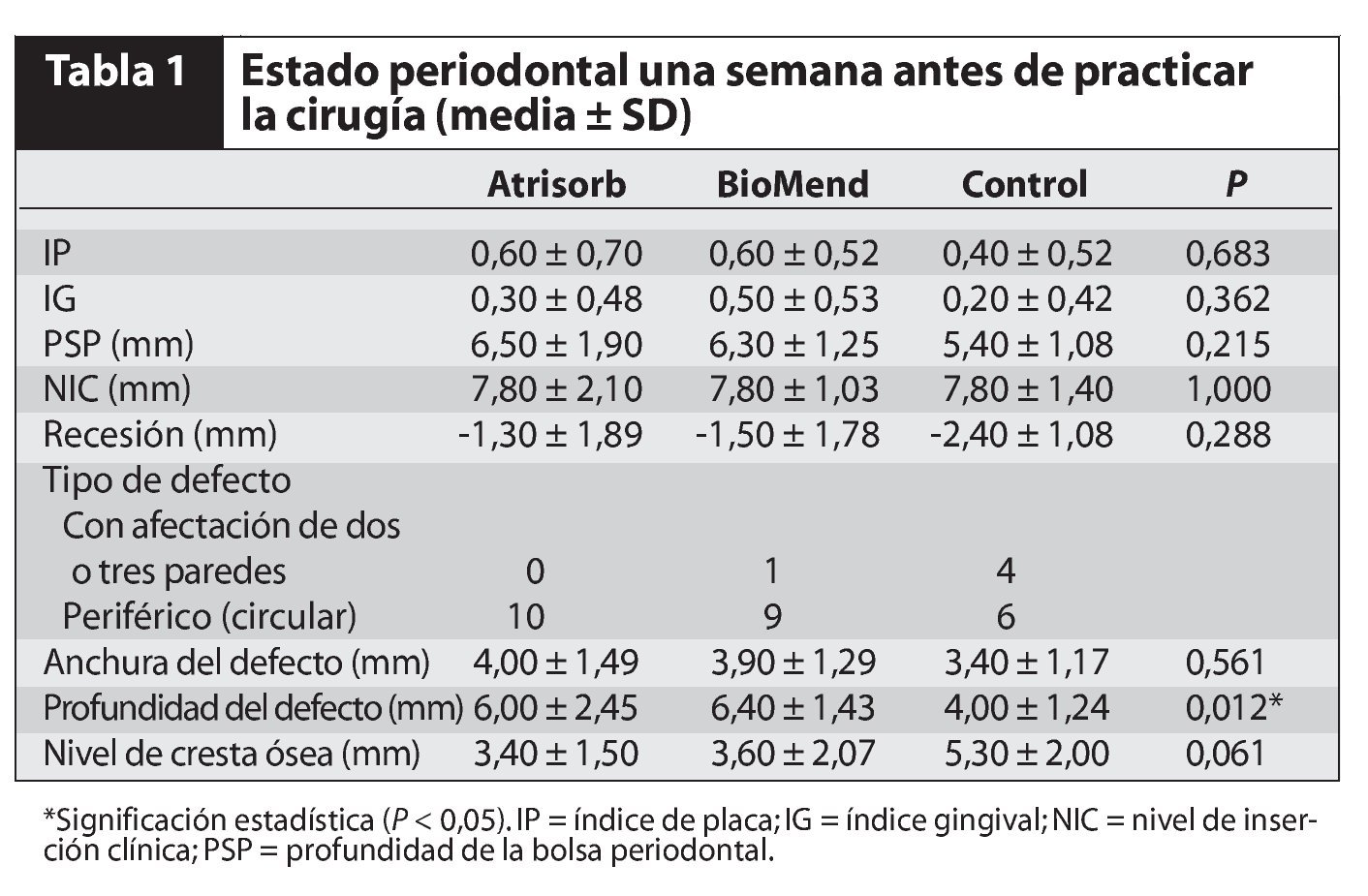
No se observaron diferencias significativas entre los tres grupos en cuanto a la edad, sexo o distribución de los defectos en los premolares y los molares. Los tipos de defectos que aparecen en este estudio se muestran en la figura 1. La tabla 1 resume el estado periodontal de los tres grupos que participaron en el tratamiento una semana antes del tratamiento. Tampoco se observaron diferencias estadísticamente significativas para la IP, IG, PSP, NIC, recesión y anchura ósea y nivel de la cresta alveolar en los defectos intraóseos en los tres grupos. Sin embargo, sí se observó una diferencia significativa en cuanto a la profundidad del defecto intraóseo: 6,00 ± 2,45 mm para el grupo con Atrisorb, 6,40 ± 1,43 mm para el grupo de BioMend y 4,00 ± 1,24 mm para el grupo control (P < 0,05). Nueve barreras del grupo con Atrisorb (90 %) fueron expuestas una semana después de la intervención, y tres del grupo con BioMend (30 %).
Figura 1a Defecto localizado en dos paredes (paredes distal y lingual).
Figura 1b Defecto localizado en tres paredes (paredes vestibular, mesial y lingual).
Figura 1c Defecto óseo circular.
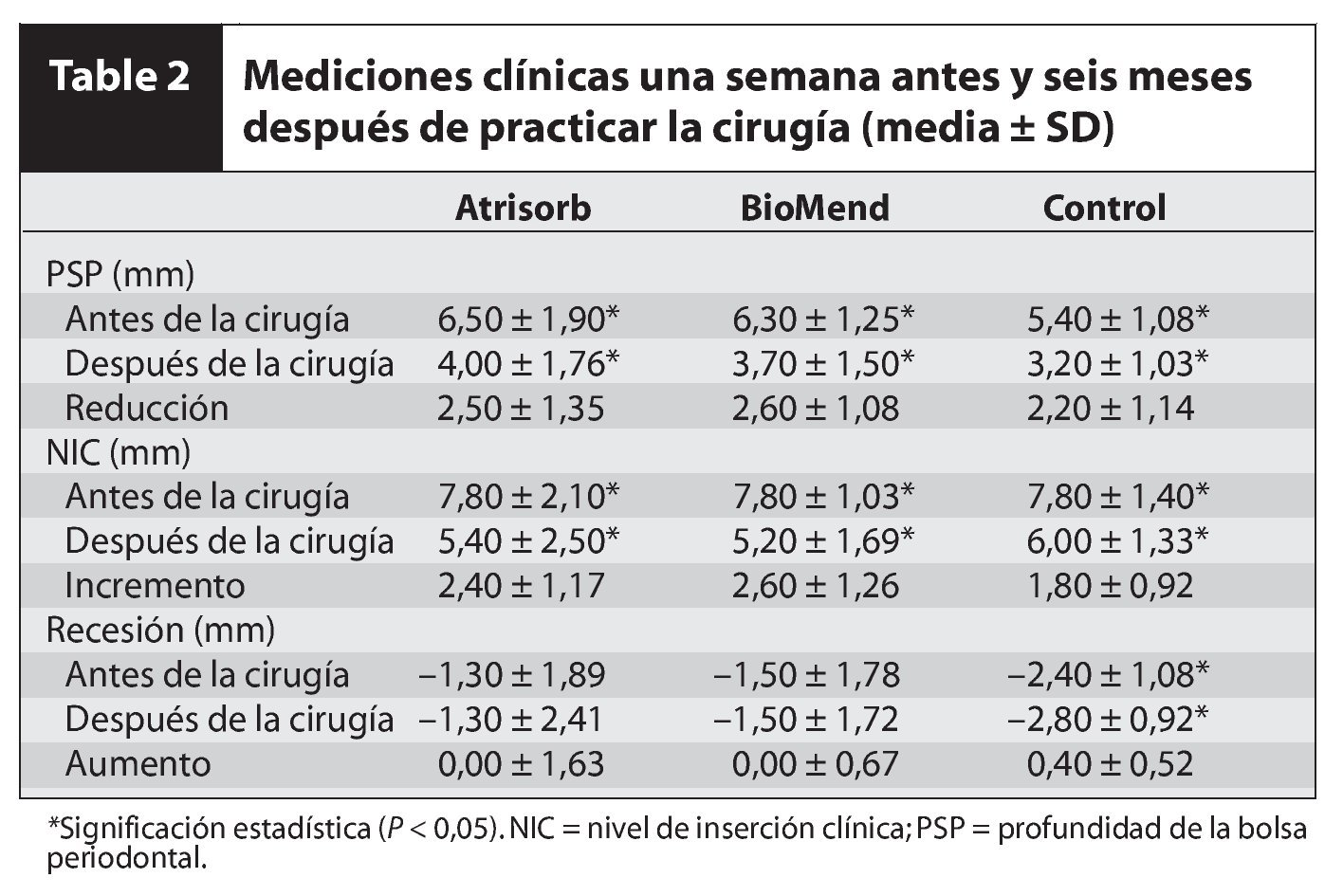
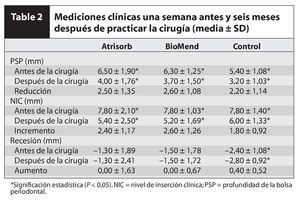
Se observó un efecto del tratamiento estadísticamente significativo en los tres grupos en cuanto a la PSP y al NIC (P < 0,05, tabla 2). No se detectaron diferencias significativas al comparar los resultados clínicos en los tres grupos. El nivel de recesión fue el mismo antes y después de la cirugía en los grupos con RTG, aunque aumentó ligeramente en el grupo control (P < 0,05, tabla 2).
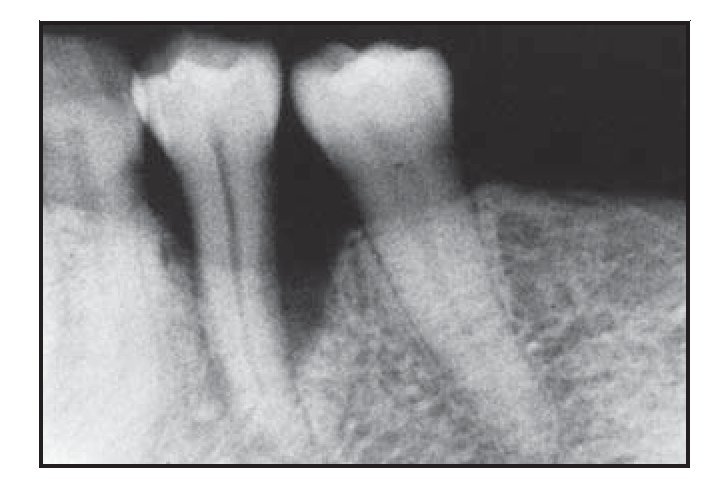
En todos los grupos se observaron diferencias radiográficas entre las mediciones obtenidas al inicio y a los seis meses de la cirugía (figuras 2 y 3). La cantidad de material de obturación ósea fue mayor en el grupo con BioMend (2,57 ± 1,64 mm) que en el grupo con Atrisorb (0,33 ± 1,89 mm) y el grupo control (1,05 ± 0,77 mm) (P < 0,05). Sin embargo, en todos los grupos se observó una cantidad similar de reabsorción de la cresta alveolar a los seis meses de la cirugía (0,41 ± 0,95 mm, 0,92 ± 1,54 mm y 0,70 ± 0,84 mm, respectivamente).
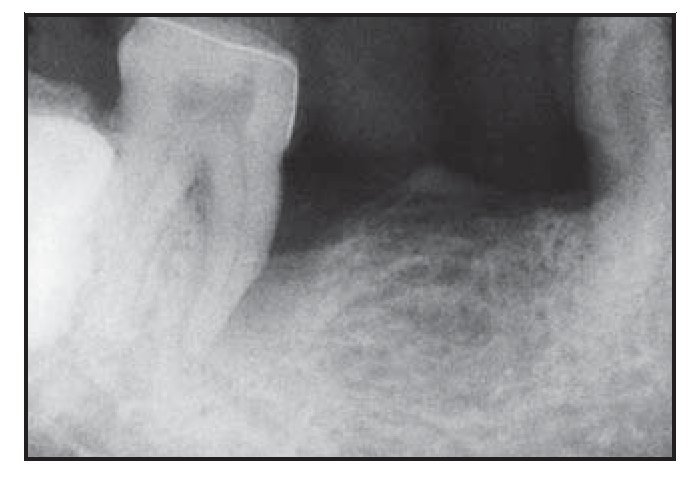
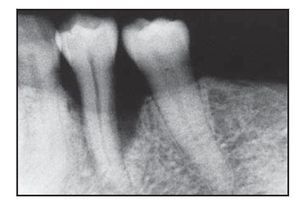
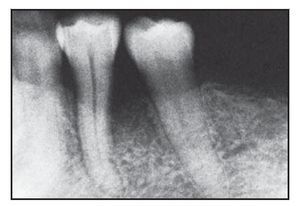
Figura 2a (izquierda) Radiografía representativa realizada una semana antes de practicar la cirugía en el grupo con Atrisorb.
Figura 2b (derecha) Radiografía representativa realizada a los seis meses de practicar la cirugía en el grupo con Atrisorb.
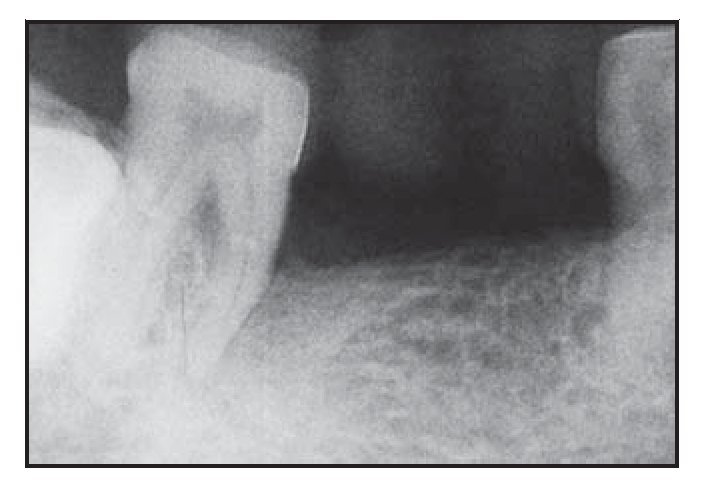
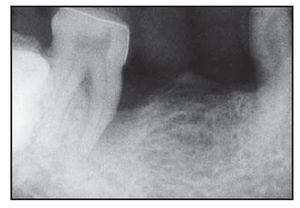
Figura 3a (izquierda) Radiografía representativa realizada una semana antes de practicar la cirugía en el grupo con BioMend.
Figura 3b (derecha) Radiografía representativa realizada a los seis meses de practicar la cirugía en el grupo con BioMend.
Discusión
El propósito de este ensayo clínico consistió en comparar los resultados de la RTG empleando Atrisorb y BioMend. Chen y cols.17 han demostrado que la adición de aloinjertos óseos desmineralizados liofilizados a BioMend no parece añadir beneficios adicionales frente a la RTG con BioMend solo. Dado que siempre se utiliza un rellenador de espacio o material de injerto óseo con Atrisorb, para este estudio se emplearon en ambos grupos con RTG aloinjertos óseos desmineralizados liofilizados. Los participantes de ambos grupos alcanzaron reducciones significativas en la PSP y ganancias en el NIC y el relleno óseo.
Las cadenas de polímero polilácticas en Atrisorb se desdoblan por hidrólisis para formar ácidos monoméricos y son eliminados del cuerpo a través del ciclo de Krebs en forma de dióxido de carbono y agua. Estudios previos10,12,13,18,19 han demostrado una reacción de la PSP de 2,2 a 4,7 mm, un incremento de 1,7 a 3,7 mm de NIC y una recesión gingival de -0,4 a 0,3 mm. La variación se explica por la inclusión de los defectos de la furca19, los diferentes materiales de injerto mineral óseo de origen bovino con diferentes tiempos de observación18 y la presencia de defectos de furca de clase II10,12,13.
Las membranas de colágeno poseen la capacidad de prevenir parcialmente la migración apical epitelial y de soportar tejido conectivo de inserción neoformado cuando se utiliza en los defectos peridontales en perros5,7. Se cree que la membrana de colágeno se incorpora tanto al tejido conectivo cicatrizal como se degrada por los macrófagos a las 6 u 8 semanas. En las zonas tratadas con la membrana de colágeno, los resultados para la PSP y el NIC en el presente estudio concuerdan con los obtenidos en un estudio previo20.
Tras llevar a cabo un estudio comparativo de la literatura17,21 sobre las membranas de colágeno utilizadas para el tratamiento de los defectos intraóseos en humanos muestran una reducción en la PSP de 2,84 a 3,4 mm y un incremento de 1,67 a 2,3 mm en el NIC. En estos resultados pueden haber influido un defecto más profundo,17 y diferentes maneras de evaluar el relleno óseo (utilizando la cirugía de reentrada y una membrana de colágeno menos esponjosa21).
Los resultados obtenidos a los 6 meses de la cirugía mostraron más relleno óseo con el uso de BioMend (2,57 ± 1,64 mm) que con Atrisorb (0,33 ± 1,89 mm). El relleno óseo observado con el grupo de BioMend concuerda con los estudios previos21,22. En comparación con los estudios previos, el uso de diferentes tipos de membrana de colágeno4,20,23 y de hueso de origen bovino anorgánico pueden haber influido en los resultados. Existe una falta de información sobre relleno óseo tras la RTG con Atrisorb en la literatura periodontal. Se necesitan más estudios para comprender las características de la cicatrización que tiene lugar en los tejidos duros.
En el presente estudio, el 90 % de las membranas fue expuesto tras un tratamiento de RTG con Atrisorb, comparado con el 30 % que fue expuesto con BioMend. La frecuencia de exposición de las membranas de BioMend fue inferior a la registrada previamente para las membranas de colágeno21,22. La mayor incidencia de exposición de las membranas en el grupo con Atrisorb comparada con la del grupo de BioMend podría ser el resultado de la dificultad que supone controlar el grosor, así como de la amplitud de las lesiones periféricas. En estudios previos se han registrado exposiciones del 87 %24 y del 63 %25 para los defectos óseos interproximales tratados con RTG que utilizaron una membrana de politetrafluoroetileno. Previamente se había comunicado una correlación negativa entre la exposición de la membrana y la cantidad de tejido neoformado que se apreciaba al extraer la membrana26.
Más aún, la cantidad de tejido neoformado en el momento de la extracción de la membrana no está necesariamente relacionada con el aumento de inserción clínica obtenido tras la RTG25. Sin embargo, se apreció una recesión significativamente mayor tras la RTG cuando las membranas fueron expuestas durante todo el proceso25,27-30.
La regeneración tisular guiada, tanto con Atrisorb, BioMend o con sólo una operación de colgajo, aportó un nivel similar de reducción de PSP y de incremento de la inserción tras la cirugía. La tendencia de la RTG fue causar una menor recesión. Adicionalmente, se obtuvo más relleno óseo con BioMend frente a Atrisorb o cuando sólo se empleó la operación de colgajo.
Agradecimientos
La investigación recibió la beca VGH-90-85 del Hospital General de Veteranos de Taipei.
Correspondencia: Dr Li-Jane Ling,
3F, No. 306, Sec. 2, Shi-Pai Road, Taipei, Taiwan; fax: +886-2-28742375;
e-mail: poetry9138@gmail.com.