Las infecciones invasivas por mohos, fundamentalmente por Aspergillus, suponen más del 10% de las complicaciones infecciosas en el trasplante pulmonar. Suelen tener una presentación bimodal: precoces, principalmente invadiendo la vía aérea, y tardías, más frecuentemente localizadas en pulmón o diseminadas. La colonización en cualquier momento postrasplante es uno de los principales factores de riesgo. Dicha colonización es, junto con el rechazo crónico, una de las principales causas de las formas tardías. Un valor de 0,5 de galactomanano en el lavado broncoalveolar se considera actualmente indicativo de infección invasiva. No hay una estrategia universal de actuación en materia de profilaxis. La profilaxis dirigida y el tratamiento anticipado van teniendo más adeptos, en contraposición a la profilaxis universal. La monitorización de las concentraciones de los azoles en los enfermos se considera altamente indicada durante el tratamiento. La monoterapia con voriconazol es el tratamiento de elección en la aspergilosis, y solo se recomiendan terapias combinadas ante aspergilosis graves, diseminadas y por otros mohos.
Invasive infections by molds, mainly Aspergillus infections, account for more than 10% of infectious complications in lung transplant recipients. These infections have a bimodal presentation: an early one, mainly invading bronchial airways, and a late one, mostly focused on lung or disseminated. The Aspergillus colonization at any time in the post-transplant period is one of the major risk factors. Late colonization, together with chronic rejection, is one of the main causes of late invasive forms. A galactomannan value of 0.5 in bronchoalveolar lavage is currently considered a predictive factor of pulmonary invasive infection. There is no universal strategy in terms of prophylaxis. Targeted prophylaxis and preemptive treatment instead of universal prophylaxis, are gaining more followers. The therapeutic drug monitoring level of azoles is highly recommended in the treatment. Monotherapy with voriconazole is the treatment of choice in invasive aspergillosis; combined antifungal therapies are only recommended in severe, disseminated, and other infections due to non-Aspergillus molds.
Las infecciones por hongos son una causa importante de morbimortalidad en el trasplante pulmonar (TP). Aproximadamente el 15-35% de los receptores sufren infecciones fúngicas, y las producidas por mohos (Aspergillus, Scedosporium y mucorales) son relevantes por su frecuencia o gravedad2,21,40,41,46–48,51,56.
Las conidias de los mohos son ubicuas en la naturaleza, fácilmente dispersadas en aerosoles e inhaladas y, en condiciones normales, continuamente eliminadas por los mecanismos de defensa locales del pulmón.
La mayor susceptibilidad a las infecciones por hongos de los receptores de TP se produce como consecuencia de la continua exposición ambiental a las esporas o conidias, y a la incapacidad del injerto para su adecuada eliminación como consecuencia de los cambios posquirúrgicos que se producen en el pulmón. La ausencia de revascularización bronquial promueve la aparición de isquemia de la vía aérea y altera de forma significativa el drenaje mucociliar normal. La pérdida de reflejo tusígeno, como consecuencia de la denervación bronquial y del drenaje linfático, favorece el desarrollo de infecciones locales. Todos estos factores dificultan la eliminación de las partículas inhaladas y generan un medio endobronquial isquémico y edematoso que favorece la germinación de las esporas y la multiplicación celular.
AspergillusLos mohos del género Aspergillus son la causa más frecuente de infección fúngica en los receptores de TP. Se estima que alrededor del 6% de los receptores (rango entre 3-15%) desarrollan una aspergilosis, con una incidencia anual del 3,8%51. Aspergillus fumigatus es la especie aislada con mayor frecuencia, pero también se identifican otras especies, como Aspergillus niger, Aspergillus flavus o Aspergillus terreus. La identificación de A.terreus es especialmente relevante por su potencial resistencia a la anfotericinaB. La infección por Aspergillus es frecuente en los 6 primeros meses postrasplante, cuando los cambios en el injerto son especialmente relevantes y la intensidad de la inmunosupresión es mayor. El 72% de los casos de aspergilosis se producen en estos primeros meses, y el tiempo medio de infección tras la intervención es de 3,2meses. Otros periodos de mayor riesgo son los episodios de rechazo agudo y la bronquiolitis obliterante, que condiciona cambios estructurales en el pulmón y obliga a intensificar el tratamiento inmunosupresor2,21,46–48,56.
ScedosporiumLas esporas de Scedosporium son ubicuas en el suelo y en las aguas contaminadas. Las 2especies identificadas como patógenas en el hombre son Scedosporium apiospermum y Scedosporium prolificans (Lomentospora prolificans), y ambas especies tienen una distribución mundial, incluyendo Europa, Australia y Estados Unidos2,6,40,48.
La infección por Scedosporium se produce tras la inhalación de las esporas ambientales y su paso al pulmón o los senos paranasales, o a través de inoculación directa por la vía cutánea. Se han descrito episodios de infección nosocomial en pacientes inmunodeprimidos como consecuencia de la contaminación del aire (en relación con remodelación de edificios).
Scedosporium apiospermum es el segundo hongo filamentoso aislado con mayor frecuencia en los pacientes con fibrosis quística en los que, además de infección invasiva, puede producir una reacción alérgica similar a la producida por Aspergillus.
MucoralesLos mucorales o zigomicetos son también mohos ubicuos en la naturaleza y pueden causar infecciones tras la inhalación de esporas o la inoculación accidental. En pacientes inmunodeprimidos los mucorales pueden causar infecciones rinosinusales, pulmonares, cerebrales, gastrointestinales o cutáneas. Los géneros de mucorales que producen con mayor frecuencia enfermedad en enfermos con TP son Rhizopus y Mucor.
Aunque la infección por mucorales se produce prácticamente siempre en pacientes inmunodeprimidos, su desarrollo es poco frecuente en el receptor de trasplante de órgano sólido. En este sentido, aparecen en menos del 1% de las infecciones fúngicas observadas en este grupo de pacientes.
En los receptores de TP la presentación más frecuente es la pulmonar, aunque también se han descrito casos de infección de la anastomosis bronquial y de localización rinosinusal y gastrointestinal.
Factores de riesgoLos receptores de TP presentan mayor riesgo de infección por mohos que otros receptores de trasplante de órgano como consecuencia de los factores de riesgo locales secundarios a la cirugía previamente mencionados. Otros factores de riesgo son la colonización pre y postrasplante, especialmente frecuente en los pacientes con fibrosis quística, el trasplante unilateral, la exposición ambiental como consecuencia de obras de remodelación, la bronquiolitis obliterante y la infección por citomegalovirus (CMV)2. Otros factores de riesgo observados con menor frecuencia son las infecciones virales distintas del CMV, la hipogammaglobulinemia (IgG<400mg/dl), el tratamiento con globulina antitimocítica y el polimorfismo en los genes de los receptores Toll-like implicados en la inmunidad innata (tabla 1)2,41,46.
Factores de riesgo para la infección por Aspergillus
| Factores preoperatorios |
| Exposición ambiental |
| Colonización bronquial |
| Fibrosis quística |
| Trasplante unilateral |
| Factores postoperatorios |
| Exposición ambiental |
| Colonización bronquial |
| Tratamiento con globulina antitimocítica |
| Hipogammaglobulinemia (IgG<400mg/dl) |
| Infección por citomegalovirus |
| Bronquiolitis obliterante |
| Polimorfismo del receptor Toll-like |
Tomada de las referencias6,11.
Alrededor del 30% de los receptores de TP presentan colonización de la vía aérea por Aspergillus. En los receptores con fibrosis quística, el porcentaje de colonización puede ser mayor y son más frecuentes las formas traqueobronquiales que las invasivas21.
Los factores de riesgo para la infección por otros mohos son menos conocidos pero probablemente similares, con la peculiaridad de que la colonización es menos frecuente y suele producirse de forma más tardía, asociada al aumento de la inmunosupresión y la presencia de comorbilidades como la insuficiencia renal o la diabetes47,48.
Formas clínicasLas infecciones por mohos pueden adoptar distintas formas clínicas, desde la colonización hasta la enfermedad invasiva40. La infección por Aspergillus, de la que mayor conocimiento de sus diferentes presentaciones clínicas se tiene, es la más frecuente y puede ser tomada como ejemplo.
El aislamiento de mohos como Aspergillus en muestras respiratorias puede ser debido a colonización, traqueobronquitis y/o infección de la sutura bronquial, y a enfermedad invasiva o enfermedad diseminada.
ColonizaciónLa colonización de la vía aérea por Aspergillus viene definida por la ausencia de enfermedad probada o probable2,6,36. En los receptores de TP la colonización por Aspergillus es frecuente antes y después de la intervención. Dicha colonización cursa de forma asintomática y es un hallazgo de laboratorio en los cultivos de seguimiento de esputo o de muestras endobronquiales.
La colonización pretrasplante ha sido especialmente estudiada en los pacientes con fibrosis quística. Se ha detectado colonización por Aspergillus antes de la intervención en más del 50% de los pacientes con fibrosis quística, y esta colonización ha sido asociada al desarrollo de formas de infección traqueobronquiales tras la intervención21. Se desconoce la frecuencia y los factores de riesgo para la colonización bronquial pretrasplante en otros receptores pulmonares como los pacientes afectados de enfermedad pulmonar obstructiva crónica y de fibrosis pulmonar.
La colonización postrasplante es frecuente en los 6 primeros meses tras la cirugía y ha sido descrita hasta en el 46% de los casos6,21. Los pacientes con colonización postrasplante tienen un riesgo de enfermedad invasiva en el primer año 6 veces superior a la de los que no presentan colonización40. A partir del primer año, la colonización por Aspergillus es un marcador precoz de rechazo crónico y un factor de riesgo para su aparición56.
Traqueobronquitis/infección de la sutura bronquialMás de una tercera parte de los casos de infección aspergilar en el receptor de TP son formas de enfermedad traqueobronquial. La traqueobronquitis por Aspergillus es la infección invasiva de la vía aérea sin afectación concomitante del parénquima pulmonar que afecta casi de forma exclusiva al receptor de TP y, como se ha mencionado previamente, es especialmente frecuente en los pacientes con fibrosis quística con colonización antes de la intervención6,21,41.
Las lesiones macroscópicas características de la afectación traqueobronquial son la inflamación difusa de la vía aérea, las úlceras necróticas por invasión vascular local y las placas de fibrina, que pueden ser muy extensas y llegar a formar pseudomembranas obstructivas (figs. 1 y 2). Las lesiones suelen iniciarse en la anastomosis bronquial, que es la zona sometida a una mayor isquemia bronquial tras la intervención. El tiempo medio de aparición es de 50días postrasplante. Si la infección se limita a la zona de anastomosis se conoce como infección de la sutura bronquial. A partir de dicha zona la infección puede extenderse por contigüidad hacia las vías aéreas más distales o hacia la zona traqueal.
Los síntomas incluyen tos, disnea, fiebre, estridor y hemoptisis. Ocasionalmente el diagnóstico se realiza por una fibrobroncoscopia de rutina en pacientes asintomáticos. Los hallazgos son muy variados, yendo desde una simple estenosis a dehiscencias de la vía área.
La mortalidad asociada a la traqueobronquitis es de alrededor del 20%. Sin tratamiento, los pacientes están en riesgo de desarrollar enfermedad invasiva46,48.
Aspergilosis invasiva y diseminadaLa incidencia de aspergilosis invasiva en el receptor de TP está alrededor del 6%, aunque algunos autores opinan que la incidencia real puede ser superior al no realizarse de forma sistemática un estudio necrópsico de rutina en los receptores de TP2.
Dado que la mayor parte de los programas de trasplante realizan de forma sistemática profilaxis antifúngica en los primeros meses postrasplante, la forma más frecuente de la enfermedad aparece actualmente de forma tardía. En este sentido, el tiempo medio desde la intervención hasta el desarrollo de la aspergilosis invasiva es de 504días, y el factor de riesgo observado con mayor frecuencia en esta fase tardía es el rechazo crónico (fig. 3)56.
Los síntomas son inespecíficos: fiebre, tos, dolor torácico, disnea y hemoptisis. Gracias a las mejoras progresivas del manejo terapéutico la mortalidad de la aspergilosis invasiva se ha reducido en los últimos años al 40-50%, según las series más recientes2,51.
La aspergilosis diseminada es infrecuente y se caracteriza por la extensión de la infección fúngica a órganos extratorácicos como el sistema nervioso central, las articulaciones, los huesos, la piel y el globo ocular.
DiagnósticoCultivoLas técnicas microbiológicas convencionales, la tinción y el cultivo, son de elección en el diagnóstico de las infecciones fúngicas y dan información de las diferentes especies así como de las sensibilidades a los antifúngicos. No obstante, la rentabilidad de estas pruebas es baja en el TP, incluso en el caso de una infección activa, y además no ofrecen los resultados en el tiempo deseable40,46. Por ello es necesaria la realización de técnicas más sensibles y rápidas, como las que se exponen a continuación.
GalactomananoEl galactomanano (GM) es un polisacárido de la pared fúngica que se libera durante el crecimiento del hongo (crecimiento de las hifas). Diferentes hongos son capaces de liberar GM, entre ellos Aspergillus. El GM se puede determinar mediante test ELISA, tanto de suero como de lavado broncoalveolar (BAL). Por tanto, es una forma de inferir el crecimiento del hongo allí donde se aísle. El dilema está en cuál es la muestra idónea para analizar y el límite de positividad (punto de corte) de la prueba. Existen diferentes estudios que indican que el GM en suero no es de utilidad en trasplantes de órganos sólidos11,19. De hecho, un metaanálisis mostró una sensibilidad del 82% en pacientes neutropénicos hematológicos frente a solo un 22% en pacientes con trasplante de órgano sólido34. Concretamente en el TP se ha descrito una sensibilidad de alrededor del 30% en la detección de la aspergilosis invasiva14,33, por lo que este método no debería usarse para su diagnóstico en TP. Respecto a la determinación de GM en BAL, un valor de 0,5 debería considerarse indicativo de infección invasiva. Con ello se pierde especificidad pero se gana en sensibilidad (comunicación personal del Dr. Husain en San Diego, congreso de la ISHLT 2014, recomendaciones para el manejo de la infección por hongos en trasplantes cardiotorácicos). Además, un GM positivo sin otra manifestación orienta a la detección precoz de una infección invasiva más que a la simple colonización22. Existen diferentes estudios sobre esta cuestión: un metaanálisis13 y 5 estudios centrados en trasplantes pulmonares/cardiotorácicos7,15,22,33,52, 2 de ellos retrospectivos7,22 y 3 prospectivos15,33,52.
Usando un punto de corte de 0,5, la sensibilidad del GM en BAL varió entre el 77 y el 100%, y la especificidad entre el 40 y el 100%. Incrementar el punto de corte de 0,5 a 1 mejoró la especificidad pero no la sensibilidad, por lo que actualmente se recomienda un punto de corte de 0,5 como valor umbral diagnóstico en BAL. De hecho, como es un marcador de crecimiento de las hifas en el estudio de Luong et al.22, podía considerarse un marcador precoz de infección más que de colonización. Un tema pendiente es cómo protocolizar el BAL, dado que está sujeto a variabilidad entre centros en función precisamente del protocolo usado.
PCR de AspergillusLa realización de PCR (polymerase chain reaction) para amplificar el ADN de Aspergillus ha demostrado tener utilidad en la detección de infecciones invasivas. Esta técnica puede usarse en muestras de suero y en BAL, con una sensibilidad descrita entre el 75-88 y el 70%, respectivamente24,53.
La PCR tiene el mismo inconveniente que el cultivo, y es que no discrimina entre infección y colonización22. Además, presenta una amplia variación entre centros, no diferencia entre las subespecies de Aspergillus y hay reactividad cruzada con otros mohos. Por todo ello, no se recomienda su uso de forma rutinaria.
1,3-β-D-glucanoEl 1,3-β-D-glucano (BDG) es otro componente de la pared celular del hongo que se libera a la circulación sanguínea durante la enfermedad invasiva. No es específico de Aspergillus, siendo detectable en infecciones por mohos y levaduras (como Candida y Pneumocystis).
Solo existe un estudio prospectivo en TP en suero, con unos valores BDG (punto de corte positivo de 60pg/ml con el test Fungitell) de sensibilidad y especificidad del 71 y del 59%, respectivamente, en la enfermedad invasiva1. Su utilidad en BAL no se ha estudiado con profundidad. Por todo ello no se recomienda su uso rutinario en clínica; se precisan más estudios tanto en suero como en BAL.
Criterios radiológicosEl signo del halo, expresión de hemorragia angioinvasiva por el moho infectante, es muy poco frecuente en TP en contraposición al paciente neutropénico. De hecho, son hallazgos relevantes las consolidaciones peribronquiales y las opacidades en vidrio deslustrado8,12,32,44,45.
Es interesante que el tipo de profilaxis antifúngica influye en la imagen radiológica (por ejemplo, los pacientes con profilaxis presentan menos nódulos). Posiblemente estamos asistiendo a diferentes patrones radiológicos en función del tiempo postrasplante, el diferente grado de inmunosupresión y las profilaxis aplicadas.
ProfilaxisEn TP existen 2 tipos de aproximaciones a la profilaxis antifúngica postrasplante inmediato: a)profilaxis universal, y b)profilaxis dirigida. Se ha demostrado que cualquier tipo de profilaxis es efectivo, pero por el momento ninguno se ha mostrado superior ni en la estrategia, ni en el fármaco ni en su duración5,20,25,27,28,50.
La profilaxis universal consiste en administrar un fármaco antifúngico, y se aplica a todos los pacientes en el postoperatorio inmediato. Actualmente es el procedimiento más frecuente, si bien va ganando adeptos la profilaxis dirigida en base a los factores de riesgo presentes (por ejemplo, los pacientes colonizados por mohos antes del trasplante). Existe una tercera modalidad, que sería el tratamiento preventivo/anticipado cuando se aísla Aspergillus en una muestra respiratoria sin otros hallazgos.
En el post-TP inmediato es muy importante estudiar los pulmones explantados y tener en cuenta si se aíslan mohos, ya que en ocasiones no han sido identificados previamente y son un factor de riesgo de enfermedad invasiva en el postrasplante54. Como ninguna de las 2 estrategias de profilaxis ha demostrado superioridad, usar una u otra dependerá de la experiencia de cada centro10,17,30.
La efectividad de la anfotericinaB nebulizada en el posoperatorio inmediato se ha demostrado eficaz en algunos estudios controlados, de ahí que sea el procedimiento más empleado en la actualidad4,17 (tablas 2–5).
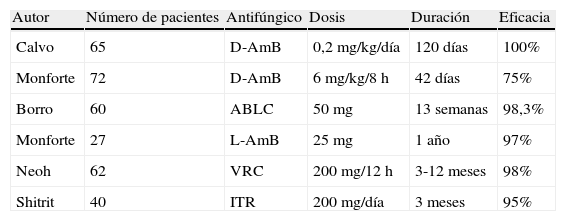
Estudios no comparativos de profilaxis antifúngica en trasplante pulmonar
| Autor | Número de pacientes | Antifúngico | Dosis | Duración | Eficacia |
| Calvo | 65 | D-AmB | 0,2 mg/kg/día | 120 días | 100% |
| Monforte | 72 | D-AmB | 6 mg/kg/8 h | 42 días | 75% |
| Borro | 60 | ABLC | 50mg | 13 semanas | 98,3% |
| Monforte | 27 | L-AmB | 25 mg | 1 año | 97% |
| Neoh | 62 | VRC | 200 mg/12 h | 3-12 meses | 98% |
| Shitrit | 40 | ITR | 200 mg/día | 3 meses | 95% |
ABLC: anfotericinaB complejo lipídico; D-AmB: anfotericina B desoxicolato; ITR: itraconazol; L-AmB: anfotericinaB liposómica; VRC: voriconazol.
Tomada de las referencias35,37,42–45.
Estudios comparativos de profilaxis antifúngica con anfotericinaB nebulizada en trasplante pumonar
| Autor | Número de pacientes | Aspergilosis invasiva | Intervalo de confianza del 95% |
| Reichenspurner | 49 D-AmB24 placebo | 8%20% | (5,2-32,8) |
| Drew | 49 D-AmB51 ABLC | 2%2% | (30-∞) |
| Minari | 87 AmB nebulizadaITR 101 Control | 4,9%14% | (5,5-13,1) |
| Husain | 30 ITR±AmB nebulizada65 VRC | 21%1,5% | (4,5-15,7) |
ABLC: anfotericinaB complejo lipídico; D-AmB: anfotericinaB desoxicolato; ITR: itraconazol; VRC: voriconazol.
Tomada de las referencias36,38–40.
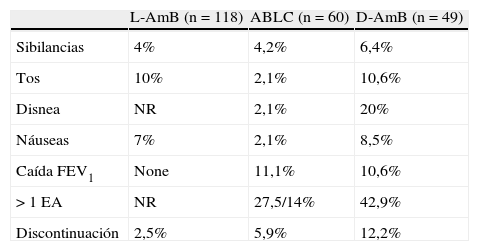
Efectos adversos descritos con preparaciones de anfotericinaB nebulizada
| L-AmB (n=118) | ABLC (n=60) | D-AmB (n=49) | |
| Sibilancias | 4% | 4,2% | 6,4% |
| Tos | 10% | 2,1% | 10,6% |
| Disnea | NR | 2,1% | 20% |
| Náuseas | 7% | 2,1% | 8,5% |
| Caída FEV1 | None | 11,1% | 10,6% |
| >1 EA | NR | 27,5/14% | 42,9% |
| Discontinuación | 2,5% | 5,9% | 12,2% |
ABLC: anfotericinaB complejo lipídico; D-AmB: anfotericinaB desoxicolato; L-AmB: anfotericina B liposómica.
Tomada de las referencias39,42,44.
Hepatotoxicidad descrita con voriconazol
| Grupo con voriconazol (n=65) | Grupo estándar (n=27) | p | |
| GGTP | 60% (39/65) | 41% (11/27) | 0,07 |
| ALT | 45% (29/65) | 15% (4/27) | 0,005 |
| AST | 37% (25/65) | 15% (4/27) | 0,02 |
El 14% (9/65) de los pacientes suspendieron la medicación, en comparación con el 8% (2/27) en el grupo estándar (p=0,20).
Tomada de la referencia40.
En cuanto al uso de azoles como profilaxis, existe mucha más variabilidad. De hecho, dadas las interacciones con los inmunosupresores y los efectos adversos, su uso se reserva en muchos centros para el tratamiento anticipado/preventivo, es decir, cuando se aísla un moho en muestras respiratorias. Existen varios estudios de cohortes que analizan el tratamiento preventivo con azoles en TP en comparación con la profilaxis universal. En ellos se concluye que una estrategia que incluya al itraconazol sin monitorización de las concentraciones en plasma se asocia con peores resultados, siendo más favorables las series en las que el antifúngico utilizado fue el voriconazol16,18,31.
Actualmente, en base a los factores de riesgo de la enfermedad invasiva, hay evidencias para apoyar el tratamiento anticipado cuando se aísla Aspergillus o Scedosporium de muestras respiratorias postrasplante. El tratamiento está menos indicado cuando se aíslan mucorales, por su riesgo intermedio, y no está aconsejado cuando los mohos aislados pertenecen a otros géneros, como Cladosporium o Phialemonium39.
En el tratamiento anticipado, los azoles son la estrategia más usada. Por norma general, en la profilaxis dirigida/tratamiento anticipado solo se aconseja la monitorización terapéutica en el caso del itraconazol.
En cuanto a la duración, puede usarse cualquier tipo de estrategia en los 3 o 4 primeros meses postrasplante40,46.
Una asignatura pendiente es la profilaxis/tratamiento anticipado más allá del periodo precoz, cuando la estrategia no está bien definida y concurren importantes factores de riesgo (rechazo crónico, insuficiencia renal) que se relacionan con infecciones invasivas tardías40,46. De hecho, si bien la profilaxis con anfotericinaB lipídica nebulizada es una buena opción como profilaxis universal en el periodo precoz, cuando existen factores locales que dificultan su distribución pulmonar, como en el rechazo crónico, su eficacia puede estar disminuida, en cuyo caso es más recomendable un antifúngico sistémico en el periodo tardío con o sin anfotericinaB nebulizada57. En el caso de estrategias tardías, se aconsejan tratamientos de 4-6meses con azoles.
En resumen, la anfotericinaB inhalada con o sin profilaxis frente a aislamientos de Candida en el postoperatorio inmediato es razonable, siendo más prescrita que los azoles en la profilaxis universal. En la profilaxis dirigida, según los factores de riesgo peritrasplante, va ganando adeptos el uso del voriconazol en base a estudios recientes16.
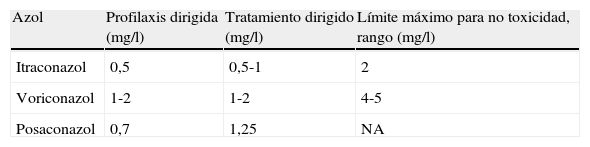
Monitorización terapéuticaUna de las dudas cuando se manejan azoles es si se debería recurrir a la monitorización terapéutica. Es sabido que existe una variabilidad importante entre pacientes y dentro del propio paciente, y es muy frecuente encontrar concentraciones infraterapéuticas. Hay estudios en trasplantes torácicos que apuntan a que sería conveniente monitorizar las concentraciones de los azoles al menos durante el tratamiento primario49 (tabla 6).
Concentraciones recomendadas de azoles en el plasma
| Azol | Profilaxis dirigida (mg/l) | Tratamiento dirigido (mg/l) | Límite máximo para no toxicidad, rango (mg/l) |
| Itraconazol | 0,5 | 0,5-1 | 2 |
| Voriconazol | 1-2 | 1-2 | 4-5 |
| Posaconazol | 0,7 | 1,25 | NA |
Tomada de la referencia49.
Existe un trabajo prospectivo en el cual solo el 32% de los pacientes alcanzaban concentraciones en el rango terapéutico para el voriconazol, y ello se relacionaba con un 10% de infecciones fúngicas invasoras26. Lo mismo ocurre con la monitorización del posaconazol, habiéndose encontrado concentraciones infraterapéuticas inicialmente en un 47%. En general, concentraciones por encima de 0,5mg/l se asocian con buenos resultados37.
Así pues, en el TP todos los pacientes en tratamiento con azoles deberían tener determinadas concentraciones valle en los 5-7 días de inicio del tratamiento, y siempre que se realicen ajustes de dosis o si se prescriben con una medición concomitante que modifica sus concentraciones (tabla 7). Posteriormente, una vez las concentraciones son estables, se deberían monitorizar mensualmente. En el caso del posaconazol, además, es aconsejable que se tomen medidas dietéticas para favorecer su absorción digestiva.
Modificaciones de las dosis de los inmunosupresores (reducción) al administrarlos conjuntamente con azoles
| Inhibidores de la calcineurina | m-TOR (Mammalian Target of Rapamycin Inhibitors) | |||
| Azol | ↓Ciclosporina | ↓Tacrolimus | ↓Everolimus | ↓Sirolimus |
| Fluconazol (>150mg/día) | 50% | 40-50% | 50% | 50-70% |
| Itraconazol | 50-60% | 50-60% | No recomendado | No recomendadoa |
| Posaconazol | 25% | 67-75% | 75% | Contraindicadob |
| Voriconazol | 50% | 67% | 80-90% | 90%c |
Una mención especial requieren los receptores de trasplante con fibrosis quística, que constituyen un grupo importante dentro del TP por el riesgo de infecciones fúngicas dada su alta colonización por mohos. Además, este grupo reúne una serie de características que influyen en la farmacocinética de los azoles, como son la edad del paciente (pacientes jóvenes), bajo índice de masa corporal, trastornos gastrointestinales (retraso o aumento de la motilidad), malabsorción, cambios en el volumen de distribución, aumento del aclaramiento renal y reflujo gastroesofágico. Existe bibliografía específica en relación con la fibrosis quística que apunta a que se deben administrar dosis más altas de azoles para alcanzar concentraciones terapéuticas3.
TratamientoInfecciones por AspergillusA pesar de disponer de potentes antifúngicos, el tratamiento de las aspergilosis invasivas en TP fracasa en un porcentaje elevado. Así, se asume una mortalidad del 50%6,40,47,48,51. La modalidad más adecuada del tratamiento antifúngico (monoterapia, secuencial o combinada) no está establecida. No obstante, la monoterapia con voriconazol es el tratamiento de elección (categoría A-I, guía IDSA [Infectious Diseases Society of America])49,55 tanto para la traqueobronquitis aspergilar como para la aspergilosis pulmonar invasiva. La Agencia Europea del Medicamento aprobó en 2002 la inclusión del voriconazol para el tratamiento de la aspergilosis invasiva, las infecciones invasoras por especies de Candida resistentes al fluconazol y las infecciones graves causadas por Fusarium y Scedosporium apiospermum. La eficacia del voriconazol en el tratamiento de infecciones por Aspergillus y S.apiospermum se ha demostrado en varios casos individuales de infección fúngica invasora en TP (con afectación pulmonar y diseminadas a riñón, piel, mediastino, ojos, sistema nervioso central y otros focos)40,55. En general, la estrategia apunta a una duración mayor que en otros pacientes inmunodeprimidos, que puede oscilar entre los 4 y los 6meses (incluso de por vida en las escedosporiasis), o al menos hasta 6semanas después de la resolución clínica o radiológica. Se recomienda el tratamiento quirúrgico tanto en formas pulmonares invasoras localizadas como en otras ubicaciones accesibles.
El tratamiento antifúngico combinado ofrece prometedores resultados in vitro, en modelos animales y en clínica. No obstante, faltan estudios prospectivos que validen estos resultados. Las interacciones aditivas in vitro y la buena respuesta clínica de las infecciones fúngicas invasoras tratadas con una combinación de voriconazol y equinocandinas, anfotericinaB o terbinafina sugieren un gran potencial de los tratamientos combinados. A partir de los resultados de 2 únicos estudios23,42,43 de combinación de antifúngicos (voriconazol y equinocandina) se desprende que, si no todos, al menos puede que existan algunas subpoblaciones de trasplantados con posibilidad de beneficiarse de esta estrategia en el tratamiento primario de la aspergilosis invasiva, como son los infectados por cepas de A.fumigatus y aquellos con insuficiencia renal, en los cuales podría disminuir la mortalidad.
Otros hongos filamentosos de relevancia clínicaLas infecciones por mucorales tienen una incidencia en trasplantados pulmonares de 13,7-14 casos por cada 1.000 pacientes. No obstante, se han descrito infecciones fúngicas invasoras por Scedosporium, Fusarium, Purpureomyces, Paecilomyces, Scopulariopsis, Acremonium, Trichoderma y otros géneros en pacientes con TP6,47,48.
El tratamiento de la mucormicosis requiere un diagnóstico rápido, la corrección de los factores predisponentes y la resección quirúrgica, si es posible. La anfotericinaB lipídica es el tratamiento médico de elección. Los azoles, como el posaconazol y el ravuconazol, tienen buena actividad in vitro.
Las infecciones por S.apiospermum suponen el 25% de las infecciones fúngicas invasoras producidas por hongos filamentosos de otros géneros diferentes a Aspergillus9,16. Son más habituales en el trasplante unipulmonar, donde el pulmón nativo actúa como reservorio. En una infección fúngica invasora por hialohifomicetos en TP, el voriconazol debe ser considerado como tratamiento de primera línea hasta la identificación de la especie causante. El voriconazol es eficaz en el control, pero puede no erradicar el hongo, por lo que es recomendable un tratamiento antifúngico indefinido o combinado (azol con terbinafina).
La infección por Fusarium es excepcional en TP. Dada la resistencia de esta especie a la mayoría de los antifúngicos, la aproximación terapéutica sería una combinación de una formulación lipídica de anfotericinaB y de voriconazol.
Consideraciones especialesEn los pacientes receptores de un TP existen varias consideraciones de interés para el manejo de las infecciones por otros hongos filamentosos. En primer lugar, la alta incidencia de insuficiencia renal que acontece en los trasplantados, en algunos casos superando el 40% de los enfermos a los 5años del trasplante, obliga al ajuste de la dosis de muchos fármacos según el aclaramiento de la creatinina, además de vigilar la presencia de algunos excipientes nefrotóxicos que contienen algunos antifúngicos (como la ciclodextrina, en el caso del voriconazol, administrado por vía intravenosa)49.
En segundo lugar, deben valorarse las potentes interacciones farmacológicas de los triazoles (itraconazol, voriconazol y posaconazol) con la mayoría de los inmunosupresores (ciclosporina, tacrolimus, everolimus y sirolimus) (tabla 7). Esto es debido a que inhiben el metabolismo hepático de la isoenzima CYP3A4 en el citocromo P450 y obligan al ajuste de la dosis y la monitorización de las concentraciones en sangre, fundamentalmente reduciendo la posología. Debido a las interacciones, los propios agentes antifúngicos pueden comprometer la viabilidad del injerto: puede que se favorezca la aparición de rechazo del injerto o, al contrario, puede promoverse un síndrome inflamatorio de reconstitución inmune, dado que en muchas ocasiones las dosis de los inmunosupresores se reducen más del 50%.
En tercer lugar, otro problema actual es el riesgo de selección y aparición de infecciones por hongos emergentes, derivado en parte de las estrategias de profilaxis universales de amplio espectro o de tratamiento anticipado que se están aplicando en receptores de alto riesgo49.
Por último, hay que considerar la retirada de elementos extraños, como dispositivos de asistencia ventricular, nutrición parenteral o prótesis endobronquiales, que pueden perpetuar la infección en estos pacientes.
En situaciones especiales se emplean en aplicaciones locales agentes antifúngicos, mayoritariamente la anfotericinaB, en un intento de conseguir concentraciones mucho más altas del antifúngico en localizaciones concretas y delimitadas, y así obviar los efectos sistémicos adversos del fármaco. La instilación intracavitaria transtorácica de anfotericinaB puede ser eficaz en el caso del aspergiloma o bola fúngica, pero implica riesgos de neumotórax, hemoptisis y diseminación pleural. La administración de este antifúngico por instilación directa constituye un abordaje alternativo al tratamiento de la aspergilosis traqueobronquial, en asociación con el tratamiento sistémico29.
La administración de antifúngicos por vía inhalatoria mediante nebulizaciones en aerosol se ha ensayado con fármacos de diferentes familias de antifúngicos. Sin embargo, esta modalidad basa su conocimiento sobre todo en estudios de profilaxis antifúngica más que de indicación de tratamiento de una infección fúngica invasora establecida, donde las experiencias comunicadas son más limitadas y dirigidas al objetivo de un tratamiento adyuvante.
Perspectivas futurasEl diagnóstico precoz de cualquier infección fúngica invasora sigue siendo crucial para mejorar los resultados del tratamiento antifúngico. Queda por resolver cómo protocolizar el procedimiento del BAL para que los resultados obtenidos sean reproducibles. De la misma manera, debería implementarse y protocolizarse la detección de GM, BDG y PCR en BAL para el diagnóstico precoz de la enfermedad, incluso para poder guiar el tratamiento anticipado, con las consiguientes efectividad y racionalidad en el consumo de fármacos antifúngicos. Otra asignatura pendiente es la medición sistemática de la concentración en sangre de los triazoles, de gran ayuda para mejorar la eficacia terapéutica y el control de los efectos adversos. El conocimiento de la patogenia del hongo, así como de la respuesta inmunitaria del huésped, se postula actualmente como una herramienta imprescindible para optimizar el manejo (profilaxis y tratamiento) de estas infecciones. La restauración, en lo posible, de la inmunidad del paciente es otro factor clave para la prevención y el tratamiento de las micosis invasoras. En el futuro podrá verse si todas las terapias mencionadas son capaces de disminuir la morbimortalidad. Para finalizar, no se puede olvidar que el manejo de la enfermedad subyacente y el grado de inmunosupresión son elementos clave en el devenir de cualquier enfermedad fúngica invasiva.