Candida glabrata es un patógeno emergente con capacidad de desarrollar tolerancia y resistencia a los antifúngicos azólicos, lo que genera incertidumbre sobre la utilidad de la profilaxis antifúngica en recién nacidos.
ObjetivosEl objetivo de este estudio fue describir los factores asociados a la infección por C. glabrata en una UCIN que utiliza la profilaxis con fluconazol.
MétodosSe diseñó un estudio de casos y controles pareado por edad gestacional realizado en el Hospital Civil de Guadalajara Dr. Juan I. Menchaca. Se estudiaron los recién nacidos con infección por C. glabrata y para cada uno se seleccionó un control pareado por edad gestacional; se estimaron razones de momios (RM) con intervalos de confianza del 95% (IC 95%) y prueba de McNemar para contraste de hipótesis.
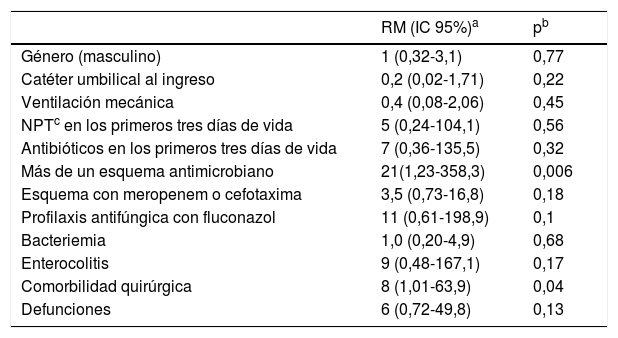
ResultadosVeintiún pacientes presentaron infección, con el 66,7% de ellos de género masculino; la mediana de edad gestacional fue de 31,5 semanas. Se observó mayor riesgo de infección por C. glabrata cuando hubo prescripción de más de un esquema antimicrobiano (RM 21, IC 95% 1,23 - 358,3; p=0,006) y en pacientes con comorbilidades quirúrgicas (RM 8, IC 95% 1,01 - 63,9; p=0,04). Durante el periodo de estudio el riesgo de infección no se vio aumentado por la exposición a fluconazol.
ConclusionesPresentaron mayor riesgo de infección por C. glabrata los neonatos con más de un esquema antimicrobiano y aquellos con comorbilidades quirúrgicas.
Candida glabrata is an emerging pathogen with the ability to develop tolerance and resistance to azole antifungals, which creates uncertainty about the usefulness of antifungal prophylaxis in newborns.
AimsThe aim of this study was to describe the factors associated with C. glabrata infection in a NICU that uses prophylaxis with fluconazole.
MethodsA case-control study paired by gestational age was designed and conducted at the Civil Hospital of Guadalajara Dr. Juan I. Menchaca. Newborns with C. glabrata infection were studied and for each one a matched control was selected by gestational age. Odds ratios (OR) were estimated with 95% confidence intervals (95% CI) and McNemar test for contrast of hypothesis was applied.
ResultsTwenty-one infected patients were identified, from whom 66.7% were male; the median gestational age was 31.5 weeks. Increased risk of infection with C. glabrata was observed when there was a prescription of more than one antimicrobial scheme (OR 21, 95% CI, 1.23 - 358.3; p=0.006) and also among patients with surgical comorbidities (OR 8, 95% CI 1.01 - 63.9; p=0.04). During the study period, exposure to fluconazole showed no difference in the risk of infection.
ConclusionsNeonates with more than one antimicrobial regimen and those with surgical comorbidities had a higher risk of C. glabrata infection.
Las infecciones por levaduras son causa frecuente de morbilidad y mortalidad en recién nacidos prematuros y en los de muy bajo peso al nacer. Entre las intervenciones profilácticas se recomienda el uso de antifúngicos azólicos, principalmente en las Unidades de Cuidados Intensivos Neonatales (UCIN) donde las infecciones son prevalentes11,14.
Candida glabrata es un patógeno emergente que, a diferencia de otras especies de Candida, no tiene la capacidad de formar hifas o secretar proteasas; sin embargo, puede evadir el sistema inmune y adherirse a las células epiteliales para colonizar tejidos, lo que causa infecciones graves, principalmente en pacientes inmunodeficientes12. Otra característica es su capacidad de tolerancia y resistencia a los antifúngicos azólicos, lo que ha generado incertidumbre sobre el beneficio de la profilaxis antifúngica en neonatos de alto riesgo12,13.
Con el objetivo de describir los factores asociados a la infección por C. glabrata en una UCIN con uso de fluconazol profiláctico se realizó un estudio de casos y controles pareado por edad gestacional en el Hospital Civil de Guadalajara Dr. Juan I. Menchaca (HCGJIM) de la ciudad de Guadalajara, Jalisco. La institución concede atención a población de escasos recursos económicos; el Servicio de Neonatología cuenta con 57 cunas de terapia intermedia y 18 cunas de terapia intensiva neonatal. En este servicio las especies de Candida representan el 3,8% del total de aislamientos microbianos en sangre o líquido cefalorraquídeo (LCR); las especies prevalentes son Candida albicans y Candida parapsilosis.
Los casos fueron diagnosticados durante los meses de julio a octubre de 2018, periodo en el cual se registró un aumento de infecciones del torrente sanguíneo por C. glabrata. En el análisis de los factores asociados, y de forma retrospectiva, se seleccionó como control para cada uno de los casos el último paciente de la misma edad gestacional (±10 días) nacido en la institución que no presentara infección por Candida. Se consultó la información clínica y demográfica de los expedientes clínicos.
En el HCGJIM la toma de muestras para estudios microbiológicos es acorde al protocolo de diagnóstico de sepsis neonatal de la Secretaría de Salud6. Las muestras para los cultivos de sangre y de LCR se obtienen con técnica aséptica y se inoculan en frascos BacT/ALERT PF Pediatric FAN®. El crecimiento microbiano se controla en el sistema automatizado Bact/ALERT®3D durante un periodo de siete días. En los cultivos con crecimiento microbiano se realiza tinción de Gram; en caso de observar levaduras se realiza siembra en agar Sabouraud, para posteriormente identificar el género, la especie y realizar una prueba de sensibilidad a los antifúngicos en sistema automatizado Vitek®2.
Para el análisis estadístico de las variables cualitativas se describieron frecuencias y porcentajes, y de las cuantitativas mediana y rangos intercuartiles (RIQ). Como pruebas de contraste de hipótesis se usó χ2 para la comparación de proporciones y U de Mann-Whitney para las medianas. Se realizó una estimación de la razón de momios (RM) para los pares de casos y controles con prueba de McNemar para contraste de hipótesis. Se consideró significación estadística un valor de p<0,05. Se utilizó el programa IBM SPSS Statistics Versión 20 y OpenEpi (http://openepi.com/Menu/OE_Menu.htm).
Durante el periodo de estudio se aisló C. glabrata en el hemocultivo de 21 pacientes; no se realizaron estudios moleculares para determinar si los aislamientos eran la misma cepa. La prueba de sensibilidad a los antifúngicos arrojó valores de sensibilidad intermedia al fluconazol, y sensibilidad a la anfotericina B, la caspofungina, la flucitosina, la micafungina y el voriconazol. El 66,7% (n=14) de los pacientes eran de género masculino; la mediana de edad gestacional fue de 31,5 semanas (máxima 39,2, mínima 29,1; RIQ 6,4) y la mediana de peso al nacimiento 1.311g (máximo 3.410, mínimo 786; RIQ 1033).
Todos los pacientes recibieron antibióticos en los primeros tres días de vida. Los esquemas indicados fueron ampicilina/gentamicina (n=16) y vancomicina/amikacina (n=5); la mediana de duración del tratamiento fue de 3 días (máxima 10, mínima 1; RIQ 3). Con anterioridad a la fungemia cinco pacientes presentaron bacteriemia por Klebsiella pneumoniae productora de betalactamasas de espectro extendido. Todos los pacientes recibieron un segundo esquema antimicrobiano; se prescribió cefotaxima o meropenem en el 47,6% (n=10). Recibieron profilaxis antifúngica con fluconazol el 76,2% (n=16); los neonatos con un peso al nacimiento superior a 1.500g no recibieron el antifúngico.
Se colocó catéter umbilical en el 66,7% (n=14) y en el resto se insertó catéter percutáneo (n=7). Recibieron ventilación mecánica el 66,7% (n=14) y a todos se administró nutrición parenteral total desde los primeros tres días de vida. El 38,1% (n=8) presentaron alguna comorbilidad quirúrgica (gastrosquisis [n=5], atresia intestinal [n=1], hernia diafragmática [n=1] y hernioplastia inguinal [n=1]), y cuatro pacientes presentaron datos clínicos de enterocolitis.
La mediana de edad al diagnóstico de la infección por C. glabrata fue de 9 días (máxima 38, mínima 3; RIQ 12). En seis pacientes se aisló C. glabrata de sangre y LCR, y en uno se diagnosticó endocarditis. Ocho de los neonatos recibieron tratamiento inicial con anfotericina B complejo lipídico (ABCL), pero en cinco de ellos se agregó al tratamiento caspofungina por presentar fungemia persistente (≥5 días); los tres restantes murieron antes de modificar el tratamiento. En trece pacientes se inició tratamiento con ABCL y caspofungina; se mantuvo la terapia antifúngica en todos los supervivientes hasta contar con dos hemocultivos negativos. Al comparar la letalidad en función del tratamiento que recibieron al inicio del cuadro clínico se observó que fue mayor en los pacientes con monoterapia (62,5% vs. 23,1%; p=0,3), aunque no fue estadísticamente significativa. Tampoco hubo diferencia en el riesgo de fungemia persistente (62,6% vs. 69,2%; p=1).
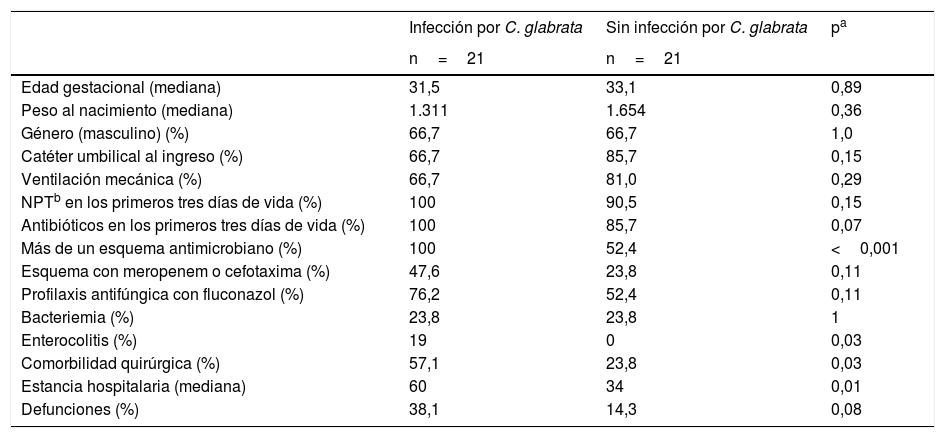
Para el análisis de los factores asociados, para cada caso se seleccionó un control sin la infección de la misma edad gestacional. En la tabla 1 se muestran las características clínicas, demográficas y terapéuticas de los casos y los controles. En los pacientes infectados por C. glabrata se observó con mayor frecuencia la prescripción de más de un esquema antimicrobiano (p<0,001) y la presencia de comorbilidades quirúrgicas (p=0,03) o enterocolitis (p=0,03); el tiempo de estancia hospitalaria también era mayor (60 días vs. 34 días; p=0,01); y la mortalidad, si bien no existía una diferencia significativa, fue porcentualmente mayor en los neonatos infectados (38,1% vs. 14,3%; p=0,08). En la tabla 2 se recogen las RM para los grupos pareados de las variables estudiadas. Aunque no se identificó como un factor de riesgo, casi la mitad de los casos recibieron antibióticos de amplio espectro (cefotaxima o meropenem) después de un esquema antimicrobiano empírico por sospecha de sepsis. Se ha descrito que esta intervención promueve una mayor densidad de colonización por Candida10.
Datos demográficos, clínicos e intervenciones terapéuticas en función de la infección del torrente sanguíneo por Candida glabrata
| Infección por C. glabrata | Sin infección por C. glabrata | pa | |
|---|---|---|---|
| n=21 | n=21 | ||
| Edad gestacional (mediana) | 31,5 | 33,1 | 0,89 |
| Peso al nacimiento (mediana) | 1.311 | 1.654 | 0,36 |
| Género (masculino) (%) | 66,7 | 66,7 | 1,0 |
| Catéter umbilical al ingreso (%) | 66,7 | 85,7 | 0,15 |
| Ventilación mecánica (%) | 66,7 | 81,0 | 0,29 |
| NPTb en los primeros tres días de vida (%) | 100 | 90,5 | 0,15 |
| Antibióticos en los primeros tres días de vida (%) | 100 | 85,7 | 0,07 |
| Más de un esquema antimicrobiano (%) | 100 | 52,4 | <0,001 |
| Esquema con meropenem o cefotaxima (%) | 47,6 | 23,8 | 0,11 |
| Profilaxis antifúngica con fluconazol (%) | 76,2 | 52,4 | 0,11 |
| Bacteriemia (%) | 23,8 | 23,8 | 1 |
| Enterocolitis (%) | 19 | 0 | 0,03 |
| Comorbilidad quirúrgica (%) | 57,1 | 23,8 | 0,03 |
| Estancia hospitalaria (mediana) | 60 | 34 | 0,01 |
| Defunciones (%) | 38,1 | 14,3 | 0,08 |
Razón de momios para las variables estudiadas al comparar casos y controles
| RM (IC 95%)a | pb | |
|---|---|---|
| Género (masculino) | 1 (0,32-3,1) | 0,77 |
| Catéter umbilical al ingreso | 0,2 (0,02-1,71) | 0,22 |
| Ventilación mecánica | 0,4 (0,08-2,06) | 0,45 |
| NPTc en los primeros tres días de vida | 5 (0,24-104,1) | 0,56 |
| Antibióticos en los primeros tres días de vida | 7 (0,36-135,5) | 0,32 |
| Más de un esquema antimicrobiano | 21(1,23-358,3) | 0,006 |
| Esquema con meropenem o cefotaxima | 3,5 (0,73-16,8) | 0,18 |
| Profilaxis antifúngica con fluconazol | 11 (0,61-198,9) | 0,1 |
| Bacteriemia | 1,0 (0,20-4,9) | 0,68 |
| Enterocolitis | 9 (0,48-167,1) | 0,17 |
| Comorbilidad quirúrgica | 8 (1,01-63,9) | 0,04 |
| Defunciones | 6 (0,72-49,8) | 0,13 |
Durante el periodo de estudio se registraron cuatro pacientes con infección por otras especies de Candida (C. albicans [n=1] y C. parapsilosis [n=3]); al comparar estos con los pacientes con infección por C. glabrata no se observó diferencia en el peso al nacimiento (p=0,23), la edad gestacional (p=0,41) o los días de vida al momento del diagnóstico de la infección (p=0,18). Si bien el peso al nacimiento se ha identificado como un factor de riesgo para la infección neonatal por especies de Candida, en este estudio se observó que el 38% de los casos presentaron un peso al nacer igual o superior a 1.500g. Similar a nuestros hallazgos, Fairchild et al. describieron en pacientes con infección por C. glabrata mayor peso y edad gestacional que en aquellos con aislamiento de otras especies de Candida, y observaron que la infección se presenta en promedio después de diez días de vida y que el uso de antibióticos incrementa el riesgo7.
Otro hallazgo en nuestro estudio fue la asociación de la infección y la disrupción de las mucosas intestinales, ya fuera por procedimientos quirúrgicos o por la presencia de enterocolitis; es probable que estas situaciones favorezcan la translocación de microorganismos desde el tracto intestinal hacia el torrente sanguíneo10. En los casos y controles incluidos en este estudio se constató una alta frecuencia en el uso de dispositivos invasivos y la prescripción de antibióticos desde las primeras horas de vida. Si bien estas intervenciones pueden ser necesarias para el cuidado del paciente, se deben vigilar las técnicas de asepsia y antisepsia en la inserción y manejo de los dispositivos, e implementar un programa de control de antimicrobianos que restrinja su uso a los casos realmente necesarios12.
Debido a la frecuencia de fungemia persistente en los pacientes que inicialmente recibieron monoterapia con ABCL (5/8), el resto de los pacientes fueron tratados con dos antifúngicos, situación similar a la llevada a cabo en otros casos publicados4,8. Si bien existen estudios sobre la farmacocinética y seguridad de la ABCL en recién nacidos, incluso en los de muy bajo peso al nacer, el medicamento presenta una alta variabilidad interindividual2,16; hasta la fecha, no se cuenta con estudios comparativos concluyentes entre las diferentes opciones de antifúngicos5,15. Ascher et al. describieron una mayor mortalidad en neonatos tratados con formulaciones lipídicas de anfotericina B en comparación con quienes fueron tratados con anfotericina B desoxicolato1. En las últimas décadas diferentes estudios describen una distribución constante de las infecciones por especies de Candida y en sus patrones de resistencia, pero en recién nacidos la información es inconsistente3,9, por lo que se debe controlar la aparición de brotes en entornos donde el fluconazol es utilizado como profiláctico. El reducido número de pacientes, una limitación en este estudio, condiciona el hallazgo de factores con menor fuerza de asociación.
Podemos concluir que los factores de riesgo para sufrir una infección por C. glabrata en pacientes recién nacidos son la prescripción de más de un esquema antimicrobiano (RM 21, IC 95% 1,23-358,3; p=0,006) y la presencia de comorbilidades quirúrgicas (RM 8, IC 95% 1,01-63,9; p=0,04).