En el presente estudio se cuantificó la producción de biopelículas individuales y mixtas de Candida albicans y Staphylococcus aureus para determinar si dichas biopelículas mixtas se favorecen sinérgicamente. Los ensayos se realizaron utilizando placas de microtitulación de poliestireno de 96 pocillos de fondo plano, se determinó la actividad metabólica de las células en la biopelícula por medio de la reducción enzimática de una sal de tetrazolio (XTT) a través de los cambios colorimétricos que fueron medidos a 490nm. Para visualizar las biopelículas de cada microorganismo y su cinética de crecimiento se utilizo microscopia láser confocal. La mayor formación de biopelícula se observó en las biopelículas mixtas, seguida de las de Candida albicans y, por último, la menor producción la obtuvo Staphylococcus aureus, lo cual nos sugiere la presencia de una relación sinérgica entre los microorganismos ensayados.
This study quantifies the production of single and mixed biofilms of Candida albicans and Staphylococcus aureus to determine if such mixed biofilms have synergistic effects. Assays were performed using polystyrene microtitre plates of 96 wells, metabolic activity was measured by the enzymatic reduction of a tetrazolium salt (XTT) and colorimetric changes were measured at 490nm. Confocal scanning laser microscopy was used to visualise the biofilms of each microorganism and its growth kinetics. The highest levels of biofilm formation were observed in mixed biofilms, followed by those of Candida albicans only, with the lowest levels of biofilm formation being detected for Staphylococcus aureus; all together these results suggest a synergistic relationship between the tested microorganisms.
Una biopelícula es un ecosistema complejo de microorganismos y sus productos extracelulares adheridos sobre una superficie biótica o abiótica9. De acuerdo a los Institutos Nacionales de Salud de los Estados Unidos y de Europa, se estima que más del 60% de las infecciones microbianas involucran a las biopelículas10,25. La arquitectura de estas muestra una estratificación intrínseca en poblaciones polimicrobianas, organizadas espacialmente con importantes interacciones de comunicación interespecies14, las cuales han sido particularmente estudiadas en el desarrollo de biopelículas bacterianas15,39,42. Respecto al desarrollo de Candida con diferentes bacterias, se han estudiado los fenómenos de coagregación y coadhesión, así como el efecto de factores moduladores como la saliva, azúcares o el pH16,17,22,26,28,36. Se estima que el 65% de las candidiasis están asociadas a la formación de biopelículas debido a la resistencia a los antimicrobianos que desarrollan las levaduras en estas comunidades31,34,41, así como a la evasión de las defensas del huésped, lo que hace que su eliminación sea complicada18. Candida albicans sigue siendo la especie del género que prevalece con mayor frecuencia, sea colonizando o infectando superficies epiteliales de la boca, el tracto gastrointestinal o la vagina. Esto se ha asociado al elevado potencial que posee para formar biopelículas sobre dispositivos médicos, lo que la ubica entre uno de los 4 principales microorganismos asociado a infecciones nosocomiales7.
Las biopelículas formadas tanto en dispositivos médicos como en ambientes naturales con frecuencia son polimicrobianas. Las de C. albicans y Staphylococcus se desarrollan con facilidad12,24,32, incrementándose la patogenicidad de las mismas4. Se ha revelado mediante microscopia electrónica que en estas biopelículas mixtas se desarrollan numerosas interacciones entre Staphylococcus y las hifas o las levaduras, observando que las células fúngicas pueden moderar la acción de los antimicrobianos y las bacterias afectar la actividad de los agentes antifúngicos11,13,19.
En las últimas décadas se ha utilizado un amplio rango de modelos in vitro para estudiar la formación y el desarrollo de biopelículas; en el propuesto por Ramage et al.33 se forman biopelículas sobre el fondo plano de los pocillos en placas de poliestireno y posteriormente se mide la reducción de una sal de tetrazolio (XTT), la misma que resulta a consecuencia de la actividad enzimática de las células viables en dichas biopelículas30. En lo que respecta a las bacterias, el XTT es reducido por enzimas de la cadena respiratoria que están localizadas en la membrana plasmática, mientras que, en las levaduras, esta sal se reduce por deshidrogenasas mitocondriales6,29,37. La finalidad de este estudio fue demostrar si existe una relación sinérgica entre C. albicans y Staphylococcus aureus en la formación de biopelículas mixtas utilizando el ensayo de XTT y realizando observaciones de estas mediante microscopia láser confocal.
Materiales y métodosSe utilizaron 2 aislamientos clínicos, uno de C. albicans y uno de S. aureus, ambos provenientes de un paciente con estomatitis protésica recurrente de difícil tratamiento. Estos aislamientos fueron seleccionados después de realizar un ensayo para medir la capacidad de formación de biopelículas en 20 aislamientos clínicos de ambos microorganismos provenientes de una colección del Laboratorio de Microbiología Bucal del Instituto de Ciencias Biomédicas de la Universidad Autónoma de Ciudad Juárez; adicionalmente se ensayaron las cepas de referencia obtenidas de la American Type Culture Collection (ATCC) C. albicans ATCC 90028 y S. aureus ATCC 25923.
Los aislamientos fueron caracterizados y tipificados previamente mediante métodos microbiológicos convencionales incluyendo cultivos convencionales, las pruebas de asimilación de carbohidratos API Staph y API 20 C (bioMérieux, Marcy l’Etoile, Francia) y, adicionalmente, formación de seudohifas en agar harina de maíz para C. albicans y pruebas de catalasa y coagulasa para S. aureus. Los aislamientos utilizados fueron clasificados previamente como altamente productores de biopelícula y se demostró una capacidad de formación de biopelículas constante bajo diferentes condiciones de crecimiento en experimentos por triplicado realizados en 3 ocasiones por separado.
Condiciones de crecimiento y preparación del inóculoLos aislamientos de C. albicans fueron incluidos para su crecimiento en agar dextrosa Sabouraud durante 24h a 36°C±1°C, mientras que los aislamientos de S. aureus lo fueron en agar sal y manitol bajo las mismas condiciones de crecimiento.
De estos cultivos se sembró una colonia en tubos cónicos (Falcon®) con 10ml de caldo YDP (extracto de levadura, dextrosa, peptona) para C. albicans y con 10ml de caldo de soya tripticasa para S. aureus, y fueron incubados toda una noche a 36°C±1°C con agitación orbital (100 RPM) (New Brunswick Scientific, Edison, JJ. EE. UU.). La pureza de cada aislamiento fue monitorizada entre cada ensayo usando Chromagar Candida® y Chromagar Sthap® (Chromagar®, Francia).
Posteriormente, cada uno de los cultivos en caldo fue centrifugado, lavado en 3 ocasiones con tampón fosfato (cloruro de fosfato 2,7mm, cloruro de sodio 1,37mm, y pH a 7,4 Sigma) y resuspendido en RPMI-1640 con MOPS (Sigma). Se ajustó a una densidad de 1 a 5×106 levaduras/ml y de 1 a 5×108 bacterias/ml mediante recuento con cámara de Neubauer.
Ensayo de formación de biopelículasSe realizaron ensayos de formación de biopelículas de acuerdo al método previamente descrito33 utilizando placas comerciales de microtitulación de poliestireno de 96 pocillos de fondo plano (Costar, EIA/RIA plate, with low evaporation lid, high binding, sterile; Corning, NY, EE. UU.). Los ensayos se realizaron para cada especie individualmente y con un inóculo mixto; cada aislamiento se ensayó por triplicado en series de 96 pocillos, inoculando cada pocillo con 150μl de una suspensión de los microorganismos individualmente en RPMI-1640 y otros donde el inóculo fue mixto con 75μl de cada microorganismo (levadura/bacteria). Una vez preparadas, las placas fueron incubadas a 37°C para posteriormente hacer mediciones de crecimiento, a los 30min, 1, 2, 3, 4, 6, 8, 12, 24 y 48h. Transcurrido el periodo de incubación se retiró el medio y se eliminaron las células no adheridas con una serie de 3 lavados con tampón de fosfatos (PBS) estéril, para posteriormente cuantificar la formación de las biopelículas.
Medición de la formación de biopelículasLa formación de biopelículas se midió indirectamente de forma semicuantitativa colorimétrica usando un ensayo de reducción de 2,3 bis (2 metoxi-4-nitro-5 sulfofenil) 2H tetrazolio, 5 carboxanilida (XTT). El XTT (Sigma) que se preparó como una solución saturada a 0,5g/l en solución de lactato de Ringer, a una concentración final de 10μm de menadiona, fue filtrado (poro de 0,22μm) y alicuotado previamente en tubos de 10ml. Previo al ensayo y en condiciones de baja luminosidad, se añadieron 150μl de la solución XTT/menadiona a cada pocillo que contenía las biopelículas prelavadas y a los pocillos control. Las placas se incubaron en total oscuridad durante 1 h a 37°C y los cambios colorimétricos se midieron con el sistema Multiskan (FISHER, EE. UU.) a una longitud de onda de 490nm. Paralelamente se realizaron exámenes microscópicos de las biopelículas formadas utilizando un microscopio óptico invertido.
Se realizó una estadística descriptiva (media, varianza y desviación estándar) de los valores obtenidos en la formación de biopelículas y se analizaron las diferencias entre cada ensayo, comparando los valores entre levaduras, bacterias, el cultivo mixto y por periodo de tiempo, utilizando para tal fin la prueba estadística de la t de Student, con un nivel de significancia del 95%, a través del programa SPSS 15.0®.
Microscopia láser confocalSe realizaron ensayos de formación de biopelículas como se ha descrito en los apartados anteriores; se utilizaron discos precortados y esterilizados obtenidos del fondo plano de las placas comerciales de microtitulación de poliestireno de 96 pocillos empleadas (Costar, Corning, NY, EE. UU.). Los ensayos se realizaron individualmente para cada especie y con un inóculo mixto utilizando las cepas ATCC de cada especie. Los discos fueron sumergidos en placas de cultivo de 24 pozos y, después de cada periodo de formación de biopelícula, fueron retirados y lavados en 3 ocasiones con PBS, para posteriormente teñir las biopelículas de C. albicans con el sistema LIVE/DEAD® Yeast Viability Kit (Invitrogen) y para el caso de S. aureus con el sistema LIVE/DEAD® BacLight Bacterial Viability Kit (Invitrogen). En el caso de las biopelículas mixtas se utilizaron ambos sistemas, tiñendo primero las levaduras incubando a 30°C durante 45min, y posteriormente las bacterias incubando a temperatura ambiente durante 15 a 20min más. Para el análisis microscópico de las biopelículas se utilizó un microscopio láser confocal (Leica® DMI 4000B), con un láser de argón. Se obtuvieron imágenes y se observaron diferentes campos de la superficie inoculada en aumentos de 10×, 40× y 100× utilizando longitudes de onda de 488 y 532nm. Además, se analizaron las imágenes y se realizaron reconstrucciones tridimensionales utilizando el software LAS AF Lite (Leica® Microsystems, Alemania).
ResultadosCinética de la formación de biopelículas individuales y mixtasSe determinó la formación de biopelículas de levaduras, de bacterias y mixtas midiendo los cambios colorimétricos en el ensayo de reducción de la sal XTT, y se analizaron imágenes mediante microscopia láser confocal de las biopelículas bacterianas y levaduriformes teñidas con los colorantes SYTO 9 y FUN 1/FUN 2, respectivamente.
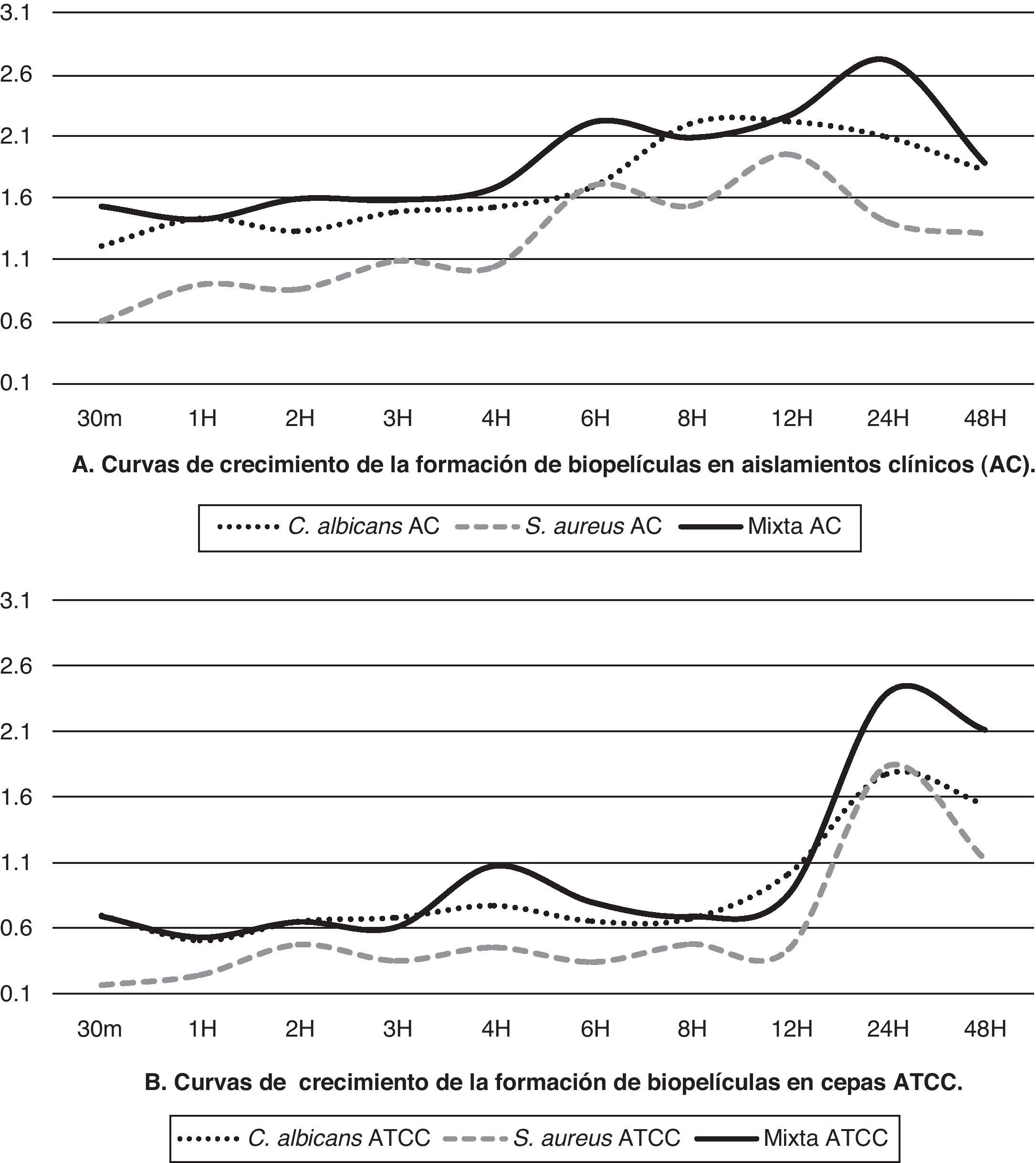
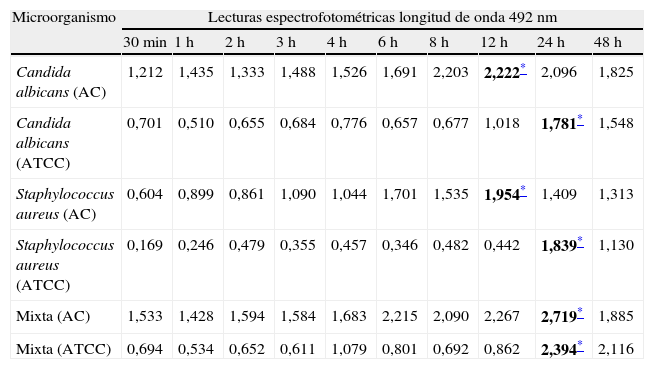
Los cambios colorimétricos producto de la reducción del XTT fueron leídos por espectrofotometría a una longitud de onda de 490nm; solo se consideraron válidos los ensayos cuando las mediciones promedio tenían desviaciones estándar intraensayo ≤0,25 y ≤0,5 interensayo. En el ensayo de biopelículas con XTT observamos que los cultivos mixtos (levadura/bacteria) presentaron la mayor producción o actividad metabólica (p<0,01) de las células en biopelícula, seguidos por los valores de las biopelículas individuales de C. albicans, que mostraron una mayor actividad metabólica (p<0,01) en comparación con S. aureus. En la tabla 1 se muestran los valores promedio de la actividad metabólica de las células en biopelículas de cada uno de los aislamientos y cepas ensayadas en los diferentes periodos de tiempo de formación (desde los 30 min hasta las 48 h).
Cinética de crecimiento de biopelículas en diferentes periodos de tiempo, midiendo la reducción del XTT por espectrofotometría a una longitud de onda de 490nm proporcional a la actividad metabólica de las células en biopelícula de aislamientos clínicos y cepas ATCC
| Microorganismo | Lecturas espectrofotométricas longitud de onda 492nm | |||||||||
| 30min | 1h | 2h | 3h | 4h | 6h | 8h | 12h | 24h | 48h | |
| Candida albicans (AC) | 1,212 | 1,435 | 1,333 | 1,488 | 1,526 | 1,691 | 2,203 | 2,222* | 2,096 | 1,825 |
| Candida albicans (ATCC) | 0,701 | 0,510 | 0,655 | 0,684 | 0,776 | 0,657 | 0,677 | 1,018 | 1,781* | 1,548 |
| Staphylococcus aureus (AC) | 0,604 | 0,899 | 0,861 | 1,090 | 1,044 | 1,701 | 1,535 | 1,954* | 1,409 | 1,313 |
| Staphylococcus aureus (ATCC) | 0,169 | 0,246 | 0,479 | 0,355 | 0,457 | 0,346 | 0,482 | 0,442 | 1,839* | 1,130 |
| Mixta (AC) | 1,533 | 1,428 | 1,594 | 1,584 | 1,683 | 2,215 | 2,090 | 2,267 | 2,719* | 1,885 |
| Mixta (ATCC) | 0,694 | 0,534 | 0,652 | 0,611 | 1,079 | 0,801 | 0,692 | 0,862 | 2,394* | 2,116 |
AC: aislamientos clínicos; ATCC: American Type Culture Collection.
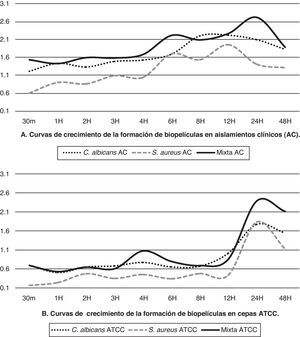
Los aislamientos clínicos de C. albicans y S. aureus desarrollados individualmente alcanzaron su máximo crecimiento a las 12h y las cepas ATCC lo hacen a las 24h, mientras que en los cultivos mixtos el máximo crecimiento se obtuvo a las 24h. El comportamiento de aislamientos clínicos y cepas ATCC muestra algunas diferencias (tabla 1) tanto en la cinética como en los valores promedio de la actividad metabólica de las células en biopelícula; para el aislamiento de C. albicans es evidente una mayor producción del aislamiento clínico versus la cepa ATCC, mientras que para los aislamientos clínicos de S. aureus y para el cultivo mixto el aumento que se observó fue más discreto.
El aislamiento clínico de C. albicans mantuvo un crecimiento sostenido después de las 3 h, mostrando la fase de declinamiento después de las 24h, mientras que S. aureus mostró crecimiento constante a partir de la primera hora, con ligeros acoplamientos antes de continuar su crecimiento exponencial, que mostró su máximo pico a las 12h para posteriormente empezar a decrecer. Las curvas de crecimiento de los aislamientos clínicos y las cepas ATCC de biopelículas de los microorganismos tanto en crecimiento individual como en crecimiento mixto se muestran en la figura 1.
Se observó que los aislamientos clínicos tienen un aumento sostenido de su actividad metabólica desde periodos tempranos de la formación de las biopelículas, mientras que las cepas ATCC presentan menor actividad en las etapas tempranas con una fase exponencial marcada a partir de las 12h de formación; sin embargo, en ambos la actividad metabólica de las células en biopelículas mixtas fue mayor (p<0,01) que cuando los microorganismos se hicieron crecer individualmente, con algunas diferencias en su cinética y con una curva de crecimiento para las biopelículas mixtas que alcanza su máximo a las 24h, para empezar a decrecer posteriormente (fig. 1).
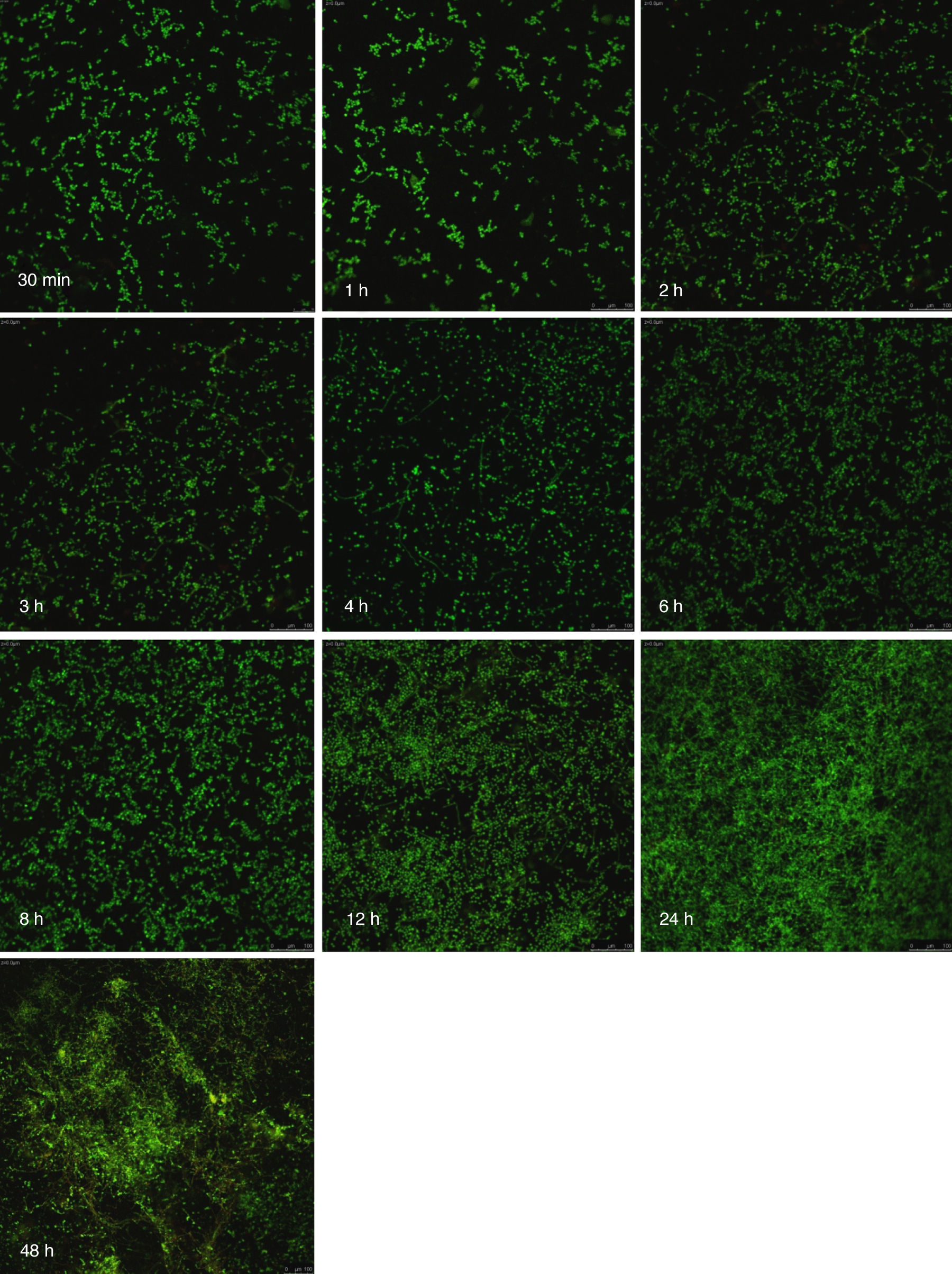
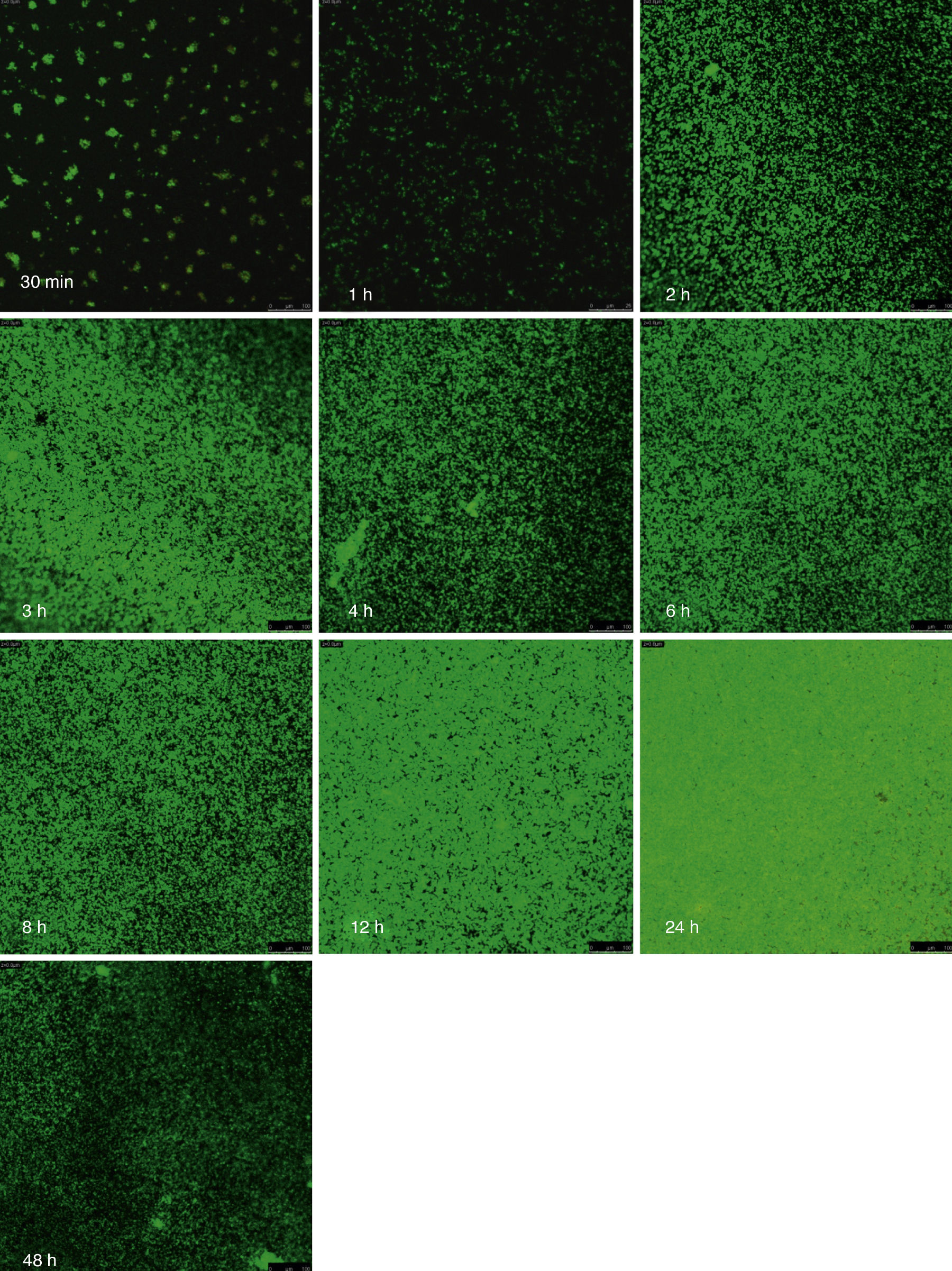
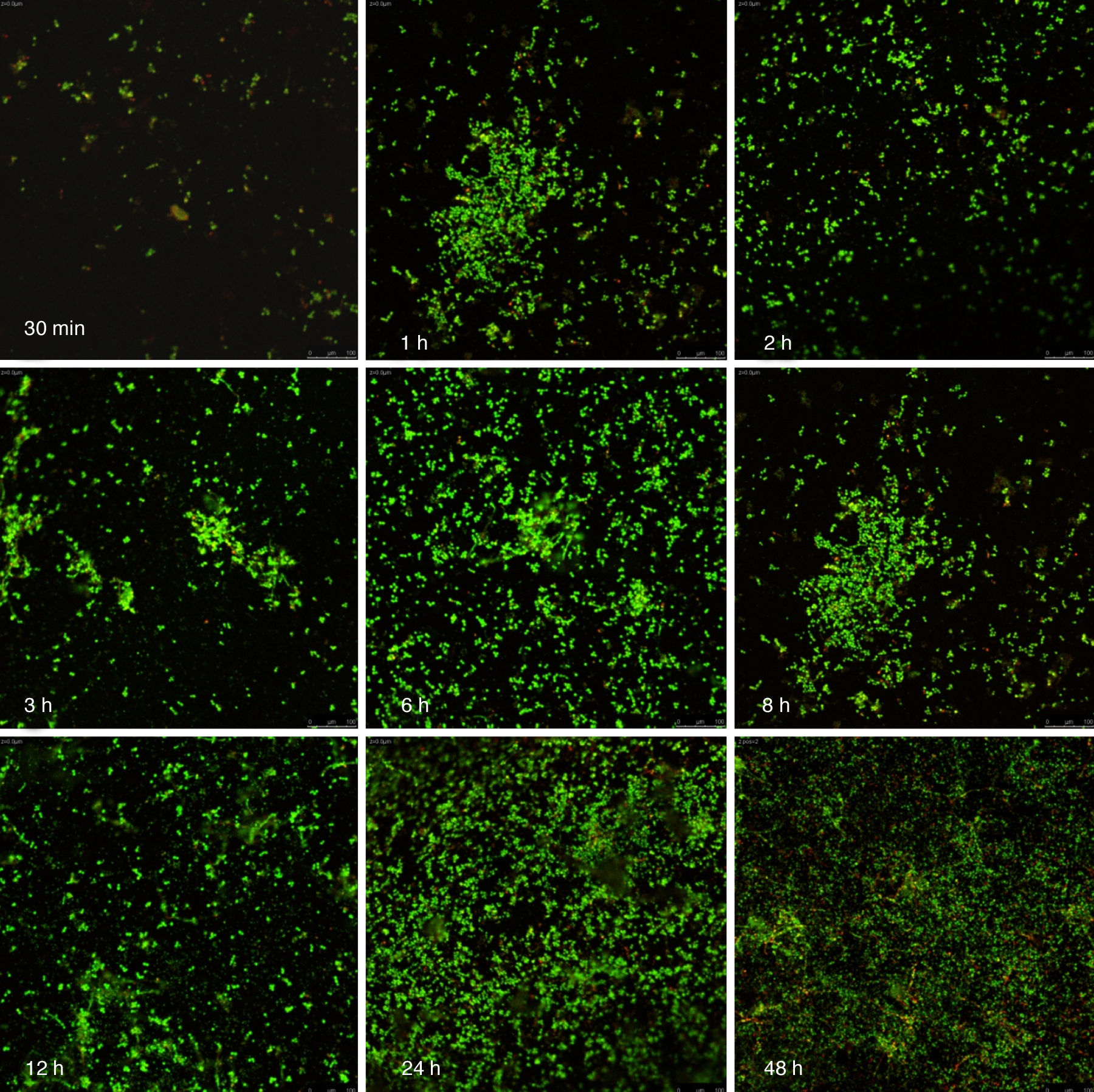
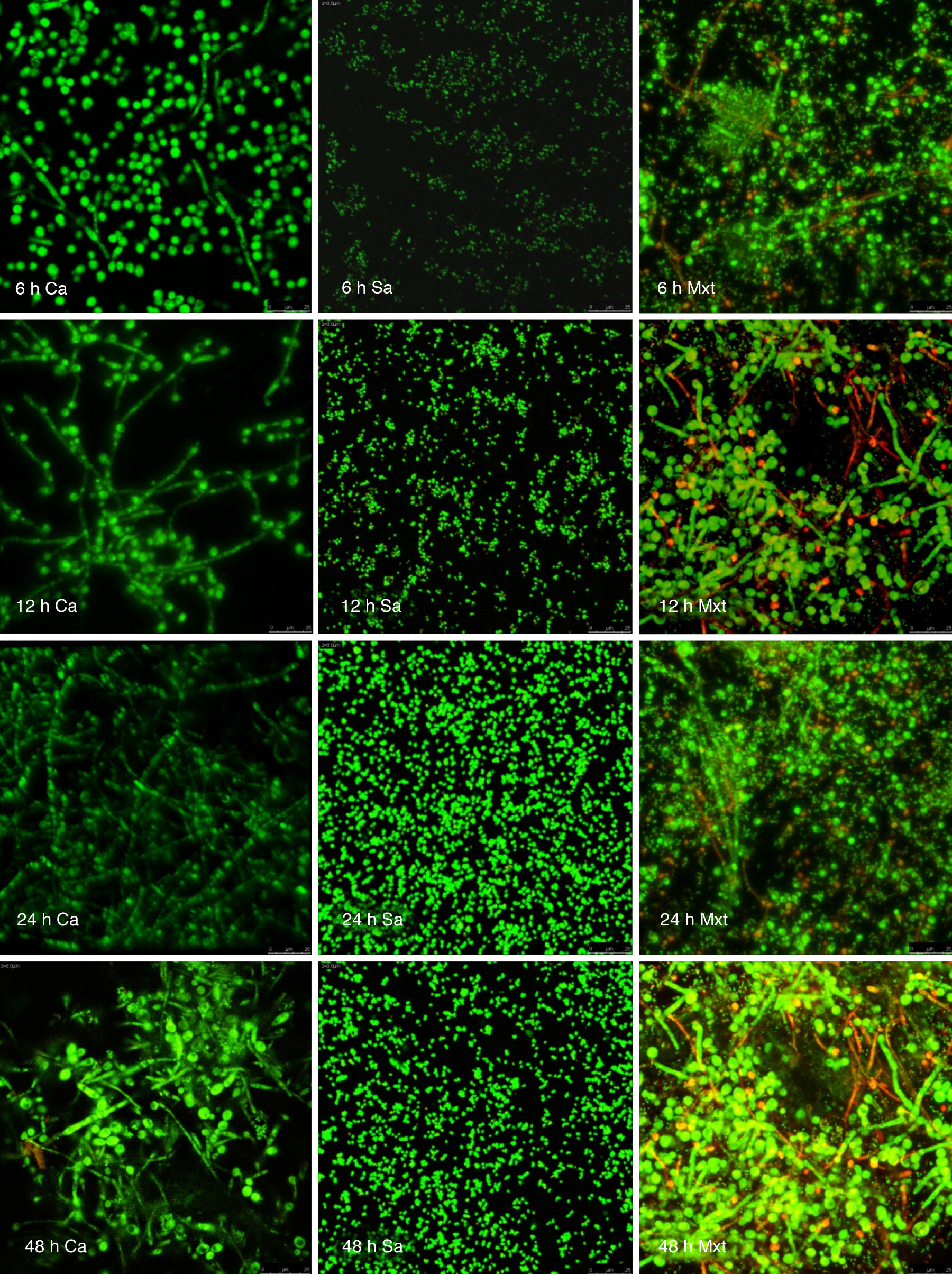
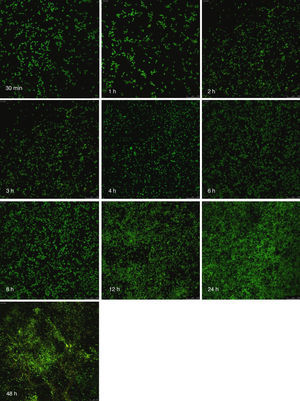
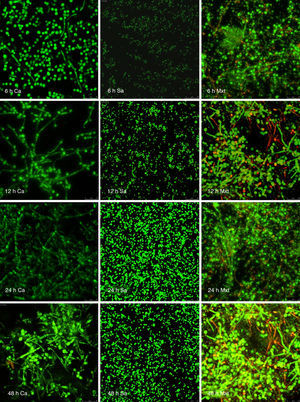
Visualización de las biopelículas individuales y mixtas mediante microscopia láser confocalLa visualización mediante microscopia láser confocal de las biopelículas permitió evaluar la cinética de formación y las características morfológicas de las mismas. El LIVE/DEAD® Yeast Viability Kit usado para teñir las biopelículas de C. albicans y el LIVE/DEAD® BacLight Bacterial Viability Kit para el caso de S. aureus permitieron visualizar las células metabólicamente activas. En el caso de las levaduras, la actividad metabólica se traduce en un cambio de verde a rojo fluorescente, dentro de las estructuras intravacuolares. Debido a la colocalización de tintes fluorescentes (FUN-1,2 y blanco de calcoflúor), las células metabólicamente activas aparecen de color verde-amarillo cambiando a naranja-rojo durante la captura de imágenes de varios canales. En el caso de las bacterias, el colorante SYTO® 9 es verde-fluorescente de ácidos nucleicos y el yoduro de propidio es un colorante de ácidos nucleicos de color rojo-fluorescente; ambos tienen características espectrales con capacidades distintas para penetrar en las células bacteriana (en aquellas con las membranas celulares intactas se tiñen en verde fluorescente, mientras que las bacterias con las membranas dañadas se tiñen en rojo fluorescente).
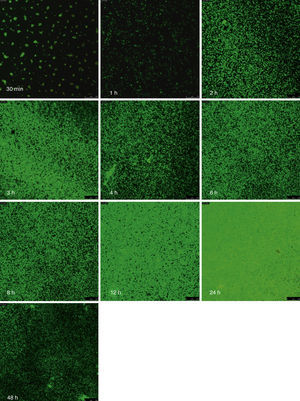
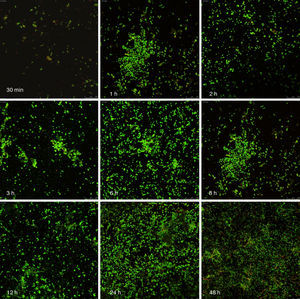
Las figuras 2 y 3 a un menor aumento (10x) permiten visualizar un amplio panorama del crecimiento de las biopelículas sobre la superficie; ambos microorganismos van ocupando la superficie de manera gradual. C. albicans ocupa la totalidad de la superficie de manera clara a las 24h, formando una estructura compleja de células levaduriformes, seudohifas e hifas verdaderas y con una mayor madurez estructural a las 48h, evidenciada por el cambio de tonalidades fluorescentes de amarillo-verde a naranja-rojo (fig. 4). S. aureus ocupa la totalidad de la superficie a las 8h de formación y alcanza su máximo crecimiento y su mayor complejidad estructural a las 24h (figs. 3 y 4), las células se agrupan en forma de tétradas y sarcinas entre los 30min y 1h, y después de 3h las agrupaciones racimosas empiezan a distribuirse sobre la superficie ocupándola en su totalidad para las 8h. Las biopelículas mixtas ocupan la totalidad de la superficie hasta las 24h (fig. 5), alcanzando su mayor complejidad estructural y madurez a las 48h, observándose una comunidad de conglomerados verde fluorescente de blastosporas que filamentan y múltiples hifas verdaderas, algunas de las cuales tienen menor actividad o están en etapa de muerte, lo que es evidenciado por el cambio en las tonalidades a naranja-rojo fluorescente (fig. 4). Las múltiples estructuras se enredan dejando espacios que son ocupados por las agrupaciones cocoides de las bacterias. En las diferentes imágenes analizadas, la madurez y complejidad estructural de las biopelículas mixtas es mayor que cuando los microorganismos se desarrollan individualmente, observando conglomerados complejos poco uniformes adheridos sobre la superficie.
Imágenes de la formación de las biopelículas de Candida albicans (Ca) y Staphylococcus aureus (Sa) y mixtas (Mxt) utilizando microscopia laser confocal. Observaciones 40×. Los diferentes paneles muestran el desarrollo de la biopelícula en diferentes intervalos de tiempo de formación.
En la actualidad, C. albicans se considera uno de los hongos que más afecta al ser humano; el estudio de las interacciones que este hongo puede tener con otros microorganismos que se desarrollan en los mismos microambientes o que son también habitantes de la microbiota normal resulta de gran relevancia para entender su virulencia37. Nuestros resultados muestran que las interacciones de C. albicans con S. aureus, objetivo fundamental del presente estudio, incrementan la actividad metabólica, el desarrollo y la complejidad de las biopelículas que desarrollan, lo que resulta en el aumento de su virulencia, hecho que ha sido demostrado por otros autores19,43. La formación de biopelículas y su cinética de crecimiento han sido estudiadas mediante técnicas directas como la microscopia, o indirectas utilizando ensayos con recuento de unidades formadoras de colonias, midiendo la actividad metabólica de las células en biopelículas por colorimetría usando sales como el XTT o el mosman, por bioluminiscencia de ATP y midiendo la elución de cristal violeta. Independientemente de la diversidad de técnicas disponibles y de las utilizadas, existe una estrecha correlación entre las mediciones obtenidas35. Sin embargo, se ha reportado que la formación de biopelículas depende de la especie20, o incluso que cepas de la misma especie de Candida en distintos ensayos tienden a metabolizar el XTT de diferente manera, lo que resulta en lecturas variables23. Por lo anterior, decidimos utilizar un método ampliamente validado33 basado en la reducción de XTT utilizando un solo aislamiento y cepas ATCC que previamente se mostraron constantes en su comportamiento y, al mismo tiempo, analizamos las imágenes de las biopelículas formadas bajo las mismas condiciones mediante microscopia láser confocal, observando en estos últimos ensayos una elevada fluorescencia de células metabólicamente activas de S. aureus, lo que nos permite asumir que esta especie bacteriana metaboliza el XTT en menor proporción que la viabilidad observada por otros métodos, particularmente con la tinción con SYTO 9.
En lo que respecta a la cinética del crecimiento de biopelículas, Ramage et al.33 sugieren que la mayor producción de biopelículas de C. albicans se observa a las 24h, empezando desde las 8h con la formación de seudohifas e hifas verdaderas. Nuestros resultados muestran que el mayor crecimiento de los cultivos individuales de aislamientos clínicos de C. albicans y de S. aureus se presenta a las 12 h y en cultivo mixto posterior a las 24 h, mientras que en las cepas ATCC coincidimos con Ramage. Lo anterior probablemente se debe a que los aislamientos clínicos provenientes de un paciente con estomatitis protésica presentan factores de virulencia activados y se desarrollan con mayor patogenicidad que las cepas de referencia.
En cuanto a las biopelículas polimicrobianas, en particular las de C. albicans y especies bacterianas, se ha sugerido que la naturaleza de las bacterias modula la fisiología de estas biopelículas, desarrollando relaciones complejas que dependen de la especie bacteriana y del número, y que estas pueden afectar la morfogénesis de las levaduras3,5,41. A este respecto son pocos los estudios acerca de biopelículas mixtas de Candida con otros microorganismos y son escasos los resultados sobre el estudio de las interacciones positivas que puede llegar a tener con bacterias como S. aureus. En las imágenes de microscopia confocal de las biopelículas mixtas de C. albicans y S. aureus observamos que, cuando las biopelículas alcanzan su mayor madurez, se forman conglomerados de blastosporas, seudohifas e hifas verdaderas de C. albicans que se entrecruzan y sobreponen dejando múltiples porosidades o microcanales que se ocupan por las agrupaciones cocoides de S. aureus, lo que crea una relación positiva donde la actividad metabólica aumenta y se hace más diversa conforme se desarrollan estas comunidades, observando células en diferentes grados de viabilidad evidenciadas por las tinciones de los sistemas LIVE/DEAD e incluso células en fase de muerte que se mantienen dentro del andamiaje estructural de dichas biopelículas. Algunos autores han estudiado el desarrollo de las biopelículas mixtas de Candida con otros microorganismos, evidenciando relaciones negativas con una disminución del crecimiento y formación de las biopelículas cuando Pseudomonas aeruginosa se cocultiva con C. albicans2,21,27; y otros a su vez han demostrado la existencia de interacciones positivas entre C. albicans con Staphylococcus epidermidis1, Streptococcus gordonii38, Streptococcus spp.,31,40, Fusobacterium y Actinomyces8,16,17,41. Sin embargo, poco se ha descrito de esta complejidad estructural y de cómo afectan las bacterias la morfogénesis de Candida, como lo observado por nosotros en esta relación sinérgica entre C. albicans con S. aureus, donde se observa un aumento de la actividad metabólica de las células crecidas en estas biopelículas mixtas. Futuros estudios deberán analizar si esta relación sinérgica se afecta o se incrementa debido a la variabilidad genética intraespecies y al origen del aislamiento. Asimismo, estudios in vitro e in vivo deberán centrarse en las interacciones de C. albicans y otras especies del genero con S. aureus, que sustenten el desarrollo de protocolos de investigación sobre el uso de nuevos materiales y estrategias preventivas32 que puedan emplearse para inhibir la formación de estas complejas biopelículas mixtas con elevada patogenicidad.
ConclusionesDado que la actividad metabólica y el crecimiento de las biopelículas mixtas fue mayor y más complejo que el crecimiento de biopelículas individuales, se puede sugerir que existe una posible relación sinérgica entre estos microorganismos al desarrollarse en biopelículas, lo cual resulta en un importante factor de virulencia de las biopelículas de Candida.
El ensayo con XTT mostró ser útil, práctico y confiable para el estudio de biopelículas individuales y mixtas de C. albicans y S. aureus; sin embargo, la metabolización del XTT por parte de las células en biopelícula de S. aureus es menor que la proporción de la viabilidad observada mediante microscopia confocal de las bacterias teñidas con el colorante verde fluorescente de ácidos nucleicos SYTO 9 utilizado para observar y cuantificar bacterias viables.
FinanciaciónEste trabajo ha sido financiado por el proyecto CHIH-2009-C02-125216 del fondo mixto del Gobierno del Estado de Chihuahua y el Consejo Nacional de Ciencia y Tecnología (CONACYT, México), y con aportaciones de los proyectos C12-FAI-03-45.45 y el 162651 del CONACYT, México.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Los autores agradecen el apoyo para los muestreos clínicos del Departamento de Estomatología del Instituto de Ciencias Biomédicas de la Universidad Autónoma de Ciudad Juárez y de la inestimable asesoría de la bióloga Keila Alvarado para la obtención de las imágenes de microscopia confocal en la Universidad Autónoma de San Luis Potosí.