Introducción
Se ha demostrado la eficacia, seguridad y aceptación por los pacientes de la terapia con inhibidores del factor de necrosis tumoral (TNF) en ensayos clínicos de artritis reumatoide (AR). Sin embargo, se desconoce su efectividad y su seguridad a largo plazo en poblaciones no seleccionadas. Basándose en el esperanzador panorama abierto por estos fármacos, están apareciendo otras moléculas con dianas inmunológicas diferentes, aún en fase de estudio, y es probable que en breve dispongamos de un arsenal de terapias biológicas, no sólo para el tratamiento de la AR, sino para otras artropatías inflamatorias de difícil control.
Desde diversos foros se ha advertido de la necesidad de seguir de forma detallada la implantación de terapias con potencial tóxico, como son estos nuevos moduladores inmunológicos. No existe en la actualidad una guía consensuada de cómo debe hacerse este seguimiento, y se sospecha una infranotificación por los cauces habituales de seguimiento farmacológico. La Sociedad Española de Reumatología (SER) ha creído oportuno realizar un estudio de seguimiento que proporcione información sobre la efectividad y la seguridad de estos medicamentos como complemento de los sistemas de farmacovigilancia establecidos. La intención es hacerlo de la forma más homogénea posible conforme a otros estudios de seguimiento similares que hayan sido ya implantados o estén en vías de serlo en países de nuestro entorno.
Material y métodos
Todos los socios a escala nacional registrados en la SER han sido informados del registro y tienen a su disposición el protocolo y los materiales de notificación. Se recoge la información de todos los pacientes que han estado o estén en tratamiento con terapias biológicas fuera de ensayos clínicos. El registro BIOBADASER recoge, de forma centralizada en la sede de la SER, información básica de todos los pacientes en tratamiento con estas terapias, en los centros que aceptan participar voluntariamente (anexo 1) y se les asignan un código aleatorio. Este código es único y vitalicio para cada paciente participante, independientemente del cambio de terapia biológica, y debe ser comunicado por el médico que incluye inicialmente al paciente a los médicos que se hagan cargo de su seguimiento posterior. En cualquier caso, para evitar pacientes duplicados, se comprueba, mediante rutinas específicas, la información básica de los pacientes incluidos. La información básica de cada paciente incluye: fecha de nacimiento, sexo, diagnóstico reumatológico y fecha de diagnóstico, fármaco utilizado y fecha de inicio. Además, se recoge la fecha de interrupción del tratamiento en los casos pertinentes y el motivo, así como todos los acontecimientos adversos relevantes que presenten los pacientes. Se define acontecimiento adverso relevante como cualquier suceso relacionado o no con el tratamiento que, con independencia de la dosis, produzca la muerte, ponga en peligro la vida, precise de ingreso hospitalario o lo prolongue, o produzca una discapacidad persistente o importante. También son recogidos aquellos acontecimientos adversos que el médico considere importantes por obligar a una actitud preventiva de los anteriores supuestos. De todos los pacientes que hayan presentado un acontecimiento adverso, se recoge además información sobre comorbilidad y tratamientos concomitantes.
La cohorte de BIOBADASER se describió según índices de medida central y dispersión apropiados a las variables descriptivas. Se obtuvieron tablas y curvas de Kaplan-Meier para describir los tiempos de utilización de las terapias. Las comparaciones de duración del tratamiento entre grupos se realizaron con el test de rangos logarítmicos, utilizando un nivel de significación de 0,05. Para hallar el riesgo relativo de un acontecimiento adverso concreto se determinó la densidad de incidencia del acontecimiento en la cohorte (casos/pacientes/año), y se utiliza la densidad de incidencia de este suceso en la cohorte de EMECAR como denominador. La cohorte EMECAR es una cohorte nacional de AR formada por 788 pacientes seleccionados aleatoriamente de los registros de 34 centros. La duración media de la enfermedad en esta cohorte de comparación es de 10 ± 8 años, y un 72% de los pacientes son mujeres1.
Resultados
El 27 de diciembre de 2001 se habían registrado 1.309 pacientes en BIOBADASER, procedentes de 65 centros, y un total de 1.336 ciclos de tratamiento (27 pacientes han estado en tratamiento con dos agentes biológicos distintos en algún momento de su evolución).
Descripción de los pacientes registrados
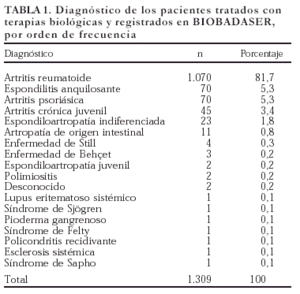
La mayoría de los pacientes registrados en BIOBADASER son mujeres (n = 951; 72,7%). La edad media es de 53 ± 15 años, y la proporción de niños (menores de 16 años) es del 1,8% (n = 24). En la tabla 1 se exponen los diagnósticos de los pacientes que recibieron terapias biológicas y han sido registrados en BIOBADASER. La gran mayoría de los diagnósticos corresponde a AR, aunque se han utilizado en otras enfermedades inflamatorias.
Descripción de los ciclos de tratamiento registrados
Los dos agentes biológicos registrados hasta el momento son etanercept e infliximab. El 87,3% de los 1.336 tratamientos registrados corresponden a infliximab (n = 1.172). La proporción infliximab/etanercept se mantiene en todos los diagnósticos salvo en la artritis crónica juvenil (ACJ), donde el agente más utilizado es el etanercept (35/45).
Supervivencia de las terapias biológicas en nuestro medio
Se han registrado 165 interrupciones del tratamiento (12,4%), en la mayoría de las ocasiones como resultado de un acontecimiento adverso. En la tabla 2 se presenta la distribución de los motivos de interrupción del tratamiento comunicados. En 27 ocasiones, como ya se ha mencionado, la interrupción del tratamiento con un agente biológico se siguió del inicio de tratamiento con otro distinto. Este segundo agente fue, subsecuentemente, retirado en tres de los 27 pacientes.
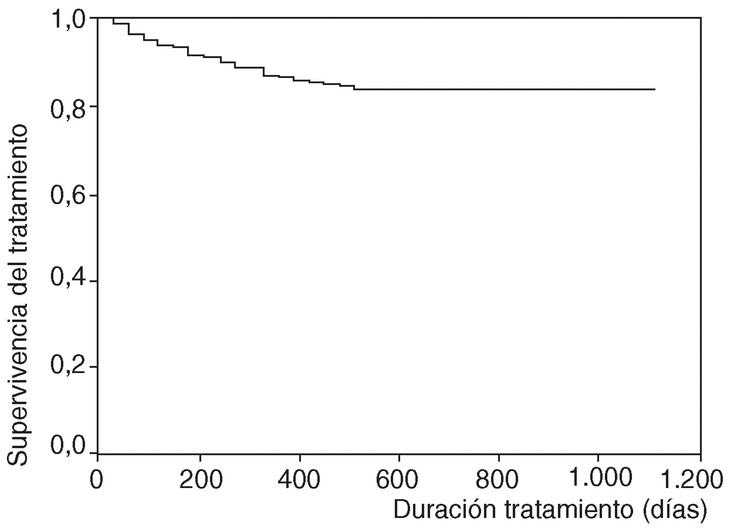
No han aparecido diferencias estadísticamente significativas entre la proporción de interrupciones de tratamiento comunicadas con etanercept (9,8%) o con infliximab (12,7%) (p = 0,918). La frecuencia de interrupción del tratamiento tampoco parece variar en función del sexo (el 11% en varones y el 12,8% en mujeres; p = 0,136) o la edad (el 20,8% de interrupciones del tratamiento en niños frente al 12,3% en adultos; p = 0,348).
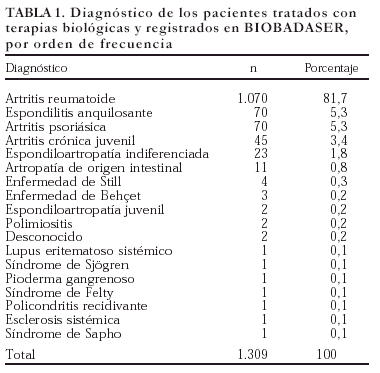
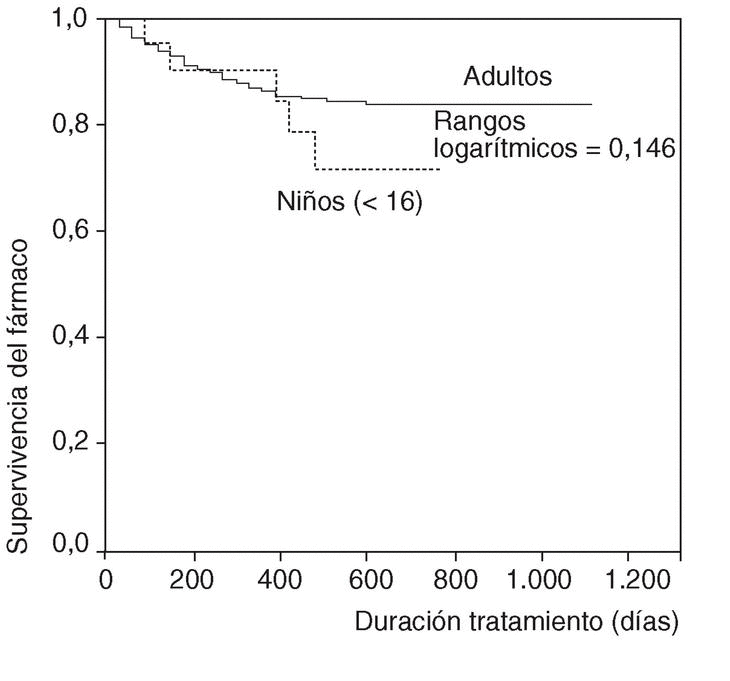
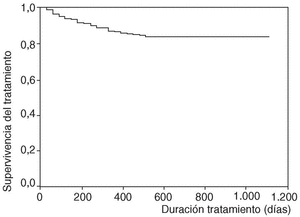
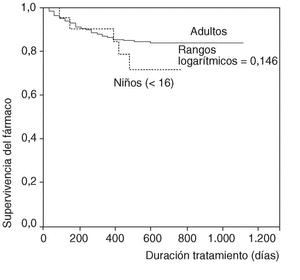
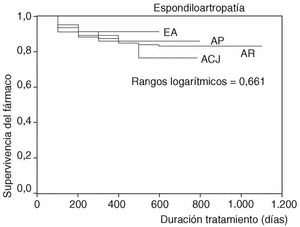
En la figura 1 se expone la curva de supervivencia de las terapias biológicas en nuestro medio. La duración media del tratamiento de ambos agentes es de 343 ± 201 días (mediana 314 días; P25-75, 181-495). Las tasas de supervivencia de la terapia a los 6, 12, 18, y 24 meses del inicio del tratamiento con los agentes registrados fueron respectivamente del 94, el 86, el 84 y el 83%. No se han observado diferencias estadísticamente significativas en la duración del tratamiento entre etanercept e infliximab, ni entre ambos sexos, ni entre adultos y niños (fig. 2). En la figura 3 se presenta la supervivencia de la terapia dependiendo del diagnóstico (p de rangos logarítmicos: 0,661).
Figura 1. Curva de supervivencia de las terapias biológicas BIOBADASER.
Figura 2. Curva de supervivencia de las terapias biológicas según la edad del paciente.
Figura 3. Curva de supervivencia de las terapias biológicas dependiendo del diagnóstico. ACJ: artritis crónica juvenil; EA: espondilitis anquilosante; AR: artritis reumatoide; APs: artritis psoriásica.
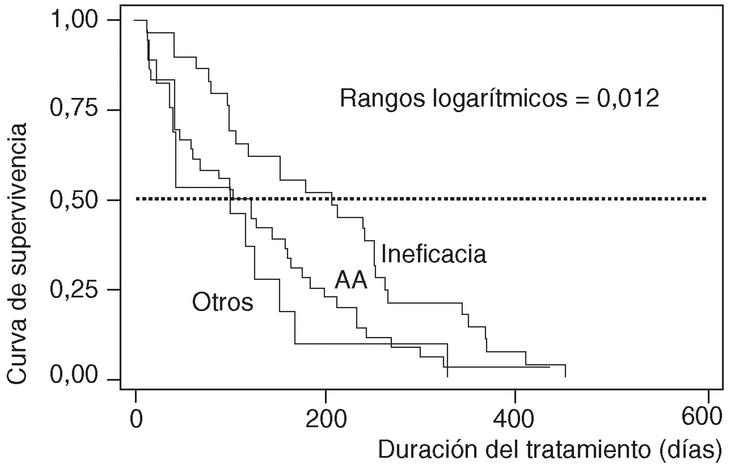
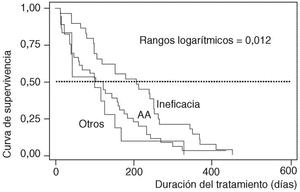
En cuanto a la duración del tratamiento dependiendo de los motivos que causaron su suspensión, ésta era significativamente menor si ocurría como consecuencia de un acontecimiento adverso (mediana 122; P25-75, 42-198), que si tenía lugar por ineficacia (mediana 207; P25-75, 98-264; p de rangos logarítmicos: 0,012) (fig. 4).
Figura 4. Curvas de supervivencia de los pacientes que suspendieron la terapia, por motivo de suspensión. AA: acontecimientos adversos.
Descripción de los acontecimientos adversos
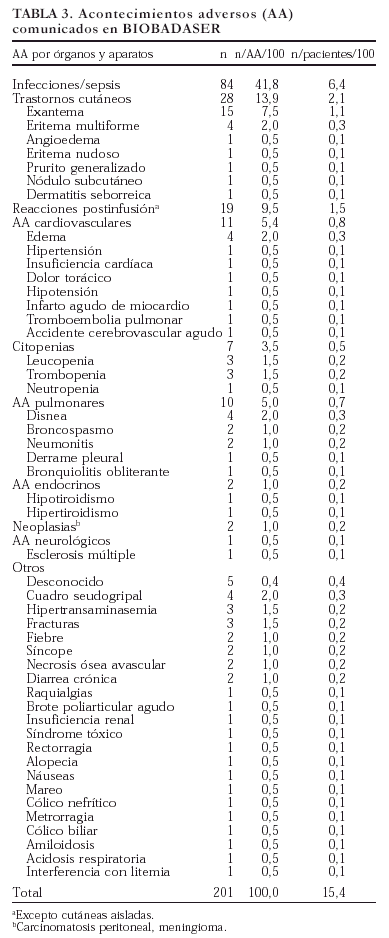
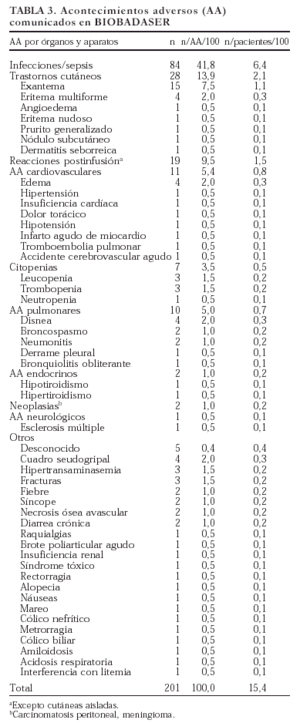
Se comunicaron 201 acontecimientos adversos en 166 pacientes (en 20 pacientes se comunicaron dos acontecimientos, en 2 pacientes tres acontecimientos y en 3 pacientes cinco). En la tabla 3 se exponen los acontecimientos adversos registrados en BIOBADASER y su frecuencia relativa al total de acontecimientos y de pacientes. El tipo de acontecimiento adverso más frecuente fue la infección (42%), seguido de los trastornos cutáneos (14%) y las reacciones postinfusión (el 9,5% si exceptuamos las reacciones puramente cutáneas). Dada la elevada frecuencia de infecciones registradas, se comentan en un epígrafe específico más adelante.
Los acontecimientos adversos cardiovasculares y pulmonares también fueron frecuentes. Se notificó un infarto agudo de miocardio en una mujer de 48 años sin factores de riesgo cardiovascular salvo menopausia temprana (a los 36 años). Un caso de insuficiencia cardíaca en una mujer de 67 años con historia de bronquitis crónica fue relacionado
con un proceso infeccioso de vías respiratorias bajas subyacente. De entre los 4 casos de edemas comunicados, uno, periférico, fue relacionado por el médico responsable con el uso de antiinflamatorios concomitantes y otro, palpebral, pudo ser parte de un cuadro alérgico más general. Una mujer de 67 años sin antecedentes de interés sufrió durante el seguimiento un accidente cerebrovascular agudo. Dos pacientes que sufrieron neumonitis tomaban metotrexato de forma concomitante.
En cuanto a la gravedad de los acontecimientos adversos, se produjeron ocho fallecimientos, de los cuales seis tuvieron relación directa con un proceso infeccioso. En un paciente con tuberculosis, la muerte se produjo como consecuencia de una hepatitis tóxica por isoniazida, y el último fallecimiento estaba relacionado con una historia de amiloidosis avanzada. En total fueron ingresados 77 pacientes por acontecimientos adversos.
Se produjeron dos efectos adversos en niños (< 16 años): una mononucleosis infecciosa y una citopenia.
Efectos adversos infecciosos
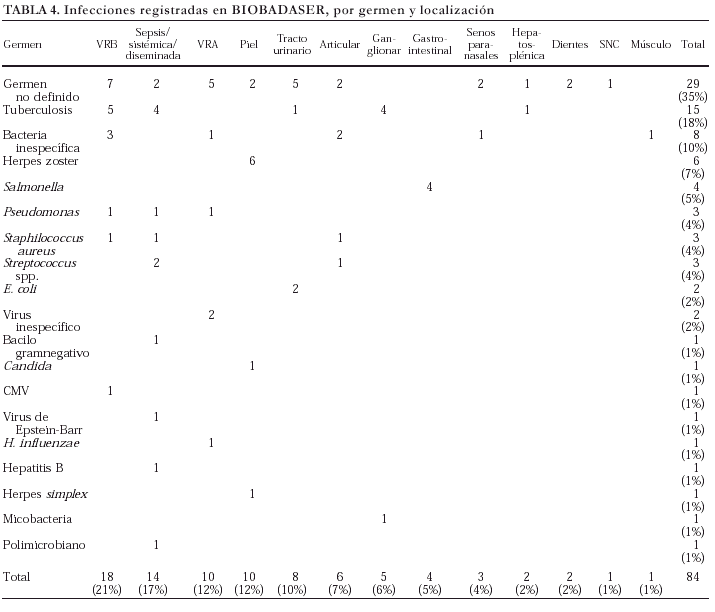
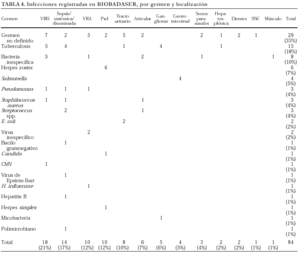
En la tabla 4 se exponen los gérmenes identificados en las infecciones comunicadas y la localización de éstas. Se comunicaron, sobre todo, infecciones de vías respiratorias altas y bajas, muchas sin identificación del germen causal, que en ocasiones obligaron a la retirada temporal del agente biológico. Otra infección notificada con frecuencia fue la de piel y faneras por herpes zoster. Por desgracia, no llegó a identificarse un microorganismo causal en gran parte de las infecciones comunicadas. En las ocasiones en las que consta notificación microbiológica, puede observarse que se trata de gérmenes de alta virulencia, como Pseudomonas o Salmonella.
Hasta el momento se han registrado 15 casos de tuberculosis (TB), más una infección por micobacteria pendiente de identificación. En un paciente, ya mencionado, el proceso tuberculoso tuvo un desenlace fatal, si bien estuvo relacionado con una hepatitis tóxica por isoniazida. La afección de base era AR en todos los casos de TB (13/1.070 AR) salvo en dos, con artritis psoriásica (2/70 AP). La localización de la infección tuberculosa fue variada: pulmonar (5), ganglionar (4), diseminada (4), urinaria (1) y hepatosplénica (1).
La densidad de incidencia de TB en AR se ha estimado en EMECAR en 102 casos por 100.000 pacientes/año y el riesgo relativo de TB en la AR en 4,4 (intervalo de confianza [IC] del 95%, 2,8-6,9), estandarizado por edad y sexo2. La última incidencia anual de TB comunicada en España fue de 21 casos por 100.000 habitantes, según datos del año 2000 del Centro Nacional de Epidemiología.
En BIOBADASER, la densidad de incidencia de TB fue de 766 casos por 100.000 pacientes/año (5/653 pacientes/año) en el año 2000 y algo menor, 754 casos por 100.000 pacientes/año (10/1.327 pacientes/año), en el año 2001. El riesgo relativo (RR) de TB en pacientes AR con terapias biológicas fue de 7,5 y 7,4, respectivamente, en los años 2000 y 2001, con respecto a los pacientes AR sin estas terapias.
Discusión
El proyecto BIOBADASER aspira a convertirse en una fuente de conocimientos sobre seguridad de las terapias biológicas en España para el profesional que necesita utilizar estos fármacos en el control de sus pacientes con artropatías inflamatorias. En el momento actual, la experiencia en nuestro medio con infliximab es superior a la que se tiene con etanercept, en relación con problemas de comercialización y abastecimiento de este último agente en España.
De los resultados obtenidos en el análisis del registro se desprende que la supervivencia de estas terapias en nuestro medio es similar a la encontrada en otros escenarios no experimentales. El número de tratamientos que se suspenden, por ejemplo por ineficacia (el 3,1% terapias), es comparable a los resultados comunicados en cohortes norteamericanas (el 7,4% en Alberta, Canadá3, y el 2,0% en Alabama, EE.UU.4). La proporción de terapias suspendidas por acontecimientos adversos (el 7,1% terapias) es también equivalente a la de una cohorte belga (8%)5 y la de la cohorte de Alberta (7,4%)3.
La incidencia de infecciones relevantes (el 6,2% de todos los pacientes tratados), y en concreto la frecuencia de infecciones respiratorias y sepsis, no es superior a la de otras series5. Sí parece ser un problema especialmente relevante en España la alta tasa de tuberculosis observada, tanto pulmonar como extrapulmonar, siete veces mayor que la esperada en pacientes con AR. La realización de radiografía de tórax y PPD previas al inicio de la terapia ha sido esporádica en la cohorte, según la información que hemos podido recabar a posteriori entre los casos con TB notificada. Esta misma conclusión extrae Baker6, quien, por otro lado, observa que el 78% de los casos de TB activa con infliximab ocurre en las primeras tres dosis de terapia, por lo que sugiere como mecanismo la reactivación de una TB latente. De acuerdo con Bouza7, el cribado de TB latente debe incluir historia personal y de contactos, exploración, radiografía de tórax, PPD y cultivos en caso de duda. Un PPD de 5 mm debe considerarse positivo en pacientes con alto riesgo de desarrollar TB, incluyéndose en este grupo a cualquier paciente que reciba más de 15 mg de prednisolona durante un mes. Si la prueba es negativa, el resultado definitivo lo dará el booster o PPD recordatorio que se hace a la semana. El tratamiento de TB latente se hará, con independencia de la edad, en todas las personas con factores de riesgo. La isoniazida 300 mg/día durante nueve meses sigue siendo la terapia estándar.
Otro acontecimiento adverso que se registra con frecuencia es la reacción por hipersensibilidad al fármaco, con diferentes valores de gravedad (exantema, broncospasmo, síncope), que no siempre obligan a la suspensión de la terapia. Acontecimientos adversos poco frecuentes hasta ahora han sido el diagnóstico de tumores y las citopenias. No obstante, este último acontecimiento no es considerado normalmente relevante, por lo que puede no estar siendo notificado en la medida en que está ocurriendo en la realidad.
La metodología de recogida de datos en BIOBADASER ha de ser depurada en varios aspectos. La intención es utilizar un sistema de alerta y de entrada de datos automáticos, así como clasificar los acontecimientos adversos según el diccionario médico MedRA, ya que en la actualidad se está clasificando a criterio de las personas que manejan la base de datos (M.J.M.B. y L.C.), con apoyo del diccionario de acontecimientos adversos de la Organización Mundial de la Salud (OMS), que es muy limitado. Respecto a las notificaciones, cabría mejorar la proporción de gérmenes identificados, comunicando el germen aislado, bien en el momento de la notificación a BIOBADASER, bien a posteriori si se conoce. También sería deseable que en los casos de hipersensibilidad al fármaco se describieran los síntomas aparecidos y el momento de su aparición respecto de la infusión8,9.
Consideramos que el esfuerzo por parte de todos los participantes ha sido elogiable y que la información que se desprende es útil e importante, más si cabe a medida que crezca la experiencia con estas terapias y se perfeccione el sistema de transmisión y análisis de los datos. Dicha información está disponible para todos los miembros de nuestra sociedad en forma de informes de resultados actualizados cada seis meses en la página web de la SER (www.ser.es). Finalmente, deseamos agradecer la participación en BIOBADASER de los profesionales que a continuación se detallan y animar en general a todos los reumatólogos a formar parte de este registro.
Comité Científico de BIOBADASER*. Sociedad Española de Reumatología (SER)
*Comité científico de BIOBADASER: Juan Gómez-Reino Carnota, Reumatología, Hospital Universitario de Santiago, Santiago de Compostela; Loreto Carmona, Epidemiología Clínica, Hospital de la Princesa, Madrid; Dolores Montero, División de Farmacoepidemiología y Farmacovigilancia, Agencia Española del Medicamento, Madrid; Emilio Martín Mola, Reumatología, Hospital la Paz, Madrid; Jordi Carbonell Abelló, Reumatología, Hospitales del Mar y de la Esperanza, Barcelona; Vicente Rodríguez Valverde, Reumatología, Hospital Marqués de Valdecilla, Santander; Eliseo Pascual Gómez, Reumatología, Hospital General de Alicante, Alicante; Jesús Tornero Molina, Reumatología, Hospital General de Guadalajara, Guadalajara; Manuel Figueroa Pedrosa, Reumatología, Hospital Ntra Sra de Aránzazu, San Sebastián; Rafael Cáliz Cáliz, Reumatología, Hospital Virgen de la Nieves, Granada; Juan Mulero Mendoza, Reumatología, Hospital Puerta de Hierro, Madrid; Armando Laffón Roca, Reumatología, Hospital de la Princesa, Madrid; José Luis Marenco de la Fuente, Reumatología, Hospital de Valme, Sevilla; Luis Carreño Pérez, Reumatología, Hospital Gregorio Marañón, Madrid; Xavier Tena Marsa, Reumatología, Hospital Germans Trias i Pujol, Badalona; José M.ª Álvaro-Gracia, Reumatología, Hospital de la Princesa, Madrid.
BIOBADASER se realiza en colaboración con la División de Farmacoepidemiología y Farmacovigilancia de la Agencia Española del Medicamento.
Anexo 1. Participantes en BIOBADASER
Miquel Sala (Hospital de Figueres, Figueres), Montserrat Centellas (Hospital de Mataró, Mataró), Saúl Mario Gelman, Roser Tuneu (CH Manresa, Manresa), Sara Marsal, Cristina Arnal Guimera (CS Vall D'Hebron, Barcelona), Gabriel Herrero-Beaumont, J.C. Acebes Cachafeiro, Olga Sánchez Pernauto, Carolina Bordoy Ferrer (Clínica Nuestra Señora de la Concepción, Madrid), Juan Mulero Mendoza, Raúl Veroz González (Clínica Puerta de Hierro, Madrid), Manuel Rodríguez Gómez (CH Cristal-Piñor, Orense), Santiago Benito Urbina, J.A. López Martín, J.A. Cabezas Lefler (CH San Millán-San Pedro, Logroño), Marta Larrosa Padró, Jordi Gratacós (CH del Parc Taulí, Sabadell), Poca, Valverde, Daniel Roig Escofet (Hospital de Bellvitge Prínceps d'Espanya, l'Hospitalet de Llobregat), Isabel Mateo Bernardo, Patricia Carreira Delgado, Rosa González Crespo, María Galindo Izquierdo (Hospital 12 de Octubre, Madrid), Raimon Sanmartí, Juan D. Cañete (Hospital Clínic i Provincial, Barcelona), César Hernández García, Pilar Macarrón, (Hospital Clínico Universitario San Carlos, Madrid), Eduardo Ucar Angulo, Ana Intxaurbe Pellejero, José M.a Aramburu Albizuri (Hospital de Basurto, Bilbao), Lucía Pantoja Zarza, Valvanera Pinillos, Juan Ortiz de Saracho (Hospital del Bierzo, Ponferrada), Eva Tomero Muriel, Isidoro González Álvaro, José M. Álvaro Gracia, Armando Laffon (Hospital de la Princesa, Madrid), Cesar Díaz López, Arturo Rodríguez de la Serna (Hospital de la Santa Creu i Sant Pau, Barcelona), Eugenio Chamizo (Hospital General de Mérida, Mérida), Tomás Tinturé Eguren, Loza, Fito (Hospital de Navarra, Pamplona), Josep Pujol (Hospital de Sant Pau i Santa Tecla, Tarragona), M.ª Victoria Irigoyen, Inmaculada Ureña (Hospital General Carlos Haya, Málaga), Paloma Vela Casasempere (Hospital General Universitario de Alicante, Alicante), Miquel Belmonte Serrano, Juan Beltrán Fabregat (Hospital General de Castellón, Castellón), Juan Gómez-Reino Carnota, Antonio Mera Varela (Hospital Clínico Universitario de Santiago, Santiago de Compostela), Elena Ciruelo Monge (Hospital General de Segovia, Segovia), Juan Carlos Cobeta García (Hospital Obispo Polanco, Teruel), Eduardo Kanterewicz Binstock (Hospital General de Vic, Vic), Rosa Roselló Pardo, Dolores Fábregas (Hospital General San Jorge, Huesca), Vera Ortiz Santamaría, Javier Tena Marsá (Hospital Universitario Germans Trias i Pujol, Badalona), Jesús Tornero Molina, Javier Vidal Fuentes (Hospital General Universitario de Guadalajara, Guadalajara), Luis Carreño Pérez, Javier López-Longo, Miriam Bascones (Hospital Gregorio Marañón, Madrid), Mercedes Freire González, José A. Pinto Tasende (Hospital Juan Canalejo, La Coruña), Francisco Javier Manero Ruiz (Hospital Universitario Miguel Servet, Zaragoza), Alfredo Buisan Aguirre, Carlos M.ª Pascual Martín-Gamero (Hospital Militar Universitario Gómez Ulla, Madrid), Manel Pujol, Josep Granados i Duran (Hospital Mútua Terrassa, Terrassa), Manuel Figueroa Pedrosa (Hospital Nuestra Señora de Aránzazu, San Sebastián), Carmen Torres, Montserrat Corteguera (Hospital Nuestra Señora de Sonsoles, Ávila), Carlos Rodríguez Lozano, Félix Francisco Hernández, Íñigo Rúa-Figueroa (Hospital Dr. Negrín, Las Palmas de Gran Canaria), Ángel Aragón Díez (Hospital Nuestra Señora del Prado, Talavera de la Reina), Emilia Aznar, Ricardo Gutiérrez (Hospital Reina Sofía, Tudela), Jaime Calvo Alen (Hospital Comarcal Sierrallana, Torrelavega), Antonio Juan (Hospital Son Dureta, Palma de Mallorca), Juan Carlos Vesga Carasa, E. Cuende Quintana (Hospital Txagorritzu, Vitoria), Sagrario Sánchez Andrada, Vicente Rodríguez Valverde (Hospital Universitario Marqués de Valdecilla, Santander), José Luis Marenco de la Fuente, Eduardo Rejón (Hospital Universitario de Valme, Sevilla), F. Javier Toyos Sáenz de Miera, José V. Montes de Oca Mercader, Federico Navarro Sarabia (Hospital Universitario Virgen Macarena, Sevilla), M.ª Francisca Pina Pérez, Carlos Marras Fernández-Cid, Juan Moreno Morales, Luis Fco. Linares Ferrando (Hospital Virgen de la Arrixaca, Murcia), M.ª Enriqueta Peiró (Hospital Virgen de la Luz, Cuenca), Rafael Cáliz Cáliz, Manuel Guzmán Úbeda, Antonio García Sánchez, Miguel Ferrer González (Hospital Virgen de las Nieves, Granada), Amalia Sánchez-Andrade (Hospital Xeral-Calde, Lugo), Gema Díaz Moya, Julia Fernández Melón, Emilio Martín Mola (Hospital La Paz, Madrid), F. Xavier Arasa Fava (Hospital Verge de la Cinta, Tortosa), José Raúl Noguera Pons, Francisco Javier Navarro Blasco, Juan Víctor Tovar Beltrán (Hospital General Universitario, Elche), Isabel Ibero Díaz, Vega Jovani Casado (Hospital General, Elda), Isabel Rotés Más (Hospital de San Rafael, Barcelona), Jordi del Blanco Barnusell (Hospital Sant Jaume, Calella), Gaspar Pérez Lidón, Manuel Tenorio Martín (Hospital del Insalud, Ceuta), Carolina Pérez García, Joan Maymó Guarch (IMAS CH de L'Esperança y del Mar, Barcelona), Víctor Eliseo Quevedo Vila (Hospital Comarcal de Monforte, Monforte de Lemos), Javier Rivera Redondo, Teresa González Hernández (Instituto Provincial de Rehabilitación, Madrid), José Manuel Rodríguez Heredia, Ángel Gallegos Cid, Jesús García-Arroba Muñoz, Miguel Cantalejo Moreira (Hospital Universitario de Getafe, Getafe), Alfonso Corrales Martínez (Hospital Comarcal de Laredo, Laredo), Francisco Pérez Torres (Hospital General de Requena, Requena), José Ivorra Cortés (Hospital General de Onteniente, Onteniente), Xabier Suris Armangue (Hospital General de Granollers, Granollers), Cristina Hidalgo Calleja (Hospital de Salamanca, Santa Marta de Tormes), Julia García-Consuegra, Rosa Merino Muñoz (Hospital Infantil La Paz, Madrid), Cristina Medrano le Quement (Hospital Internacional Meetimar, Alicante).