Este es el segundo artículo de una serie de dos publicados en esta revista, en los que examinamos las características histopatológicas, así como el diagnóstico diferencial, de las principales entidades que se presentan en forma de estructuras quísticas y pseudoquísticas en la biopsia cutánea. En este segundo artículo, abordamos los quistes cutáneo ciliado, branquial, de Bartholino, onfalomesentérico, tímico, del conducto tirogloso, sinovial, y del rafe medio, así como el mucocele, el ganglión y los pseudoquistes auricular y mixoide digital.
This is the second article in a two-part series published in this journal, in which we examine the histopathological characteristics, as well as the differential diagnosis, of the main entities that present as cystic and pseudocystic structures in cutaneous biopsy. In this second article, we address ciliated cutaneous cysts, branchial cysts, Bartholin's cysts, omphalomesenteric cysts, thymic cysts, thyroglossal duct cysts, synovial cysts, and median raphe cysts, as well as mucocele, ganglion, and auricular and digital myxoid pseudocysts.
En un artículo previo publicado en esta misma revista, hablamos de un primer grupo de estructuras quísticas que pueden encontrase frecuentemente en la biopsia cutánea (el quiste infundibular, el quiste dermoide, el quiste velloso eruptivo, el quiste folicular pigmentado, el sinus pilonidal, el esteatocistoma, el quiste tricolemal, los comedones, los quistes de milio, los quistes híbridos, el hidrocistoma, y el quiste broncogénico cutáneo).
En esta segunda parte, abordaremos un segundo grupo de tumoraciones quísticas frecuentemente vistas en la biopsia de piel, así como algunas formaciones pseudoquísticas.
Todas las biopsias fueron obtenidas bajo consentimiento informado de los pacientes, que incluye apartados sobre el manejo de imágenes derivadas de los procedimientos diagnósticos. El manejo de dichas imágenes, así como el del resto de la información, se ha ajustado a la Declaración de Helsinki de la Asociación Médica Mundial sobre principios éticos para investigación médica.
MucoceleDefinición: se trata de una lesión reactiva de la mucosa oral en zonas ricas en glándulas salivales menores o glándula sublingual secundaria al acúmulo y extravasación de moco que atrae a macrófagos (mucífagos) para su fagocitosis1.|
Patogenia: se reconocen dos tipos: de retención y por extravasación. En el de retención, se produce un cúmulo de secreción en la glándula, dilatándola. En el de extravasación, la glándula se rompe por diversos motivos (uno de ellos puede ser una dilatación previa), dejando escapar una colección de mucina al estroma adyacente. En muchos casos se relaciona con un traumatismo de la mucosa.
Clínica: el mucocele se presenta por igual en hombres y mujeres sin diferencias geográficas significativas. Es más prevalente en las tres primeras décadas de la vida y también es la lesión de mucosa oral que se biopsia con mayor frecuencia en la edad pediátrica2,3. La localización más habitual es la mucosa del labio inferior. Si se origina bajo la lengua recibe el nombre de ránula. Se presenta como lesión nodular sésil fluctuante no dolorosa de tamaño variable entre pocos milímetros a varios centímetros. El mucocele superficial se asocia a hiposalivación y a lesiones liquenoides tales como liquen plano oral, erupción liquenoide farmacológica y enfermedad de injerto contra huésped1.
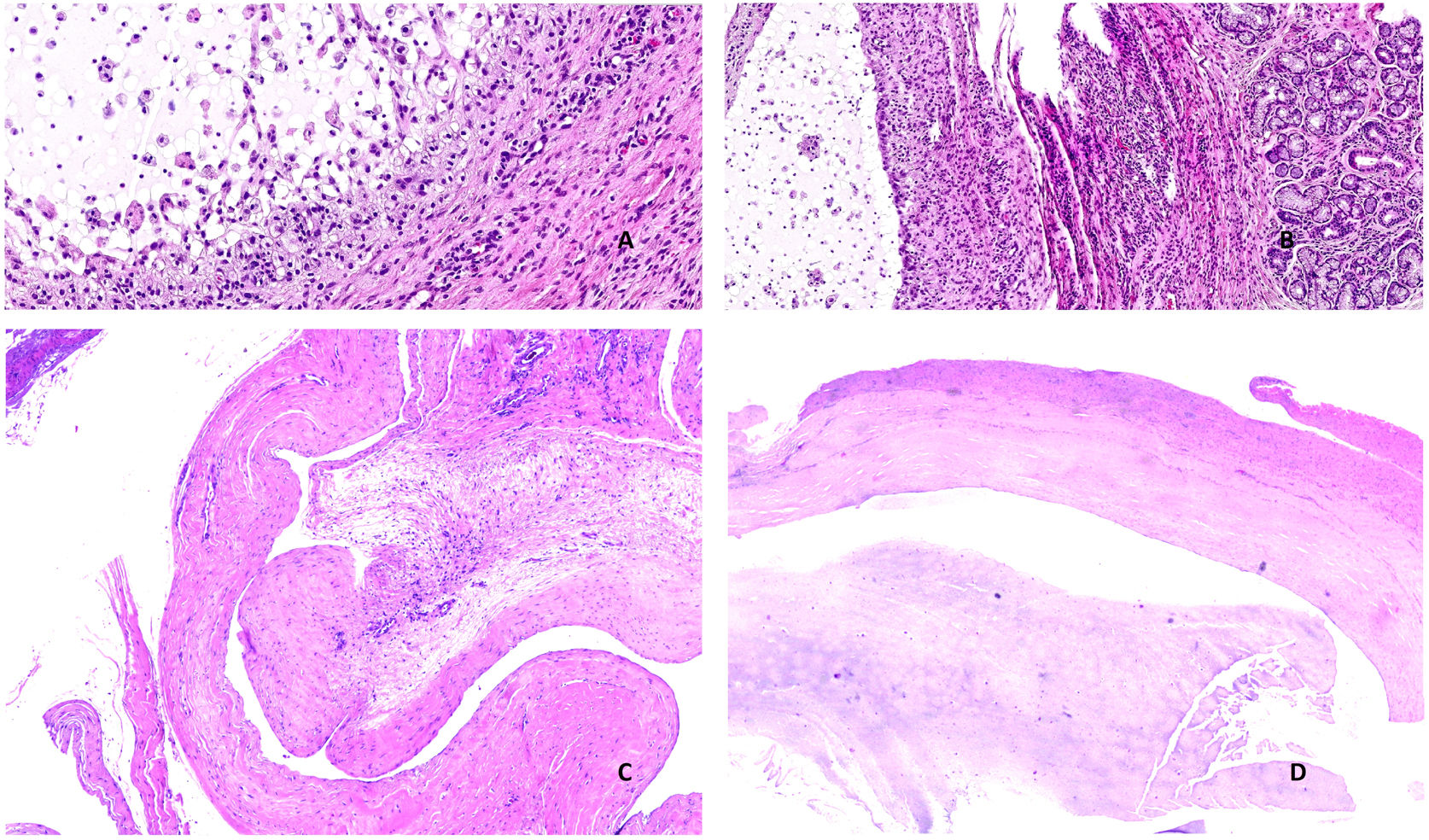
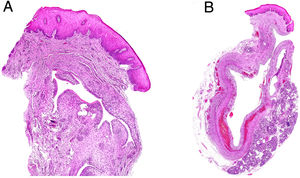
Histopatología: el examen microscópico muestra una lesión situada en la submucosa, con frecuencia asociada a una glándula salival menor. En el mucocele por retención, se observa la glándula salival dilatada (fig. 1A). Es común, sin embargo, que estos quistes por retención, ya se hayan roto focalmente, y coexistan con focos de extravasación de la mucina. Por el contrario, en los quistes llamados de extravasación, se observa principalmente mucina en el estroma, que lo ensancha y produce una cavidad pseudoquística sin revestimiento epitelial (fig. 1B). En la cavidad pseudoquística repleta de mucina, se suelen ver macrófagos que la fagocitan (mucífagos) y algunos neutrófilos (fig. 2A). En la pared de la lesión hay fibrosis variable con incremento de vascularización (fig. 2B). En lesiones de larga evolución, predomina la fibrosis. En la periferia, se suelen identificar lóbulos de glándula salival menor con inflamación y atrofia variables.
A) Mucocele. Visión panorámica de un mucocele de retención con revestimiento epitelial mayoritariamente preservado, aunque, en este caso, se observa ya extravasación focal de mucina (Hematoxilina-eosina x200). B) Mucocele. Visión panorámica de un mucocele de extravasación con abundantes macrófagos, sin revestimiento epitelial (Hematoxilina-eosina x100).
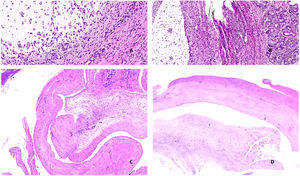
A) Mucocele. Material mucoide y mucífagos de citoplasma amplio y microvacuolado en la luz de un mucocele (Hematoxilina-eosina x400). B) Mucocele. A la izquierda de la imagen se observa la luz del mucocele; en el centro, la pared con inflamación, fibrosis e incremento de vascularización; a la derecha, la glándula salival menor (Hematoxilina-eosina x200). C: Ganglión. Esta zona muestra un área de degeneración mucinosa del tejido conectivo. Como resultado de dicha degeneración, se forman cavidades irregulares sin revestimiento epitelial (Hematoxilina-eosina x40). D) Ganglión. En esta área cavitada se observa abundante contenido mucoide (Hematoxilina-eosina x40).
Diagnóstico diferencial: el carcinoma mucoepidermoide puede ser quístico con abundante componente de mucina, pero suele presentar componentes citológicos de células epidermoides e intermedias. En las lesiones de mayor grado, además, serán evidentes el pleomorfismo y la necrosis. En el quiste odontogénico se observan células caliciformes y a veces también ciliadas. Además, son comunes la formación de esférulas. En la mucinosis oral focal, a pesar de su nombre, no se observa mucina suelta en el estroma, sino tejido conectivo mixomatoso.
GangliónDefinición: se trata de una degeneración mucinosa del tejido conectivo periarticular. Es este sentido, no se trata de un verdadero quiste, ya que las cavidades formadas carecen de un epitelio de revestimiento. Se trataría de un pseudoquiste.
Patogenia: se han postulado varias hipótesis para explicar su formación: a) una herniación sinovial a través del tendón; b) restos embrionarios sinoviales persistentes; c) crecimiento desde las membranas sinoviales; d) quistes degenerativos por modificaciones de las bursas; e) degeneración mucoide del tejido conectivo; f) incremento de producción mucinosa tras un estímulo variable, por ejemplo, traumático. Estas dos últimas son las más aceptadas. De hecho, en un pequeño porcentaje de pacientes, es posible identificar un antecedente traumático. En contra de estas hipótesis, está el hecho de que en algunos casos se observa conexión entre el ganglión y la articulación sinovial cercana, mediante un «tallo»4, sugiriendo una conexión patogénica «a partir de» la sinovial.
Clínica: se presentan como tumores subcutáneos, generalmente asintomáticos, cercanos a una articulación. Pueden evidenciarse en todas las edades, aunque lo más frecuente es entre la segunda y la cuarta décadas de la vida5. Lo más frecuente es que aparezcan en el área dorsal de la muñeca, representando 60-70% de todos los casos6. En ocasiones, sin embargo, la sintomatología es considerable, con dolor o déficit funcional neural. Inusualmente, un ganglión puede abrirse al exterior y drenar su contenido mucinoso.
Histopatología: el tejido conectivo aparece separado por cavidades irregulares de distinto tamaño que parecen disecarlo (fig. 2C). Dichas cavidades no muestran revestimiento epitelial. Contienen material de aspecto mucoide (fig. 2D), positivo con técnicas tradicionales para mucinas, tales como azul Alcián o hierro coloidal. En focos, se pueden ver áreas mixoides dentro del tejido conectivo, que podrían indicar fases más precoces de degeneración del colágeno. Salvo que el ganglión se acompañe de complicaciones ulteriores, no se observa infiltrado inflamatorio acompañante.
Diagnóstico diferencial: el mixoma es un tumor con células fusiformes CD34-positivas, que suele presentarse extendiéndose por el músculo y sin relación con una articulación próxima, como el ganglión. El mixofibrosarcoma de bajo grado es un tumor maligno de bajo grado y, por lo tanto, el diagnóstico es crucial. Muestra celularidad fusiforme (con positividad focal para actina de músculo liso y CD34), de densidad variable, con atipia (que a veces puede ser discreta y focal). Además, es frecuente la presencia de vascularización de vasos finos curvilíneos. Aunque algunos neurofibromas pueden ser muy mixoides, se trata de tumores sólidos, con celularidad S100-positiva. Esta positividad se observa también en los mixomas de vaina nerviosa. En el caso del angiomixoma superficial, el tumor muestra un componente fusocelular y/o estrellado, con patrón de vascularización de vasos finos arborizados.
Quiste sinovialDefinición: se trata de una cavidad, generalmente dérmica, revestida por tejido sinovial metaplásico7,8.
Patogenia: la idea más aceptada es que se trata de una forma especial de reparación tisular mediante metaplasia. De hecho, muchos de los casos se asocian a una historia de traumatismo previo. Sin embargo, este tipo de quiste implica un proceso metaplásico. Existe una asociación con el síndrome de Ehlers-Danlos, probablemente por la fragilidad cutánea y tendencia a los microtraumas que se ve en dicho síndrome9–11. También hay casos asociados a artritis reumatoide12,13 y artrosis14, apoyando la hipótesis de un proceso reparativo después de trauma o inflamación.
Clínica: el aspecto clínico es el de granuloma, tratándose de un nódulo eritematoso. No muestra predilección por sexo ni por localización topográfica.
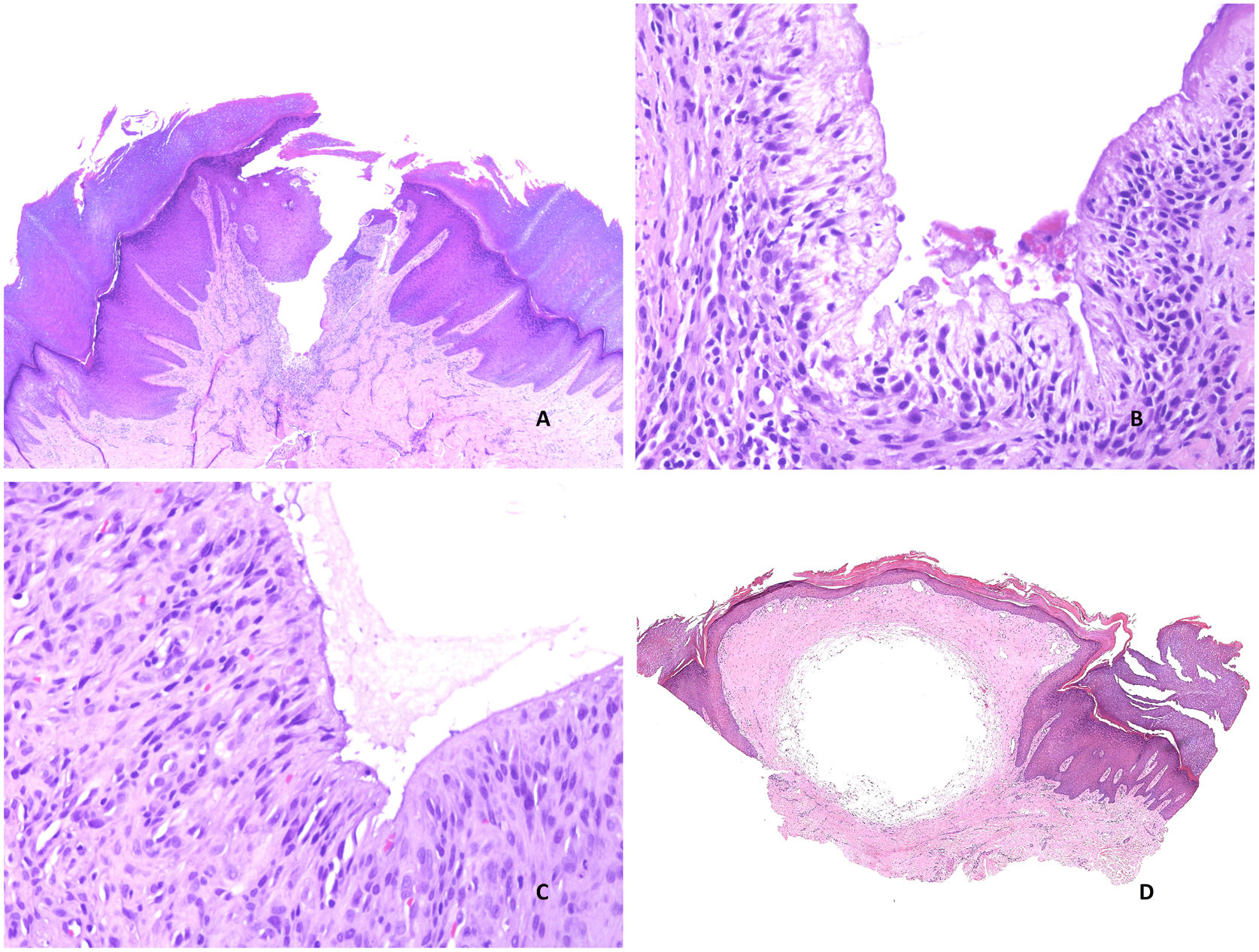
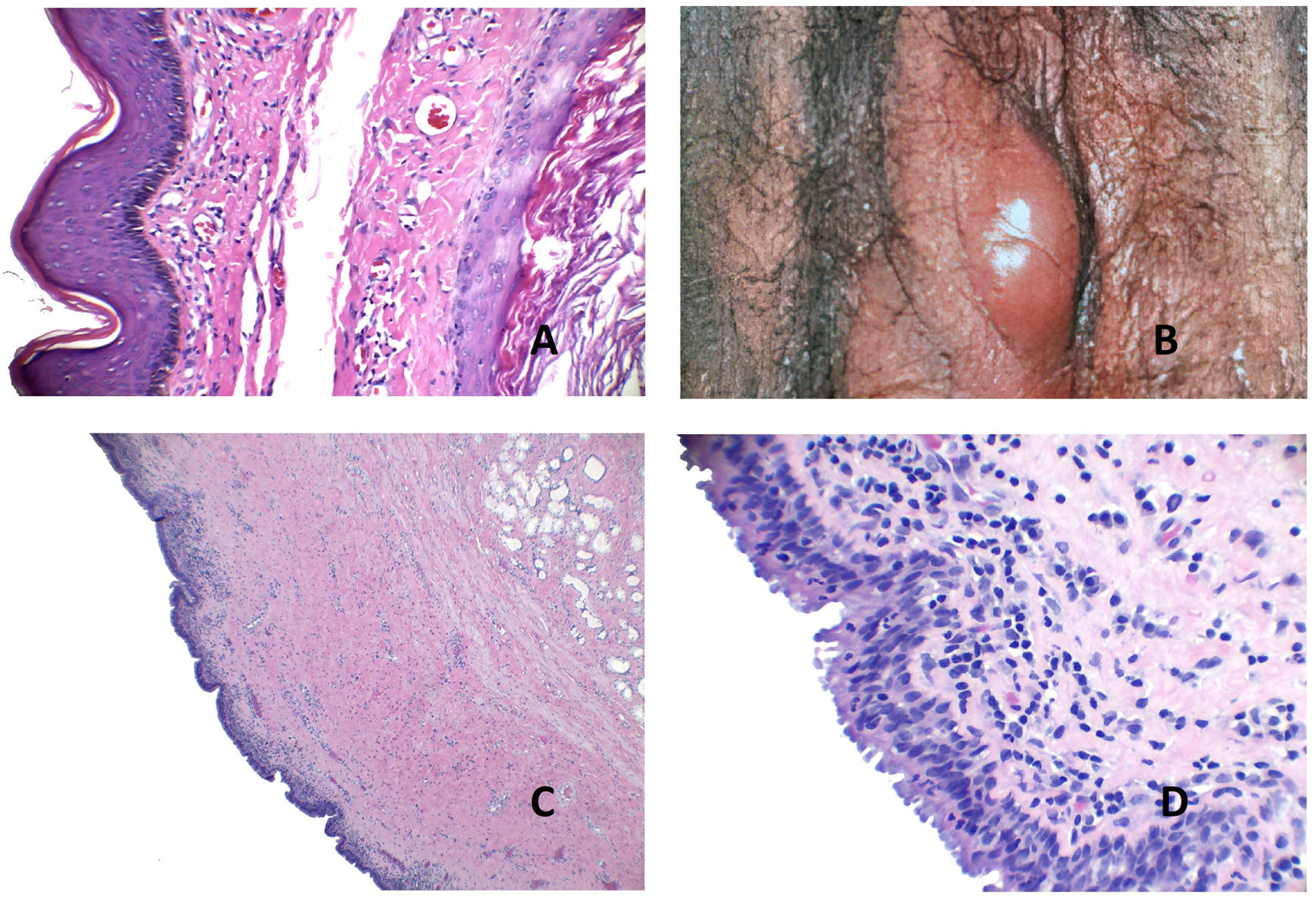
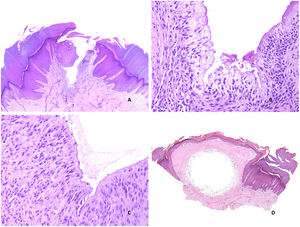
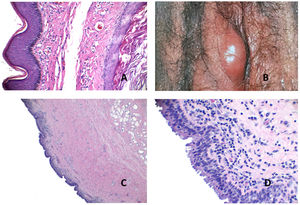
Histopatología: se trata de una cavidad quística irregular dérmica (aunque puede extenderse a la hipodermis), que suele comunicar con la superficie, a la que se encuentra abierta (fig. 3A). En zonas conserva un revestimiento conocido como íntima, aunque en áreas, la superficie interna aparece denudada. En las zonas denudadas se suelen observar depósitos de fibrina y zonas de hialinización (fig. 3B). La íntima es una monocapa de dos tipos de sinoviocitos: A y B. El tipo A son macrófagos derivados de monocitos de la sangre y se tiñen con CD163 o CD68. El tipo B son sinoviocitos fusiformes que se parecen a los fibroblastos y que, de hecho, presentan algunos marcadores fibroblásticos como el CD44, la molécula de adhesión 1, la molécula de adhesión vascular 1, integrinas beta, colágeno, vimentina y alfa-actina. La capa íntima también expresa podoplanina (D2-40), y S100 (con una expresión débil). Sin embargo, es negativa para desmina, citoqueratina, CD34, factor VIII o actina de músculo liso. Esta capa íntima suele ser aplanada (fig. 3C), aunque en ocasiones, puede mostrar proyecciones papilares intraquísticas con exudado fibrinoso.
A) Quiste sinovial. Se observa una cavidad irregular abierta al exterior, con hiperplasia de la epidermis adyacente (Hematoxilina-eosina x20). B) Quiste sinovial. En esta área, se conserva la íntima y se ve una capa aplanada de sinoviocitos (Hematoxilina-eosina x400). C) Quiste sinovial. En esta zona, la íntima ha desaparecido y en su lugar se observan restos fibrinoides y hialinos. Los fibroblastos inmediatamente subintimales adoptan una posición vertical (Hematoxilina-eosina x400). D) Pseudoquiste mixoide. Área nodular circunscrita mixoide (Hematoxilina-eosina x20).
Por debajo de la íntima, se encuentra la subíntima, constituida por un estroma con macrófagos, linfocitos, células madre mesenquimales, adipocitos y vasos sanguíneos. Esta capa subíntima puede llegar a ser considerablemente gruesa (hasta 200 micras) en comparación con la sinovial normal (un grosor máximo de 20 micras). En esta capa subíntima, se observan zonas más celulares y otras menos. En las zonas más celulares, hay una mezcla de fibroblastos, infiltrado inflamatorio mononuclear y en ocasiones, células multinucleadas. Los fibroblastos inmediatamente subintimales suelen adoptar una disposición vertical, perpendicular a la íntima. Estos fibroblastos subintimales expresan marcadores de célula madre, tales como CD13, CD105, CD9, CD44, CD54, CD90, CD166, o D7-FIB, así como con vimentina.
Diagnóstico diferencial: el principal diagnóstico diferencial es la bursitis que, histológicamente, puede ser muy similar o incluso idéntica. Sin embargo, las bursitis suelen ser lesiones profundas, localizadas sobre prominencias óseas. También debe distinguirse de las verdaderas herniaciones de la sinovial que ocurren a través de la cápsula.
Pseudoquiste mixoide digitalDefinición: se trata en realidad de un pseudoquiste por colección mixoide en el estroma, ya que carece de revestimiento epitelial. A pesar de eso, se le ha llamado también quiste mucoide o mucoso digital.
Patogenia: mediante inyección de azul de metileno en la articulación interfalángica distal se ha descrito la existencia de una comunicación con el espacio articular15. Es decir, se postula la salida de contenido sinovial al espacio periarticular en el contexto de degeneración articular. De hecho, muchos pacientes presentan ostoeartritis de la articulación interfalángica distal y se ha propuesto que el aumento de líquido sinovial y la formación de osteofitos puede tener un papel patogénico. Se ha descrito también una asociación ocupacional por traumatismos repetitivos16.
Clínica: se presenta como una pápula cupuliforme o nódulo, que suele ser traslúcido y generalmente brillante y se localiza preferentemente en el dorso de la falange distal de los dedos de las manos, siendo infrecuente en los de los pies. Su contenido es un fluido viscoso o gelatinoso incoloro17. Habitualmente es solitario y de tamaño inferior a 1cm, pero puede llegar a los 2cm, y se han descrito casos múltiples. Generalmente es asintomático, aunque si afecta al pliegue proximal ungueal puede producir una distrofia ungueal. Es más frecuente en mujeres y el rango de edad es amplio, entre la 2ª y 7ª década.
HistopatologíaExisten dos subtipos histológicos:
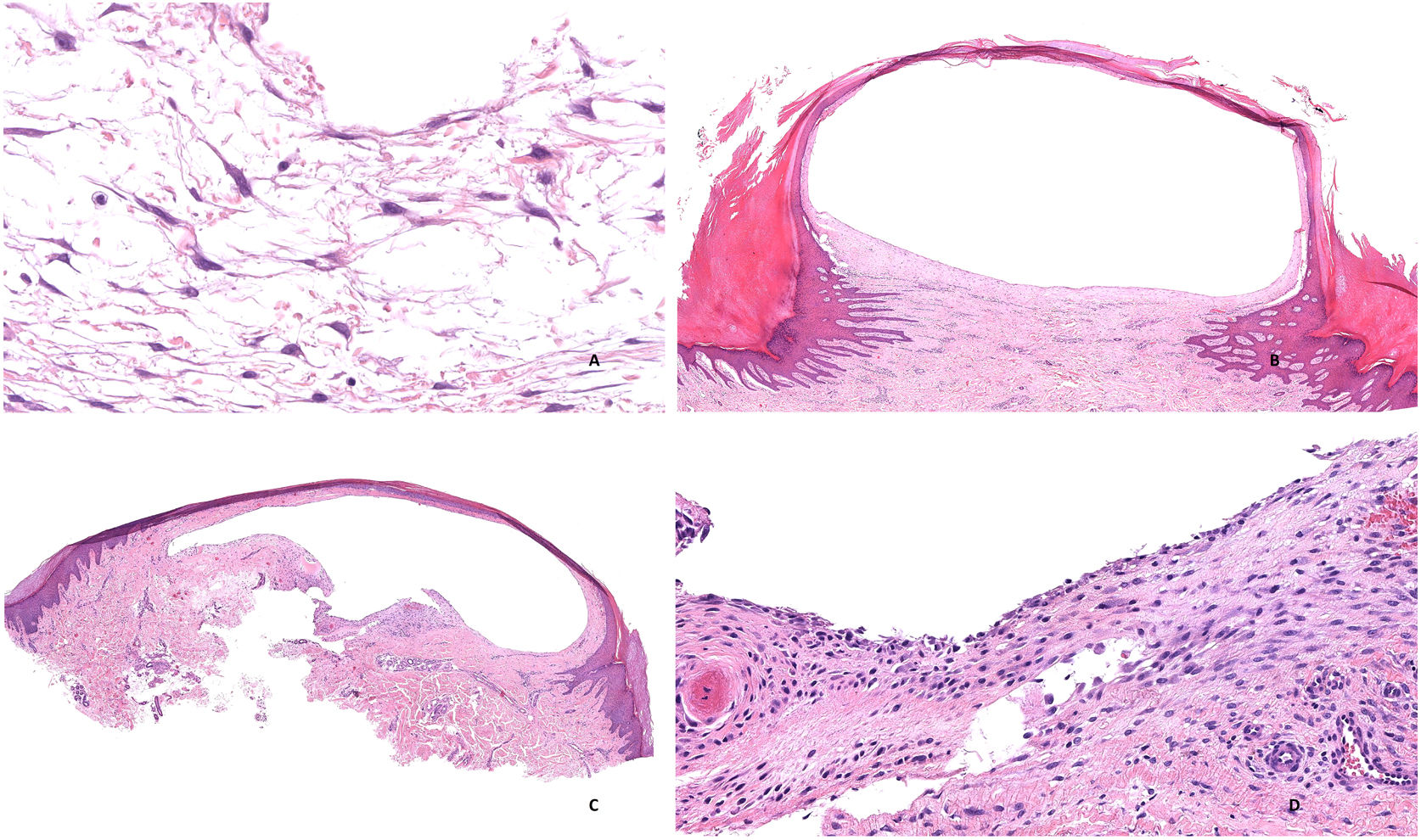
-Tipo mixomatoso: se observa un área nodular circunscrita de tejido mixoide (fig. 3D) constituida por células fibroblásticas fusiformes o estrelladas de tamaño variable sin atipia nuclear (fig. 4A) acompañadas de cantidad variable de mucina que se puede poner en evidencia con las tinciones de Azul Alcián y Hierro Coloidal, y que parece ser rica en ácido hialurónico. Puede haber focos pseudoquísticos así como hendiduras rodeadas por tejido fibroso sin revestimiento epitelial.
A) Pseudoquiste mixoide. Fibroblastos fusiformes y estrellados en la colección de mucina (Hematoxilina-eosina x400). B) Pseudoquiste mixoide. Se observa una cavidad pseudoquística con pared fibrosa colágena de grosor variable (Hematoxilina-eosina x20). C) Pseudoquiste mixoide. La pared fibrosa de la lesión tiene un grosor variable Hematoxilina-eosina x20). D) Pseudoquiste mixoide. La cavidad puede en ocasiones mostrar un revestimiento similar a la membrana sinovial (Hematoxilina-eosina x400).
-Tipo ganglión: se trata de una cavidad pseudoquística (fig. 4B) con pared fibrosa colágena de grosor variable (fig. 4C). Esta variante suele aparecer sobre la articulación interfalángica distal. Puede haber ocasionalmente discreto componente mixoide periférico por debajo de la pared fibrosa e incluso focal revestimiento de tipo sinovial (fig. 4D).
Diagnóstico diferencial: el angiomixoma superficial es de mayor tamaño, suele ser lobulado, presenta vasos más numerosos y variable cantidad de neutrófilos. La mucinosis dérmica focal puede ser similar al pseudoquiste mixoide digital (de hecho, algunos autores lo consideran una variante de ella) aunque suele tener una ligeramente mayor densidad celular.
Quiste cutáneo ciliadoDefinición: El término «quiste cutáneo ciliado» se refiere principalmente al quiste cutáneo ciliado de las piernas, aunque existen otros quistes que pueden estar revestidos total o parcialmente por epitelio columnar ciliado: tanto el quiste broncogénico, el quiste branquial y el tirogloso, los quistes mucinosos y ciliados de la vulva o la endosalpingiosis, pueden tener también epitelio ciliado, pero por su localización y características clínicas se consideran separadamente.
Patogenia: se considera que son quistes de origen mülleriano. En los casos (menos frecuentes) de pacientes varones, se ha postulado un origen en las glándulas sudoríparas metaplásicas o en restos embrionarios cloacales18,19.
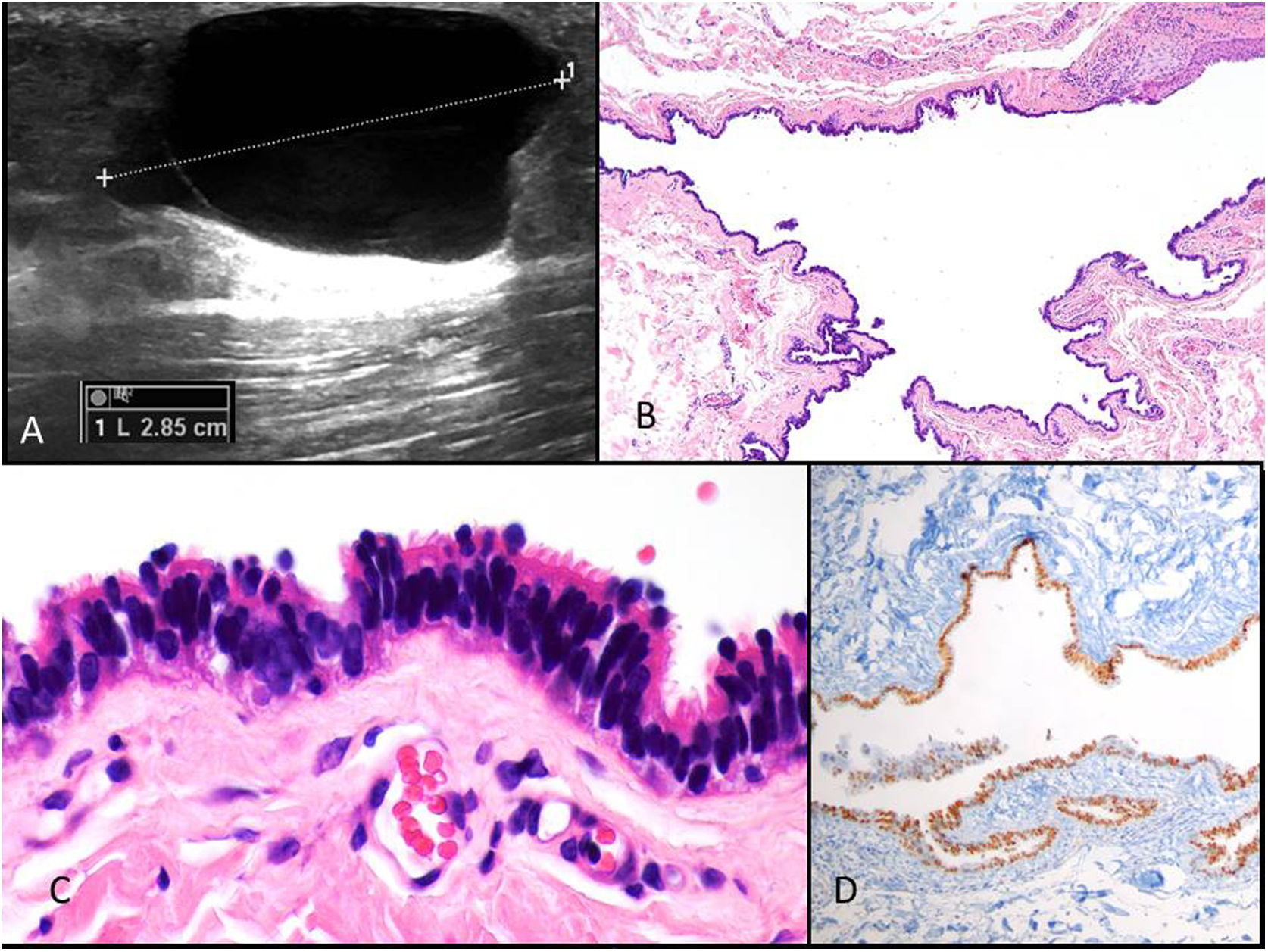
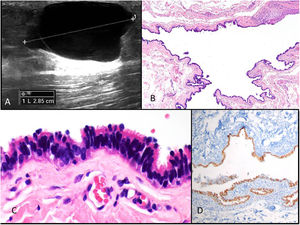
Clínica: ocurre sobre todo en las extremidades inferiores de mujeres entre 15 y 30 años. Son poco frecuentes, con menos de 60 casos publicados20–24. Se presenta como un nódulo móvil, fluctuante. Es indoloro y puede aumentar de tamaño con los picos hormonales. Rara vez puede ocurrir en otros sitios, como la pared abdominal, ombligo, periné, rodilla o dedos25–29. Los quistes miden menos de 3cm de diámetro. La ecografía muestra un quiste de tamaño variable de contenido anecógeno sin datos de malignidad (fig. 5A). La luz puede contener secreciones y restos celulares.
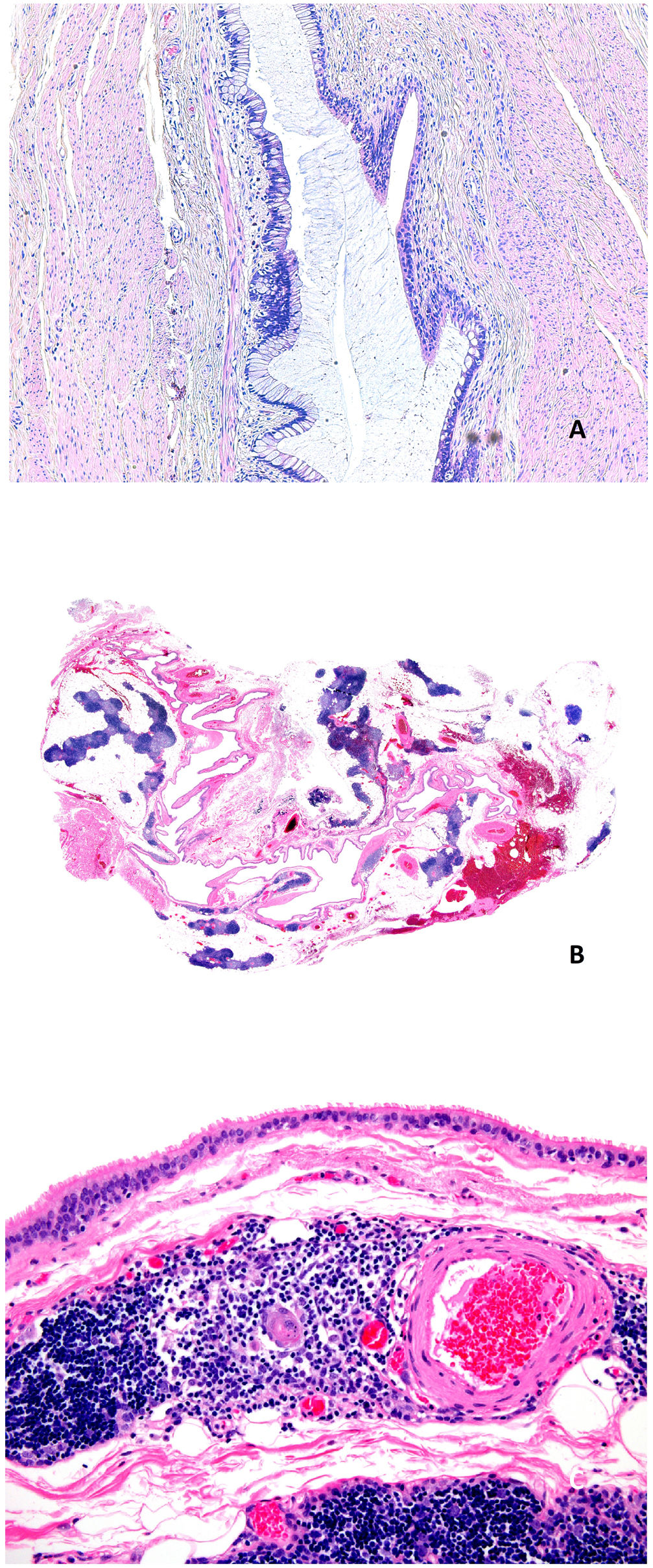
Histopatología: el quiste es dérmico, uni o multilocular, de contorno festoneado y está revestido por epitelio cuboideo o cilíndrico ciliado con áreas pseudoestratificadas (fig. 5B y 5C). A veces puede existir metaplasia escamosa focal y ocasionalmente células mucinosas o de aspecto apocrino. Con frecuencia muestran proyecciones papilares en la luz. La pared es fina y no muestra músculo liso. No se observa atipia ni mitosis. El índice de proliferación es bajo. Inmunohistoquímicamente el fenotipo sugiere origen mülleriano, mostrando positividad para CK7, receptores de estrógenos (fig. 5 D) y de progesterona, WT1, PAX8, EMA, y dineina en la porción apical. CEA, CK20 y calretinina resultan negativas30–32.
Diagnóstico diferencial: el quiste broncogénico suele tener músculo liso, glándulas y, a veces, cartílago. Además, suele presentarse en la línea media esternal. El quiste branquial muestra normalmente epitelio escamoso, aunque puede mostrar focos de epitelio ciliado. En su pared, suele presentar focos de infiltrado linfoide, así como músculo liso y cartílago. El quiste del conducto tirogloso aparece en la línea media del cuello y, aunque puede tener un epitelio ciliado de tipo respiratorio, suele tener folículos tiroideos. En cuanto al teratoma quístico maduro, a su diagnóstico ayuda la presencia acompañante de estructuras de otras capas germinales.
Quiste del conducto tiroglosoDefinición: quiste derivado de la persistencia y dilatación de restos del conducto tirogloso embrionario. El quiste del conducto tirogloso es el quiste congénito más frecuente del cuello, con una prevalencia estimada de 7%.
Patogenia: en la vida embrionaria, el tiroides desciende hacia el cuello, a la vez que las dos eminencias linguales se fusionan en la línea media. Durante este periodo, la porción media de la glándula permanece unida al foramen cecum, que se localiza en la unión del tercio posterior con los dos tercios anteriores de la base de la lengua, mediante el conducto tirogloso. Pasa por delante del hioides y se atrofia entre la séptima y décima semanas de la gestación. Su obliteración incompleta causa la persistencia del conducto tirogloso y en ocasiones se desarrolla un quiste por el acúmulo de secreciones o por un proceso inflamatorio.
Clínica: aunque suele presentarse en niños y adolescentes, puede detectarse a partir de la tercera década de la vida como una masa blanda, asintomática, habitualmente en la línea media del cuello, proximal al hioides33,34. Es igual de frecuente en varones que mujeres. Característicamente la masa se desplaza hacia arriba con la protrusión de la lengua33.
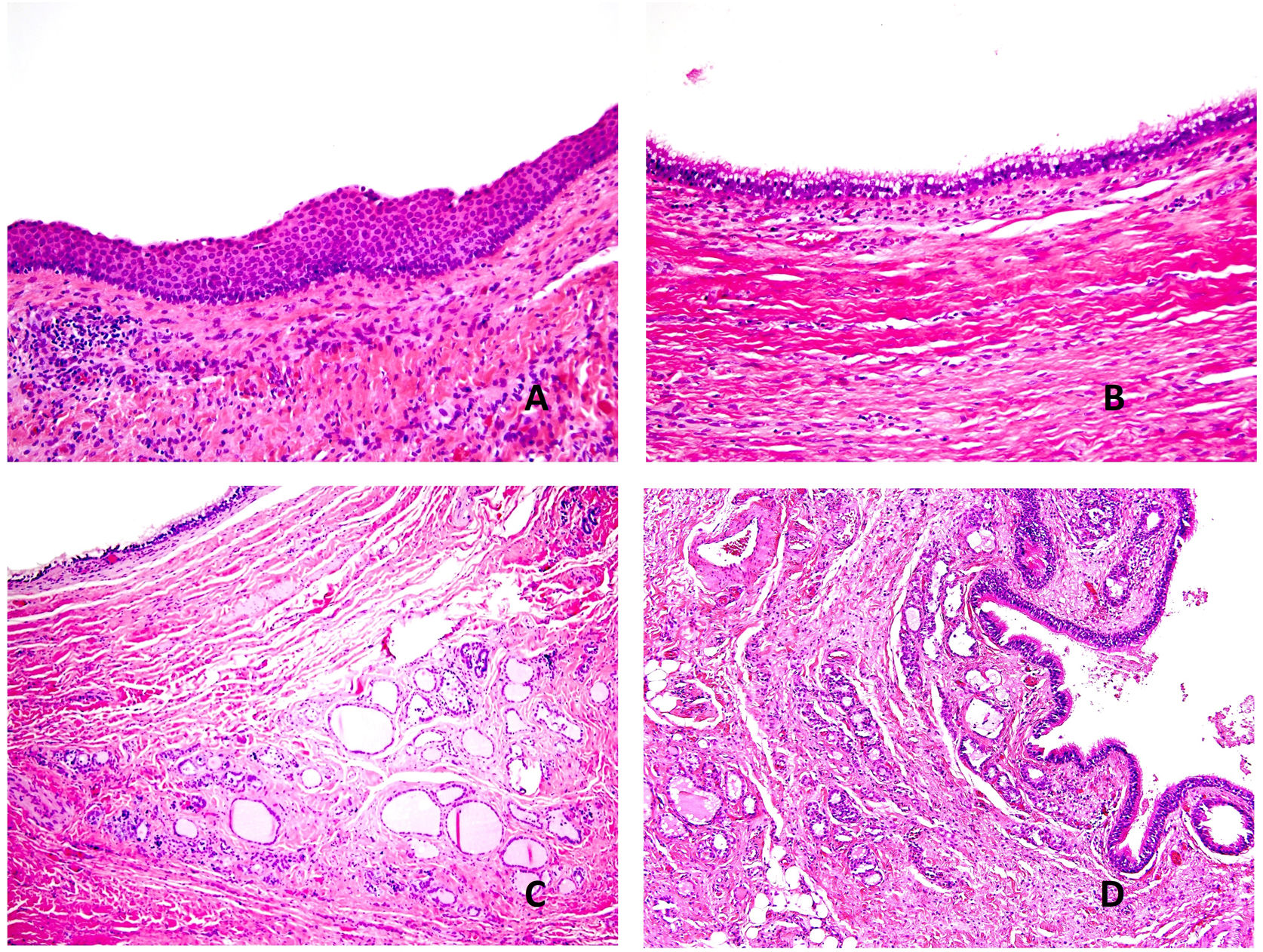
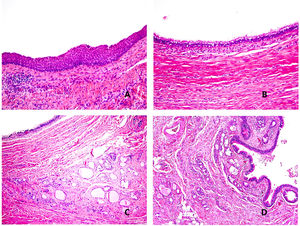
Histopatología: la pared del quiste está revestida por epitelio escamoso (fig. 6A) o columnar, en ocasiones ciliado (fig. 6B) o, frecuentemente, una combinación de ambos. Es común la identificación de restos de tejido tiroideo normal (fig. 6C) y glándulas mucoproductoras (fig. 6D), así como cambios inflamatorios. Solo 1% de los casos carece de revestimiento epitelial35. Alrededor de 1% de los casos albergan un carcinoma33,36. El tipo histológico más común es el carcinoma papilar, seguido de tumores mixtos (papilar y folicular) y, más raramente, el carcinoma epidermoide, cuyo pronóstico es peor.
A) Quiste del conducto tirogloso. Revestimiento por epitelio escamoso (Hematoxilina-eosina x100). B) Quiste del conducto tirogloso. Revestimiento por epitelio cilíndrico ciliado (Hematoxilina-eosina x40). C) Quiste del conducto tirogloso. Restos tiroideos en la pared del quiste (Hematoxilina-eosina x40). D) Quiste del conducto tirogloso. Se observa revestimiento por epitelio ciliado. En la pared del quiste se observan restos tiroideos y glándulas mucoproductoras (Hematoxilina-eosina x40).
Diagnóstico diferencial: aunque en el quiste dermoide puede haber otros componentes tisulares en su pared y rara vez tejido tiroideo, el epitelio de revestimiento es escamoso queratinizante, con apéndices cutáneos acompañantes. El quiste branquial muestra una localización lateralizada en el cuello, al contrario que el del conducto tirogloso y el epitelio de revestimiento suele ser total o parcialmente escamoso. Un diagnóstico diferencial muy importante y que puede resultar complicado es la degeneración quística de una metástasis ganglionar de un carcinoma papilar de tiroides. En este último caso habrá que prestar atención a los restos periféricos de parénquima ganglionar y a la evidencia de caracteres nucleares de carcinoma papilar si los hubiere. El quiste tímico presenta revestimiento escamoso, cuboidal, columnar, micropapilar o mixto, sin restos tiroideos. Otro diagnóstico diferencial difícil puede ser un nódulo tiroideo coloide con degeneración quística, para lo que ayudará la información radiológica de proximidad/contigüidad con el tiroides, así como la ausencia de revestimiento escamoso.
Quiste branquialDefinición: se trata de un quiste malformativo como resultado de un defecto del cierre del arco branquial.
Patogenia: surgen como trastornos congénitos, en la 4ª semana de gestación, durante el desarrollo del aparato faríngeo, por falta del cierre de alguno de los cuatro arcos branquiales. Esto da lugar a un quiste (75% de los casos) o a una fístula (25% restante)37.
Clínica: suelen manifestarse en niños o adultos jóvenes, tras una infección del tracto respiratorio superior. Los quistes del arco branquial constituyen casi 20% de las masas pediátricas en el cuello38, suelen aparecen en niños o en adultos jóvenes, tras una infección del tracto respiratorio superior que se complica con la infección del propio quiste39. Solo un porcentaje muy bajo se detecta en la vida adulta. Se caracterizan por una masa blanda, ovalada.
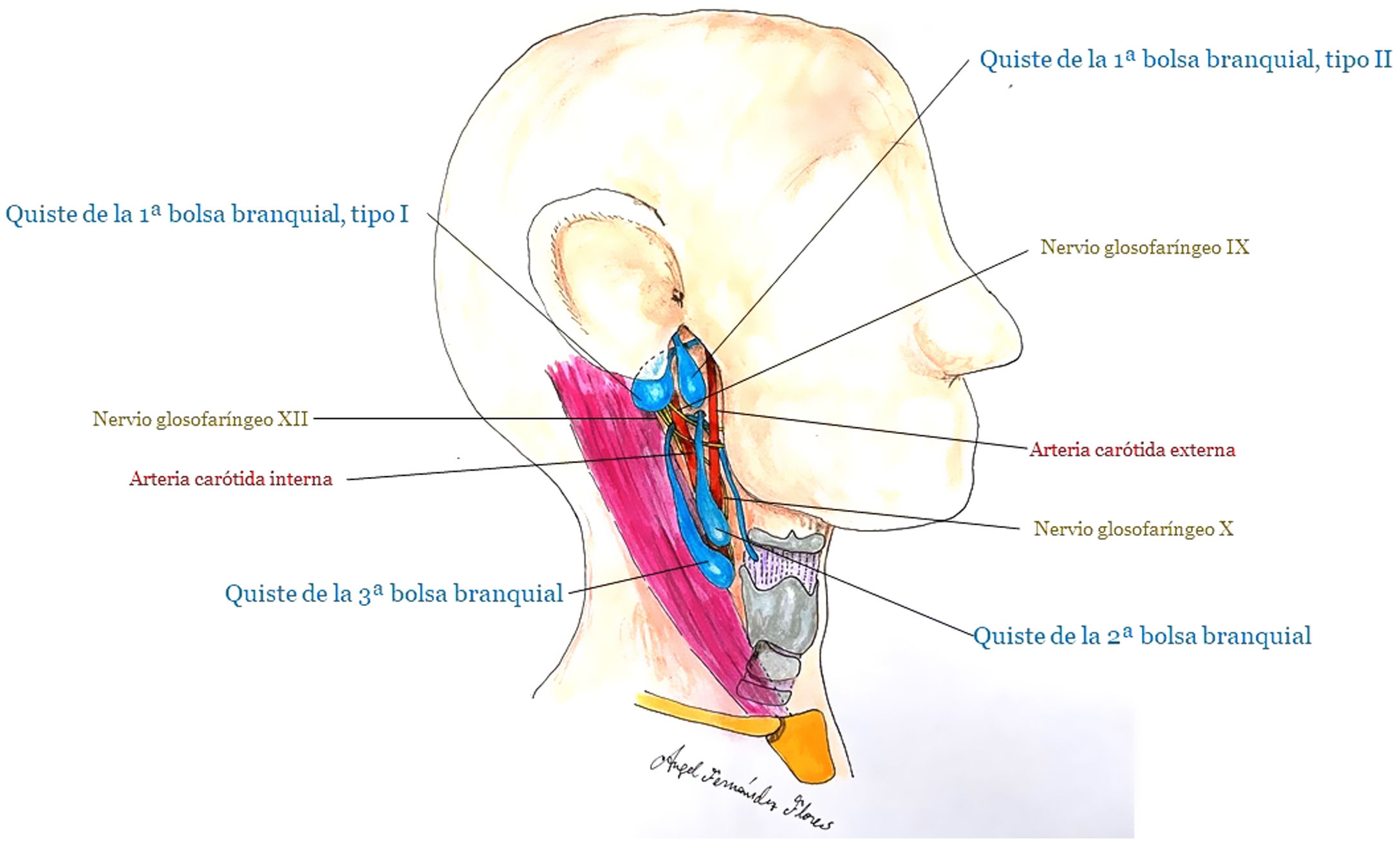
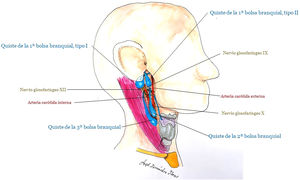
Aunque como regla general se ubican en la cara lateral del cuello, anteriores al músculo esternocleidomastoideo, basándose en el arco implicado, se distinguen (fig. 7):
- 1)
Quiste por alteración del cierre del 1er arco branquial (menos de 1%).
Aparecen en la cara, cerca del lobulillo de la oreja. Se subdivide a su vez en dos tipos39:
- a.
Tipo I: es de origen ectodérmico y corresponde a duplicaciones del canal auditivo externo. Atraviesa la glándula parótida y se localiza próximo al nervio facial.
- b.
Tipo II (más frecuente que el I): contiene elementos ectodérmicos y mesodérmicos. Se suele localizar por debajo del ángulo mandibular, atraviesa la glándula parótida medial o lateral al nervio facial y acaba por debajo del canal auditivo externo o en la unión cartilaginosa-ósea del canal auditivo externo.
- 2)
Quiste por alteración del cierre del 2° arco branquial (el más frecuente, 90-95% de los casos). Se localiza justo por debajo de ángulo mandibular, anterior al músculo esternocleidomastoideo, en el nivel II del paquete ganglionar del cuello. Su localización y naturaleza quística puede plantear dificultades de diagnóstico diferencial con metástasis de carcinomas escamosos orofaríngeos (virus de papiloma humano [VPH+]).
- 3)
Quiste por alteración del cierre del 3er arco branquial. También aparece anterior al músculo esternocleidomastoideo, pero en zonas más inferiores del cuello que los anteriores. Termina en la faringe, en la membrana tiro-hioidea o en el seno piriforme.
- 4)
Quistes por alteraciones del cierre del 4° arco branquial (muy infrecuentes)40.
Las infecciones recurrentes de los quistes branquiales son relativamente frecuentes, pudiendo fistulizar a la piel. Estas infecciones aumentan el riesgo de lesiones a estructuras próximas como el nervio facial, especialmente cuando la parótida está afectada. Infecciones graves de los quistes del 3er o 4° arco branquial pueden causar edema faríngeo y de las vías aéreas.
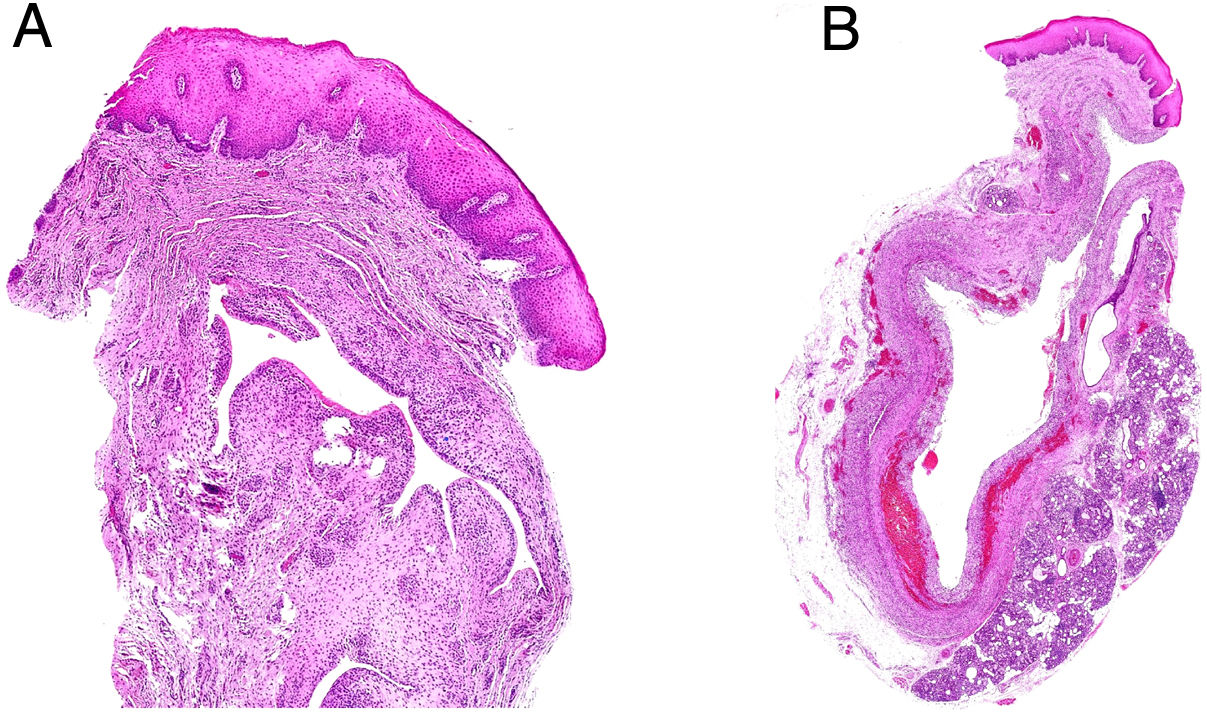
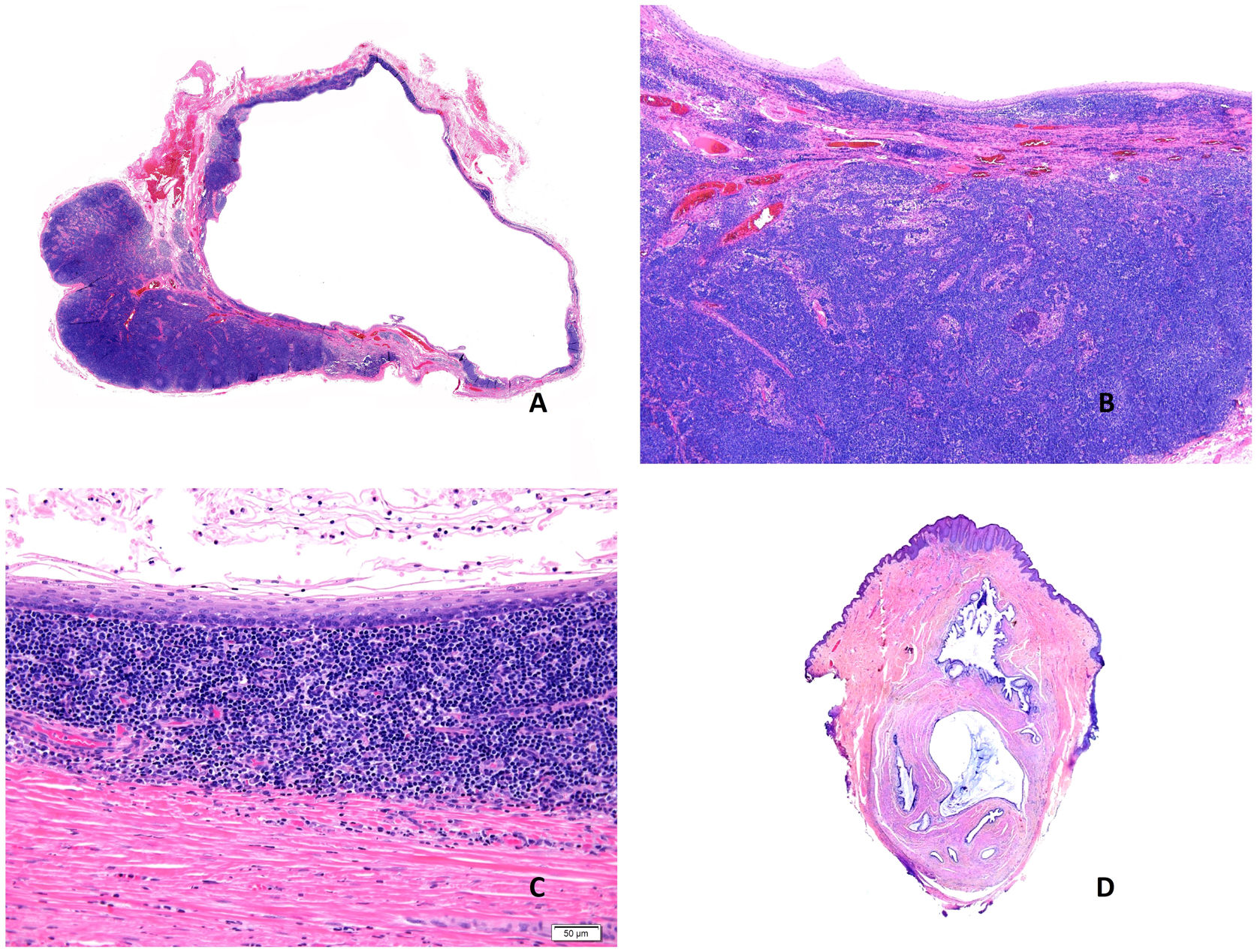
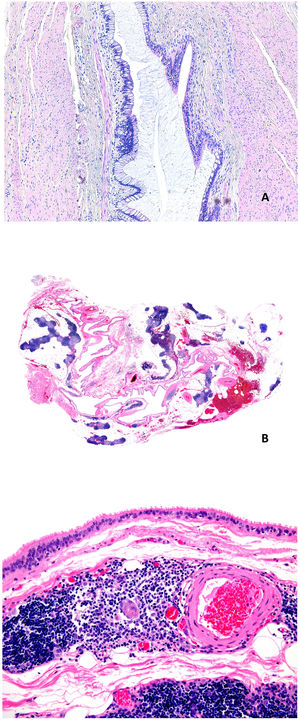
Histopatología: se trata de fístulas o quistes bien delimitados de un diámetro que oscila entre 2 y 5cm (fig. 8A), aunque se han descrito casos gigantes41. La mayoría corresponden a quistes revestidos por epitelio escamoso plano estratificado (fig. 8B), a veces cilíndrico, ciliado, mucinoso, o pseudoestratificado, ulcerado o no, por debajo del cual se identifica una pared de tejido fibroso en la que se observa abundante tejido linfoide (fig. 8C) con prominentes centros germinales. Los quistes localizados en la zona inferior del cuello también pueden contener glándulas sebáceas, seromucinosas o mucinosas42,43. Las infecciones secundarias pueden dificultar el diagnóstico histopatológico.
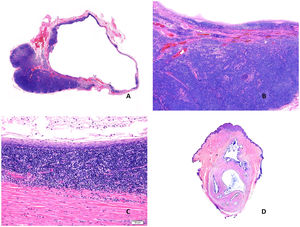
A) Imagen panorámica de un quiste branquial con una cavidad revestida por epitelio escamoso con abundante tejido linfoide asociado (Hematoxilina-eosina x20). B) Pared del quiste en la que se identifica tejido linfoide con folículos y centros germinales (Hematoxilina-eosina x40). C) Detalle donde se reconoce la pared fibrosa revestida por epitelio escamoso con una banda de tejido linfoide subyacente (Hematoxilina-eosina x100). D) Quiste onfalomesentérico. Vista panorámica. Lesión vertical de aspecto quístico de contenido mucoide (Hematoxilina-eosina x20).
Se han descrito carcinomas escamosos desarrollados sobre quistes del arco branquial, pero son excepcionales. Remanentes de la bolsa del arco branquial se pueden encontrar también en la glándula tiroides en forma de nidos celulares sólidos.
Diagnóstico diferencial: el diagnóstico diferencial más importante y trascendente es con la metástasis quística ganglionar del carcinoma escamoso orofaríngeo o pulmonar. Estos casos son a veces difíciles de distinguir del quiste branquial. Datos a favor de una metástasis son: la presentación en un adulto y la presencia de atipias prominentes. Adicionalmente, los quistes branquiales infectados pierden el epitelio de superficie y se pueden confundir con abscesos recurrentes.
Quiste onfalomesentéricoDefinición: el quiste del ducto onfalomesentérico se forma como remanente anómalo de dicho ducto.
Patogenia: el ducto onfalomesentérico es una estructura embrionaria que comunica el saco vitelino con el intestino, y normalmente desaparece antes de la novena semana de gestación44. Las dilataciones quísticas de remanentes de dicho ducto forman este tipo de quiste45.
Clínica: se presenta como un quiste en la región periumbilical. Puede tener comunicación con la superficie e incluso drenar líquido seroso46. El tamaño medio es de 1cm, aunque se han descrito casos de hasta 10cm44. Dada su asociación con el divertículo de Meckel se recomienda realizar ecografía o escaner con Tc9945.
Histopatología: se trata de una formación quística que al corte aparece uni- o multi-locular (fig. 8D), revestida por mucosa gastrointestinal que puede ser de tipos gástrico, colónico o de intestino delgado. De manera variable puede tener músculo en la pared o incluso tejido pancreático ectópico44 (fig. 9A).
A) Quiste onfalomesentérico. Pared revestida por epitelio intestinal y foveolar con músculo alrededor (Hematoxilina-eosina x100). B) Quiste tímico. Se observa una estructura quística multilocular con múltiples focos linfoides (Hematoxilina-eosina x20). C) Quiste tímico. El revestimiento epitelial de este caso era cilíndrico ciliado monocapa. En la pared del quiste se observan restos linfoides, así como un corpúsculo de Hassall (Hematoxilina-eosina x100).
Diagnóstico diferencial: si solo se observa un tracto ductal de similar revestimiento epitelial, pero sin dilatación quística, el diagnóstico preferido es persistencia del conducto onfalomesentérico45,46.
Quiste tímicoDefinición: se trata de un quiste malformativo a partir de vestigios embrionarios remanentes del conducto timofaríngeo.
Patogenia: se produce como consecuencia de una alteración del desarrollo a partir de restos del conducto timofaríngeo47,48.
Clínica: se presenta como una lesión quística congénita cervical que se localiza entre el ángulo de la mandíbula y el manubrio esternal, fundamentalmente en niños (primera década de la vida), con una presentación excepcional en adultos. Su localización más frecuente es en la porción lateral izquierda del cuello49. En la mayoría de los casos son quistes asintomáticos, pero en ocasiones, sobre todo en la infancia, pueden producir alteraciones como distrés respiratorio y disfagia49.
Histopatología: macroscópicamente se trata de quistes uni o multiloculados con un contenido gelatinoso claro o parduzco (fig. 9B). Histológicamente presentan una pared fibrosa con agregados linfocitarios, tapizada por un epitelio de naturaleza variable. Puede ser escamoso estratificado, cuboideo, columnar pseudoestratificado o ciliado (fig. 9C). La pared contiene restos tímicos que incluyen corpúsculos de Hassall y ocasionales granulomas a colesterol47,49,50.
Diagnóstico diferencial: uno de los diagnósticos más difíciles es el de un verdadero timoma con áreas quísticas. Esta última entidad suele mostrar mucha más cantidad de tejido tímico en la pared, acompañado de zonas de timoma franco sólido. También se debe distinguir de las degeneraciones quísticas de linfomas de estas áreas topográficas. Para ello, se debe prestar atención a la naturaleza tumoral del infiltrado linfoide, con las dificultades que ello implica, similares al diagnóstico diferencial entre linfoma y población linfoide reactiva en cualquier otra biopsia. También, las malformaciones vasculares linfáticas pueden contener abundante infiltrado linfocitario en su pared y se presentan como estructuras quísticas, pero están constituidas por vasos linfáticos dismórficos, con revestimiento endotelial y positividad para marcadores de endotelio linfático como D2-40. Se debe tener cuidado también con los tumores germinales con degeneración quística, especialmente con el seminoma, que puede mostrar un componente linfocitario denso y abundante. Para ello, se debe prestar atención al componente germinal tumoral que, en el caso del seminoma, puede estar representado por pocas células sueltas. En este sentido, la inmunohistoquímica apropiada (OCT 3/4 CD117, D2-40, PLAP) puede ayudar a identificar las células del seminoma.
Pseudoquiste auricularDefinición: se trata de una patología poco frecuente del pabellón auricular, correspondiente a un pseudoquiste de contenido líquido. También es conocido como condromalacia quística idiopática benigna, seroma auricular, pseudoquiste endocondral o quiste intracartilaginoso.
Patogenia: la etiopatogenia no es completamente conocida, aunque se relaciona con traumatismos repetidos, como supone el uso de auriculares, manipulación de la oreja, etc. La lesión se origina por un cúmulo de líquido estéril intracartilaginoso formando una cavidad quística no revestida por epitelio. El líquido es viscoso, de color amarillo o marronáceo y no contiene células. Posiblemente los traumatismos menores repetidos favorecen la liberación de enzimas del cartílago auricular degenerado que acaban fragmentando la estructura cartilaginosa.
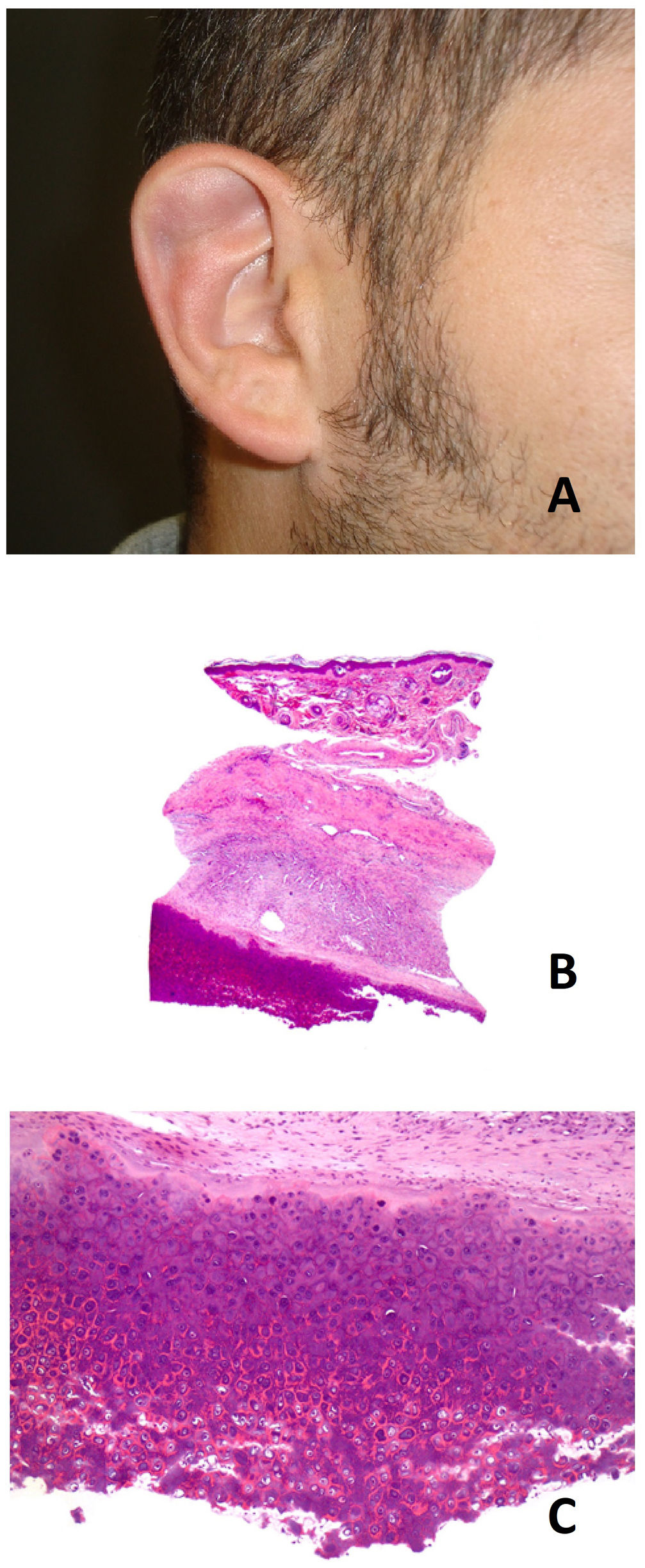
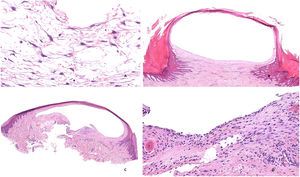
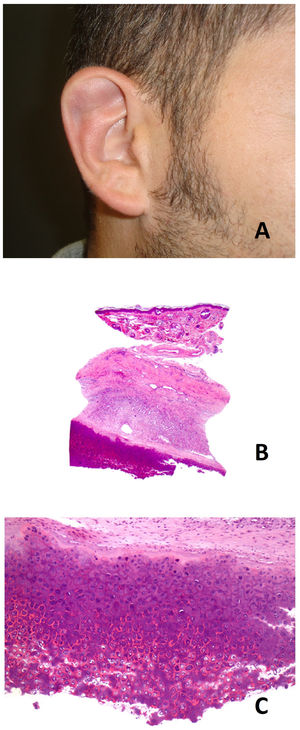
Clínica: clínicamente se presenta como un nódulo asintomático, fluctuante, de un tamaño entre 1 y 2cm localizado habitualmente en el tercio superior del hélix, siendo más frecuente el lado derecho. Por lo general es unilateral, aunque se han descrito casos bilaterales. Afecta típicamente a varones jóvenes (fig. 10A)51. Es una entidad benigna, aunque sin tendencia a la resolución espontánea. Sin tratamiento, produce una deformidad permanente del pabellón auricular.
Pseudoquiste auricular. A) Quiste de consistencia elástica en tercio superior de hélix derecho en paciente que utiliza habitualmente auriculares en su trabajo. B) Imagen panorámica mostrando dermis e hipodermis sin alteraciones, con cartílago adelgazado por encima de la cavidad quística (Hematoxilina-eosina x20). C) Pared cartilaginosa de la cavidad quística, mostrando la ausencia de epitelio de revestimiento, así como degeneración hialina de los condrocitos que dan a la luz del quiste (Hematoxilina-eosina x100).
Histopatología: se observa una formación quística cuya pared está formada por cartílago auricular adelgazado con degeneración hialina de los condrocitos (fig. 10B). La pared del quiste no muestra revestimiento epitelial, aunque pueden encontrarse áreas con tejido de granulación (fig. 10C)52.
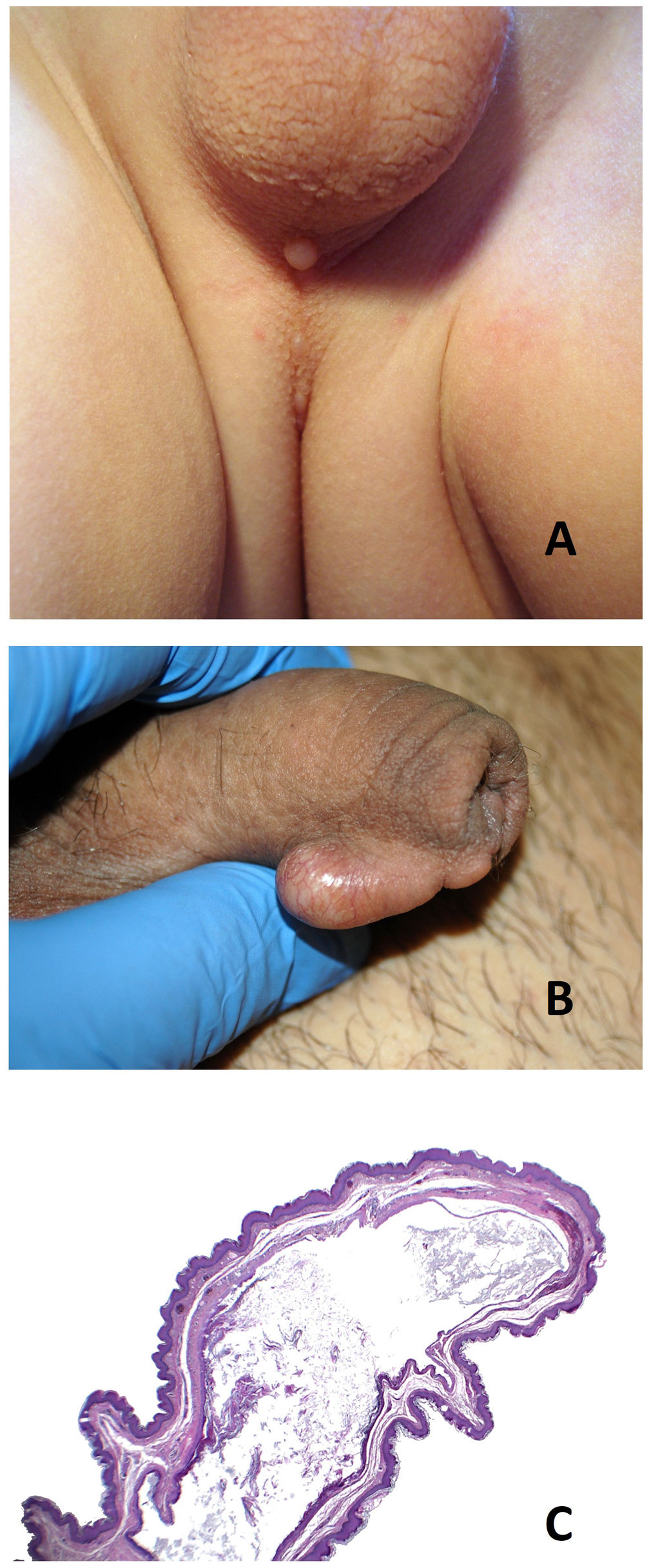
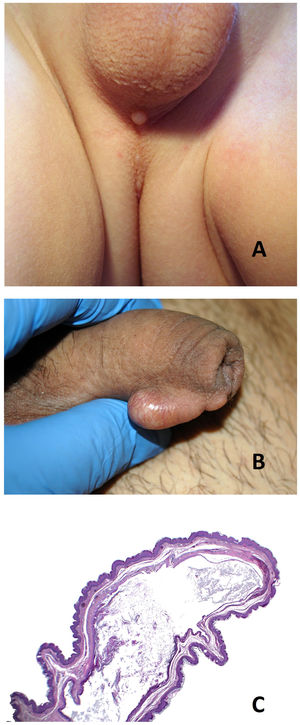
Quiste del rafe medioDefinición: este quiste fue descrito por Mermet en 189553. Se trata de quistes congénitos que se disponen a lo largo del rafe medio desde el extremo distal del pene hasta el margen anal (fig. 11A). Aunque el término más empleado y consensuado es quiste del rafe medio, también podemos encontrarlos en la literatura con otras denominaciones, tales como: quistes del rafe genitoperineal, quistes mucoides del pene, cistadenoma apocrino del pene, hidrocistoma del pene, quiste epidermoide del pene y quiste parameatal54.
Patogenia: es muy controvertida, existiendo varias teorías con una aceptación variable55. La más aceptada propugna que se trata de restos epiteliales atrapados durante el cierre de los pliegues urogenitales. Existen dos teorías alternativas: en primer lugar, la que sugiere que se originan como consecuencia de la formación anómala de yemas epiteliales uretrales que se vuelven independientes tras el cierre del rafe medio. En segundo lugar, aquella que favorece que proceden de glándulas periuretrales de Littre ectópicas.
Clínica: generalmente se presentan como quistes solitarios asintomáticos a lo largo del rafe medio detectados en la primera década de la vida (fig. 11B). En la edad adulta adquieren mucha más relevancia clínica, probablemente relacionadas con sus complicaciones (infecciones, obstrucción del flujo urinario o dificultad en las relaciones sexuales).
Histopatología: habitualmente son quistes uniloculares, aunque también existen formas multicamerales y, por definición, no están comunicados ni con la uretra ni con la piel. El tapizamiento epitelial de los mismos depende de su ubicación, eventualidad que supone que en la actualidad se clasifique en seis tipos:
- •
Uretral (55-70%): es el más frecuente, tapizado por epitelio pseudoestratificado.
- •
Epidermoide (5-10%): revestido por epitelio pavimentoso no queratinizante (fig. 11C y 12A). Dentro de este grupo, se han descrito algunos casos con tapizamiento de tipo infundibular (queratina laminada)56.
- •
Glandular (3%): exhibe células mucosecretoras que se sitúan en el seno de un epitelio de tipo uretral.
- •
Mixto (36%): mezcla de epitelios de los tres tipos anteriores en proporciones variables.
- •
Ciliado: presencia de células ciliadas en el seno de un epitelio pseudoestratificado57.
- •
Pigmentado: con melanocitos y melanina intraepitelial de extensión variable6.
Con relación a su fenotipo suelen ser positivos para CK5/6, CK7, CK13, p63, CEA y negativos para CK20 y actina de músculo liso. Recientemente, dependiendo de su ontogenia, se ha estudiado la expresión de GATA3, URO III y HMFG158.
Diagnóstico diferencial59: el quiste epidérmico infundibular puede ser de difícil diagnóstico diferencial con la variante infundibular. En este sentido serán relevantes los datos clínicos con la localización topográfica en el rafe. Algo similar puede ocurrir con el quiste dermoide pero este último mostrará además, otros componentes parietales.
Quiste de BartholinoDefinición: son quistes producidos por dilatación de las glándulas de Bartholino. Estas últimas están ubicadas en el vestíbulo vulvar, constituyen el compartimento glandular de mayor tamaño de esta región, con unas dimensiones aproximadas de 10mm. Su función es asegurar la adecuada lubrificación de vulva y vagina, merced a su secreción mucosa.
Patogenia: los quistes de Bartholino obedecen a una dilatación de los conductos excretores de dichas glándulas, condicionada por obstrucción de sus extremos distales, eventualidad que ocasiona acúmulo de secreciones en su seno. Esto puede estar en relación con infecciones (en muchos casos por Escherichia coli y algunos agentes asociados a infecciones de transmisión sexual (ITS) (como Neisseria gonorrhoeae y Chlamydia trachomatis), traumatismos o cirugía vulvovaginal.
Clínica: Del total de las mujeres, 2% desarrollan quistes o abscesos (tres veces más frecuentes que los quistes) de Bartholino, en algún momento de su vida, alcanzando su mayor incidencia entre la 2ª y 3ª década. Clínicamente se caracterizan por ser tumoraciones unilaterales, ubicadas en el introito lateral medial del labio menor60 (fig. 12B). Habitualmente son indoloras, dado que su contenido inicialmente es estéril. Cuando se produce una complicación -generalmente por sobreinfección- ocasionan sintomatología, dolor y tumefacción, que puede impedir la deambulación, la sedestación y ocasionar dispareunia.
A) Quiste del rafe medio. Tapizamiento epitelial de tipo escamoso infundibular (Hematoxilina-eosina x100). B) Quiste de glándulas de Bartholino. Tumoración circunscrita con relación al labio menor derecho. C) Quiste de glándulas de Bartholino. Imagen panorámica en la que se ve la pared del quiste de acuerdo con el compartimento glandular habitual de la glándula de Bartholino (Hematoxilina-eosina x20). D) Quiste de glándulas de Bartholino. Detalle del tapizamiento del quiste constituido por un epitelio transicional (Hematoxilina-eosina x200).
Histopatología: son quistes unicamerales de contenido de densidad variable, fluido o gelatinoso. Miden entre 1 y 4cm, aunque algunos pueden alcanzar los 10cm. Están tapizados por un epitelio transicional (fig. 12C y 12D) que en ocasiones puede estar trufado de áreas mucosecretoras y/o escamosas61. En la mayor parte de los casos dicho epitelio es positivo para CEA.
Diagnóstico diferencial62: la diferencia con otros quistes regionales (los quistes de inclusión epitelial, el quiste mucoso del vestíbulo vulvar, el quiste de Gartner, el quiste de Nuck, los quistes de glándulas de Skene) se puede hacer en virtud del revestimiento epitelial63. En la hidradenitis supurativa existen rasgos inflamatorios complejos que no se ven en esta lesión, así como otro tipo de revestimiento epitelial glandular. El hidradenoma papilar es un tumor de crecimiento mayoritariamente glandular con morfología epitelial de diferenciación apocrina.
ConclusiónAl igual que en la primera parte sobre quistes en dermatopatología, publicada en esta misma revista, el artículo presente pone de manifiesto la relevancia del examen cuidadoso de la naturaleza del revestimiento epitelial de las estructuras quísticas, para el diagnóstico y diagnóstico diferencial.
Consideraciones éticasTodo el material utilizado en la elaboración de este artículo, incluyendo la iconografía mostrada, ha sido obtenido con los pertinentes consentimientos informados.
FinanciaciónLos autores declaran no haber recibido ningún tipo de financiación para la elaboración de este artículo.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.