diseñar una técnica que mejore las laxitudes residuales en las cirugías del ligamento cruzado anterior (LCA).
Material y métodose efectuó un estudio anatómico en 20 rodillas de cadáver y en 50 fémures y 50 tibias humanas. Además, se analizó mecánicamente el comportamiento tras la sección de los fascículos en la rodilla del cadáver.
Resultadosel LCA presentó una inserción piriforme en la tibia, con eje mayor oblicuo y un área de 15,8×11,6mm. La inserción femoral fue ovoidea (15×8mm) con 15–30° de inclinación respecto a la cortical posterior. La longitud del fascículo anteromedial (AM) fue de 34±4,5mm y el posterolateral (PL) de 22±4mm. La técnica de doble fascículo mostró un 32,8% más de resección ósea que el monotúnel, pero con un 62,5% menos exigencias para el sistema de fijación; las cargas máximas hasta la rotura fueron de 785N. La sección de los fascículos mostró, en rotación neutra y 30° de flexión, un comportamiento idéntico de ambos fascículos; con la rodilla en flexión de 95° y rotación neutra, el fascículo AM soportó mayores tensiones mientras el PL las mantuvo en extensión y en rotación externa.
Conclusionesla reproducción de la morfología bifascicular del LCA se adapta a la biomecánica y a la anatomía del LCA, siendo posible hacerlo a través de un único orificio tibial.
To design a technique Ahmed at reducing the incidence of residual laxity in anterior cruciate ligament (ACL) surgery.
Materials and methodsAn anatomic study was performed in 20 cadaver knees and in 50 human femurs and 50 human tibias. In addition, a mechanical study was made of the consequences of sectioning the bundles in the cadaver knee.
ResultsThe ACL presented with a tibial piriformis attachment, with an oblique greater axis and ana rea of 15.8×11.6mm. The femoral attachment was egg-shaped (15×8mm) with a 15–30° inclination with respect to the posterior cortex. The length of the anteromedial (AM) bundle was 34±4,5mm and of the posterolateral (PL) bundle 22±4mm. The double-bundle technique afforded 32.8% more bone resection than the single tunnel, but causing 62.5% less stress on the fixation system; maximum loading strength of 785N. On being sectioned, both bundles showed, at neutral rotation and 30° flexion, identcal behaviors; with the knee at 95° flexion and neutral rotation the AM bundle had to withstand greater strains while the PL bundle had to withstand them in extension and external rotation.
ConclusionsReproducing the double-bundle morphology of the ACL is a successful method that is well-adapted to the anatomy and biomechanics of the ACL and that can be carried out through a single tibial tunnel.
La profundización en el conocimiento de las características anatómicas y biomecánicas del ligamento cruzado anterior (LCA) perfecciona las técnicas quirúrgicas, la prevención y la rehabilitación de lesiones en la articulación de la rodilla.
El LCA es una estructura tridimensional de tejido conectivo denso que se extiende entre la tibia y el fémur. En la tibia se inserta en la superficie preespinosa de la meseta tibial, y se dirige hacia arriba, atrás y hacia afuera, fijándose en la mitad posterior de la cara intercondílea del cóndilo femoral1. Siendo una de las estructuras que más lesiones sufre en las actividades deportivas2 y dada su incapacidad de reparación, tras la aparición de la inestabilidad articular, requiere de cirugía reparadora para restaurar la estabilidad y la cinemática de la rodilla lesionada, y prevenir cambios degenerativos y daño meniscal3; si bien no hay pruebas que certifiquen que su reconstrucción elimine ese riesgo4,5.
Ante la persistencia de inestabilidades rotacionales tras la reconstrucción del LCA, pensamos que una plastia que reproduzca la anatomía bifascicular puede prevenir la inestabilidad articular. En el presente trabajo describimos los tipos de fibras que componen el LCA y sus inserciones; además, analizamos las implicaciones de cada uno de sus fascículos en la estabilidad articular para diseñar una técnica de doble fascículo que respete los dos fascículos originales del ligamento.
Material y métodoSe estudiaron las articulaciones de la rodilla de 18 preparaciones de cadáver fresco (36 rodillas), correspondientes a adultos de sexo masculino con edades comprendidas entre 35 y 75 (media, 66) años y con una talla de 162 a 173 (media, 167) cm, examinando la estructura y los tipos de fibras, así como las inserciones, longitud y diámetro del LCA.
Tras la retirada de la membrana sinovial, mediante una microdisección, con un microscopio quirúrgico (Zeiss®) y con el ligamento in situ, se procedió a su análisis para extraer los dos fascículos, desinsertados proximal y distalmente, y medir su longitud y su diámetro con un calibre digital (Vernier®). Para medir y comprobar la localización de las superficies de inserción se utilizaron 50 fémures y tibias procedentes de cadáveres clasificados con anterioridad.
El estudio biomecánico se basó en el análisis matemático de ingeniería, y un estudio biomecánico en el cadáver.
Se realizó un estudio matemático teórico para conocer el volumen del cilindro ocasionado por el túnel óseo y la superficie de contacto del ligamento o superficie del cilindro. Un doble túnel en el fémur implica que el volumen óseo a mecanizar será igual a la suma de los volúmenes de los fascículos dentro del túnel, lo que a su vez vendrá determinado por el grosor de cada plastia independiente de isquiotibiales, ya que el grosor del túnel es directamente proporcional a la medida en grosor de cada uno de los fascículos para obtener un relleno completo.
En el cóndilo femoral externo, en su cara medial, se origina un cilindro cuyo volumen óseo a mecanizar será igual al volumen de la plastia dentro del hueso según la fórmula: v=π r2 h, donde r es el radio y h, la longitud de la parte de ligamento dentro del hueso, y que en el caso del doble túnel será el sumatorio de: v=π r12 h+π r22 h.
Igualmente, la superficie de contacto óseo será igual a la superficie de contacto de la superficie de cada fascículo en el hueso, que en este caso, al tratarse de una fijación femoral transfixiante, será en los 360° del túnel, y estará determinada por la fórmula v=2 π r h, igualmente r es el radio y h, la longitud de la parte del ligamento en el hueso, y que en el doble túnel será el sumatorio de v=2 π r1 h+2 π r2 h.
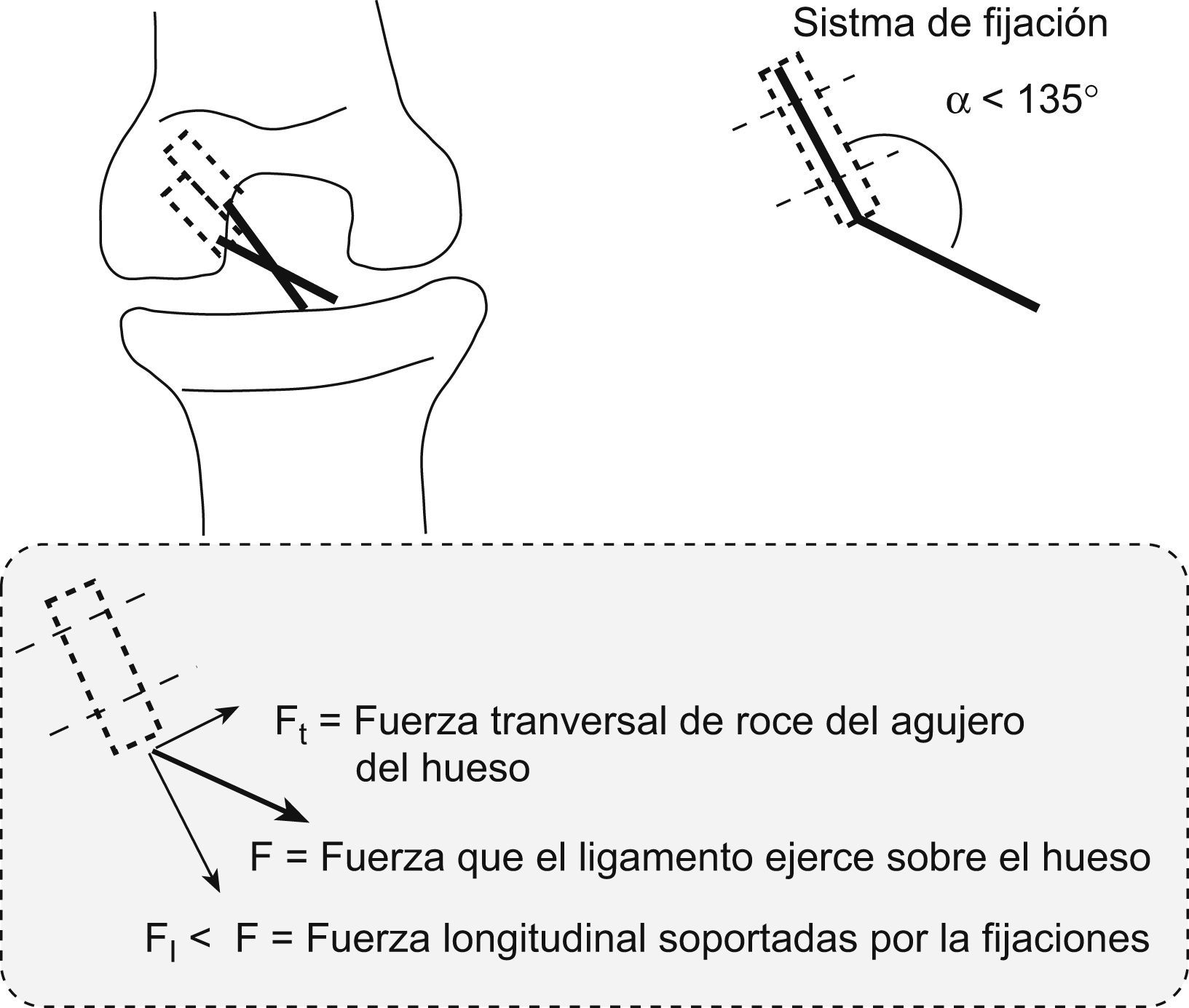
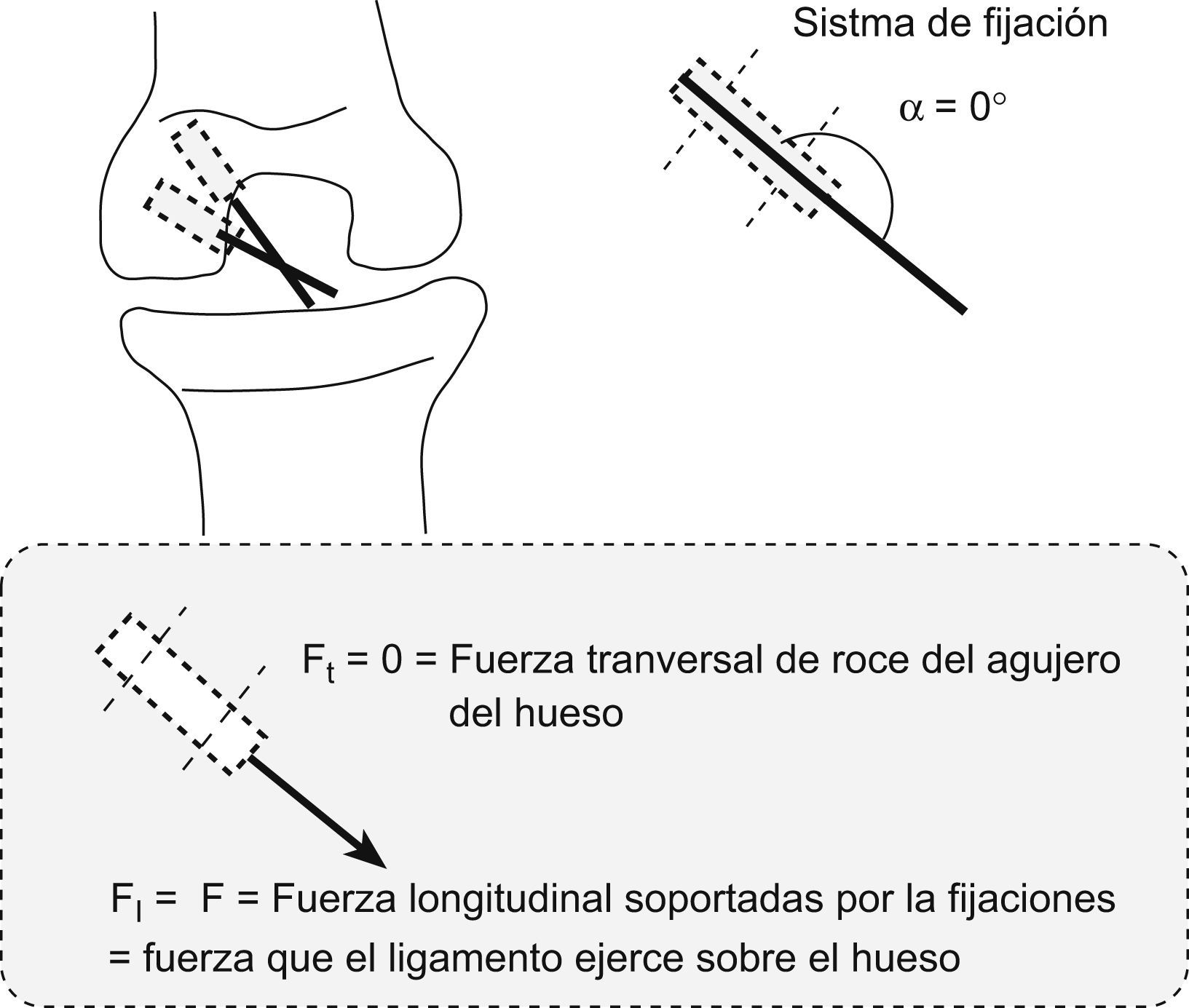
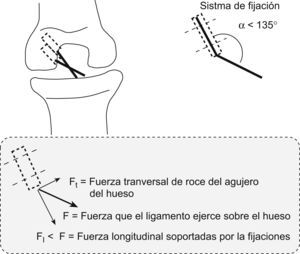
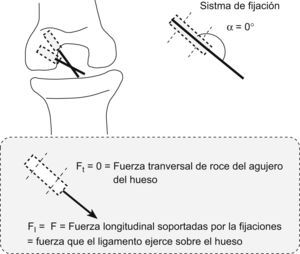
Descomponiendo las fuerzas en el supuesto de utilizar un doble túnel en paralelo (como propugnamos) o utilizar un doble túnel en oblicuo o divergente entre ambos (como ocurre en las técnicas de doble fascículo disponibles en el arsenal terapéutico), el estudio matemático considera que la tracción de los dos fascículos, independientemente de que se trate de divergentes o paralelos, descomponen sus fuerzas en tres sentidos en relación con los ejes de aplicación de dicha fuerza y según el ángulo α o ángulo de ataque del fascículo; que han sido denominados: la fuerza Ft o fuerza transversal de tracción o rozamiento que el fascículo hará en el orificio o la zona de entrada del túnel óseo, la fuerza F o fuerza pura de tracción del ligamento sobre el hueso en el túnel y la fuerza denominada F1 que será la que el fascículo o neoligamento ocasionará sobre las fijaciones en el sentido del eje del túnel y orientación del fascículo.
Se valoró la laxitud ligamentosa y la implicación del LCA y cada uno de sus fascículos, en la estabilidad anteroposterior y rotatoria del cadáver, utilizando un artrómetro tipo KT-1000 (Medmetric®), mediante la aplicación de una fuerza anterior sobre la meseta tibial para obtener la denominada «medición manual máxima». Determinamos la laxitud de las 20 rodillas con el LCA intacto, a 30° y 95° de flexión, y en rotación neutra de la pierna y en rotación externa de 30°. Posteriormente, en 8 articulaciones de las preparaciones cadavéricas, extirpamos el fascículo anteromedial (AM); en otras 8, el posterolateral (PL), y en 4, ambos fascículos (AM y PL) valorando la influencia que tiene cada uno de ellos en los mismos grados de flexión y rotación que con el LCA intacto.
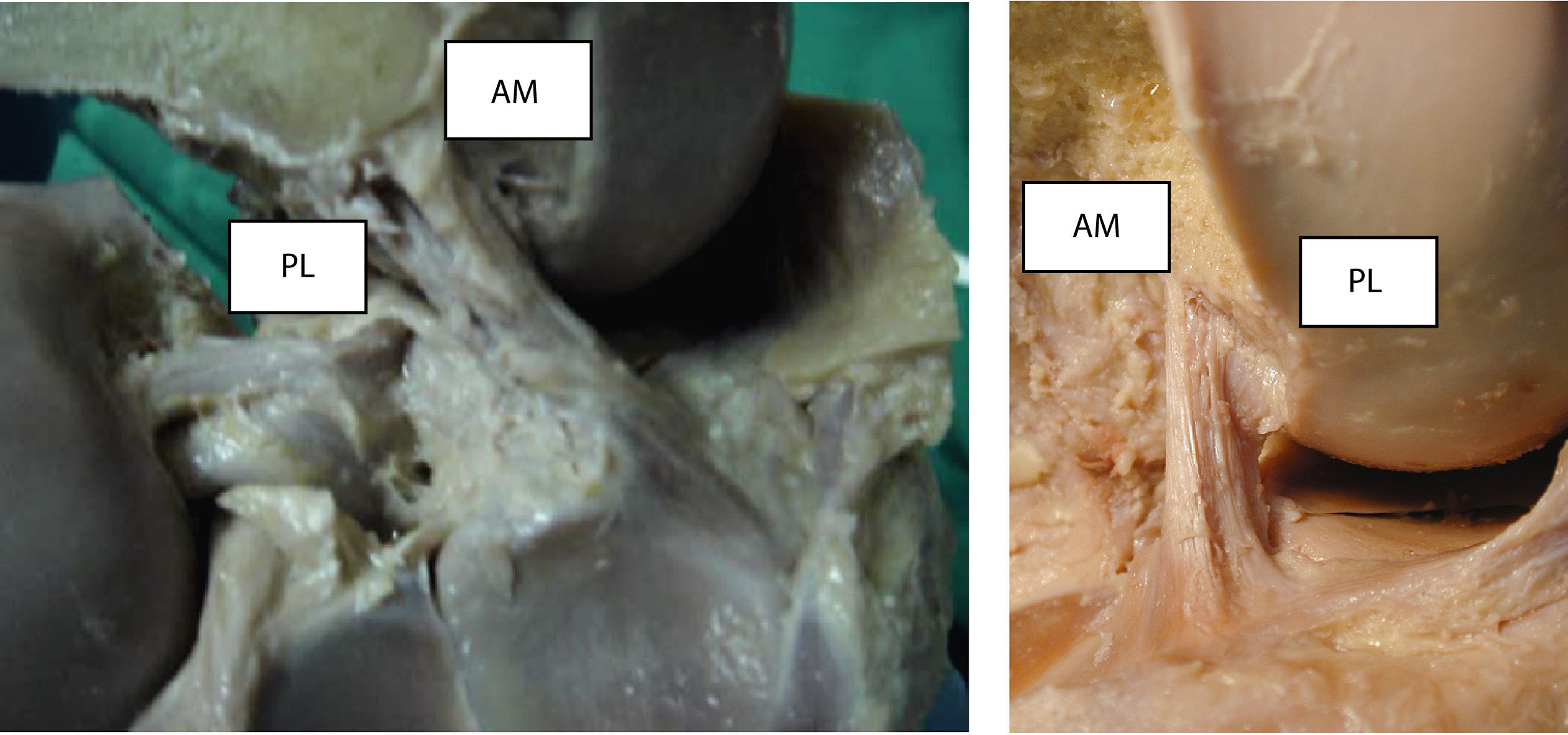
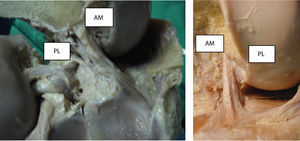
ResultadosEl LCA en su inserción tibial se ubica sobre la superficie preespinosa de la meseta tibial desde donde se dirige hacia arriba y atrás y hacia afuera para fijarse en la mitad posterior de la cara intercondílea del cóndilo femoral externo (fig. 1), con dos fascículos bien identificados: el fascículo anteromedial y el fascículo posterolateral.
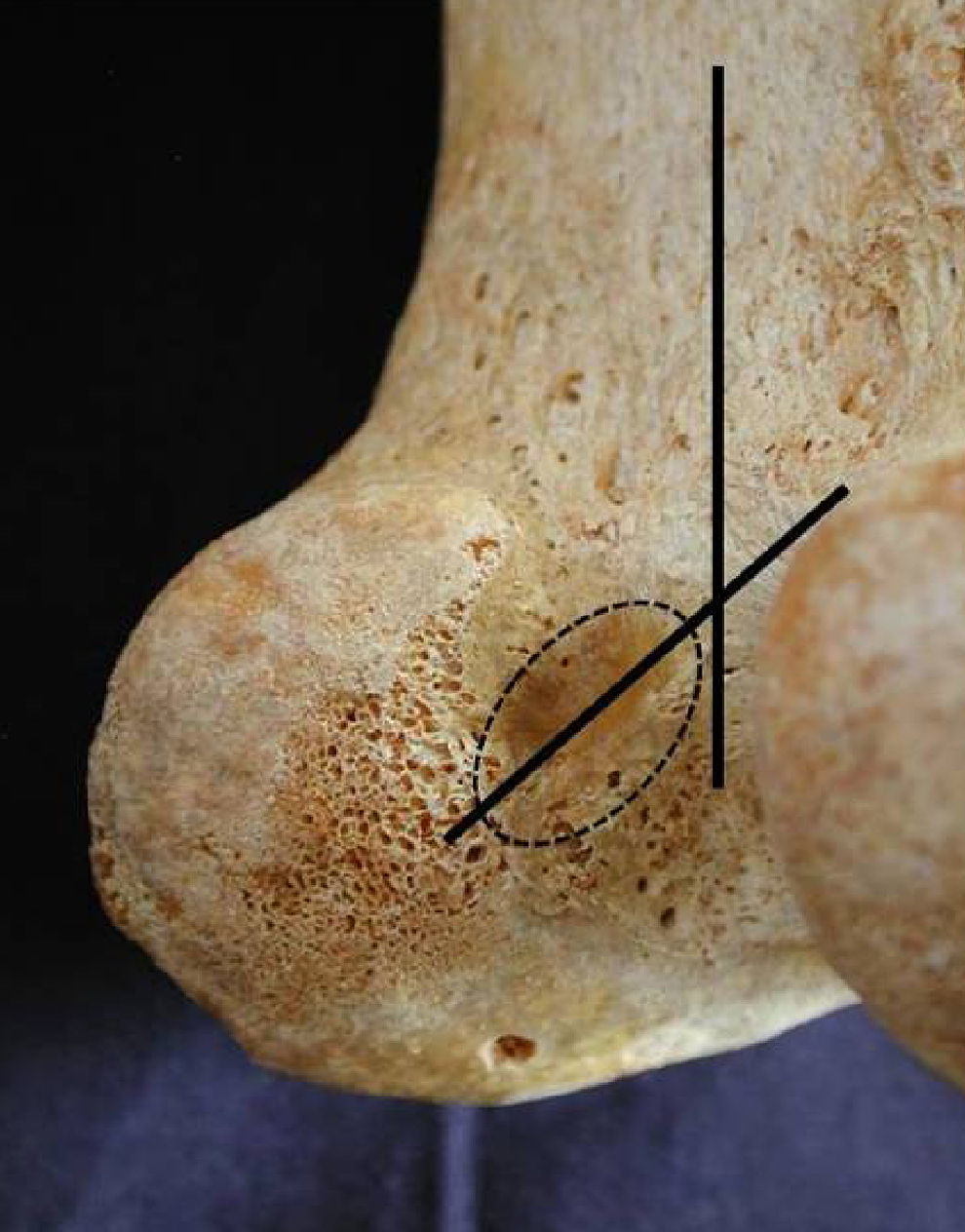
La unión osteoligamentosa en la inserción femoral se localizó en la parte posterior de la cara medial (intercondílea) del cóndilo femoral externo. Nuestros resultados muestran que la inserción femoral tiene forma semicircular en el 58% de los casos y ovoidea en el resto (62%), aunque con importantes variaciones individuales. El diámetro mayor se encontró en una disposición casi vertical. Las mediciones realizadas de esta inserción sobre los 50 fémures analizados nos dieron un diámetro mayor de 15±2,6mm de longitud y de 8±2,9mm de anchura.
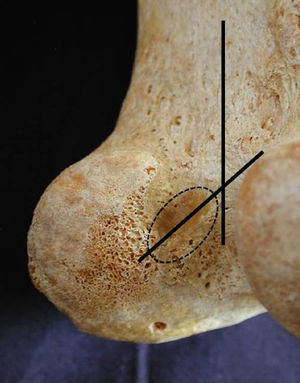
En la inserción femoral, los dos fascículos del LCA presentaban un ensanchamiento. El eje mayor de la superficie de inserción no se encontró en ningún caso paralelo al eje longitudinal del fémur de la cortical posterior, sino que forma un ángulo variable con valores entre 15 y 30° de inclinación (fig. 2) y con la zona de inserción a la mínima distancia del cartílago (3±0,9mm).
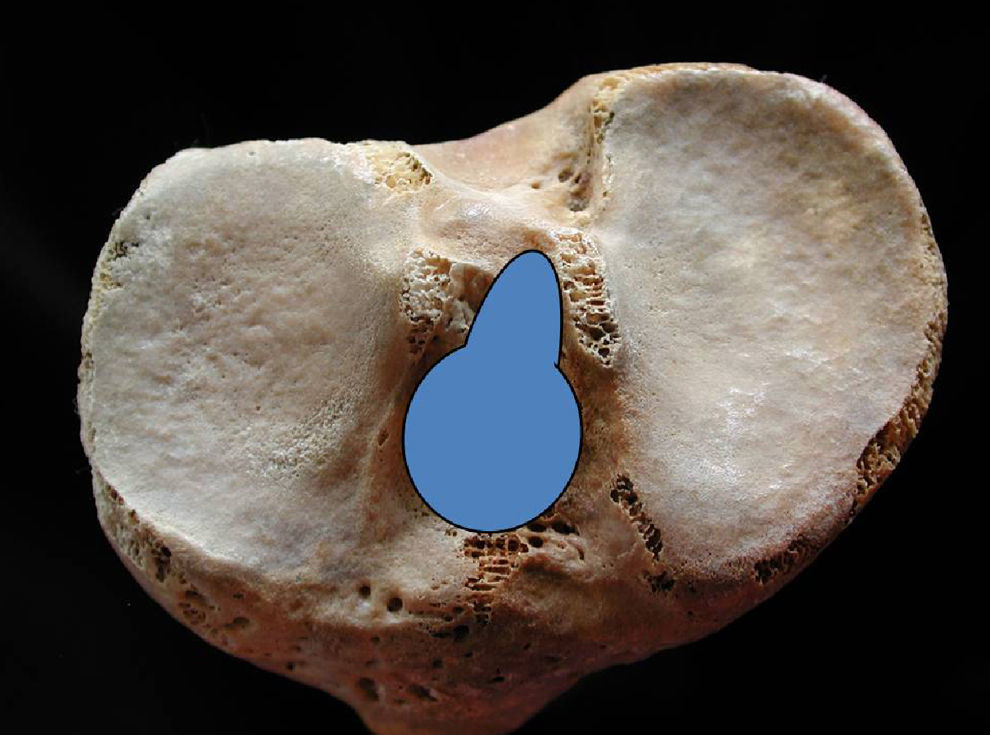
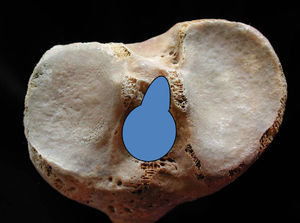
Desde la inserción femoral, el LCA se dirige hacia delante, medial y distal, abriéndose en abanico y aumentando su diámetro cuando llega a la superficie de inserción tibial (fig. 3) que se localiza en una fosa situada en la parte anterolateral de la espina con la referencia del cuerno anterior del menisco externo, al que envía algunas fibras de expansión.
Medidas en las 50 tibias las características morfológicas de la inserción del LCA, comprobamos que tiene forma piriforme, ovoidea o semitriangular, con la parte más ancha hacia delante, con un eje mayor oblicuo de delante a atrás y de fuera a dentro, que mide 15,8±1,9mm, y un eje menor que mide 11,6±2,2mm. La parte más anterior de la inserción tibial se encontró a 2,5±0,5mm por detrás de la inserción anterior del menisco externo.
Las mediciones de la longitud del LCA, una vez desinsertado de sus puntos de unión ósea, mostraron que el AM es diferente del PL, en que los valores medios son 34±4,5mm y 22±4mm respectivamente. El AM se originó en la parte más anterior y proximal del fémur y se inserta en la parte anterior de la espina tibial. Por su parte, el haz PL tiene un origen más distal y ligeramente posterior en el fémur para terminar disponiéndose en la tibia en una posición posterior en relación con el AM.
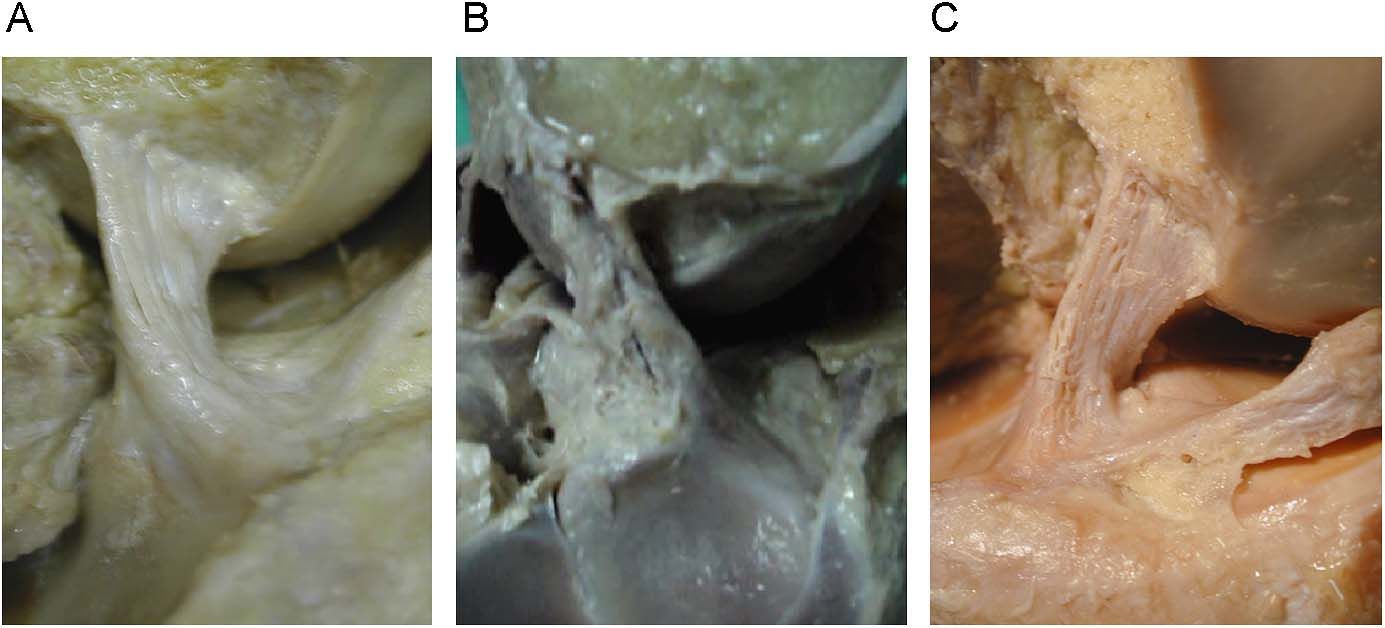
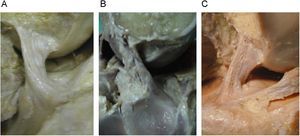
En una visión sagital, con la rodilla en extensión, los fascículos del LCA se disponen paralelos, produciéndose durante la flexión una ligera rotación del ligamento en torno a su eje longitudinal, cubriendo, entonces, el AM al resto del ligamento (fig. 4). En todas las preparaciones cadavéricas vimos que, con la rodilla en extensión, las fibras de los dos fascículos del LCA están paralelas y el fascículo PL está más tensionado que el AM.
Visión anterior (A) y lateral (B), del ligamento cruzado anterior con la rodilla en extensión donde se observa la mayor tensión de los fascículos posteriores (PL) y la amplia inserción anterior (en referencia del cuerno anterior del menisco externo) de las fibras del fascículo anteromedial.
Movilizando la rodilla en flexoextensión, la tensión del fascículo PL permanece alta hasta, aproximadamente, los 45° de flexión, mientras que colocando la rodilla a 90° de flexión las fibras posteriores se relajan y el fascículo anteromedial alcanza la máxima tensión. Los movimientos anatómicos realizados tras realizar la disección muestran que los alargamientos y tensiones del fascículo AM se acompañaban de forma sincrónica, armónica y constante de la relajación del PL.
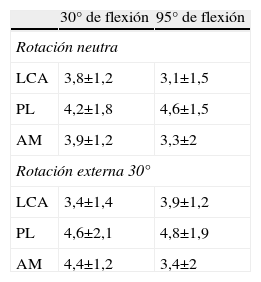
Respecto a la participación del LCA en los movimientos de rotación, con la rodilla cercana a los 30° de flexión, y la valoración de las tensiones tras la sección de los fascículos (tabla 1), comprobamos que la situación de la pierna en rotación interna incrementa la tensión del LCA más que en rotación externa.
Laxitud anteroposterior de las rodillas tras la sección de los fascículos
| 30° de flexión | 95° de flexión | |
| Rotación neutra | ||
| LCA | 3,8±1,2 | 3,1±1,5 |
| PL | 4,2±1,8 | 4,6±1,5 |
| AM | 3,9±1,2 | 3,3±2 |
| Rotación externa 30° | ||
| LCA | 3,4±1,4 | 3,9±1,2 |
| PL | 4,6±2,1 | 4,8±1,9 |
| AM | 4,4±1,2 | 3,4±2 |
AM: fascículo anteromedial; LCA: ligamento cruzado anterior; PL: fascículo posterolateral.
Tras la supuesta utilización de una técnica con un único túnel femoral, que de forma estándar es de 8mm de grosor, frente a otra de doble túnel femoral de 7 y 6mm, respectivamente, y que en ambos casos la profundidad de túnel es de 30mm, desde un punto de vista matemático y tras aplicar las fórmulas anteriormente citadas, obtuvimos que el volumen óseo a regenerar en los túneles o, lo que es lo mismo, el volumen de resección ósea en el monotúnel fue de 1.507,2μl y en el doble túnel, en total, de 2.001,7μl (1.153,9μl y 847,8μl en cada túnel). Por su parte, la superficie de contacto óseo o zona de contacto entre la plastia y el hueso fue, en el monofascículo, 753,6mm2 y en el doble fascículo en total, de 1.224,6mm2 (659,4mm2 y 565,2mm2 en cada túnel).
Estas determinaciones se pueden traducir clínicamente como que la realización de dos túneles independientes de 7 y 6mm de diámetro respectivamente, frente a un túnel único de 8mm, reseca un 32,8% más de hueso que con una técnica de túnel único, pero incrementa un 62,5% la superficie de contacto con la plastia.
Analizadas las fuerzas de la plastia en los dos túneles paralelos (fig. 5), se ocasionaba un ángulo de ataque α en el fascículo PL de unos 135°, por lo que al realizar la descomposición de fuerzas (como se explicó anteriormente) se ocasionaba una Ft o fuerza transversal de tracción tendente al roce y posible agrandamiento del orificio mayor que en el supuesto de un fascículo divergente (fig. 6) en el que dicha Ft será de 0, pues la fuerza siempre ira aplicada en el sentido del fascículo y del túnel. Por tanto, en nuestra técnica habrá un mayor índice de fricción o roce dependiente de dicho ángulo α.
La valoración de las fuerzas de tracción a través de las fijaciones determinará una menor fuerza de tracción del fascículo que presentaba un ángulo α de 135° (el PL) con la técnica del doble fascículo paralelo (F11), por lo que con un ángulo α de 135° estas tensiones soportadas en el doble fascículo paralelo representaban un 30% menos que en el doble fascículo divergente, a idéntica tracción del fascículo, por lo que dichas fijaciones tienen una menor carga cíclica o de tracción repetitiva.
DiscusiónEl LCA está formado por dos fascículos6–9, el AM, que se origina en las proximidades del cartílago articular y termina en la superficie preespinosa de la tibia y el PL, que se origina por debajo y detrás del anterior y termina en la tibia por detrás del AM. Otros autores definen el LCA formado por tres fascículos (AM, banda intermedia y PL)10–13. Nosotros no hemos podido establecer esa diferencia anatómica. En lo que respecta a las superficies de inserción, coincidimos con la mayoría de las publicaciones respecto al ensanchamiento del LCA, con una forma en embudo6,7,14,15 y un calibre entre 3 y 3,5 veces el grosor de la parte media del ligamento16.
La forma que adopta la inserción femoral, para unos autores, es semicircular y, para otros, oval1,17; en nuestro estudio es de forma semicircular en el 58% de los casos, con unos valores para el diámetro mayor de 15±2,6mm y un diámetro menor o anchura de 8±2,9mm, datos algo inferiores a los publicados que consideramos puede tener relación con las características antropométricas de la población. Coincidimos con la mayoría de los autores en que el eje mayor no es paralelo al eje longitudinal del fémur, aunque variable, entre 15 y 30° de inclinación18.
La inserción tibial se realiza en una pequeña fosita18 ligeramente por detrás de la inserción del cuerno anterior del menisco externo, de forma piriforme con la parte ancha hacia delante y ovoidea, con un eje mayor oblicuo de delante a atrás y de fuera a dentro que mide 15,8±1,9mm, y un eje menor de 11,6±2,2mm. Son valores ligeramente inferiores a los encontrados por otros autores debido, posiblemente, a las características de nuestra población. La localización de la inserción en la zona preespinal proporciona una situación anterior de las fibras más anteriores del fascículo AM que les condiciona una disposición horizontal.
La longitud del LCA, según la literatura6,10,12, presenta valores entre 22 y 41mm y de 7 a 12mm para la anchura. Los valores hallados en nuestras preparaciones son semejantes a los aportados previamente18, donde también se valoraba la longitud de los dos fascículos, con las fibras anteriores de 37±4mm que van disminuyendo de modo que las posteriores miden 24±4mm.
Cada fascículo tiene una función determinada en la estabilidad de la articulación de la rodilla6,19,20. Cuando la rodilla está en extensión, las fibras de los dos fascículos del LCA están paralelas y se encuentran en tensión, pero el fascículo PL está más tenso que el AM; esta tensión permanece alta en el PL hasta los 45° de flexión. Cuando colocamos la rodilla en flexión de 90°, las fibras posteriores se encuentran más relajadas y el fascículo AM se encuentra en máxima tensión. En general, el fascículo AM se tensa durante la flexión y el PL se relaja; mientras que en la extensión ocurre lo contrario10,21,22.
Los datos que hemos obtenido nos demuestran la importancia que tiene el LCA intacto en el control de la laxitud anteroposterior de la articulación de la rodilla y, de forma indirecta, su acción estabilizadora durante la rotación articular, habiendo comprobado que en rotación neutra, con la rodilla a 30° de flexión, la estabilidad en la rodilla del cadáver es proporcionada por ambos fascículos, principalmente por el AM, y con la rodilla en flexión de 95° el fascículo AM es mucho más importante. Esto pone de manifiesto que, con la rodilla en flexión de 30° o más, la laxitud generada es casi idéntica para los dos fascículos, lo que demuestra la importancia que tiene la sincronía de ambos fascículos en la estabilidad articular.
Teniendo en cuenta las limitaciones del estudio, al ser un análisis in vitro en el cadáver, las valoraciones de laxitud que hemos realizado también apoyan la idea de que ambos fascículos (AM y PL) se comportan de manera diferente; la sección del fascículo AM causa un cajón anterior positivo y un Lachmann negativo, mientras con la sección del PL sucede lo contrario23. Estos datos se comprobaron en la clínica24 al efectuar la reconstrucción aislada del fascículo AM, donde la laxitud anteroposterior sólo se reduce un 50–60% con la rodilla en flexión de 30°. Esto choca con la mayoría de las técnicas quirúrgicas actuales para la reconstrucción del LCA que se basan en una reconstrucción monofascicular, lo que funcionalmente suple al fascículo anteromedial que nunca podrá reproducir la función total del ligamento25,26.
Es cierto, sin embargo, que la reconstrucción bifascicular exige un exhaustivo y correcto conocimiento de la localización de las inserciones del LCA, pues la técnica se basa en la reproducción de dichas inserciones27. La amplia inserción tibial debe hacernos pensar sobre la localización del túnel quizá no tan posterior como es habitual, intentando localizarlo preespinalmente para así colocar el fascículo AM «horizontalizado y no verticalizado» por una disposición posterior. Del mismo modo, la imposibilidad de restaurar una cinemática normal en la rodilla, especialmente en el plano rotacional, tras la realización de técnicas monofasciculares, donde a pesar de cirugías realizadas por manos expertas se aprecia la imposibilidad de un control rotacional28,29, hace que la reconstrucción bifascicular del LCA deba ser tenida en cuenta hoy en día.
Como conclusión, el ligamento cruzado anterior está compuesto por dos fascículos bien diferenciados anatómica y funcionalmente, perfectamente reproducibles a través de un único orificio tibial, con un comportamiento de resistencia del sistema de fijación similar a la técnica estándar o monofascicular y, asimismo, con suficiente resistencia para el inicio de fisioterapia acelerada.
Declaración de conflicto de interesesLos autores han declarado no tener ningún conflicto de intereses.