Analizar las modificaciones del líquido sinovial (LS) en las afecciones articulares más frecuentes de la rodilla y establecer una relación en función de su concentración.
Material y métodosSe analizaron 62 muestras de LS de rodillas con afección meniscal (32), rotura del ligamento cruzado anterior (LCA) (17) y lesión condral aislada (13). De cada muestra se realizó un estudio cuantitativo y cualitativo de las citocinas (IL-1, IL-2, IL-6, IL-10, TNF-α) y factores de crecimiento (IGF-1, TGF-ß).
ResultadosEn la lesión del LCA, el ambiente del LS fue predominantemente anabólico e inflamatorio, con niveles elevados de IL1, IL6, significativos de TGF-ß (p=0,02 y p=0,004), IL-10 (p=0,046 y p=0,047) y significativamente disminuidos de TNF-α (p=0,02 y p=0,004). En la afección condral y meniscal, predominó un ambiente catabólico, con elevación significativa del TNF-α y disminución significativa del TGF-ß (p=0,02 y p=0,004). Las diferencias fueron mayores en el caso de la lesión condral aislada.
ConclusiónLos cambios observados señalan que en la lesión articular, además de la alteración biomecánica, el LS influye negativamente en la homeostasis articular, variando su composición según el tipo de afección.
To analyse the changes in synovial fluid (SF) in the most common knees joint diseases, and to establish a relationship according to its concentration.
Material and methodsA total of 62 synovial fluids were analysed from knees with, meniscus disease (32), anterior cruciate ligament (ACL) (17) and isolated chondral injury (13). A quantitative and quality study was performed on each sample, which included cytokines IL-1, IL-2, IL-6, IL-10, TNF-α, and growth factors, IGF-1 and TGF-ß).
ResultsThe SF environment in the ACL injury was mainly anabolic and inflammatory, with increased levels of IL1, IL6, significant levels of TGF-ß (P=.02 and P=.004), IL-10 (P=.046 and P=.047) and significantly decreased levels of TNF-α (P=.02 and P=.004). There was mainly a catabolic environment in chondral and meniscal disease, with a significant increase in TNF-α and a significant decrease in TGF-ß (P=.02 and P=.004). The differences were greater in the case of isolated chondral injury.
ConclusionThe changes observed show that, as well as the biomechanical changes, the SF has a negative effect on joint homeostasis, it composition varying depending on the type of pathology.
Sokoloff1 consideró al cartílago articular, el líquido sinovial, la membrana sinovial y el hueso subcondral como una unidad funcional a la que se deben añadir otros aspectos, como son el intercambio de oxígeno y de nutrientes y la liberación de hormonas y factores de crecimiento. Existe un interés creciente por desarrollar técnicas que protejan y reparen las lesiones del cartílago articular. Los estudios epidemiológicos señalan que aproximadamente el 6% de los adultos tienen una afección degenerativa de la rodilla, porcentaje que aumenta al 10% en personas mayores de 65 años2.
Desde un punto de vista bioquímico, el cartílago articular es un tejido capaz de sintetizar y degradar constantemente los componentes de la matriz extracelular. Los mecanismos de acción de los factores de crecimiento y las interleucinas (IL) potencian o inhiben la síntesis de los componentes de la matriz extracelular, y favorecen la actuación de moléculas que degradan el cartílago como son las proteasas o sus inhibidores tisulares3. Las propiedades mecánicas del cartílago varían cuando se producen alteraciones de las estructuras articulares como son la sección del ligamento cruzado anterior (LCA), una meniscectomía o la resección del platillo tibial4. El líquido sinovial (LS) que recubre las estructuras articulares de la rodilla es un dializado del plasma, secretado por la membrana sinovial, que en condiciones normales no contiene factores de coagulación, eritrocitos, ni hemoglobina, sin embargo presenta hialuronato y una glicoproteína lubricante llamada lubricina que reducen la fricción y lubrican la articulación5.
Con el avance de la biología molecular se han ido definiendo distintos patrones de expresión de proteínas y citocinas en el LS y se han relacionado con la degeneración articular. Las citocinas están implicadas en la inflamación y daño articular, por ello su concentración en el LS varía según el estado de la articulación. Las principales citocinas intraarticulares en el contexto de la inflamación articular son las interleucinas (IL)-1, 6 y 8, factor de necrosis tumoral-α (TNF-α), y el factor de granulocitos y macrófagos estimulante de colonias (GM-CSF). Igualmente, existen otros factores anabólicos como el factor de crecimiento derivado de la insulina (IGF) y el factor de crecimiento tisular-ß (TGF-ß), que también se expresan en el LS, y por lo tanto podemos analizar. Se admite que los principales efectos de los factores de crecimiento sobre los condrocitos son la estimulación de la síntesis de la matriz extracelular del cartílago y la inhibición o activación de las proteasas6.
Basándonos en la idea que la medición del balance anabólico-catabólico del LS traduce el ambiente y el estado de las estructuras a las que baña y viendo el LS como el lubricante natural del cartílago en las diartrodias, que transporta los elementos nutritivos y los residuos articulares, nos planteamos la hipótesis de que cada tipo de afección articular debe modificar la composición del LS de forma diferente, rompiendo el equilibrio metabólico y provocando un predominio de factores catabólicos y el objetivo de nuestro trabajo es analizar los factores de crecimiento y citocinas del LS en pacientes con diferentes afecciones (rotura de LCA, lesión meniscal o condropatía), y establecer una relación en función de su concentración.
Material y metodologíaEn una población de pacientes de una mutua de trabajo, tras firmar el consentimiento informado, se extrajo el líquido sinovial previo a la artroscopia de rodilla cuando iban a ser intervenidos de rotura del ligamento cruzado anterior (LCA), rotura meniscal o lesiones condrales, como consecuencia de una fractura de meseta tibial, osteotomías de rodilla o de una limpieza articular.
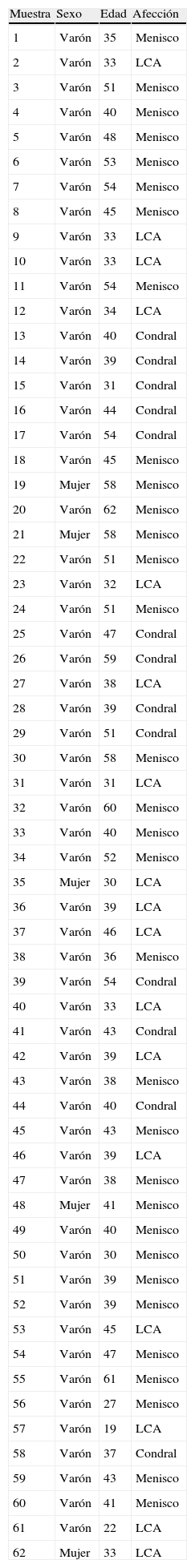
La demografía de la población estudiada queda reflejada en la tabla 1. La artrocentesis de la articulación de la rodilla se realizó en condiciones de esterilidad, en quirófano, con una jeringuilla de 10cc. Una vez obtenida la muestra se envió inmediatamente al laboratorio siguiendo el protocolo de conservación. Para evitar manipulaciones y la contaminación de las muestras, se mantuvieron en la misma jeringuilla, conservándose a 4°C, sin llegar a superar las 72 horas en la nevera.
Población estudiada
| Muestra | Sexo | Edad | Afección |
| 1 | Varón | 35 | Menisco |
| 2 | Varón | 33 | LCA |
| 3 | Varón | 51 | Menisco |
| 4 | Varón | 40 | Menisco |
| 5 | Varón | 48 | Menisco |
| 6 | Varón | 53 | Menisco |
| 7 | Varón | 54 | Menisco |
| 8 | Varón | 45 | Menisco |
| 9 | Varón | 33 | LCA |
| 10 | Varón | 33 | LCA |
| 11 | Varón | 54 | Menisco |
| 12 | Varón | 34 | LCA |
| 13 | Varón | 40 | Condral |
| 14 | Varón | 39 | Condral |
| 15 | Varón | 31 | Condral |
| 16 | Varón | 44 | Condral |
| 17 | Varón | 54 | Condral |
| 18 | Varón | 45 | Menisco |
| 19 | Mujer | 58 | Menisco |
| 20 | Varón | 62 | Menisco |
| 21 | Mujer | 58 | Menisco |
| 22 | Varón | 51 | Menisco |
| 23 | Varón | 32 | LCA |
| 24 | Varón | 51 | Menisco |
| 25 | Varón | 47 | Condral |
| 26 | Varón | 59 | Condral |
| 27 | Varón | 38 | LCA |
| 28 | Varón | 39 | Condral |
| 29 | Varón | 51 | Condral |
| 30 | Varón | 58 | Menisco |
| 31 | Varón | 31 | LCA |
| 32 | Varón | 60 | Menisco |
| 33 | Varón | 40 | Menisco |
| 34 | Varón | 52 | Menisco |
| 35 | Mujer | 30 | LCA |
| 36 | Varón | 39 | LCA |
| 37 | Varón | 46 | LCA |
| 38 | Varón | 36 | Menisco |
| 39 | Varón | 54 | Condral |
| 40 | Varón | 33 | LCA |
| 41 | Varón | 43 | Condral |
| 42 | Varón | 39 | LCA |
| 43 | Varón | 38 | Menisco |
| 44 | Varón | 40 | Condral |
| 45 | Varón | 43 | Menisco |
| 46 | Varón | 39 | LCA |
| 47 | Varón | 38 | Menisco |
| 48 | Mujer | 41 | Menisco |
| 49 | Varón | 40 | Menisco |
| 50 | Varón | 30 | Menisco |
| 51 | Varón | 39 | Menisco |
| 52 | Varón | 39 | Menisco |
| 53 | Varón | 45 | LCA |
| 54 | Varón | 47 | Menisco |
| 55 | Varón | 61 | Menisco |
| 56 | Varón | 27 | Menisco |
| 57 | Varón | 19 | LCA |
| 58 | Varón | 37 | Condral |
| 59 | Varón | 43 | Menisco |
| 60 | Varón | 41 | Menisco |
| 61 | Varón | 22 | LCA |
| 62 | Mujer | 33 | LCA |
LCA: ligamento cruzado anterior.
Se obtuvieron 62 muestras útiles de líquido sinovial. Según la afección, 32 correspondieron a lesión meniscal, 17 fueron por rotura del LCA, y 13 por lesión condral como único diagnóstico. Se analizó cuantitativa y cualitativamente la presencia de citocinas (IL-1, IL-2, IL-6, IL-10, TNF-α) y de factores de crecimiento (IGF-1, TGF-ß) en el líquido sinovial (LS).
Excluimos del estudio los pacientes que no firmaron el consentimiento informado, padecían alguna lesión combinada de la rodilla, presentaban alteraciones degenerativas, habían padecido traumatismos previos en cualquiera de las dos extremidades, presentaban ángulos en varo o en valgo superiores a 10°, o habían sido intervenidos de la rodilla contralateral, por la sobrecarga mecánica que podían producir sobre la rodilla estudio.
En la fase de lectura del LS se realizó una concentración de cada muestra (1:100) en tubos de 5cc (Centricon®, Millipore) para el estudio cualitativo y cuantitativo de las moléculas. Para ello efectuamos la técnica de ELISA (Enzyme-linked Immunosorbent Assay) con el fin de analizar los factores de crecimiento (IGF-1, TGF-ß) y las citocinas (IL-1, IL-2, IL-6, IL-10, TNF-α) presentes en las muestras (Kit de detección de anticuerpos BioLegend®, San Diego, CA. EE.UU.). Se incubó el líquido sinovial con los anticuerpos de captura, durante 16 horas, siguiendo las instrucciones del proveedor, para bloquear y detectar las uniones específicas. La detección de onda y lectura de la placa se realizó en un equipo Tecan® (Sunrisebasic™, Männedorf, Suiza) a 540nm de longitud de onda. El análisis estadístico de los datos obtenidos se realizó con el programa SPSS 16.0. Se obtuvo la descriptiva de los resultados, y se buscaron diferencias estadísticamente significativas (p=0,05) con el método U de Mann-Withney.
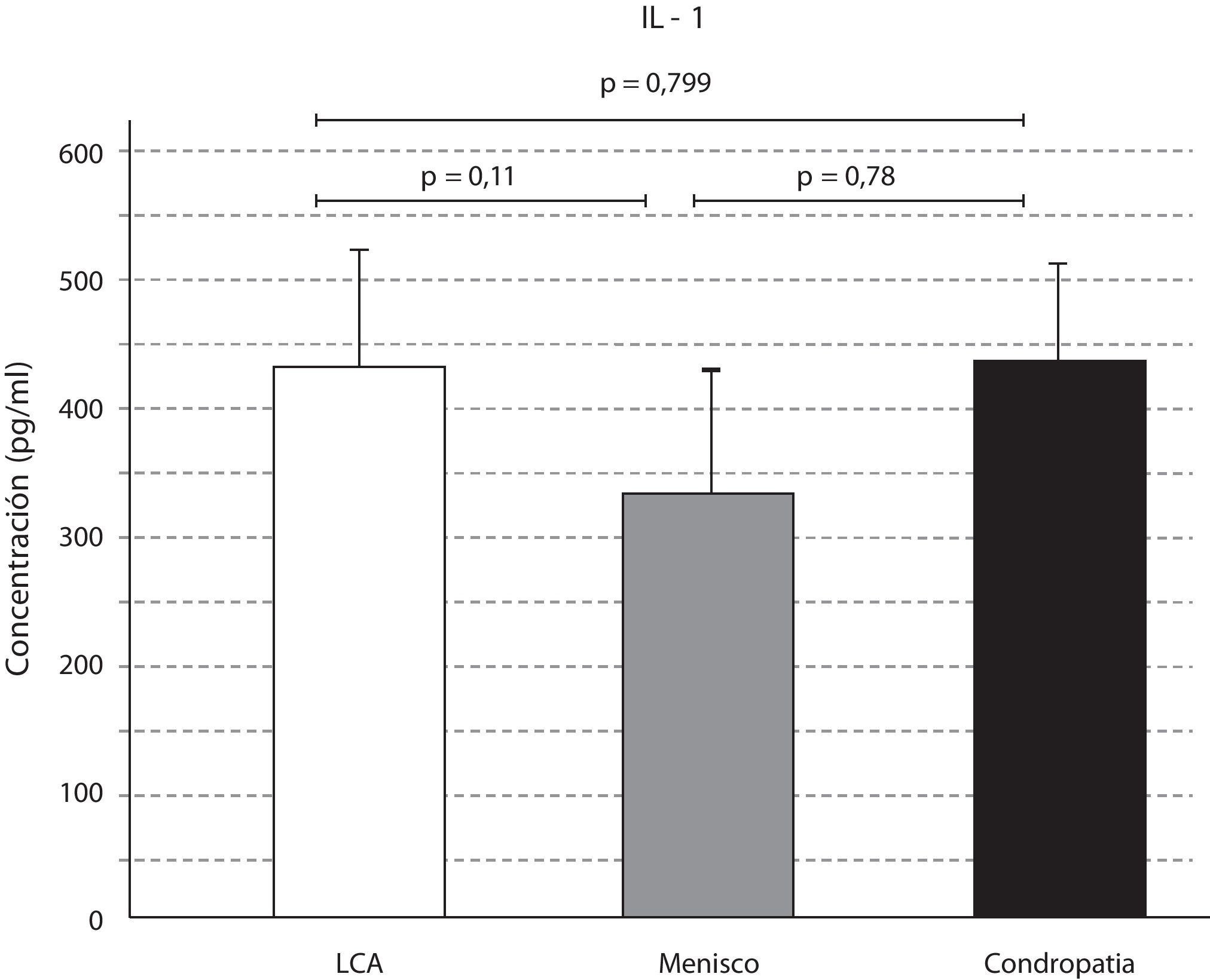
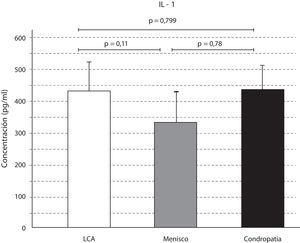
ResultadosEl análisis de las citocinas varió según la afección articular. Los niveles de IL-1 fueron mayores en las afecciones del LCA y la lesión condral, respecto a la lesión meniscal. Sin embargo, las diferencias no resultaron significativas (p=0,799) (p=0,11) (p=0,78) (fig. 1).
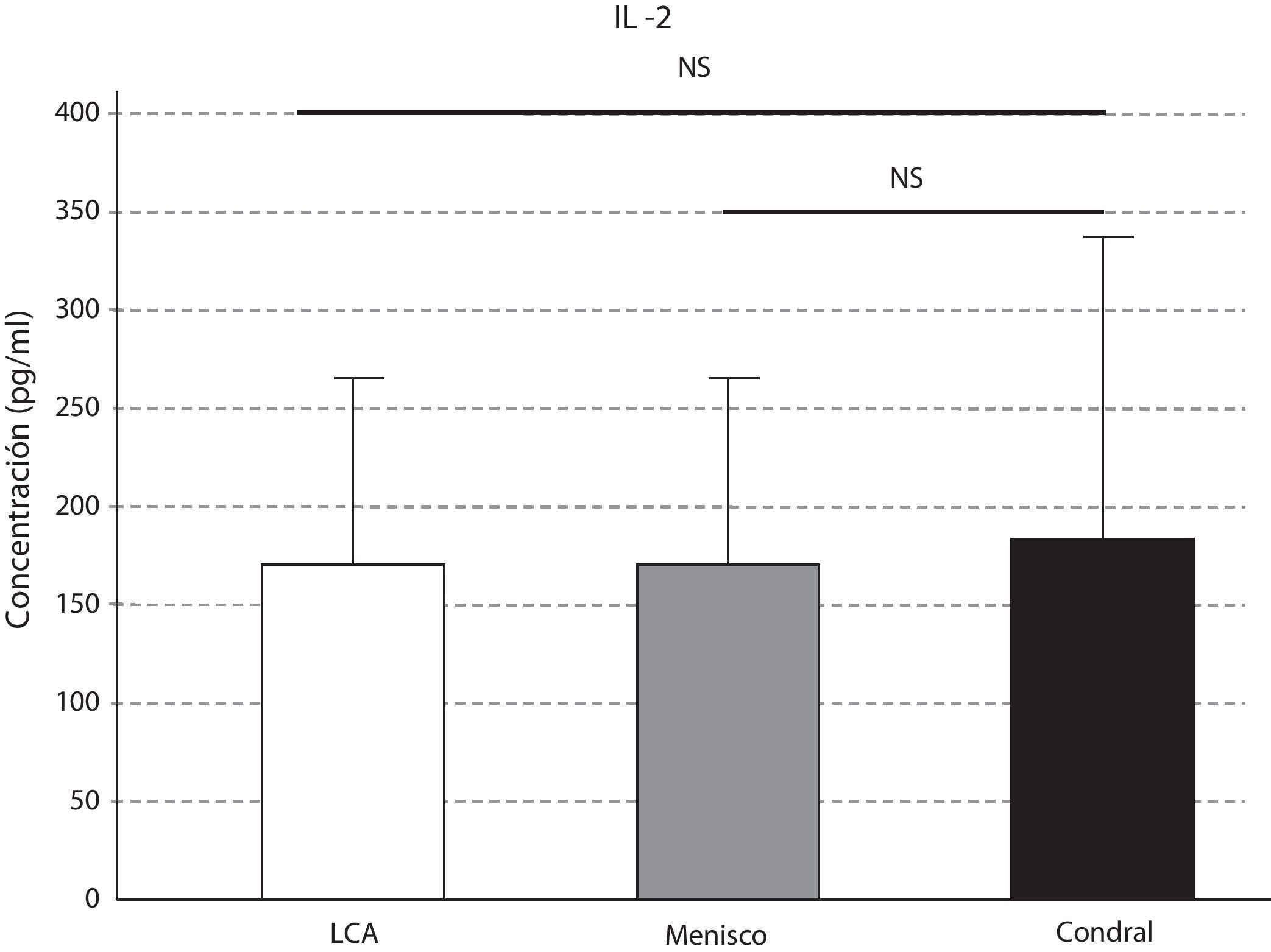
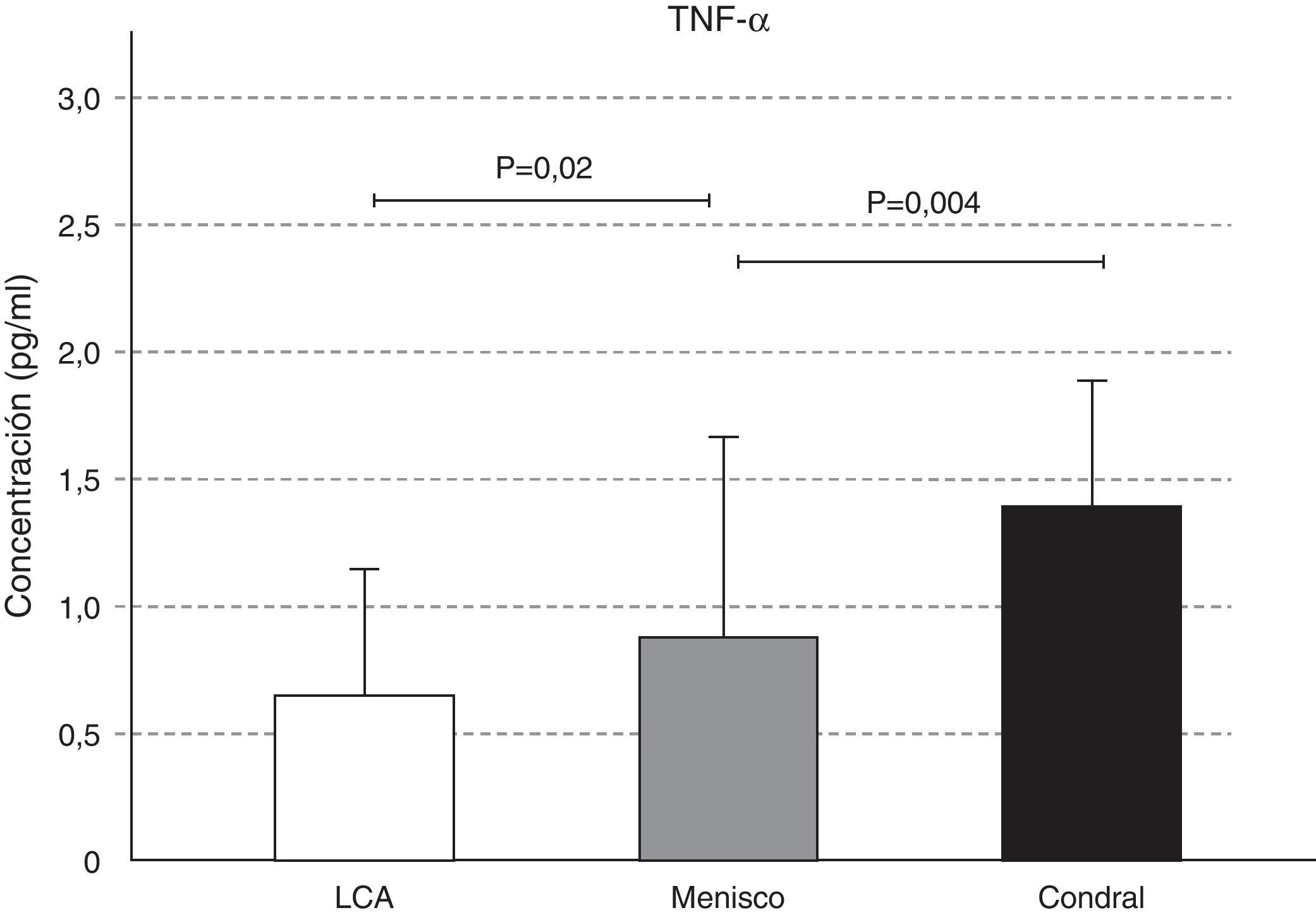
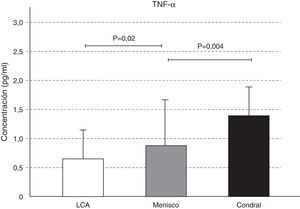
Las concentraciones de IL-2 y de TNF-α aumentaron en la afección condral, seguida de la meniscal y, por último, en la lesión del LCA; estas diferencias fueron significativas en el caso del TNF-α. Observamos un aumento significativo de la concentración del TNF-α en el líquido sinovial de la lesión meniscal respecto a la del LCA (p=0,02), y de la lesión condral con relación a la meniscal (p=0,004) (figs. 2 y 3).
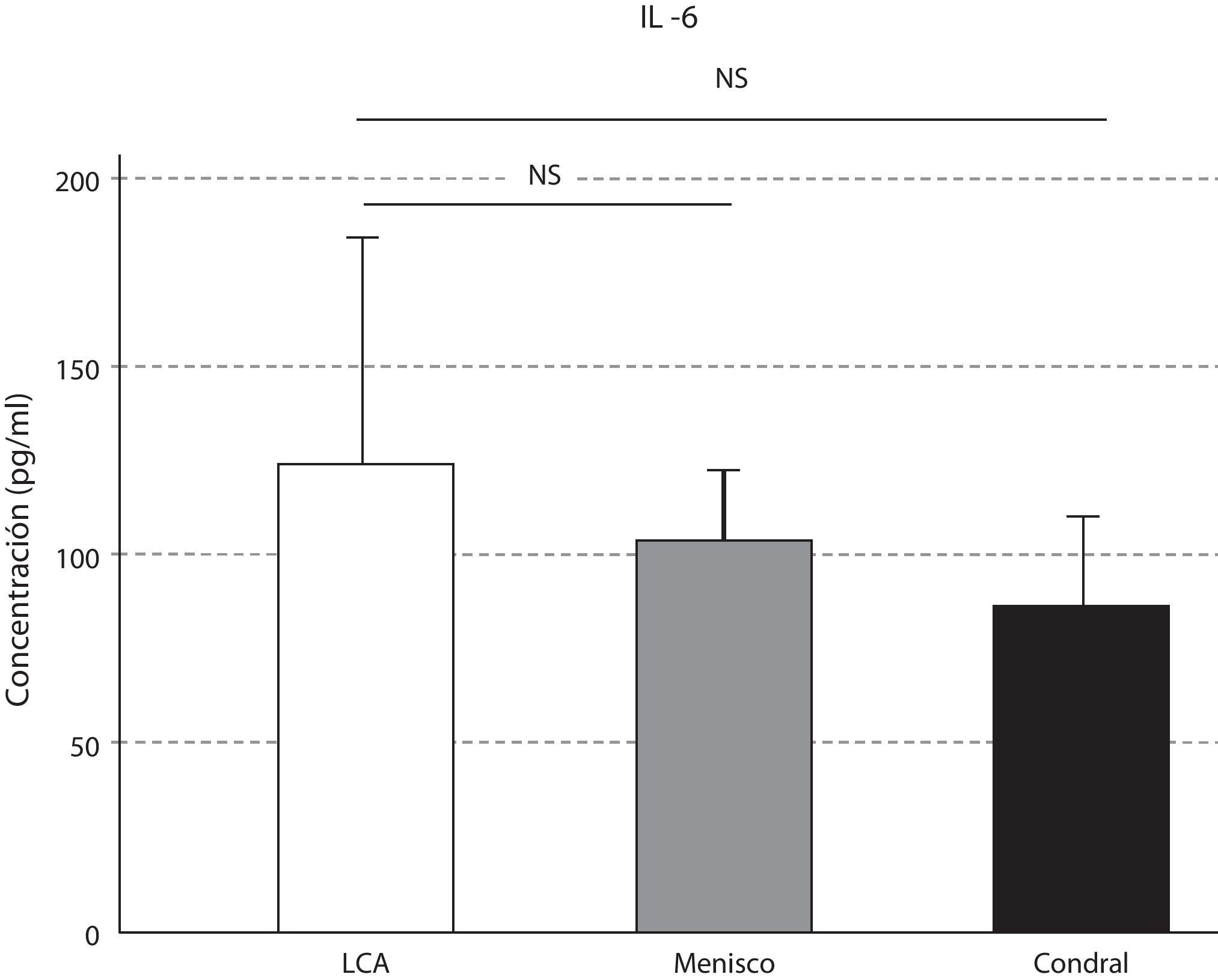
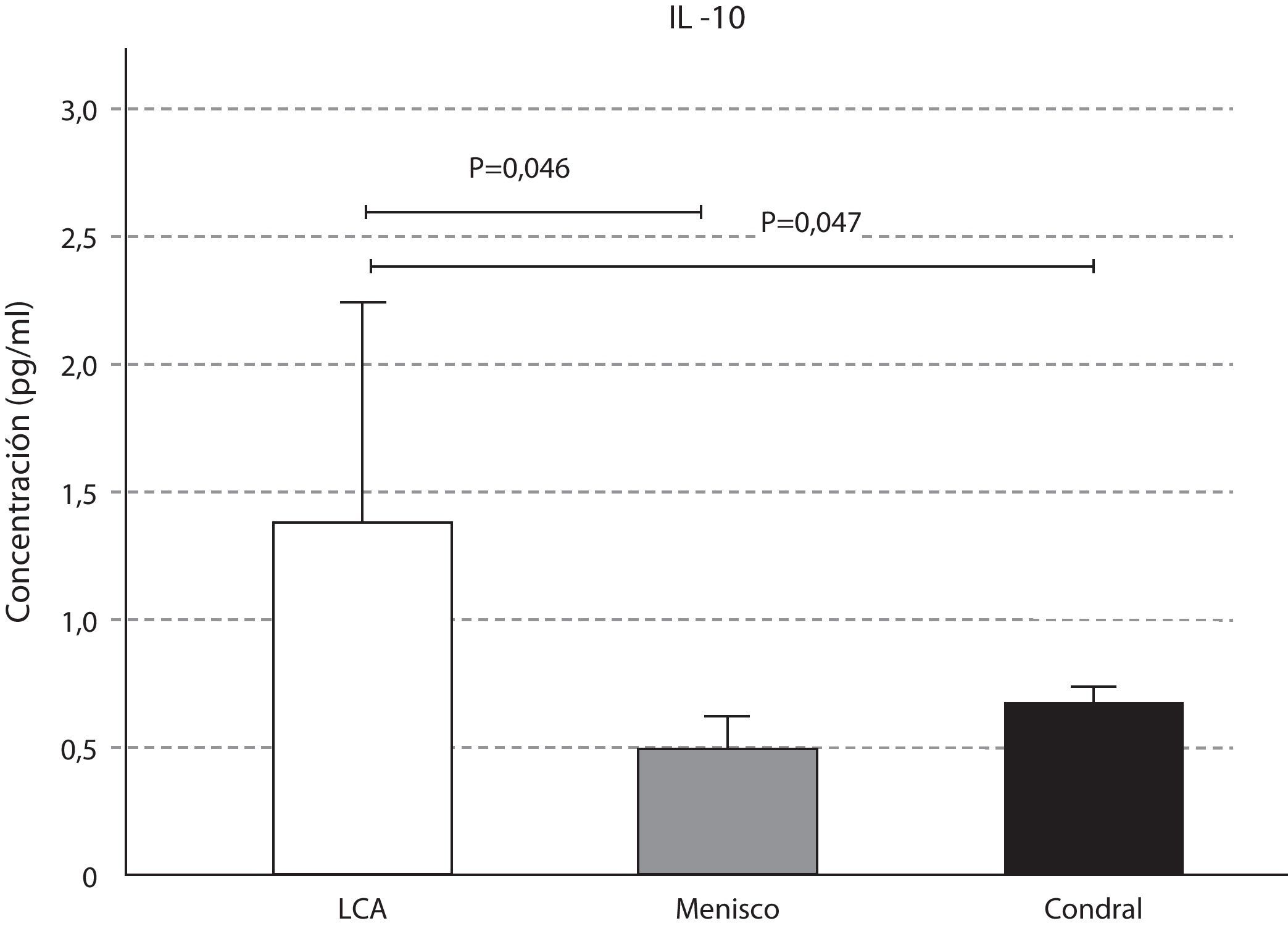
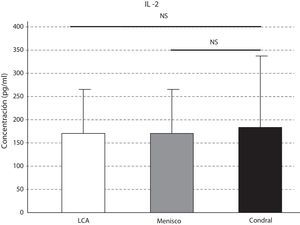
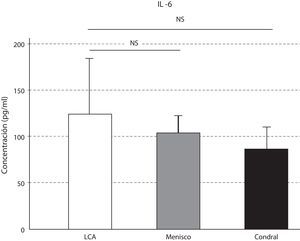
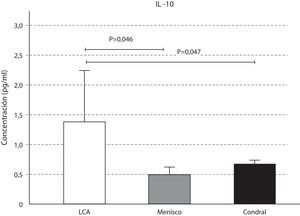
Las concentraciones de IL-6 se comportaron como las de la IL-10, que fueron mayores en la lesión del LCA respecto a la meniscal y la condral; sin resultar estas variaciones significativas (p>0,05) (fig. 4). Los niveles de IL-10 resultaron significativamente mayores en la lesión del LCA respecto al menisco (p=0,046), y respecto a la lesión condral (p=0,047) (fig. 5).
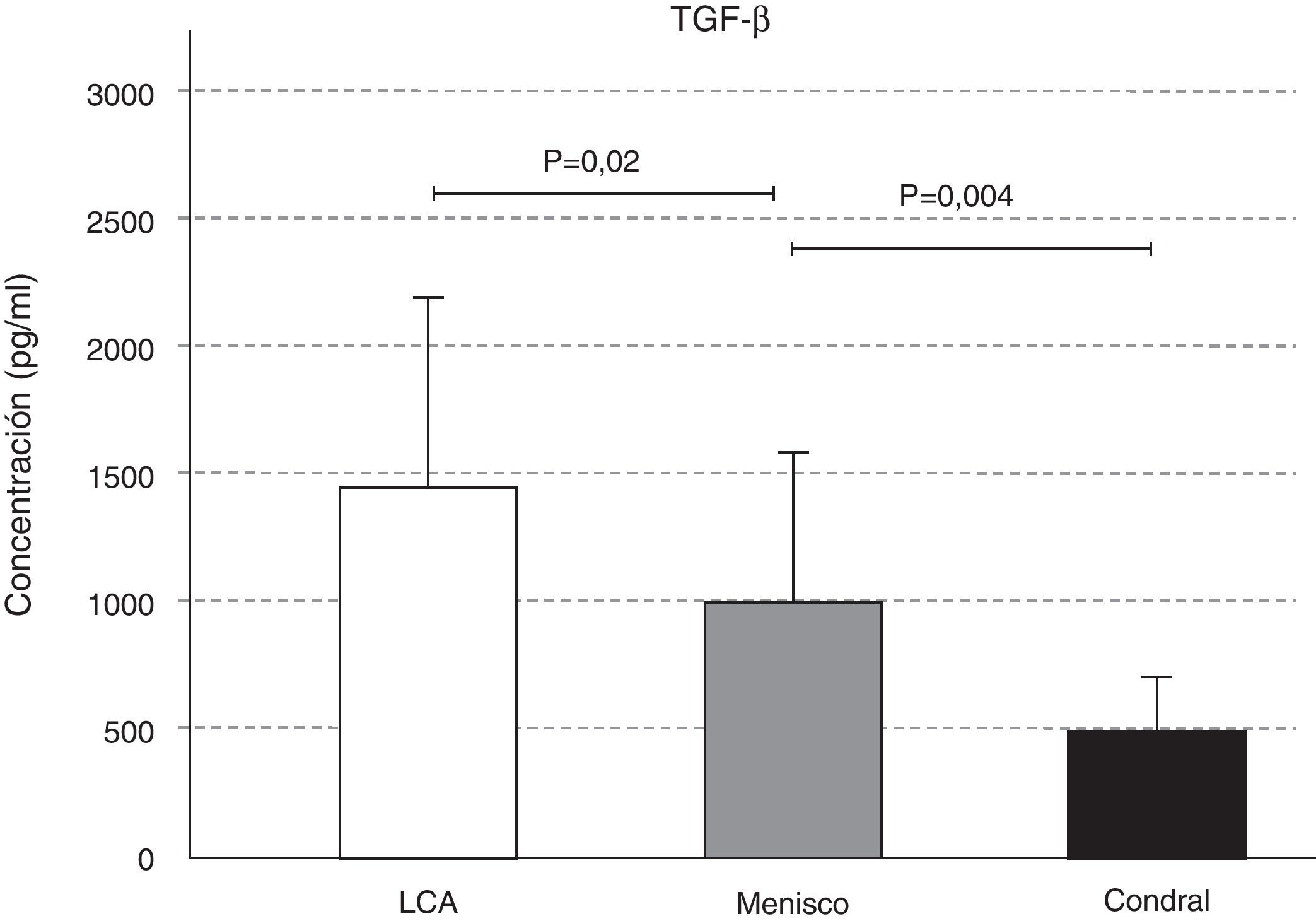
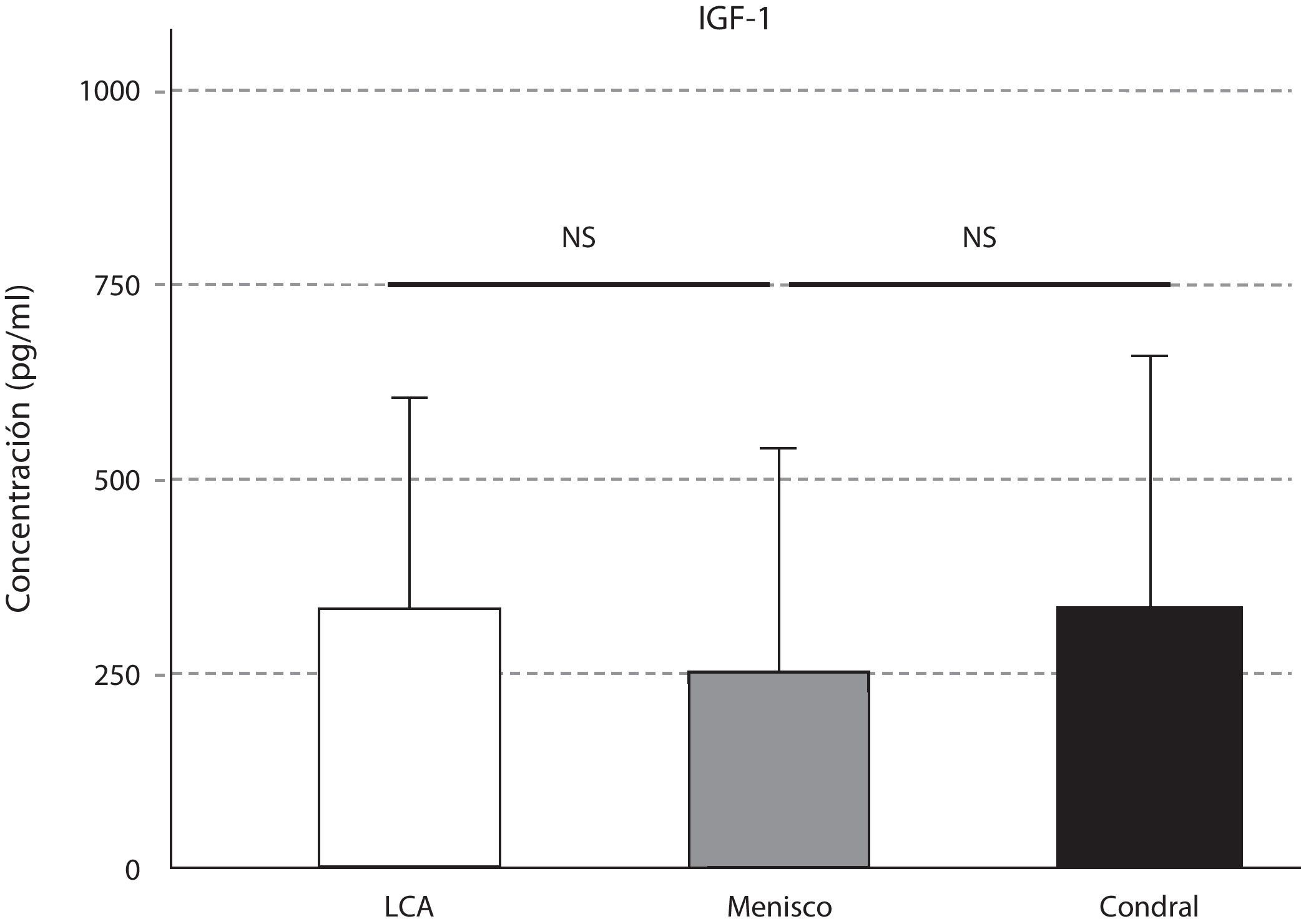
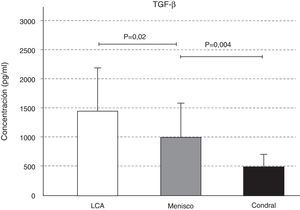
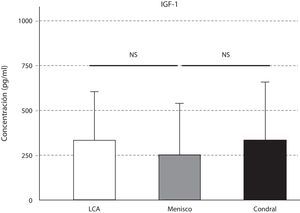
La expresión de TGF-ß se comportó de manera similar a la IL-10; se detectó mayor cantidad de TGF-ß en la afección ligamentosa, seguida de la meniscal (p=0,02), y de la condral (p=0,004) (fig. 6). La pequeña variación en la concentración de IGF-1 en las tres afecciones no fue significativa (fig. 7).
Por lo tanto, en la afección del LCA el microambiente del LS fue predominantemente anabólico e inflamatorio, con niveles elevados de IL1, IL6, significativos de TGF-ß, IL-10 y significativamente disminuidos de TNF-α. En la afección condral y meniscal, predominó un ambiente catabólico, de degeneración; con elevación significativa del TNF-α y disminución significativa del TGF-ß. Las diferencias fueron mayores en el caso de la lesión condral aislada.
DiscusiónEl análisis del líquido sinovial ha sido un procedimiento para el diagnóstico de las afecciones reumáticas. Ropes y Bauer7 puntualizaron las diferencias de apariencia y contenido celular del líquido sinovial patológico y lo relacionaron con diferentes enfermedades, distinguiendo las formas inflamatorias y no inflamatorias de la artritis reumatoide. Hollander et al.8 promulgaron el uso rutinario del análisis del líquido sinovial como ayuda al diagnóstico, documentando en detalle los principales hallazgos del líquido en las diferentes formas de artritis e introduciendo el término «synovianalysis». Más tarde, Shmerling et al.9 clasificaron algunas enfermedades con el recuento total y diferencial de los leucocitos. Amiel et al.10 realizaron un estudio experimental en rodillas de conejos, utilizando un precursor de colágeno marcado radioactivamente (prolinatritiada) y encontraron que el flujo de nutrientes, a través del líquido sinovial, es necesario para los ligamentos y los meniscos, y que la cantidad de nutrientes secretados por la sinovial se correlaciona con la exposición que los ligamentos y meniscos tienen al líquido sinovial. Apoyados en la idea que el ambiente mecánico afecta el desarrollo y maduración del tejido cartilaginoso en reparación y que las sustancias secretadas por los sinoviocitos en el líquido sinovial afectan al ambiente articular, incluido el cartílago; Vasara et al.11 confirmaron la hipótesis que los niveles de marcadores catabólicos del líquido sinovial eran mayores en pacientes con lesiones cartilaginosas, que en pacientes con otro tipo de afección de rodilla no cartilaginosa.
Se ha demostrado que a pesar de la reparación de la biomecánica articular de la rodilla12 no se evita la evolución hacia la degeneración articular de la rodilla. Por lo tanto, además de una causa mecánica influye la interacción de los factores anabólicos y catabólicos del líquido sinovial. Little et al.13 señalaron que la iniciación de la degeneración focal del cartílago en la artrosis se debe a diferencias regionales en la respuesta a las citocinas catabólicas. Por su parte, Higuchi et al.14 sugirieron que debe existir un factor añadido a la alteración biomecánica responsable de los cambios artrósicos en la rodilla tras la lesión del LCA, siendo, posiblemente, la concentración de citocinas del líquido sinovial el factor más importante de la degradación del cartílago.
Como biomarcadores de la actividad metabólica de la articulación nos hemos centrado en la IGF-1 y la TGF-ß, las interleucinas (IL1, IL2, IL6, IL10) y el TNF-α.
El IGF-I es el principal factor anabólico en el líquido sinovial15 que estimula la síntesis de proteoglicanos, colágeno II e integrinas, a la vez que inhibe la destrucción de la matriz extracelular. En nuestro trabajo los niveles de IGF-1 no difirieron significativamente según el tipo de afección. Aumentaron ligeramente en la afección asociada a la lesión del cruzado anterior y la afección condral. En el estudio de Vasara et al.11 los niveles de IGF-1 también estaban aumentados en el LS de rodillas con lesiones cartilaginosas, respecto al grupo control. Esta regulación al alza de la IGF-1 contribuye a la producción de matriz extracelular y en la remodelación de la misma.
Se ha comprobado que el TGF-ß estimula la síntesis de proteoglicanos en cartílago normal, y en cultivo de cartílago artrósico humano16. El TGF-ß tiene una fuerte acción antiinflamatoria, y está implicado en el desarrollo de fibrosis en los procesos de inflamación crónica. En el estudio, encontramos diferencias estadísticas respecto a los niveles de TGF-ß según la afección, aumentando en la rotura del LCA, respecto a la del menisco y a la lesión condral aislada. Esto es debido a que en la rotura del LCA se afecta la vascularización del mismo, y en los casos en que se produce un arrancamiento también se altera el tejido óseo de la espina tibial, lo cual provoca un sangrado en la articulación. Este sangrado articular no ocurre en la rotura del menisco ni en la lesión condral superficial. En el hemartros viajan factores de crecimiento que responden al tipo de lesión y potencian su reparación.
Las interleucinas con acción catabólica más importante o relevante en el cartílago articular son la IL-1, IL-6 y el TNF-α17. Igualmente analizamos la IL-10 porque en el contexto de la inflamación regula la respuesta del resto de las interleucinas.
La IL-1 es producida por los condrocitos y se relaciona con la destrucción del tejido cartilaginoso por lisis de la matriz, al acelerar la degradación de los proteoglicanos y disminuir los mecanismos de regeneración, inhibiendo la proliferación de los condrocitos y la síntesis de los proteoglicanos18. En nuestro estudio se confirmó la elevación de IL-1 en las tres patologías estudiadas, especialmente en la lesión del LCA y en la lesión condral. Como mediador de la inflamación sus niveles están elevados en el LS tras el daño articular. Así lo describe Irie et al.19, en su estudio, donde la concentraciones de IL-1 aumentaron en presencia de lesión meniscal y con rotura del LCA.
La sobreexpresión de factores catabólicos como IL-1 y TNF-α, parece influir en la etiopatogenia de la degeneración cartilaginosa20. En general, en las articulaciones artrósicas aumentan los niveles de citocinas inflamatorias21. Este hecho también queda plasmado en el estudio, con el aumento de la IL-1 y el TNF-α en la afección de tipo condral.
La IL-2 es necesaria para el establecimiento de la memoria inmunitaria celular, así como para el reconocimiento de autoantígenos y antígenos foráneos. Hemos demostrado como los niveles de IL-2 y TNF-α siguen un patrón de fluctuación similar según el tipo de afección articular. La IL-6, junto con la IL-1 y el TNF-α son los responsables de regular la fase aguda de la respuesta inflamatoria.
En la afección del LCA, el ambiente del LS fue predominantemente anabólico e inflamatorio, con niveles elevados de IL1, IL6, y significativos de TGF-ß (p=0,02 y p=0,004) e IL-10 (p=0,046 y p=0,047). Cuellar et al.22 demostraron que la elevación de las citocinas IL-1ß, IL-6, TNF-α y MCP-1 o proteína quimiotáctica del monocito tipo 1, tenía una correlación positiva y estadísticamente significativa respecto a los resultados de dolor agudo de rodilla y lesión meniscal, con una sensibilidad y especificidad del 100%; superando a la imagen de RNM y comparado con el patrón de referencia de los resultados intraoperatorios. Higuchi et al.14 demostraron que la concentración de IL-6 permanecía elevada en el líquido sinovial de la rodilla con lesión del LCA durante las 50 semanas tras la lesión. A partir de ese momento la concentración de IL-6 disminuía.
El factor de necrosis tumoral-α (TNF-α) junto con la IL-1, son dos citocinas proinflamatorias que contribuyen a la disregulación de la función de los condrocitos y llevan a una degradación progresiva de la matriz cartilaginosa y pérdida de la función articular23. Si bien el TNF-α estimula la producción de metaloproteinasas (MMP) y permite la degradación del cartílago, es lógico observar cómo sus mayores concentraciones se encontraron en la lesión condral seguido de la lesión meniscal (p=0,004) y por último, de la lesión del LCA (p=0,02).
La expresión de las citocinas y factores de crecimiento del LS en el contexto de la lesión del LCA traduce un ambiente inflamatorio, pero anticatabólico y proestimulante de los fibroblastos como, también, se ha señalado en la literatura19,24,25. El contexto del LS de la lesión meniscal, rico en IL-2 y TNF-α, traduce un ambiente inflamatorio y degenerativo en la articulación y, por último, en el LS de la lesión condral, encontramos las mayores concentraciones de IL-1, IL-2 y TNF-α y los menores niveles de IL-6 y TGF-ß. Esta situación traduce degeneración de los condrocitos, pérdida de las fibras de colágeno, sin un estímulo formador por parte de los fibroblastos. En la lesión condral los resultados son similares a los de Marks et al.26, donde observaron que el perfil de citocinas en el líquido sinovial de rodillas con lesión del LCA difería según el grado de lesión del cartílago. El aumento de la concentración de IL-1ß y de TNF-α se correlacionó significativamente con el grado de destrucción del cartílago y con el tiempo transcurrido desde la lesión inicial26.
Por lo tanto, la elevación de las citocinas no es el único causante del daño articular; si no que además se ha demostrado, que éstas inhiben la síntesis de otros proteoglicanos, factores de crecimiento y del colágeno II27. Además, la alteración en la regulación de la síntesis (anabólica) y la actividad de reabsorción (catabólica) en el líquido sinovial, provoca el deterioro de las propiedades funcionales y estructurales del cartílago y la pérdida neta de los componentes de la matriz cartilaginosa. De hecho, existe una evidencia creciente, que determinadas citocinas desempeñan una función en la inflamación articular y en la pérdida fisiopatológica del cartílago articular dentro de las articulaciones enfermas o dañadas28.
Las limitaciones de este estudio son las propias de un ensayo experimental in vitro, en el que se ha realizado una selección de las muestras. Las técnicas in vitro permiten realizar una investigación cualitativa en condiciones controladas. La selección de las afecciones se realizó para que cada grupo de muestras fuera lo más homogéneo posible entre sí, y la ausencia de grupo control se descartó por la falta de obtención del consentimiento informado de los pacientes ante el hecho de realizar una artrocentesis en la rodilla sana contralateral. Respecto a la selección de las citocinas estudiadas, hemos tomado los biomarcadores que más atención han recibido en el contexto de la inflamación articular.
Ningún trabajo hasta ahora ha comparado los diferentes ambientes articulares en las afecciones más frecuentes de la rodilla. En este estudio hemos demostrado la hipótesis planteada, y pensamos que las citocinas inflamatorias pueden ser un factor de riesgo añadido en el desarrollo de la artrosis, y que además este factor de riesgo varía según el tipo de lesión articular.
Las futuras líneas de investigación pueden ir encaminadas a la utilización de factores de crecimiento que estimulen la formación de cartílago hialino, y al uso de la terapia génica como instrumento para neutralizar a los inhibidores que bloquean a las citocinas inflamatorias, como la IL-1ra, con el fin último de restaurar el balance biológico articular. La alteración homeostática del LS es un factor de riesgo añadido a la alteración biomecánica y funcional que sufre la rodilla cuando se alteran sus estructuras estabilizadoras y que se agrava con la evolución.
Nivel de evidenciaNivel de evidencia: III.
Responsabilidades éticasProtección de personas y animales. Los autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.Confidencialidad de los datos. Los autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes y que todos los pacientes incluidos en el estudio han recibido información suficiente y han dado su consentimiento informado por escrito para participar en dicho estudio.Derecho a la privacidad y consentimiento informado. Los autores han obtenido el consentimiento informado de los pacientes y/o sujetos referidos en el artículo. Este documento obra en poder del autor de correspondencia.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Agradecimiento a Raúl Esparza e Isabel Zapero por el procesamiento de las muestras.