Valorar si la infusión intravenosa periférica de células madre procedentes del tejido adiposo (CMDG) después de una lesión medular isquémica, promueve la migración celular selectiva y la supervivencia celular en el tejido neural dañado.
Animales y métodoSe utilizaron 11 conejos macho de la raza Nueva Zelanda (2,5±0,5kg) a los que se les provocó una lesión medular isquémica mediante pinzamiento de la aorta abdominal durante 20min. Se aleatorizaron en 2 grupos: un grupo (n=5) recibió una infusión intravenosa de 10±2×106 CMDG a las 24h de la lesión y el grupo control (n=6) solo el vehículo. Se valoró el estado funcional a las 24h, 7 y 14 días mediante la escala de Tarlov. A los 14 días los animales fueron sacrificados y se realizó el estudio histológico e inmunohistoquímico.
ResultadosEn todos los casos de ambos grupos se obtuvo una paraplejía completa. No hubo diferencias significativas en cuanto a la recuperación neurológica que fue nula en ambos grupos. En el estudio histológico e inmunohistoquímico se comprobó la presencia de CMDG marcadas con bromodeoxiuridina en la zona de la lesión, aunque en poca cantidad.
ConclusiónLas CMDG tienen capacidad de migrar y sobrevivir en la médula espinal lesionada tras isquemia aórtica una vez que se han administrado de forma intravenosa. La infusión intravenosa es un procedimiento inocuo y sin efectos secundarios. No hemos obtenido recuperación neurológica.
To assess if a peripheral intravenous infusion of adipose tissue stem cells (ATSC), after an ischemic spinal cord injury can promote selective cell migration and cell survival in the damaged neural tissue.
Animals and methodAn ischaemic spinal cord injury was provoked by trapping the abdominal aorta for 20minutes in 11 male New Zealand rabbits (2.5±0.5kg). They were randomised into two groups: one group (n=5) received an intravenous transfusion of 10±2×106 ATSC at 24hours from the injury, and the control group (n=6) were only given the vehicle. The functional status was assessed, using the Tarlov scale at 24h, and 7 and 14 days. The animals were sacrificed at 14 days and a histological and immunohistochemical study was performed.
ResultsComplete paraplegia was achieved in both groups. There were no significant differences as regards neurological recovery, which was nil in both cases. In the histological and immunohistochemical study, it was tested to see if there was any bromodeoxyuridine-marked ATSC in the area of the lesion, but there was only a small amount.
ConclusionATSC are able to migrate and survive in the injured spinal cord after aortic ischaemia after they have been administered intravenously. Intravenous infusion is a harmless procedure with no side effect. No neurological recovery was achieved.
La implantación de células troncales mesenquimales (MSC) se considera un tratamiento prometedor para conseguir una mejoría en aquellos pacientes que han sufrido una lesión de la médula espinal (LME). Un número cada vez mayor de trabajos experimentales han comprobado el efecto positivo de la implantación de las MSC en la recuperación de la LME1. Las MSC pueden ser aisladas de tejidos como el hueso, el periostio, el músculo, la sinovial o la grasa2. La diferenciación de las células madre in vivo depende del medio en el que son sembradas y el ambiente en el que se desarrollan3,4. Estudios de reciente aparición han demostrado la capacidad de expresión de los marcadores neurales en la superficie de las MSC procedentes de la médula ósea5,6. Se ha demostrado que las MSC pueden diferenciarse en astrocitos, microglía y neuronas tanto in vivo como in vitro7–9. El tejido graso también contiene determinadas poblaciones de células pluripotenciales10,11. El perfil genético de estas células madre derivadas de la grasa (CMDG) es parecido a aquellas derivadas de la médula ósea (CMDMO)12. Las CMDG pueden diferenciarse en adipocitos, condrocitos, miocitos, osteoblastos e incluso en líneas neurales10.
La LME conduce a la muerte celular, especialmente de las neuronas, oligodendrocitos, astrocitos y células precursoras13. La LME culmina con la formación de una cicatriz glial, un proceso multifactorial donde se expresan inhibidores moleculares transmembrana del crecimiento axonal14. Las CMDG podrían disponer de un potencial terapéutico en las enfermedades neurológicas y se ha descrito la existencia de una recuperación funcional tras el trasplante in vivo de CMDG en las zonas de lesión medular en un modelo canino y de roedor con lesión de la médula espinal15,16.
Pocos trabajos publicados demuestran la potencial utilidad de una infusión periférica de estas células en el tratamiento de las lesiones isquémicas17. La inyección intratecal o directa de las células tiene riesgo de dañar la médula espinal, por lo que consideramos que debe buscarse un medio más seguro para poder utilizar clínicamente estos tratamientos. La inyección en el sistema venoso periférico puede considerarse una opción prometedora al ser más segura, más rápida y más fácil.
El objetivo del presente estudio es comprobar si la inyección venosa periférica de células madre procedentes del tejido adiposo, después de una lesión medular isquémica, promueve la migración celular selectiva y la supervivencia celular en el tejido neural dañado. Como objetivo secundario de este modelo de lesión medular isquémica en conejo se valorará la posible mejoría en la función neurológica.
Material y métodosAnimalesSe utilizaron 11 conejos macho de la raza Nueva Zelanda con un peso de 2,5±0,5kg. Los animales se encontraban en perfectas condiciones de temperatura ambiente, espacio y con libre acceso a la comida y el agua. El experimento fue diseñado según las guías éticas de la Asociación Internacional para el estudio del dolor18 y aprobado por el Comité Ético de Bienestar Animal de nuestro hospital. Se siguió la normativa legal vigente en cuanto al uso de animales de experimentación.
Los conejos fueron aleatoriamente asignados a 2 grupos basados en el tratamiento recibido tras la lesión medular. El primer grupo (n=5) recibió una infusión intravenosa de 10±2×106 células madres derivadas de la grasa 24h tras la lesión. El grupo control (n=6) recibió solo el vehículo de soporte de las células madre (5ml de DMEM). Las células se inyectaron mediante un catéter venoso de 14-G en la vena marginal de la oreja del conejo.
Aislamiento y cultivo celularLas células madre se obtuvieron del tejido adiposo de la ingle del conejo en condiciones de esterilidad. Las muestras fueron troceadas y digeridas en PBS a 37°C con 0,075% de colagenasa tipo i (Gibco® BRL, Paisley, Reino Unido) durante 30min. Los adipocitos maduros fueron eliminados por centrifugación (300g, 5min) y las células mononucleares de baja densidad se aislaron mediante centrifugación por gradiente de densidad (670g, 30min) y se cultivaron en cámara húmeda a 37°C en Dulbecco's Modified Eagle Medium (DMEM) (Gibco®), con un 10% de suero fetal bovino (FBS) y un 0,1% de antibiótico-antimicótico (Gibco®).
Se cambió el medio para extraer las células no adherentes a las 24h y posteriormente cada 4 días. Para el subcultivo, las células se re-suspendieron en tripsina al 0,05 (v/v) en solución salina balanceada de Hank's Balanced Salt Solution (HBSS) (BioWhittaker® Europe, Verviers, Bélgica) cuando se alcanzó una confluencia del 80%. Fueron marcadas con bromodeoxiuridina (BrdU), un análogo de la timidina, para la localización tisular, 48h antes de la inyección de las células.
Lesión medular isquémicaSe canalizó la vena marginal de la oreja del animal con un catéter intravenoso de 24-G y se realizó la inducción anestésica mediante un bolo de propofol (25mg/kg) (Diprivan®1%, AstraZeneca) manteniendo la sedación mediante la perfusión de 0,5mg/kg de propofol y sevoflurano 1,5% con 1% de oxígeno. La temperatura corporal se mantuvo con una manta eléctrica a 37°C. Los animales respiraban espontáneamente. Adicionalmente se les aplicó lidocaína 1%, como anestésico local en la zona de incisión.
Todas las intervenciones quirúrgicas se realizaron en el quirófano experimental de nuestro hospital por el mismo investigador (AB). Una vez anestesiados los conejos y colocados en la mesa de operaciones en decúbito supino se rasuró la región abdominal. Se realizó una laparotomía media con extracción y desplazamiento lateral del paquete intestinal que se cubrió con compresas empapadas con suero caliente para disminuir la pérdida de calor. Tras disección cuidadosa se localizó y expuso la aorta abdominal y la vena cava inferior. La arteria aorta abdominal se pinzó durante 20min mediante un clamp vascular situado a 1cm distal a la arteria renal izquierda y otro situado antes de la bifurcación ilíaca como medio indirecto de producir isquemia medular. Para disminuir el riesgo de trombosis, inmediatamente antes de la oclusión se administró vía intravenosa heparina (150U/kg). Transcurrido los 20min, los clamps fueron retirados y se revisó la aorta para comprobar su correcta función. Finalmente, se procedió al cierre de la incisión. Los animales recibieron analgesia tras la intervención y gentamicina una vez al día durante 3 días como profilaxis contra la infección. Se realizó expresión vesical por lo menos 3 veces al día hasta completar el experimento.
Valoración neurológicaLa función motora de las extremidades inferiores fue valorada por un investigador ciego al tratamiento realizado, preoperatoriamente y postoperatoriamente a las 24h 7 y 14 días después de la lesión, según la escala Tarlov modificada19 (tabla 1).
Estudio histológico e inmunohistoquímicoA los 14 días de la lesión medular los animales fueron anestesiados de nuevo y tras nueva laparotomía perfundidos mediante la aorta abdominal con paraformaldehído al 4% en buffer fosfato. La médula fue extraída y mantenida durante 3 días en paraformaldehído y, posteriormente, embebida en parafina. Finalmente, las muestras se introdujeron en sacarosa al 30% en PB al 0,1M, hasta el momento en el que se cortaron. Las secciones de la médula se realizaron en un criostato con un espesor de 12μm para su posterior estudio.
El estudio histológico de la zona isquémica se llevó a cabo mediante la tinción de las muestras con hematoxilina-eosina.
Para el estudio inmunohistoquímico se utilizó el InmunoCruz Mouse ABC Staining System (Santa Cruz Biotechnology, CA, EE. UU.). Los cortes desparafinados de la médula espinal fueron incubados durante una hora en un buffer de bloqueo (0,1M PBS conteniendo 5% suero caprino normal, 0,1% Triton X-100®) y, posteriormente, incubados durante la noche con anti-BrdU monoclonal 1:20 (DAB, Dako, Glostrup, Dinamarca). Previamente la peroxidasa endógena fue inactivada con peróxido de hidrógeno (0,03% en metanol). Para la inmunodetección, las muestras fueron incubadas con el anticuerpo secundario provisto en el kit Biotin-goat anti-mouse IgG (Zymed®, San Francisco, CA, EE. UU.), utilizando 3-3-diaminobenzidina tetrahidrocloridio (DAB; Dako, Glostrup, Dinamarca) como cromagén.
Las médulas procedentes del grupo control se procesaron en muestras que fueron incubadas sin anticuerpo primario y posteriormente procesadas con el anticuerpo secundario y cromagén.
Análisis estadísticoLos resultados del test neurológico de Tarlov se expresan como media ± DT. Para el estudio estadístico se utilizó el programa SPSS® v.21.0 (IBM®, EE. UU.). El test de Tarlov se analizó mediante la prueba de Kruskal-Wallis. La significación estadística se estableció como un valor de p<0,05.
ResultadosFunción neurológicaAntes de la lesión de la médula espinal, todos los animales alcanzaron la máxima puntuación (5) en la escala de Tarlov indicando una función medular completa. Tras la lesión isquémica, en todos los animales del grupo control se produjo una paraplejía con una puntuación media en la escala de Tarlov de 0, 0,125±0,37 y 0,125±0,37 en los días 1, 7 y 14 respectivamente. Los animales que recibieron la infusión intravenosa de CMDG a una concentración de 10±2×106, también presentaron un deterioro neurológico grave con valores medios en la escala de Tarlov muy bajos. Estas puntuaciones fueron 0,400±0,54; 0,2±0,44, y 0,4±0,54 en los días 1, 7 y 14 respectivamente. No se encontraron diferencias estadísticamente significativas en la escala de Tarlov entre los 2 grupos estudiados.
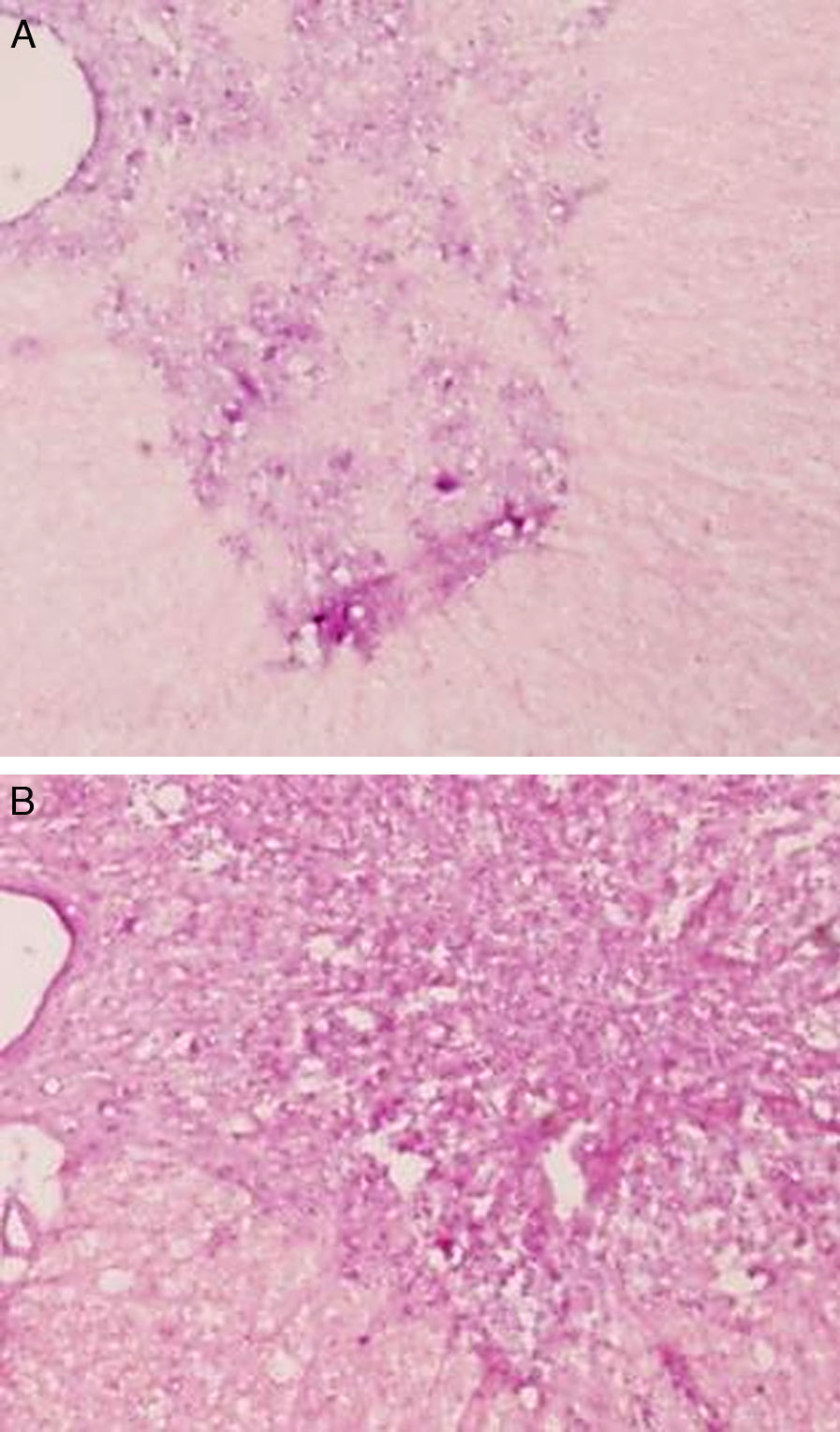
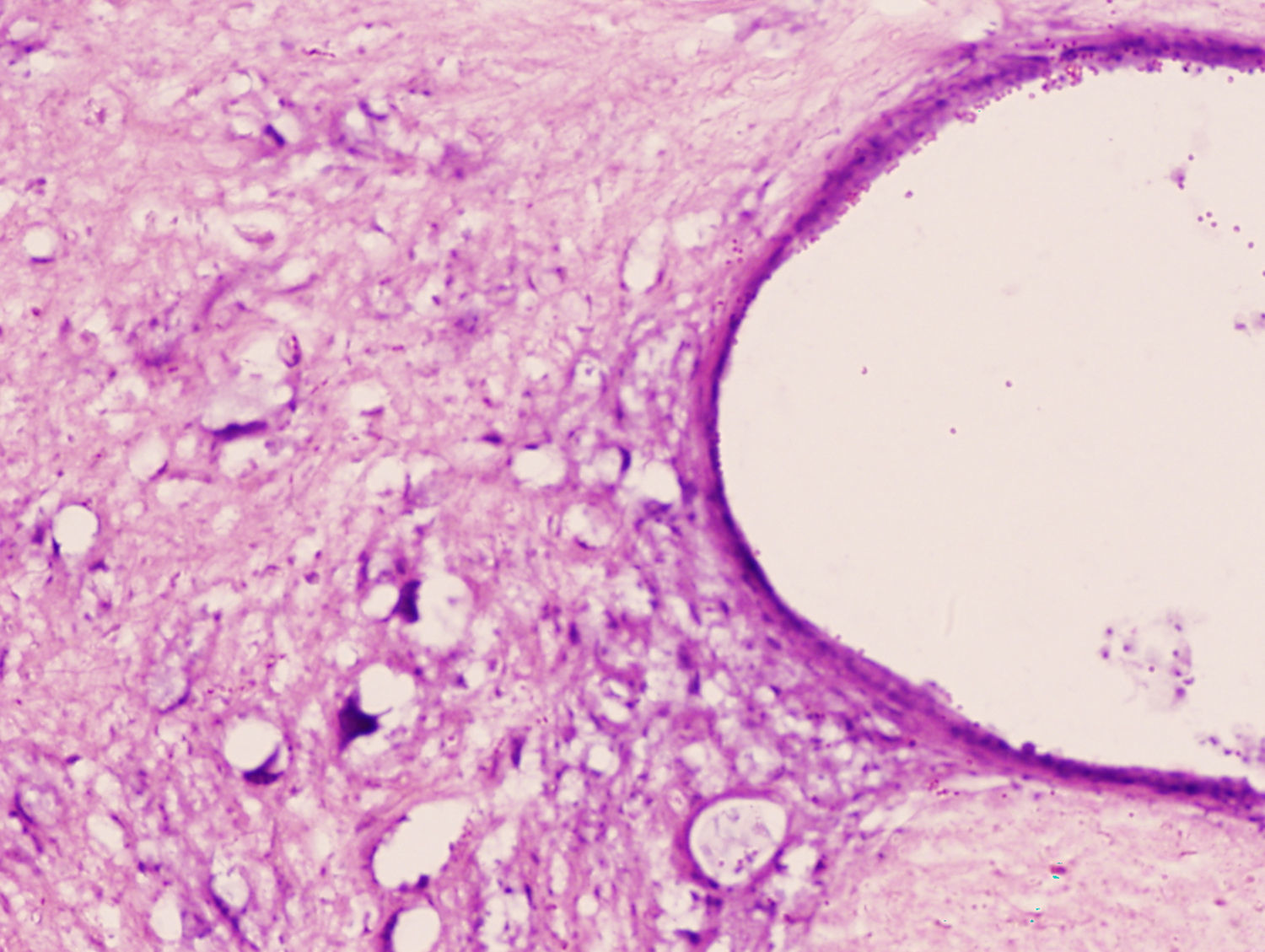
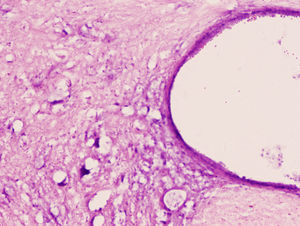
Estudio microscópico e inmunohistológicoEn ambos grupos de conejos el estudio histopatológico mostró un daño tisular de características parecidas. Se apreció una pérdida clara de la población neuronal a nivel de la sustancia gris medular. El citoplasma de las neuronas remanentes era muy eosinofílico, con ausencia de gránulos de Nissl y gran vacuolización (figs. 1 y 2). La LME fue mayor y más extensa en la región lumbar que en la torácica.
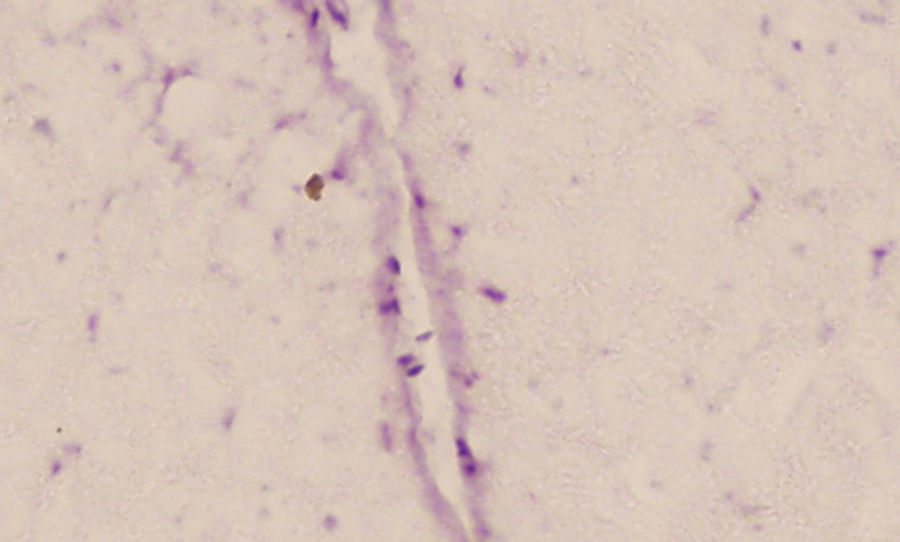
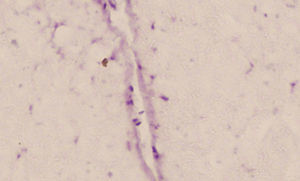
Existió migración de la CMDG infundidas a la dosis de 10±2×106 en la zona lesionada, aunque de manera escasa. Aún así, se encontraron células aisladas marcadas con BrdU el día 14 tras la lesión (fig. 3).
DiscusiónEn este trabajo, hemos podido demostrar que después de una lesión medular isquémica, la infusión intravenosa de células madre mesenquimales procedentes del tejido adiposo promueve una migración selectiva de las células al tejido neural dañado, aunque las células que alcanzan el mismo, a las dosis utilizadas, son pocas.
Estudios previos en lesiones isquémicas cerebrales han demostrado los beneficios del trasplante, mediante una inyección local de MSC procedentes de la médula ósea en el tejido neural lesionado5,6. Estos beneficios también se han demostrado en las lesiones traumáticas de la médula espinal20,21. Sin embargo, salvo en algunas lesiones traumáticas, el nivel exacto de la lesión medular suele ser amplio y no se identifica de forma clara en la práctica clínica habitual. Esto sucede de modo especial cuando la lesión es secundaria a una isquemia medular como ocurre en algunas complicaciones quirúrgicas como la corrección de curvas escolióticas o la reparación de aneurismas de la aorta abdominal. Incluso podrían inyectarse de forma profiláctica antes de una cirugía con riesgo de lesión medular, ya que las CTM han demostrado que protegen contra la lesión medular de tipo isquémico, tras la inyección intratecal 2 días antes de producirse la misma22.
Por otro lado, el uso de una inyección local podría originar un daño añadido del parénquima neural. Por ese motivo, consideramos que es importante intentar desarrollar técnicas menos invasivas para el uso clínico, como la infusión intravenosa de células madre, que en nuestro estudio ha demostrado ser una técnica inocua y con posible utilidad en el tratamiento de las lesiones medulares. Este método parece ser más fácil, rápido y seguro que la inyección directa en la zona lesionada.
Las CMDG son obtenidas fácilmente y se expanden con gran rapidez in vitro, obteniéndose de forma rápida un número suficiente de células para infundir10,23. Además, mantienen incluso a largo plazo su capacidad pluripotencial mesenquimal10,11. Teniendo en cuenta que el tiempo que transcurre desde la lesión medular al inicio del tratamiento es uno de los principales factores en el pronóstico de los pacientes con lesión medular, creemos que las CMDG pueden ser más útiles que las derivadas de la médula ósea. Otro punto que hace a estas células muy interesantes es que son capaces de secretar factores antiapoptóticos y angiogénicos in vitro en función de la hipoxia existente24.
En un reciente estudio16, las CMDG insertadas con vectores lentovirales fueron positivas para diferentes antígenos neurales (GFAP, NF160, Tuj-1), y marcadores de oligodendrocitos en lesiones de la médula espinal. Esto sugiere que las CMDG implantadas se diferenciaron en astrocitos, oligodendrocitos y células neurales. Tanto las CMDG trasplantadas como los factores quimiotácticos inducidos por la lesión medular desempeñan un importante papel en la proliferación, migración y diferenciación de las células progenitoras neurales endógenas derivadas de la médula espinal en la zona dañada15.
La capacidad de las CMDG de migrar selectivamente a la médula isquémica mediante el torrente sanguíneo ha sido confirmada por el presente estudio. En estudios previos, la capacidad de las células madre mesenquimales de movilizarse hacia zonas con lesión ya había sido demostrada. Así, tras infundir de forma intravenosa en ratas tras un infarto de miocardio las CMM, se ha comprobado la presencia de las mismas en la zona infartada y la mejoría de la función ventricular, mientras que el grupo control sin infarto, las CMM emigraron a la médula ósea25. El mecanismo por el cual se promueve esta migración es todavía desconocido.
Al representar una fuente de células madre atractiva y no presentando su uso problemas éticos, la aplicación intravenosa de CMDG para el tratamiento de daño celular secundario a distintas enfermedades se ha incrementado. Muy recientemente se ha estudiado la toxicidad y posible capacidad para generar tumores de las CMDG para su aplicación clínica17. Para probar la toxicidad se inyectaron diferentes cantidades de CMDG humanas en ratones inmunodeficientes, siendo posteriormente seguidos durante 13 semanas. Incluso a la dosis máxima (2,5×108 células/kg de peso corporal), los ratones fueron viables y no presentaron efectos secundarios. La capacidad para producir tumores se investigó en ratones durante 26 semanas. Incluso a la dosis más alta (2×108 CMDG/kg), no hubo evidencia del desarrollo de ningún tumor. Este grupo de investigación llevó a cabo un ensayo clínico en el que incluyeron 8 pacientes varones que habían sufrido una LME hace más de 12 meses. Los pacientes recibieron una infusión intravenosa de CMDG autólogas (4×108 células) una sola vez. Ninguno de los pacientes del estudio tuvo ningún efecto secundario durante los 3 meses de seguimiento17. A pesar de ello, prácticamente no se detectó ningún signo de mejoría neurológica en la clasificación ASIA de la lesión medular.
Nuestro estudio tiene limitaciones. Por un lado la migración de células, aunque existe, es muy pobre. Esto podría mejorarse incrementando el número de CMDG infundidas y es motivo de un experimento ya en marcha. Por otro lado, no ha existido ninguna mejoría significativa en la función neurológica, quizás por la pequeña cantidad de células que alcanzaron la zona de la lesión.
Otra limitación surge del modelo de lesión elegida. La oclusión de la aorta obliga a una laparotomía media extensa y a una lesión abdominal donde podrían migrar parte de las células infundidas. Esto podría minimizarse con una oclusión endovascular con un balón introducido por la arteria femoral.
Por otra parte, incluso si las células migraran adecuadamente a la zona lesionada, la amplitud de la lesión isquémica podría limitar su posible utilidad en la recuperación neurológica. Esto no ocurriría en lesiones traumáticas más limitadas.
Por último, en nuestro estudio, el número de células infundidas se ha basado en trabajos previos que utilizaron una inyección local de CMM5,26. Como hipótesis podría plantearse que el número de células que hay que aplicar por vía intravenosa debe ser superior al de la infusión local. Esta hipótesis podría justificar los pobres resultados obtenidos. Sin embargo, en un reciente ensayo clínico17, se han utilizado dosis mayores de CMDG, cubriendo además un periodo más prolongado de seguimiento de la posible recuperación neurológica, siendo los resultados también decepcionantes.
En resumen, las CMDG tienen capacidad de migrar y sobrevivir en la médula espinal lesionada tras la isquemia aórtica una vez que se han administrado de forma intravenosa. La infusión intravenosa es un procedimiento inocuo y sin efectos secundarios. No hemos obtenido recuperación neurológica.
Nivel de evidenciaNivel de evidencia i.
Responsabilidades éticasProtección de animalesLos autores declaran que el experimento fue diseñado según las guías éticas de la Asociación Internacional para el estudio del dolor y aprobado por el Comité Ético de Bienestar Animal de nuestro hospital.
FinanciaciónEste trabajo ha recibido una beca de ayuda a la investigación de la Fundación para la Investigación Sanitaria en Castilla-La Mancha (FISCAM) dependiente del Gobierno de Castilla-La Mancha en la convocatoria del 2008.
Conflicto de interésLos autores declaran no tener ningún conflicto de intereses.