Valorar el comportamiento histológico, en un modelo animal de conejo, de un nuevo cemento óseo modificado, el cual aumenta la liberación local de antibiótico, en la infección ósea.
Material y métodosSe han utilizado 16 conejos Nueva Zelanda divididos en 4 grupos, en función del cemento (comercial o experimental) y del antibiótico (vancomicina o linezolid) empleados para controlar una infección ósea por Staphylococcus aureus. El cemento comercial es Palacos® R y el cemento experimental se ha conseguido añadiendo PLGA a la fase sólida del cemento Palacos® R. Se ha empleado un método de estadificación histológica novedoso, basado en la histoarquitectura ósea. Esta estadificación nos permite tener una visión global de la capacidad de reparación ósea, en presencia del cemento modificado, así como correlacionar el daño generado con la funcionalidad del tejido.
ResultadosEl grado de desestructuración ósea encontrado depende del tipo de cemento y del antibiótico, siendo mayor en los grupos con cemento comercial respecto al experimental (p<0,01) y en los grupos con linezolid respecto a vancomicina (p=0,04). El porcentaje de macrófagos varía exclusivamente en función del antibiótico utilizado, siendo mayor en los grupos con vancomicina respecto a linezolid (p=0,04).
DiscusiónEl desarrollo de nuevas formulaciones de cemento óseo que liberan mayor cantidad, y de forma más prolongada, de antibióticos de nueva generación como el linezolid presentan un comportamiento in vivo superior al cemento comercial, respetando más la estructura ósea. Este comportamiento tendría una implicación clínica para combatir las infecciones por gérmenes cada vez más resistentes y prevenir la colonización de los espaciadores de cemento usados habitualmente en el tratamiento de la infección protésica.
To evaluate the in vivo behaviour of a new bone cement loaded with antibiotics, in a rabbit bone infection model.
Material and methodsSixteen New Zealand rabbits divided into 4 groups were used, depending on the cement (commercial or experimental) and the antibiotic (vancomycin or linezolid) used to control a bone infection caused by Staphylococcus aureus. The commercial cement is Palacos® R and the experimental cement has been achieved by adding PLGA to the solid phase of Palacos® R cement. A novel histological staging method based on bone histoarchitecture has been used. This staging allows us a global vision of bone repair capacity, in the presence of modified cement, and also allows us to correlate the damage generated with the functionality of the tissue.
ResultsThe degree of bone destructuration found depended on the type of cement and antibiotic, and was higher in the groups with commercial cement than in the experimental group (P<.01) and in the groups with linezolid with respect to vancomycin (P=.04) The percentage of macrophages varied exclusively depending on the antibiotic used, and was higher in the vancomycin groups (P=.04).
DiscussionThe development of new formulations of bone cement that release more, and more prolonged, new generation antibiotics such as linezolid, present an in vivo behaviour superior to commercial cement, respecting the bone structure. This behaviour would have a clinical implication in fighting infections by increasingly resistant germs in the treatment of prosthetic infection.
Una de las complicaciones más importantes de la cirugía protésica es la infección. Pese a su baja prevalencia (en torno al 0,5-3%)1, llega a ser una complicación devastadora debido a la dificultad de erradicar la infección por las peculiaridades del desarrollo de la biopelícula2. En España, en el registro catalán de 2009 se describe una incidencia de infección del 3% en prótesis de cadera y del 3,3% en prótesis de rodilla3.
Se han descrito varias estrategias para el tratamiento de las infecciones protésicas, dependiendo, fundamentalmente, del momento de instauración de la infección4. Para las infecciones crónicas, la cirugía de revisión protésica realizada en 2 tiempos ha sido el método más empleado, usando un espaciador de cemento óseo entre el primer y el segundo tiempo, con mejores tasas de erradicación de la infección5-8.
Este cemento óseo, compuesto en su mayoría por polimetacrilato de metilo, está cargado con antibióticos que permiten alcanzar concentraciones locales muy superiores a las conseguidas por vía intravenosa. Esta liberación depende, entre otros factores, de la composición y de las características fisicoquímicas del cemento9,10, siendo más elevada en los primeros días, y mantenida, posteriormente, desde unas horas hasta varias semanas, en muchas ocasiones en concentraciones por debajo de la mínima inhibitoria11,12, lo cual se ha asociado al desarrollo de resistencias antibióticas (50% de resistencia a la gentamicina), a la colonización de los espaciadores y, por tanto, al fracaso terapéutico.
En torno al 20% de los Staphylococcus aureus y al 80% de los Staphylococcus epidermidis aislados en infecciones protésicas son resistentes a meticilina13. El antibiótico de elección para el tratamiento de infecciones por estafilococos resistentes a meticilina es la vancomicina14. La creciente aparición de bacterias multirresistentes hace necesario el uso de nuevos antibióticos para la incorporación al cemento óseo. La daptomicina y el linezolid son las 2 principales alternativas a la vancomicina en casos de resistencia bacteriana15. Ambos antibióticos han demostrado buena cinética de liberación y propiedades antibacterianas en cemento in vitro16.
El empleo en los últimos años de compuestos biodegradables en el cemento para aumentar la liberación de antibióticos consiguió en nuestro grupo aumentar in vitro la liberación de vancomicina, daptomicina y linezolid, así como mejorar la cinética de liberación temporal de forma significativa. Esto se ha conseguido incorporando micropartículas biodegradables de ácido poliláctico-co-glicólico (PLGA) en la fase sólida del cemento Palacos® R16. Cuando se utilizan los cementos formulados con estas micropartículas, se aprecia una liberación bifásica frente a la lineal hasta la tercera semana que ocurre con los cementos comerciales, aumentando de forma exponencial entre los días 35 y 40 (sexta-séptima semana).
El objetivo del presente trabajo es valorar el comportamiento histológico de dicho cemento modificado cargado con vancomicina o linezolid (hasta ahora no probado en modelos animales) en un modelo experimental de osteomielitis en conejo, empleando como método de medición un nuevo sistema de estadificiación histológica basado en la histoarquitectura ósea, que nos permite tener una visión global de la capacidad de reparación ósea y correlacionar el daño generado con la funcionalidad del tejido.
Material y métodosSe utilizaron un total de 16 conejos de la variedad albina Nueva Zelanda. El manejo de los animales se ha hecho conforme a la Normativa Internacional vigente sobre animales de experimentación (609/86/CEE y ETS 123) en el Centro de Experimentación Animal de la Universidad de Alcalá, con informe de idoneidad del Comité de Ética de la Investigación CEI UAH 2011017.
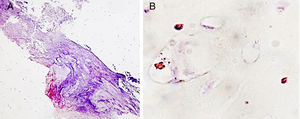
La cepa de S. aureus multirresistente seleccionada fue preparada en un inóculo ajustado a 4, según la escala McFarland (bioMérieux, Marcy-l’Etoile, Francia), en una suspensión de 3ml de suero salino, equivalente a 1,2×109UFC/ml. En cada tubo con esta suspensión se introdujo una varilla de titanio recubierta con hidroxiapatita durante 24h para producir su contaminación. Mediante microscopia electrónica de barrido se objetiva la adhesión de las bacterias a la varilla recubierta de hidroxiapatita (fig. 1). Esta varilla es el implante contaminado que introduciremos en el tejido óseo del conejo.
Se han empleado 2 cementos óseos: Palacos® R (Heraeus Medical) como cemento comercial y la sustitución parcial del 45% de la fase sólida de Palacos® R por microesferas de PLGA como cemento experimental, presentando parámetros de curado (según lo establecido en la norma ISO-5833)22, con una disminución de la temperatura de fraguado en los cementos desarrollados con micropartículas de PLGA y/o antibióticos. Las propiedades mecánicas de estas formulaciones son inferiores a las exigidas por la norma ISO-5833 para cementos utilizados en la fijación de prótesis articulares17 debido a la utilización de las micropartículas de PLGA, según se describe en estudios previos16.
Los animales fueron divididos en 4 grupos de estudio: los grupos de cemento comercial (1 y 3) y los grupos de cemento experimental (2 y 4), atendiendo al tipo de cemento (comercial o experimental) y al antibiótico (vancomicina o linezolid) empleados. La nomenclatura y la composición de cada grupo se muestran en la tabla 1.
El protocolo anestésico ha incluido la administración por vía intramuscular de la combinación de clorhidrato de ketamina a 70mg/kg, diazepam a 1,5mg/kg y clorpromazina a 1,5mg/kg.
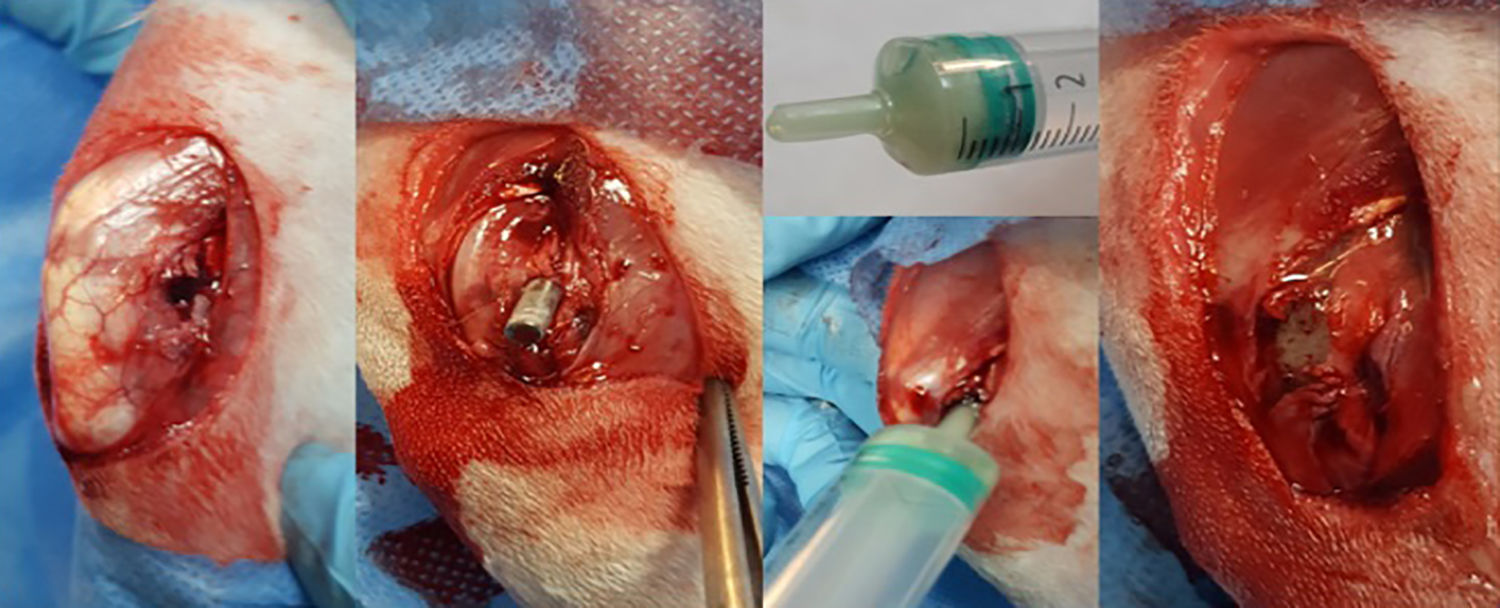
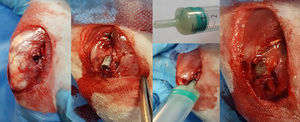
Tras el rasurado y la desinfección con clorhexidina alcohólica de la pata trasera, se coloca al animal en decúbito lateral y se realiza un pañeado estéril, dejando únicamente expuesto el tercio distal de muslo y rodilla. La incisión cutánea se realiza pararrotuliana externa en sentido ascendente buscando el eje longitudinal y lateral del muslo, hasta alcanzar los 2,5-3cm. A continuación, se localiza el plano intermuscular entre el músculo tensor de la fascia lata y el músculo bíceps femoral que, tras incidirlo, deja al descubierto la cara externa del cóndilo femoral externo. Una vez expuesto el cóndilo, se realiza, de forma manual, un orificio en la región metáfiso-epifisaria con ayuda de un punzón de sección cilíndrica de 3mm. Una vez perforada la cortical externa perpendicularmente, se procede a oblicuar el eje en sentido diafisario resultando un orificio oblongo de unos 5mm que atraviesa la región metáfiso-epifisaria de hueso esponjoso, hasta alcanzar el canal medular diafisario (fig. 2).
Con el orificio óseo preparado para acoger la varilla, se procede al destape del tubo que contiene la varilla de titanio recubierta en hidroxiapatita que ha permanecido durante 24h en la suspensión preparada con el S. aureus resistente a meticilina. Con ayuda de un porta, se procede a la introducción de la varilla en el orificio óseo hasta quedar completamente enterrada en el hueso.
Tras introducir la varilla, se realiza la preparación del cemento óseo. Los 2 componentes del cemento (fase sólida y fase líquida) se encuentran en envases separados en condiciones de esterilidad hasta el momento de preparar el cemento. La fase sólida contiene mezclado el antibiótico en polvo.
La mezcla se realiza vertiendo ambas fases en una jeringa de 5ml sin émbolo, donde se procede a una batida vigorosa hasta homogeneizar el producto con ayuda de una aguja espinal de 14G durante un minuto. Cuando la mezcla adquiere una consistencia pastosa, se coloca el émbolo en la jeringa y se realiza la introducción del cemento óseo abocando la punta de la jeringa en el orificio del cóndilo femoral previamente realizado, hasta completar el reparto del cemento en el interior del hueso, rodeando la varilla y taponando por completo el orificio (fig. 2). Durante el fraguado del cemento se realiza un lavado exhaustivo, tras el cual se procede al cierre –del plano muscular primero y cutáneo después– de la herida con sutura reabsorbible. El conejo es depositado a continuación en su jaula, donde despierta de forma espontánea, permitiéndole una actividad libre.
Pasadas 3 semanas desde la primera cirugía, el animal es sacrificado y se obtiene la pieza anatómica a analizar. Esta muestra es introducida en un bote estéril y sumergida completamente en una solución fijadora y descalcificadora (Osteosoft®) durante un período mínimo de 60 días.
Posteriormente las muestras son procesadas para su estudio histológico de la siguiente manera: se incluye la pieza en parafina y se cortan secciones con un grosor de 5μm y se tiñen para su estudio histológico con tinciones de hematoxilina-eosina y tinción de Gram. Además, se han realizado técnicas inmunohistoquímicas con el anticuerpo monoclonal RAM-11 (DakoCytomation, Glostrup, Dinamarca) para llevar a cabo un análisis cuantitativo de la respuesta macrofágica del tejido.
Para la evolución de la histoarquitectura ósea se ha empleado un modelo propio de estadificación muy sencillo, basado en la integridad y la conservación de la arquitectura del territorio afectado, diferenciando el hueso metafisario del cartílago fisario y del hueso epifisario. Dicha escala comprende valores del 1 al 9. En los grados del 1 al 3 hay una desestructuración ósea leve, con afectación progresiva del hueso metafisario y cartílago intacto. En los grados del 4 al 6 hay una desestructuración ósea moderada, con aumento del defecto metafisario y afectación progresiva del cartílago. En los grados del 7 al 9 hay una desestructuración ósea severa, con pérdida total del cartílago y desorganización progresiva del hueso epifisario. En la evaluación se ha realizado la aplicación del modelo de estadificación histoarquitectónica por 2 evaluadores de forma ciega a 4 muestras por conejo, obteniendo medias por conejo (n=4) y por grupo (n=4). Se ha analizado el grado de concordancia entre ambos mediante el coeficiente de concordancia de Lin y se ha obtenido como valor válido para los análisis, en el caso de que no coincidiesen, el valor medio obtenido entre los 2 observadores.
La valoración cuantitativa de la respuesta macrofágica se ha realizado mediante el contaje de células RAM-11+ en 15 campos por conejo, obteniendo medias por conejo y por grupo.
Se ha comprobado la normalidad de las medias obtenidas mediante test estadísticos y gráficos. Dado que no tuvieron una distribución normal, los análisis bivariantes se han realizado mediante el test de la U de Mann-Whitney y los análisis multivariantes, mediante regresiones sobre la mediana (regresiones cuantílicas). Todos estos análisis han sido realizados con el programa estadístico STATA 14 (Texas, Estados Unidos).
ResultadosLa utilización de secciones histológicas nos permite el estudio del territorio óseo afectado por la presencia de la varilla y el cemento después de 3 semanas.
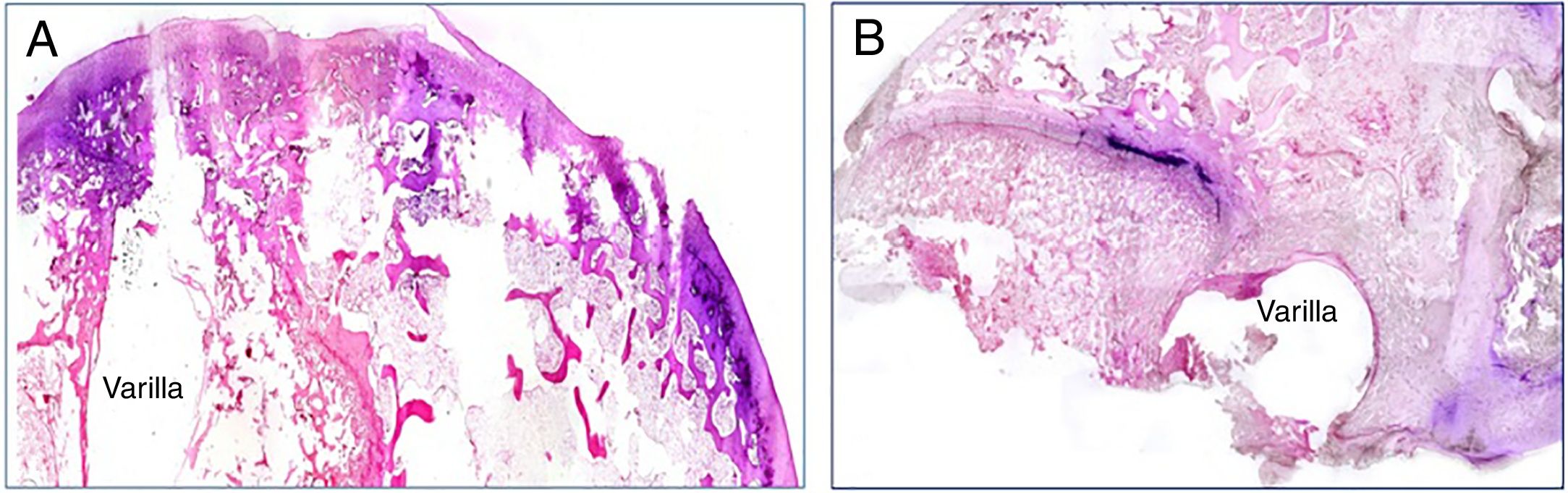
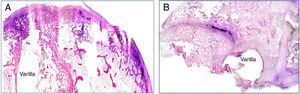
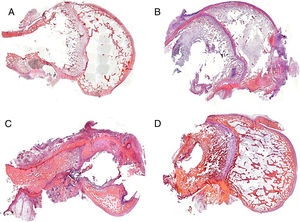
La presencia de infección ha sido valorada mediante la tinción de Gram en todos los grupos de estudio de la pieza histológica. La dispersión bacteriana ha sido máxima en los animales con varilla contaminada usando el cemento comercial y mínima en los animales en los que el cemento utilizado era el experimental. En estos casos, la presencia bacteriana quedaba restringida a las inmediaciones del implante (fig. 3A y B).
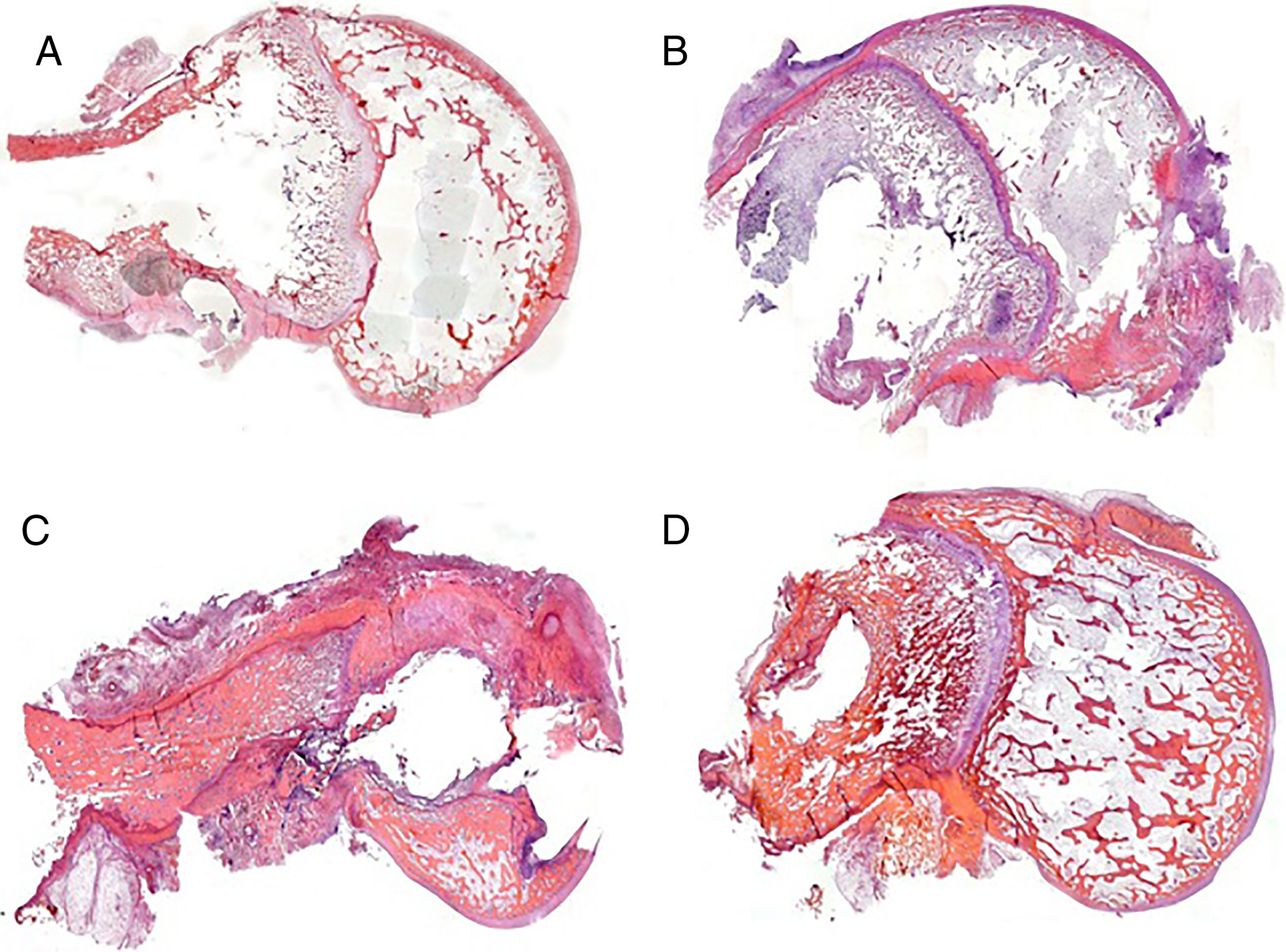
Podemos observar una mejor conservación de las estructuras tisulares en los grupos en los que en la interfaz hueso-varilla hay cemento experimental (grupos 2 y 4) respecto a aquellos en los que hay cemento comercial (grupos 1 y 3) (fig. 4). Este hecho puede estar relacionado con una mayor dispersión de la infección en los grupos con cemento comercial respecto a los grupos con cemento experimental.
En el grupo con cemento comercial y vancomicina (grupo 1), la respuesta tisular es escasa, observando la impronta ejercida por la varilla y los restos de cemento en la zona medular diafisaria. En aquellas áreas en donde el cartílago metafisario había interferido, la respuesta es nula, y en aquellas zonas con hueso epifisario afectado, la desestructuración es patente, siendo clasificada como de tipo moderado (fig. 4A). En el grupo tratado con linezolid, las panorámicas histológicas muestran un alto grado de desestructuración tisular. Las muestras en este grupo, tras el proceso de descalcificación, difícilmente mantienen la integridad anatómica y hubo gran dificultad para su procesamiento histológico. La desestructuración histoarquitectónica incluye áreas de necrosis y fibrosis. El tejido óseo cortical está claramente alterado, siendo de tipo lacunar en su porción medial, respetando solo una fina capa de hueso compacto en el reborde externo. En el reborde interno, los restos del cemento adherido muestran una buena adhesión al mismo. El resto de las estructuras interesadas por la presencia de la varilla (cartílago y epífisis) están poco conservadas. En este caso, se clasificó como desestructuración severa (fig. 4C).
En los grupos con cemento experimental y con ambos tipos de antibiótico, la impronta de la varilla, a pesar de ser patente, permite una cierta regeneración ósea a nivel medular, observada por la presencia de hueso trabecular neoformado. A nivel del cartílago hay áreas puntuales de alteración del mismo que coexisten con áreas de cartílago intacto. Este tipo de conservación de la histoarquitectura es clasificado como desestructuración leve (fig. 4B y D).
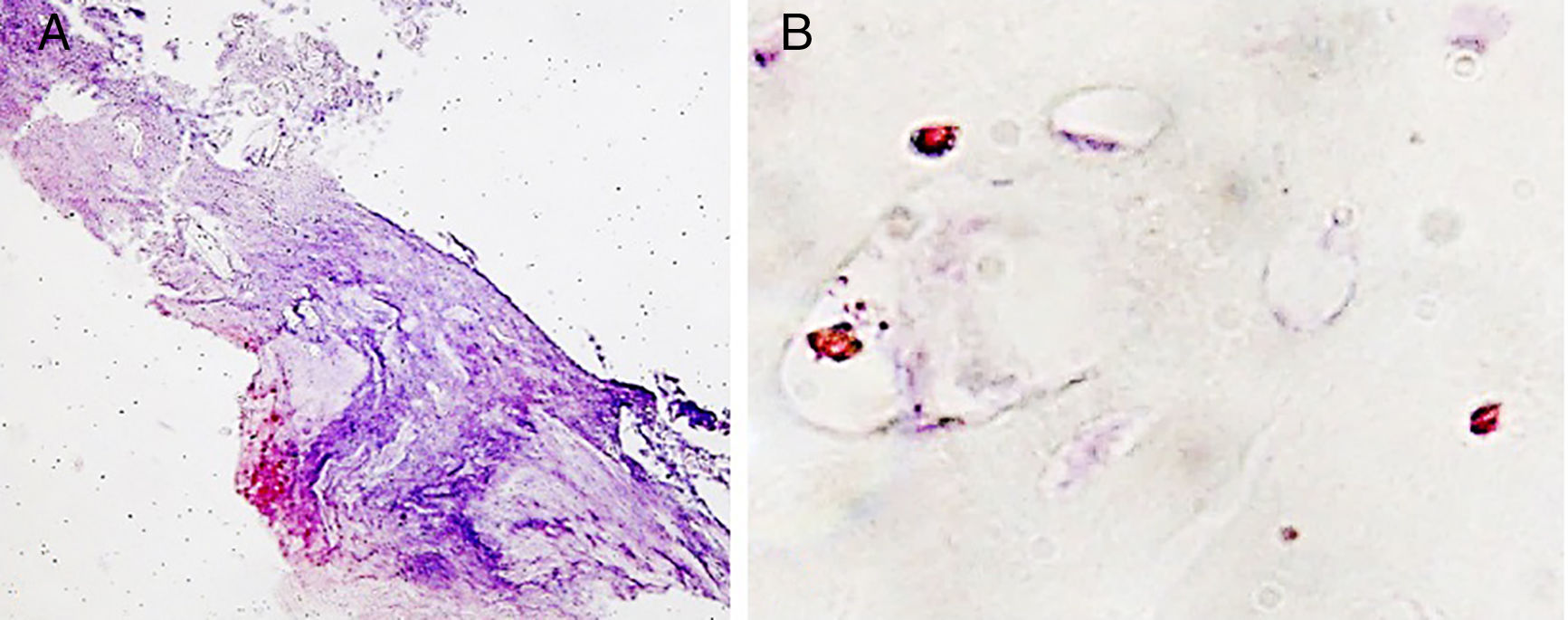
Por último, se ha valorado la presencia de reacción macrofágica. Ha tenido un comportamiento cuantitativo similar en todos los grupos de estudio, pero a nivel de localización de dichas células el patrón ha sido claramente diferente. Solo son visibles macrófagos agrupados en áreas granulomatosas en la cápsula fibrosa que se observa en los grupos con cemento experimental y sobre todo en el de vancomicina (fig. 5A). El resto de la presencia macrofágica es visualizada sobre áreas de cartílago, así como dispersa en el entorno vascular (fig. 5B).
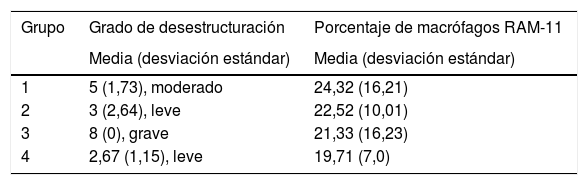
Las medias del grado de desestructuración ósea de cada grupo aplicando el modelo de estadificación histoarquitectónica, y del porcentaje de macrófagos marcados con RAM-11 respecto al total de células, quedan recogidas en la tabla 2.
Valores de grado de desestructuración y de porcentaje de macrófagos RAM-11
| Grupo | Grado de desestructuración | Porcentaje de macrófagos RAM-11 |
|---|---|---|
| Media (desviación estándar) | Media (desviación estándar) | |
| 1 | 5 (1,73), moderado | 24,32 (16,21) |
| 2 | 3 (2,64), leve | 22,52 (10,01) |
| 3 | 8 (0), grave | 21,33 (16,23) |
| 4 | 2,67 (1,15), leve | 19,71 (7,0) |
El grado de concordancia en las medidas de desestructuración ósea entre los 2 profesionales que analizaron todas las muestras es moderada-alta, según el coeficiente de Lin (Rho 0,91, con un intervalo de confianza al 95% [0,8-1,0]).
Comparando la desestructuración ósea, se objetiva en los análisis bivariantes que el cemento experimental altera menos la estructura ósea que el cemento comercial (p=0,02), no encontrándose diferencias estadísticamente significativas entre los 2 antibióticos (p=0,57).
Al realizar los análisis multivariantes, teniendo en cuenta tanto el tipo de cemento como el tipo de antibiótico, el grado de desestructuración encontrado depende de ambos, siendo mayor en los grupos con cemento comercial respecto al cemento experimental (p<0,01) y en los grupos con linezolid respecto a vancomicina (p=0,04).
Al analizar el porcentaje de macrófagos marcados con RAM-11, todos los grupos tienen resultados similares, no encontrándose diferencias en función del cemento (p=0,49) ni del antibiótico (p=0,08).
Al realizar los análisis multivariantes, y teniendo en cuenta, además del cemento y el antibiótico, el conejo del que provenían las muestras analizadas, se encontró que el porcentaje de macrófagos varía exclusivamente en función del antibiótico utilizado (p=0,04), siendo mayor en los grupos con vancomicina que en los grupos con linezolid. No se encontró que existiese interacción estadísticamente significativa entre el antibiótico y el cemento.
Inicialmente, aunque existieron diferencias en los grupos cuando se estimó el porcentaje de macrófagos con RAM-11 (tabla 2), estas no fueron estadísticamente significativas ni al comparar los 2 tipos de cementos utilizados, comercial y experimental (p=0,49), ni cuando se compararon los 2 grupos de antibióticos utilizados, linezolid y vancomicina (p=0,08).
Sin embargo, cuando se analizaron estos resultados en un análisis multivariante, teniendo en cuenta todas las variables a la vez: el tipo de cemento, el antibiótico y el conejo en el que se realizaba el experimento, el porcentaje de macrófagos se relacionó con el tipo de antibiótico de manera estadísticamente significativa (p=0,04), siendo ligeramente superior en los grupos con vancomicina.
En los grupos con contaminación bacteriana, el cemento experimental conserva mejor la estructura ósea, con una reactividad macrofágica similar. En presencia de antibióticos (vancomicina y linezolid), el cemento experimental respeta mejor la estructura respecto al comercial, especialmente por el alto grado de desestructuración en el grupo de cemento comercial con linezolid (con daño severo óseo), con un grado de respuesta macrofágica similar entre vancomicina y linezolid (a favor del linezolid, sin diferencias estadísticamente significativas) y ligeramente menores que los controles del modelo de osteomielitis sin antibiótico.
DiscusiónLa alta tasa de resistencia a los antibióticos utilizados frecuentemente en los espaciadores de cemento óseo para el tratamiento de las infecciones protésicas obliga a desarrollar nuevas formulaciones de estos. Y en este sentido, hemos entendido el comportamiento histológico de un nuevo cemento óseo modificado, el cual aumenta la liberación in situ del antibiótico empleado.
Para aumentar la liberación del antibiótico, se planteó una modificación de la composición de la fase sólida del cemento comercial Palacos® R, al que se añadieron micropartículas biodegradables de PLGA. Se utilizó un polihidroxiácido debido al mecanismo de degradación que presenta en condiciones fisiológicas. Este mecanismo está basado principalmente en una degradación en masa heterogénea más rápida en la parte interna que en la superficie18. Concretamente se eligió el copolímero de una composición PLGA 50:50 debido a que presenta una degradación más rápida que la de aquellos más ricos en lactida19. Esto, desde el punto de vista clínico, tiene importancia para el tratamiento de las infecciones protésicas, pues el intervalo entre el primer y el segundo tiempo viene a durar aproximadamente de 8 a 12 semanas. Por tanto, durante este intervalo se está produciendo la liberación de antibiótico a dosis por encima de la concentración mínima inhibitoria contra el germen causante.
La disminución de la temperatura de fraguado objetivada en la nueva formulación de cemento puede deberse al efecto que producen tanto las micropartículas como los fármacos cuando se incorporan a la fase sólida, que da lugar a una mejora de la disipación de calor que se produce durante la polimerización del monómero.
Se ha estudiado ampliamente el uso de un antibiótico en el cemento óseo, fundamentalmente la gentamicina. También se ha estudiado la combinación de 2 antibióticos, demostrando, por un efecto sinérgico, la mayor liberación de antibióticos del cemento óseo por combinación del fenómeno de difusión en masa y de superficie. Pero hasta la fecha, no hay una combinación ideal que permita cubrir todas las infecciones. En este sentido, hemos seleccionado un antibiótico de amplio espectro, como es el linezolid (no utilizado en ningún modelo animal hasta ahora), como antibiótico de última generación con actividad frente a cepas resistentes20,21, que ha demostrado buena liberación in vitro22, con una excelente actividad antimicrobiana in vitro contra S. aureus16. La toxicidad celular in vitro de dicho antibiótico se ha acompañado de un comportamiento más agresivo en la histoarquitectura ósea en el cemento comercial respecto a la vancomicina y menor en las nuevas formulaciones de cemento. La fragilidad tisular de las muestras tras el período de descalcificación corrobora este hecho.
Las propiedades mecánicas de estas formulaciones son inferiores a las exigidas por la norma ISO-5833 para cementos utilizados en la fijación de prótesis articulares17 debido a la utilización de las micropartículas de PLGA. Esto tendría un efecto negativo para su utilización en cirugía primaria o de revisión, ya que produciría una complicación mecánica de la prótesis. No obstante, el objeto de este trabajo es la utilización de estos cementos como espaciadores en el tratamiento de las infecciones protésicas, en el intervalo entre el primer y el segundo tiempo. Estos espaciadores no necesitan las propiedades mecánicas requeridas para la fijación de un implante, aunque presentan suficiente resistencia y estabilidas23.
En el momento actual no existe un modelo experimental de osteomielitis ideal, y menos todavía para evaluar los resultados de la liberación antibiótica por diferentes biomateriales reproduciendo la infección protésica. El animal de experimentación más utilizado por su versatilidad y tamaño es el conejo, concretamente la variedad Nueva Zelanda. S. aureus es la bacteria más utilizada en los modelos experimentales, empleándose en un 70% cepas con relevancia en la práctica clínica y siendo, de estas, un 30% resistentes a meticilina24. Respecto al método de inoculación de la bacteria, el uso de un cuerpo extraño mejora el establecimiento de la infección respecto al uso de la suspensión bacteriana aislada, especialmente si el cuerpo extraño se introduce colonizado25, utilizando un inóculo variable entre 103 y 108.
En cuanto a la evaluación de la eficacia de cualquier tratamiento, las limitaciones para la comparación de resultados con los métodos tradicionalmente usados por su carácter semicuantitativo (bien microbiológicos, bien histológicos, bien radiológicos) hacen necesario avanzar hacia un amplio consenso sobre el método patrón oro, que incluya especialmente determinantes cuantitativos, para evaluar los resultados del tratamiento en los modelos experimentales de osteomielitis en animales, y que sustituya a los tradicionales contajes de UFC o determinación por PCR26.
La valoración del daño y la reparación tisular basada en la histoarquitectura nos permite conocer de un modo sencillo y eficaz el estado de los tejidos, que es ampliamente variable en función del trabajo consultado. En este aspecto, las escalas creadas por autores como Smeltzer et al.27 o Petty et al.28, así como sus múltiples adaptaciones posteriores, han sido muy utilizadas, si bien ambas evalúan aspectos muy específicos de la histoarquitectura ósea y, por tanto, muy variables según la cepa bacteriana, el inóculo y el modelo animal utilizados. La primera de ellas (Smeltzer et al.) utiliza parámetros concretos de la remodelación ósea, tales como la reacción perióstica, la respuesta inflamatoria aguda y crónica o la presencia de necrosis. Sin embargo, valorar los parámetros propuestos por Smeltzer et al. no es fácil, puesto que el comparar la respuesta ósea ante una infección bacteriana de forma tan individualizada tiene un alto porcentaje de variabilidad en las áreas de hueso afectadas, como hemos observado en nuestro modelo experimental. Por ello, es necesaria la valoración de toda el área afectada, para poder extrapolar esta situación a la clínica o poder crear un algoritmo adecuado.
Una clasificación menos utilizada, y sin embargo más objetivable desde el punto de vista histológico, es la propuesta por Petty et al., en la cual se describen claramente las alteraciones que pueden presentarse en las diferentes estructuras óseas. Sin embargo, este modelo no tiene en cuenta el propio proceso reactivo y reparativo en el que podemos encontrarnos en el momento del estudio, ya que principalmente valora la presencia de células inflamatorias correspondientes a procesos de inflamación aguda. En nuestro modelo, esta escala no podría ser valorada, pues la presencia de células inflamatorias a las 3 semanas es muy baja.
Basándonos en la experiencia anterior, nuestro modelo propone una nueva escala histológica que es capaz de valorar no solo los parámetros individuales mencionados, sino también la conservación y el remodelado de la histoarquitectura ósea y cartilaginosa. La valoración del tejido de forma completa nos aporta una visión global de la capacidad de reparación ósea y permite correlacionar el daño generado con la funcionalidad del tejido. La estructura de la escala hace posible que evaluadores menos experimentados sean capaces de visualizar los cambios en el tejido de forma clara y sencilla. Además, esta estadificación es aplicable a modelos experimentales que evalúen cualquier tipo de defecto óseo, incluso en estudios de biomateriales no infectados, algo que solo es posible si se estudian los defectos y el hueso neoformado circundante de forma completa. Por último, y no menos importante, nuestro modelo sigue permitiendo valorar en detalle las zonas de tejido más reactivas con las escalas ya descritas en la literatura, ya que mayores aumentos nos permiten evaluar la celularidad del tejido, la encapsulación de los materiales o la neoformación ósea en diferentes puntos.
En este sentido, la introducción de microesferas de PLGA que modifiquen la fórmula de cementos comerciales como Palacos® R permite controlar la agresividad de la infección sobre el tejido, mostrando una mejor conservación y remodelado de la arquitectura del hueso circundante en comparación con los cementos óseos tradicionales. De nuevo, la posibilidad de valorar el defecto completo de forma histológica con la escala propuesta nos permite comparar ambos tipos de cementos y su efecto sobre el hueso de forma sencilla.
La modificación del cemento comercial con la incorporación de las micropartículas de PLGA se pone de manifiesto en el estudio del comportamiento de las células macrofágicas, cuyos resultados evidencian que de nuevo las valoraciones cuantitativas pueden ser similares; sin embargo, la localización de las mismas nos muestra un diferente papel para este tipo de células. Así, se observa que estas células aparecen en acúmulos en la cápsula fibrosa en aquellos grupos que incluyeron PLGA, si bien no forman granuloma, sino que se mantienen como macrófagos. En los casos de cemento comercial, estas células, además de en su nicho natural (lagunas vasculares), eran observadas en los territorios de cartílago, lugar preferente para el depósito bacteriano. Este hecho confirma la dispersión bacteriana en el caso del cemento comercial.
Por tanto, aunque el cultivo del líquido sinovial y de los tejidos periprotésicos ha sido considerado el «patrón oro», pueden darse falsos positivos y falsos negativos29, más especialmente en las infecciones crónicas30. Estos resultados puede deberse a la irregularidad en la dispersión bacteriana y en la toma de muestras.
El método utilizado en este estudio experimental aporta una nueva visión global del comportamiento de la infección y el papel de los antibióticos a las 3 semanas, dando un paso en esta línea, y propone un nuevo método de estadificación del grado de desestructuración ósea originada por la infección y su interacción con el efecto del propio antibiótico. Esta propuesta pretende aportar una nueva herramienta para abordar tanto el diagnóstico como el tratamiento más adecuado de aquellos pacientes afectados por infecciones protésicas de bajo grado, donde las pruebas diagnósticas aplicables no son suficientes para hacer un diagnóstico correcto.
En conclusión, podemos decir que hemos desarrollado formulaciones de cementos óseos con la introducción de micropartículas de PLGA, que mejoran la liberación de antibiótico y que respetan, en mayor medida, la estructura ósea que les rodea. Esto puede tener una implicación clínica para el tratamiento de las infecciones protésicas provocadas por gérmenes resistentes a los antibióticos convencionales a través del empleo de espaciadores de cemento óseo.
Nivel de evidenciaNivel de evidencia i.
FinanciaciónEste estudio ha sido financiado por la beca de investigación Secot 2016/0055, dotada con 15.000€.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.