El objetivo de nuestro trabajo es evaluar in vitro el comportamiento y la capacidad inductora de la diferenciación osteoblástica de una vitrocerámica 55S (Vc) sobre una población de células madre mesenquimales adultas (del inglés mesenchymal stem cells [MSCs]) de conejo.
Material y métodosEl material se obtuvo mediante el método sol-gel. Las células se obtuvieron de aspirado de médula ósea de conejo y se sembraron sobre la Vc y sobre el plástico (control). Las MSCs se cultivaron en dos medios de cultivo, uno estándar DMEM (medio de crecimiento [Mc]) y otro inductor del fenotipo osteoblástico compuesto por DMEM complementado con dexametasona, ß-glicerofosfáto y ácido ascórbico-2P (medio osteogénico [Mo]). Se evaluó la morfología de las células que crecieron mediante microscopía electrónica de barrido. Se usó el ensayo de reducción de sales de tetrazolio (XTT) para la evaluación del crecimiento celular. Para determinar la diferenciación celular se cuantificó la producción de osteocalcina y la pérdida del antígeno de superficie CD90, característico de las MSCs.
ResultadosDurante el tiempo en cultivo las MSCs se adhirieron, proliferaron y formaron matriz extracelular mineralizada sobre la Vc, mostrando finalmente un fenotipo osteoblástico, produciendo osteocalcina y disminuyendo la expresión del antigeno CD90, independientemente del medio de cultivo utilizado.
ConclusiónEn base a estos resultados podemos afirmar que la Vc 55S se comportó como un material capaz de soportar la adhesión y el crecimiento de las MSCs y de inducir por sí misma la diferenciación de las MSCs a células de estirpe osteoblástica, mostrando por tanto, propiedades osteoconductoras y osteoinductoras.
The purpose of this work is to evaluate the in vitro behaviour and the capacity to induce osteoblastic differentiation of a 55S vitro-ceramic (Vc) on a population of adult rabbit mesenchymal stem-cells (MSCs).
Material and methodsThe material was obtained using the sol-gel method. The cells were obtained from rabbit bone-marrow aspirate and seeded over the Vc, and over plastic (control). The MSCs were cultivated in two culture media; one a standard DMEM (growth medium), and the other an osteoblastic phenotype inducer, composed of DMEM complemented with dexamethasone, ß-glycerophosphate and ascorbic acid-2-phosphate (osteogenic medium). The morphology of the cells that grew was assessed using a scanning electronic microscope. The tetrazolium salt reduction test was used for evaluating the cell growth. For cell differentiation, osteocalcin production and loss of CD90 bone surface antigen, characteristic of MSCs, were quantified.
ResultsDuring the culture time the MSCs adhered, proliferated and formed a mineralised extracellular matrix over the Vc. An osteoblastic phenotype finally being shown, producing osteocalcin and decreasing the expression of the CD90 antigen, regardless of the culture medium used.
ConclusionBased on these results we can state that Vc 55S behaved like a material capable of supporting adhesion and growth of MSCs and, in turn, inducing the differentiation of the MSCs to osteoblastic cell lines, thus showing osteoconduction and osteoinduction properties.
El tratamiento de defectos óseos de gran magnitud como los derivados de grandes traumatismos, pseudoartrosis, infecciones, etc., continúa hoy día siendo difícil de resolver, debido a la alteración de los tejidos circundantes tanto estructural como fisiológicamente.
Actualmente mediante la ingeniería tisular se están desarrollando sustitutivos tisulares biológicos como matrices, biovidrios, cerámicas, etc. con capacidad de albergar y diferenciar las células madre mesenquimales adultas (del inglés mesenchymal stem cells [MSCs]), sembradas sobre ellos, hacia distintos tipos celulares, tales como adipocitos, células musculares, neurales, etc. y entre ellos también los osteoblastos.
Para tal fin, se han diseñado multitud de ensayos con diferentes tipos celulares1–4 sembrados sobre distintas matrices, con el fin de obtener una combinación que permita la regeneración tisular ósea5–9.
Se han desarrollado numerosos materiales que intentan suplir el tejido óseo proporcionando el microambiente idóneo para la adhesión y la proliferación celular. Dichos materiales o matrices destinados a la siembra celular deben ser biocompatibles, tener la capacidad de integrarse en el hueso y ser capaces de soportar el crecimiento celular (osteoconductividad) mediante un diámetro de poro determinado10,11.
En base a lo expuesto, son muchas las estrategias que pretenden encontrar la combinación más adecuada de los diversos materiales para conseguir la regeneración tisular.
En este trabajo (estudio in vitro) se ha elegido la siembra de MSCs sobre una cerámica bioactiva para evaluar sus propiedades, siendo los objetivos del mismo:
- 1.
Evaluar si las MSCs son capaces de adherirse, proliferar y diferenciarse a osteoblastos sobre el biomaterial.
- 2.
Evaluar el efecto de dos medios de cultivo, el medio de crecimiento (MC) y el medio osteogénico (MO) sobre las MSCs sembradas sobre el biomaterial.
El vidrio precursor 55% SiO2; 41% CaO; 4% P2O5 (mol %) se obtuvo mediante el método sol-gel. El gel secado obtenido se molió y se tamizó hasta obtener una fracción de partículas con tamaños entre 32 y 68mm. Las piezas se obtuvieron compactando 0,1g del gel seco por compresión uniaxial (55MPa) seguida de presión isostática (150MPa) en moldes de acero. Después, se calentó el material a 1.100°C durante 3h. Finalmente, se obtuvieron discos de 4,8mm de diámetro y 1,3mm de longitud. Las fases cristalinas presentes fueron seudowollastonita (54%), wollastonita (38%) y cristobalita (4%). Todas las piezas se limpiaron aplicando aire a presión, lavadas varias veces en tampón fosfato salino y se envasaron individualmente antes de esterilizarse con gas-plasma.
Las piezas se caracterizaron por difracción de rayos X (Miccroanalysis-Link-ISIS software JEOL 6400, New Brunswick, Canadá), microscopia electrónica de barrido (MEB) (JEOL 6400, Microscope- Oxford Pentafet, New Brunswick, Canadá) y porosimetría de mercurio (Autopore III 9420, Micromeritics Instrumente, Norcross, GA, EE. UU.).
La bioactividad in vitro se evaluó sumergiendo el material en un fluido corporal simulado (SBF), durante 3 a 7 días. La morfología del material, antes y después de la inmersión en SBF se analizó con MEB, espectroscopia de energía dispersiva (EDS) y espectroscopia transformante de infrarrojos de Fourier (espectrómetro Nicolet NEXUS, Oxford, R.U.).
Obtención de células madre mesenquimales adultasLas células madre mesenquimales se obtuvieron mediante aspirado de médula ósea de conejo, para el aislamiento, el material aspirado se depositó en un tubo conteniendo heparina sódica (20U/l ml de aspirado), seguidamente, se pasó a través de una malla de nailon de 100μm para obtener células individuales. La suspensión de células se incubó con cloruro amónico 0,16M para lisar los eritrocitos y se centrifugó a 200g durante 10 minutos. Tras estimar la viabilidad con azul triptán, las células se sembraron en frascos de cultivo de 75cm2 (Sarsted) con 10ml de medio de cultivo estándar y se incubaron a 37°C en una atmósfera de CO2 del 5 y 95% de humedad relativa. El medio de cultivo utilizado fue α-MEM (Gibco) suplementado con un 15% de suero fetal de ternera (FCS; Gibco) y antibióticos (penicilina 100U/ml, estreptomicina 100μg/ml y anfotericina B 0,25μg/ml [Gibco]).
A los 7 días se renovó el medio de cultivo eliminando de esta forma las células hematopoyéticas no adherentes y seleccionando las MSCs en base a su comprobada capacidad para fijarse al plástico de los frascos. Cuando las células fueron confluentes, se subcultivaron en una relación 1:3 tratando el frasco de cultivo en tripsina al 0,25% y EDTA (0,02%) en tampón fosfato (PBS, pH7,4) durante 5 minutos.
Obtención de osteoblastos de controlLos osteoblastos (OBs) utilizados como controles se obtuvieron mediante el método de digestión enzimática. Muestras de tejido óseo esponjoso de 1-2mm fueron lavadas varias veces en PBS con antibióticos de rutina. A continuación, se incubaron durante 15 minutos a 37°C con colagenasa tipo XI (1,25mg/ml en solución de Hank's). El producto de la digestión se filtró a través de una malla de 100μm y se centrifugó durante 10 minutos a 200g. Las células obtenidas se resuspendieron en medio de cultivo (DMEM y Mam's F12 1:1, 10% FCS y antibióticos de rutina) y se tiñeron con azul triptán para establecer su número y viabilidad. El medio se renovó cada 3 o 4 días. La incubación se realizó a 37°C en atmósfera de 7,5% CO2 y humedad relativa del 95%. El primer subcultivo se realizó a los 7 días en frascos de 25cm2 utilizándose los dos primeros subcultivos para la identificación de células.
Siembra de células madre mesenquimales adultas sobre vitrocerámicaPara evaluar el comportamiento de las células madre sobre nuestra matriz, ensayaremos sendos cultivos con dos medios diferentes. A su vez, también estudiaremos la acción y el comportamiento de ambos medios sobre las células madre en cuanto a su proliferación y diferenciación.
Los dos medios de cultivo son:
- 1.
Medio de crecimiento (MC): compuesto por α-MEM suplementado con un 10% de FCS y antibióticos (penicilina 100 U/ml, estreptomicina 100μg/ml).
- 2.
Medio osteogénico (MO) o medio de diferenciación: compuesto por el MC al que se le añade ácido l-ascórbico-2P (0,2mM) (Sigma, Madrid, España), dexametasona (10nm) (Sigma) y β-glicerolfosfato (10mM) (Merck, Madrid, España). que actúan como inductores del fenotipo osteoblástico en este medio12-15
Para nuestro estudio se siembran dos series de placas de 96 pocillos con discos de nuestra cerámica en su interior con 1×105 células. A una se le añade medio de crecimiento, a la otra medio osteogénico y se mantienen a 37°C, 5% CO2 y a 95% de humedad relativa. Como controles se siembran otras dos series de 96 pocillos en las mismas condiciones pero usando discos de plástico en vez de cerámica.
El fondo de los pocillos se cubrió con agarosa al 0,6% y sobre ella se colocaron los discos. De este modo se aseguró que el incremento del número de células detectado durante el estudio correspondería únicamente a las células que crecían adheridas al material.
Estudio celularMorfología (microscopía electrónica de barrido)Para el estudio con MEB se procede a la siembra de 1×105 células en tubos de Leighton y se añaden ambos medios de cultivo durante 15 días. Se realizó el cambio de medio cada 3 o 4 días. Posteriormente, las células cultivadas se lavaron con PBS, se fijaron con glutaraldehído al 3% en tampón cacodilato 0,1M durante 30 minutos a 4°C. Seguidamente, se lavaron y postfijaron en tetraóxido de osmio durante 1h y se deshidrataron a través de concentraciones crecientes de etanol (30, 50, 70, 90 vol%) con deshidratación final en alcohol absoluto. Posteriormente se secaron mediante el método de punto crítico, se recubrieron con oro y se observaron con un microscopio electrónico de barrido marca Jeol T-6100 a 15kV.
La superficie de la cerámica también se observó con el fin de comprobar si las células eran capaces de crecer y adherirse al material. Para ello usamos el mismo procedimiento anterior.
Crecimiento cuantitativo (absorbancia)Para determinar el número de células (aproximado) que fueron capaces de crecer se usó el ensayo de reducción de sales de tetrazolio (XTT). A cada pocillo se añadió XTT con una concentración final de 0,2ng/ml con menadiona al 0,02M y se incubaron durante 4 horas. La absorbancia del cultivo celular sobre la cerámica fue medida mediante un lector de placas (Labsystem, Multiscan MCC 340) a 450nm.
Diferenciación celularProducción de osteocalcinaLa osteocalcina (OC) es un marcador bioquímico característico exclusivamente de osteoblastos. Para la determinación se usaron cultivos de MSCs sobre plástico y sobre la cerámica, en ambos medios de cultivo durante 27 días. La presencia de OC se midió de los sobrenadantes de los cultivos y fue determinada mediante el kit Gla-type osteocalcin EIA (Reactiva S.A., Barcelona, España), aplicándose el ensayo a todas la muestras y a los estándares del kit por triplicado. Se usó una línea de osteoblastos como control positivo.
Disminución expresión CD 90El antígeno CD90 está presente en la superficie de las MSCs y se va perdiendo conforme se diferencian éstas, de manera que si son capaces de diferenciarse a osteoblastos hallaremos una disminución de la expresión del CD90 tanto mayor cuantas más células hayan sido capaces de diferenciarse.
Para determinar la presencia o no del antígeno se usó su anticuerpo (CD90) marcado con fluoresceína isotiocianato (BD Pharmingen, BD-Biosciences Europa, Bruselas, Bélgica). Después de 27 días de cultivo las células se separaron del tubo de cultivo mediante tripsina/EDTA (0,25/0,25%) y se ajustaron a una concentración de 5×106 cel/ml. De la suspensión se tomaron 100μl y se añadieron 5μl de anticuerpo marcado (0,5mgml−1), se incubaron durante 15 minutos. Una vez hecho esto, las muestras se analizaron mediante un citómetro de flujo (Becto-Dickinson modelo FACSort con láser de argón de 488nm y 15mw).
Como controles se usaron la línea celular primaria de osteoblastos aislados previamente (controles positivos) y la línea celular Kato III de carcinoma humano gástrico como control negativo.
Análisis estadísticoSe aplicó un análisis de varianza (ANOVA) de media repetidas para ver la significación estadística de los datos obtenidos en el estudio.
ResultadosCaracterización del materialEl material mostró que la fase cristalina fue seudowollastonita, wollastonita, fosfato tricálcico y cristobalita. La formación de una capa de apatita sobre la superficie del material después de la inmersión en SBF fue un indicador de bioactividad in vitro. A los tres días de inmersión, la superficie del material se recubrió con una neocapa de pequeños agregados de aspecto cristalino, tamaño que se incrementó a los 7 días de inmersión. El análisis mediante EDS mostró un incremento del contenido de calcio y fósforo y una disminución del contenido de silicio, mientras que en el espectro de infrarrojos se observaron nuevas bandas correspondientes a grupos fosfato (fas apatita) y una disminución de las bandas de seudowollastonita debida a la solubilización de esta fase.
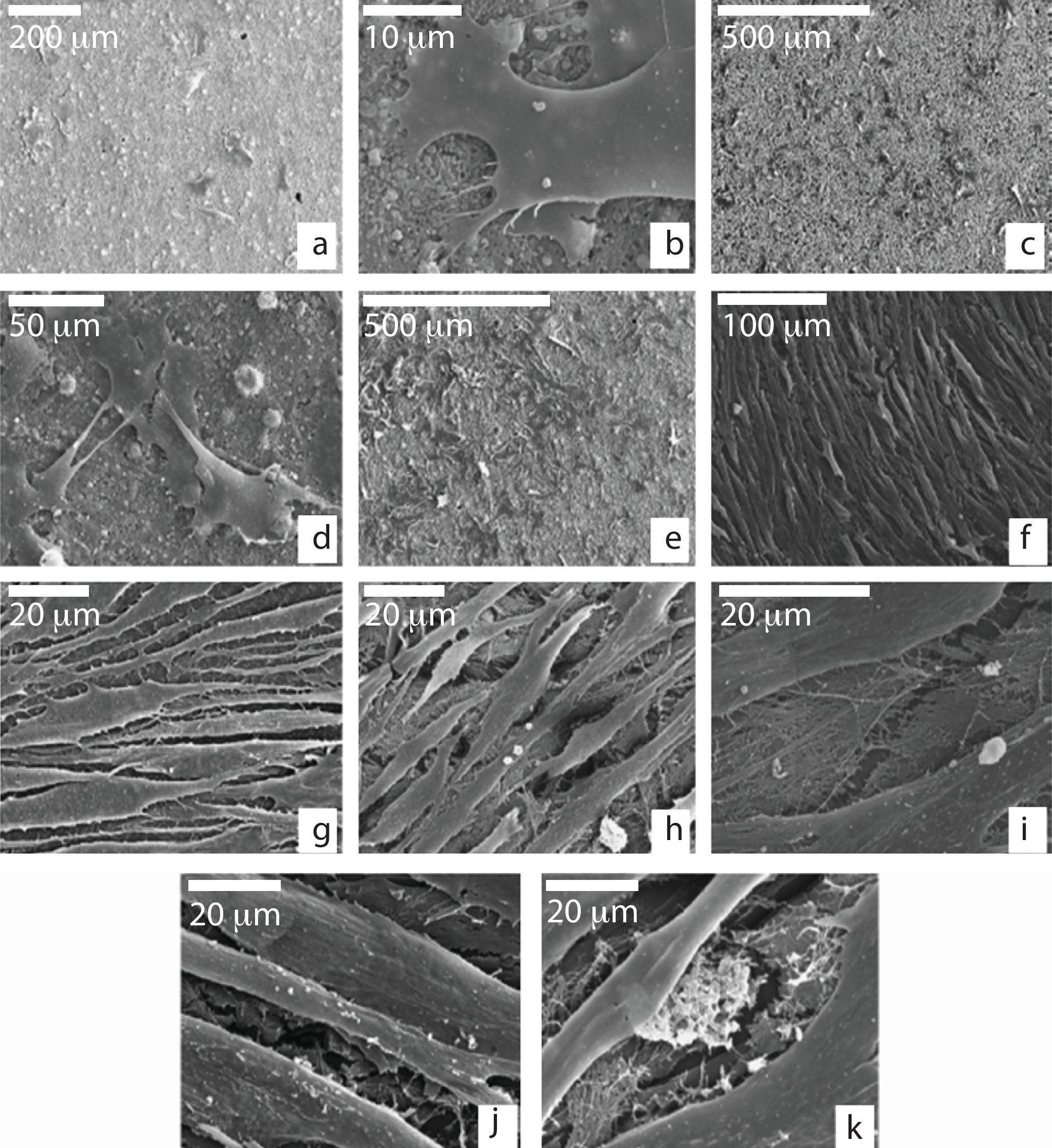
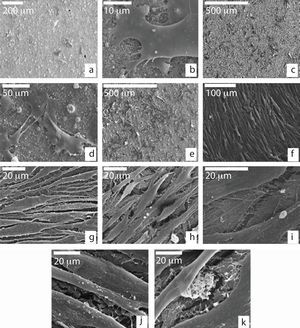
Comportamiento de células madre mesenquimales adultas sobre la cerámicaMorfología: microscopía electrónica de barridoSe observaron las MSCs sembradas en tubos de Leighton determinándose que poseían una morfología aplanada y alargada con prolongaciones citoplasmáticas (fig. 1a) En su superficie se observaban espículas y pequeños nódulos, los cuales eran más abundantes en las células que crecieron sobre el medio de crecimiento (MC) (fig. 1b-d). Conforme fueron pasando los días, las células fueron confluyendo unas con otras formando varias capas y adoptando una morfología fusiforme, con numerosas interconexiones celulares y filopodios. Mostraban una tendencia a orientarse en la misma dirección. Las células mostraban la misma morfología independientemente del medio de cultivo donde crecieron (fig. 1e y f), solo que, las que crecieron en MO fueron capaces de formar nódulos mineralizados entre una trama de matriz fibrilar extracelular (fig. 1g y h).
Microscopía electrónica de barrido de MSCs cultivadas en MCo MO sobre plástico a los 7 días (a-d) y a los 15 días (e-h); a) aspecto aplanado e interconexiones celulares en ambos medios de cultivo; b y c) presencia de espículas y pequeños nódulos en la membrana celular más evidente cuando se usa el MC; d) detalle de la membrana celular en MC; e y f) morfología fusiforme y células confluentes (MC); g y h) formación de nódulos extracelulares en presencia de MO.
Al observar las células que se sembraron sobre el biomaterial, se vio en las primeras 24 horas (fig. 2a) que crecían individualmente o en pequeños grupos dispersos sobre la superficie granular del material, siendo su morfología similar a las sembradas en tubos de Leighton. Se vio que exhibían múltiples filopodios citoplasmáticos en aras de aumentar la superficie de contacto con el material y así, por tanto, su capacidad de adhesión (fig. 2b).
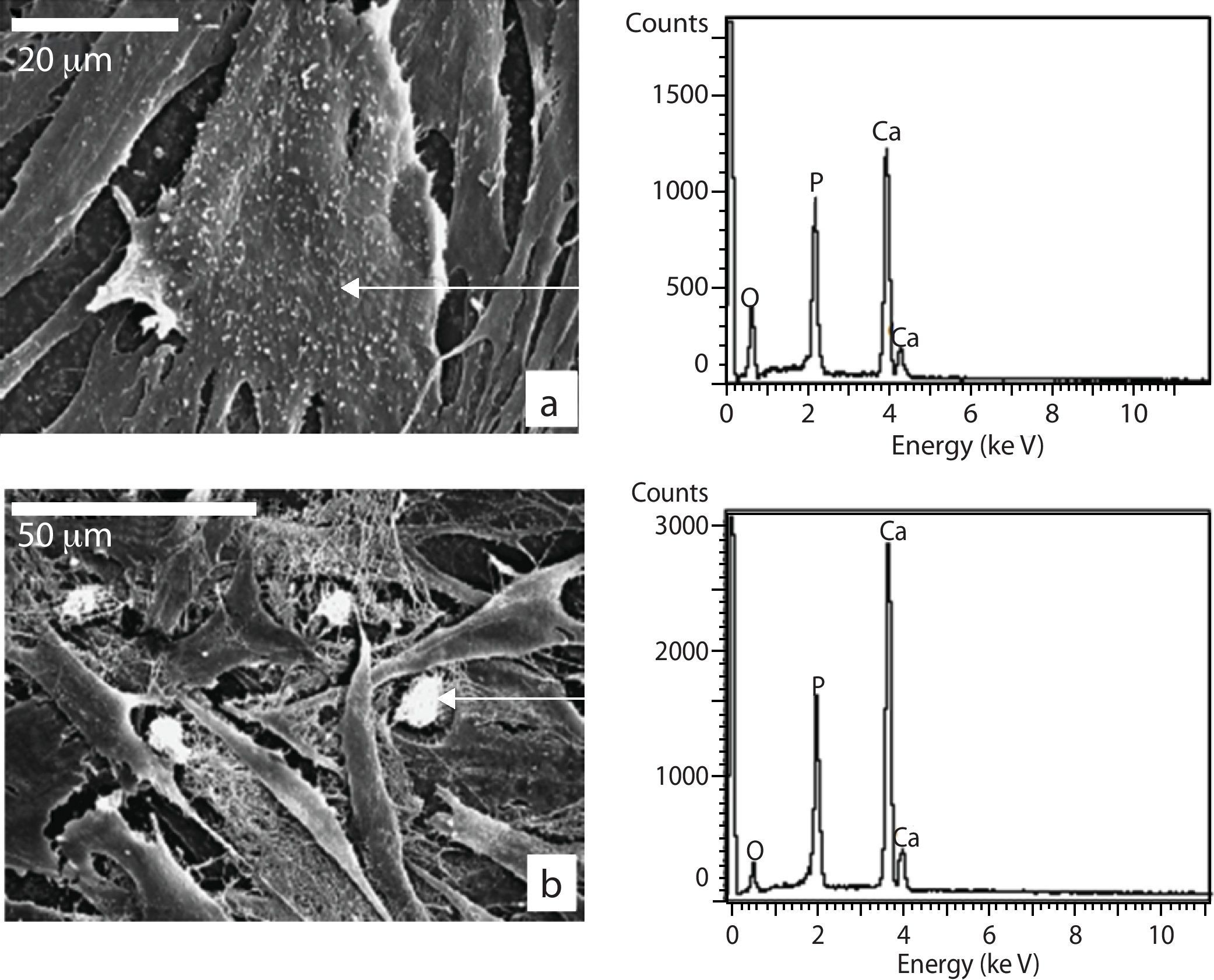
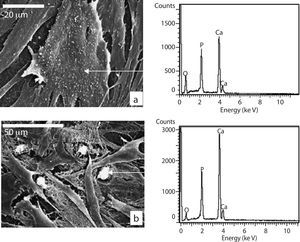
Microscopía electrónica de barrido células sembradas sobre la cerámica; a) MSCs con morfología poligonal adheridas a la superficie de la cerámica a las 24 horas de cultivo; b) MSC adhiriéndose a la cerámica mediante prolongaciones citoplasmáticas (filopodios); c y d) formación de agrupaciones con interconexiones citoplasmáticas a los 7 días de cultivo; e) proliferación celular después de 14 días de cultivo; f-h) crecimiento y morfología a los 21 días de cultivo; i) detalle de la trama fibrilar extracelular ocupando espacios intercelulares; j y k) aspecto granular de la superficie citoplasmática y depósitos granulares extracelulares a los 21 días de cultivo.
A los 7 días de cultivo, las células fueron formando pequeñas colonias y mostraron algunas interconexiones citoplasmáticas entre ellas (fig. 2c y d).
A los 14 días, las células siguieron creciendo y en ese momento se observa que son capaces de formar pequeños depósitos de matriz fibrilar extracelular (fig. 2e).
Entre los días 21 y 27, las células se van agrupando adoptando una morfología fusiforme, muestran un gran número de interconexiones y formando una única capa celular que llega a cubrir la totalidad del disco de cerámica (fig. 2f-h).
En cuanto al medio de cultivo utilizado no se observaron diferencias celulares en cuanto a su morfología, sin embargo, con el MO se vio un aumento de matriz extracelular con depósitos mineralizados con respecto al MC (fig. 2i). Además, las células mostraron una apariencia granular debido a la presencia de numerosos nódulos en su superficie (fig. 2j y k).
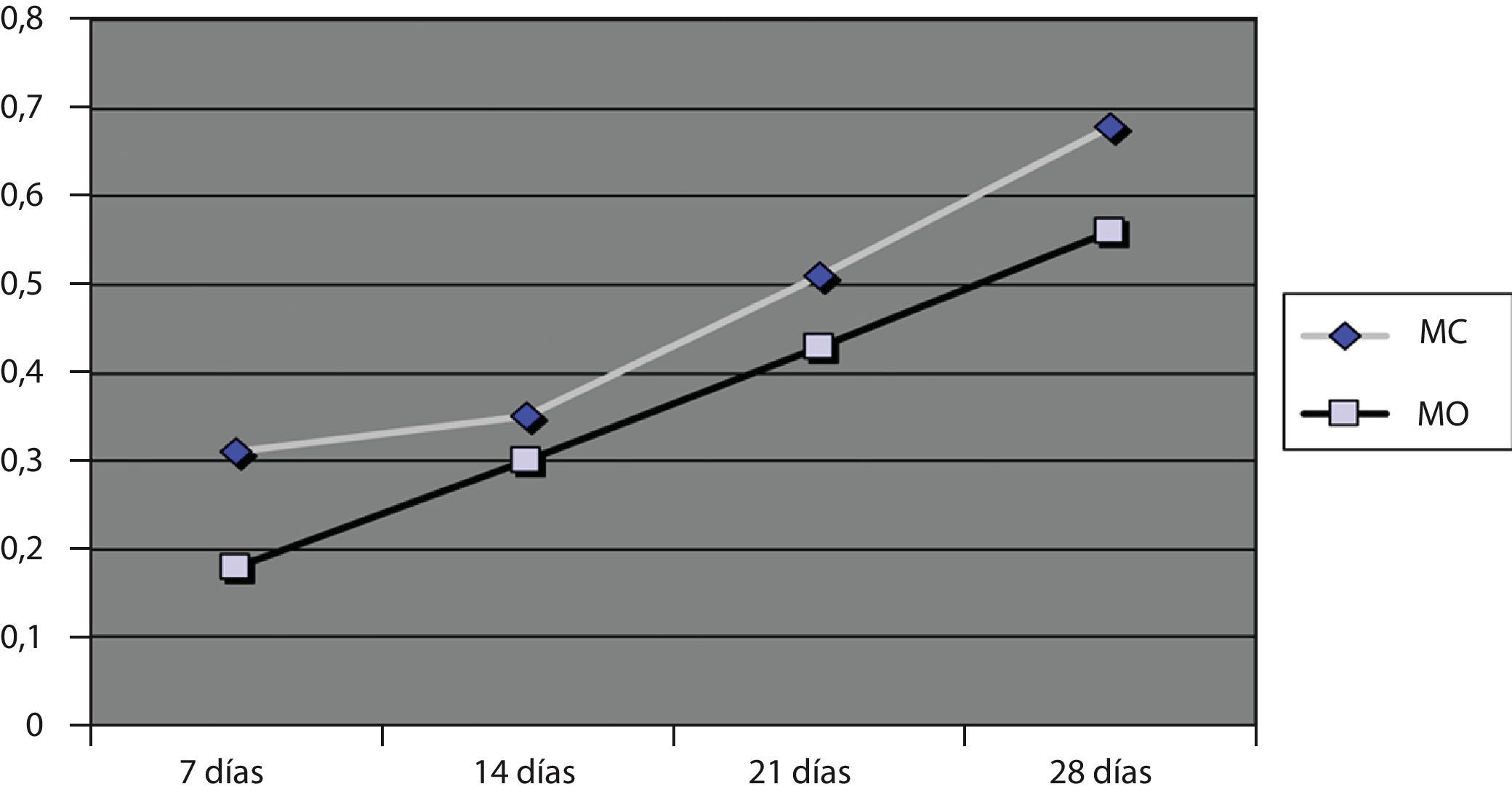
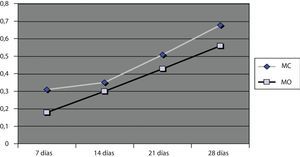
Crecimiento cuantitativo (absorbancia)Los valores de absorbancia obtenidos a las 24 horas fueron menores de 0,2 para el MO y 0,3 para el MC, indicando que el número de células que se habían adherido al material en ambos medios de cultivo fue bajo. Sin embargo, a lo largo del tiempo los valores de absorbancia y por tanto el número de células presentes, aumentó linealmente tal y como se puede apreciar en la figura 3.
El valor de absorbancia para el MO a los 28 días fue de 0,55 y para el MC de 0,68. Aunque en MC creció mayor número de células, no se vieron diferencias significativas en cuanto al crecimiento celular para ambos medios de cultivo (p<0,005), pero sí para el efecto día (p<0,005).
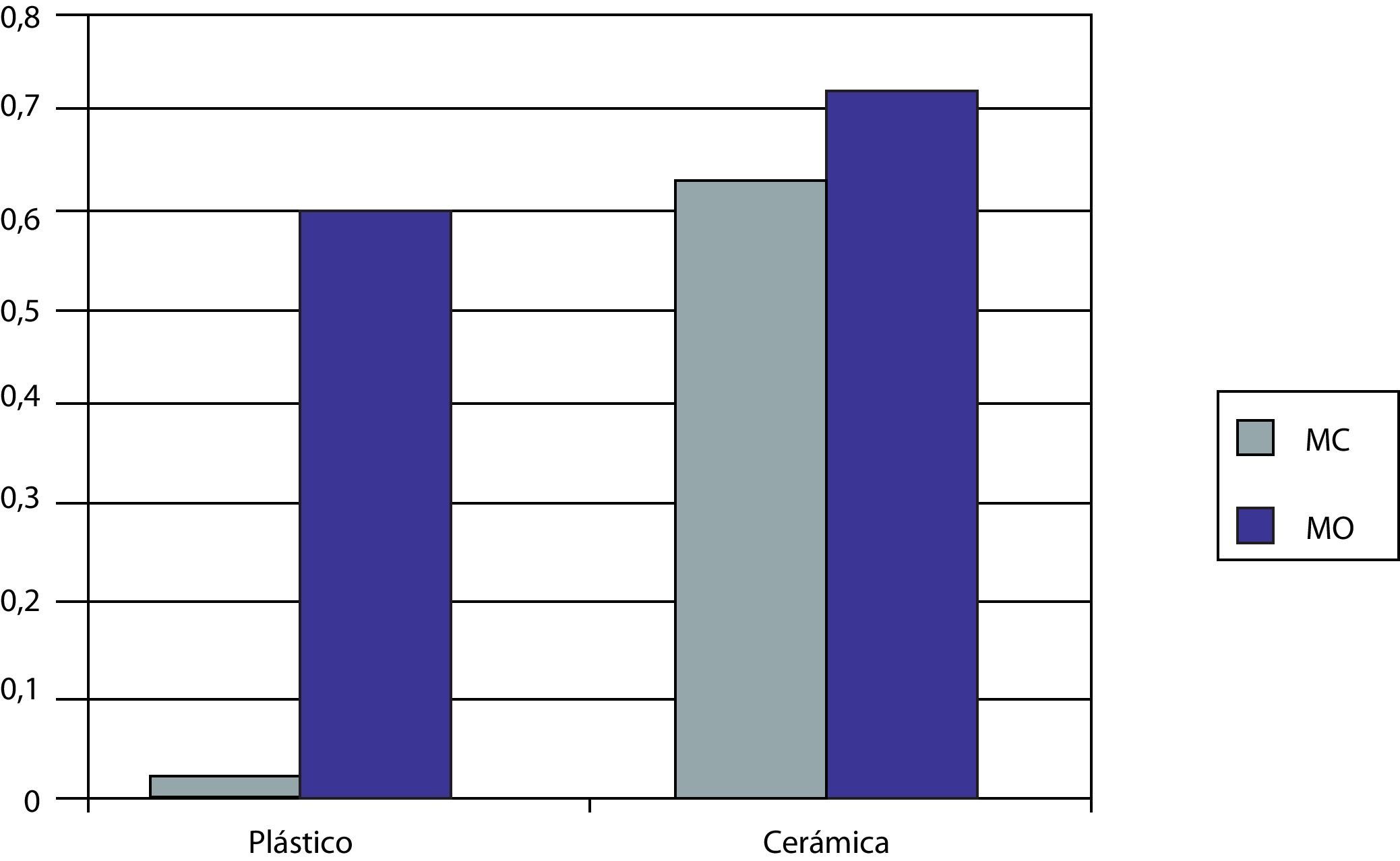
Diferenciación celularProducción de osteocalcinaLa figura 4 muestra los niveles de OC producidos en los cultivos de MSCs sobre el biomaterial y sobre el plástico control en ambos medios de cultivo a los 27 días.
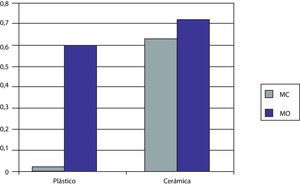
Cuando las MSCs se siembran sobre el plástico control usando el MC se vio que la cantidad de OC producida fue muy pequeña (0,02U). Sin embargo, cuando se usa el MO, este nivel aumenta significativamente hasta 0,67U.
Si usamos ahora nuestro biomaterial para la siembra, vemos como en presencia de MC se produce una cantidad similar de OC a la obtenida usando el MO en plástico (0,64U). Si usamos el MO vemos como la cantidad de OC aumenta (0,76U).
Vemos, por tanto, que el MO por sí mismo es superior en cuanto a la capacidad para la diferenciación celular a OBs que el MC y la cerámica 55S superior al plástico para el mismo fin. Este efecto se ve aumentado si se combinan el MO y la cerámica.
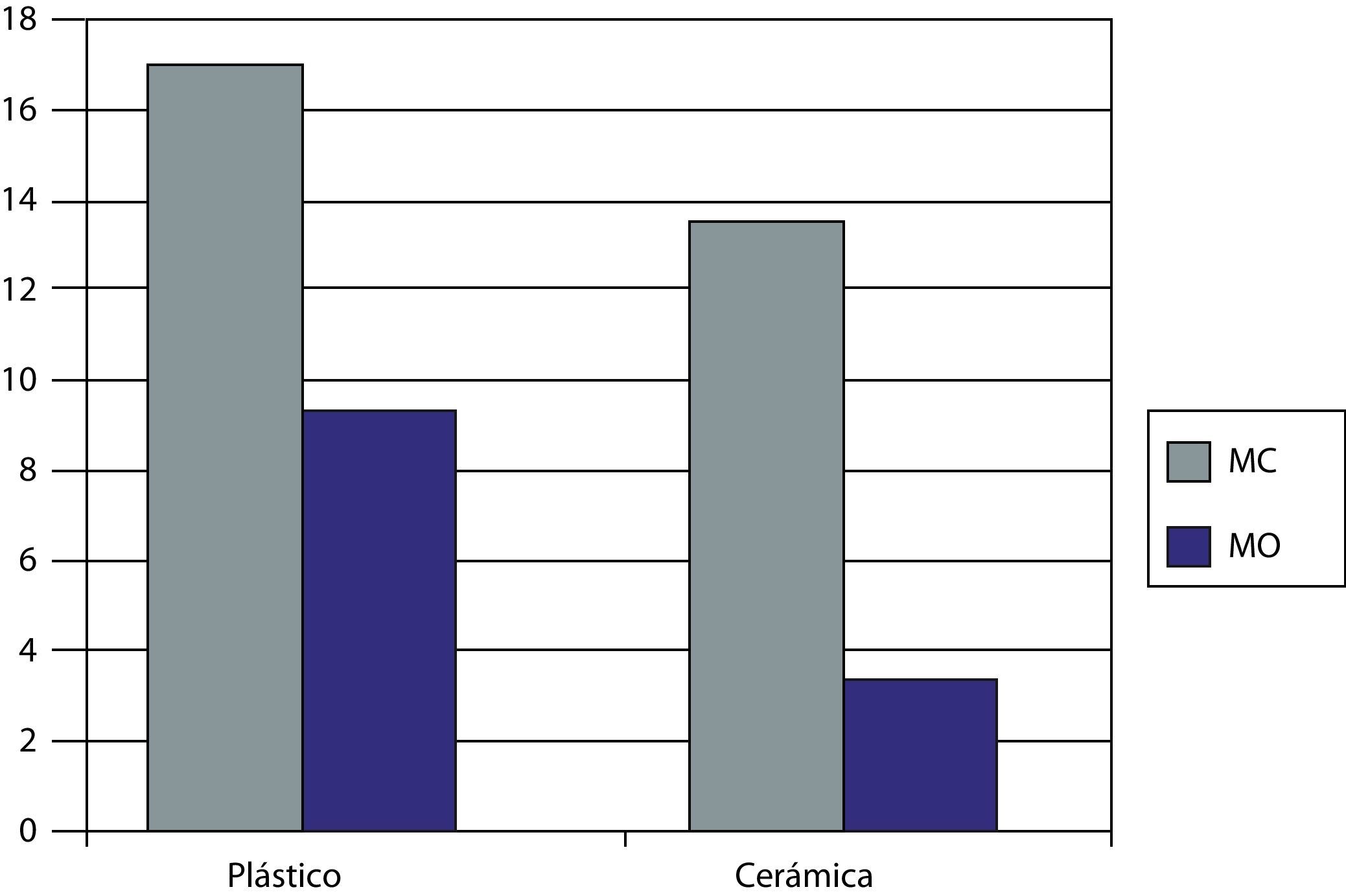
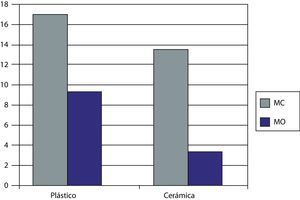
Expresión del marcador CD90En la figura 5 se representan los niveles obtenidos de CD90, característico de las MSCs, en presencia del biomaterial y el plástico y en presencia de ambos medios de cultivo a los 27 días de cultivo.
Se vio como las células Kato III (controles negativos) no obtenían valores CD90 como era de esperar. Los OBs obtenidos previamente y usados como controles positivos obtuvieron unos valores de CD90 de 3.93U.
Para las células sembradas sobre el plástico control se obtuvieron unos valores de fluorescencia de mayores para el MC (17,9U) que para el MO (10,2U) obteniendo una disminución de la presencia de CD 90 en un 43%. Cuando usamos el biomaterial los valores obtenidos fueron de muy superiores para el MC (14,5U), obteniendo una reducción de la expresión del marcador del 19% con respecto al plástico control. Para el MO en presencia de la cerámica 55S obtenemos un valor de 4,2U, una reducción de la expresión de CD 90 en un 71% con respecto al MC sobre la cerámica y de un 58% con respecto al plástico control con el mismo medio de cultivo (MO).
Matriz extracelularA los 16 días de cultivo, las MSCs sembradas en tubos de Leighton fueron capaces de formar matriz extracelular en ambos medios de cultivo.
Mediante microscopía electrónica se evidenció una red fibrilar que ocupaba los espacios intercelulares y que en presencia de MO era capaz de formar depósitos granulares de aspecto blanquecino.
Por otra parte, las células que crecieron sobre los discos de cerámica desarrollaron una matriz extracelular de similares características.
Para determinar la naturaleza de los nódulos se procedió al microanálisis mediante SEM-EDS que mostró un espectro compuesto principalmente por P, Ca y Mg como puede apreciarse en la figura 6.
Análisis estadísticoObtenemos significación estadística (p<0,005) para el efecto día, medio de cultivo y superficie de siembra.
DiscusiónLa sustitución del tejido óseo mediante técnicas de ingeniería tisular implica el uso de materiales biocompatibles, osteoconductores y bioactivos formando parte de matrices que favorezcan la adherencia y el crecimiento celular in vitro, para posteriormente trasplantarse en el defecto que se va a reparar. Diversos materiales han demostrado su capacidad de influir en la adherencia, proliferación y diferenciación de un modo muy variable, debido a las características dinámicas o reactivas de su superficie, que permite la liberación de iones Ca, P, Si, Na, Mg que cuando entran en contacto con los fluidos biológicos pueden influir en la respuesta celular favoreciendo la osteogénesis y la producción de factores de crecimiento10,11.
La cerámica desarrollada para este estudio presenta una composición de 55 SiO2; 41 CaO; 4 P2O5 (mol/%) y ha mostrado una rápida bioactividad in vitro relacionada con la formación de una capa de apatita en su superficie, a los tres días de inmersión en suero simulado humado (SBF)12,13. Esta capa es esencial para la unión química primaria entre el material y el tejido óseo receptor después de su implantación.
Es sabido que la medula ósea contiene poblaciones heterogéneas de células multipotenciales precursoras de estirpe reticular, osteogénica, condrogénica, miogénica, adipogénica, etc. capaces de diferenciarse por acción de señales inductoras de tipo proteico, químico, mecánico, etc. en osteoblastos, condorcitos, mioblastos, adipocitos, etc. Así, la ingeniería tisular persigue el lograr sustratos sobre los que sembrar estas células multipotenciales (MSCs) para diferenciarlas a la línea tisular deseada, bien mediante el propio biomaterial, bien mediante la adicción de medios de cultivo osteoinductores o mediante la acción conjunta de ambos12–15.
En relación con la morfología, las células que crecieron sobre la cerámica 55S inicialmente mostraban una forma expandida, digitaciones citoplasmáticas y una membrana celular lisa y homogénea. Con el tiempo en cultivo, algunas exhibían muchas irregularidades dorsales en la membrana celular a modo de pequeños gránulos que se analizaron mediante SEM-EDS mostrando un espectro compuesto por Ca-P muy similar a los depósitos extracelulares. Además, las células exhibían abundantes filopodios y conexiones intercelulares, hallazgos similares a los observados por Vrouwenvelder et al.16 y descritos como característica de las células osteoblásticas. Además de estos hallazgos, se vio que células mostraron una buena adhesión a la superficie del material exhibiendo una gran cantidad de expansiones citoplasmáticas al mismo, tal y como se puede comprobar en diseños utilizando otras matrices de hidroxiapatita, titanio y biovidrios macroporosos16,17.
La producción de OC es un marcador bioquímico de uso frecuente en la determinación de la funcionalidad de los OB, al igual que la producción de fosfatasa alcalina y colágeno tipo I. Sin embargo, la producción de OC es una característica exclusiva de los OB, y se considera el procedimiento más sensible y específico a diferencia de la producción de fosfatasa alcalina y colágeno I, que también son producidos por fibroblastos y otros tipos celulares. Por este motivo, la producción de OC fue el criterio utilizado en nuestro estudio para controlar el proceso de diferenciación de MSCs aisladas de médula ósea a OB18. Para valorar su producción, tanto las MSCs como los OB aislados se cultivaron en MC. En esta situación, los OB produjeron espontáneamente cantidades apreciables de OC; por el contrario, las MSCs no fueron capaces de hacerlo en los primeros subcultivos ni después de dos meses en cultivo. Sin embargo, cuando las MSCs se cultivaron sobre la cerámica objeto de estudio, se observó un incremento en la producción de OC sugerente de que expresaban fenotipo osteoblástico. A este efecto se sumó la pérdida paulatina de la expresión del marcador CD90 característico de las MSCs. Sobre la base de estos hallazgos, podemos asumir que el material ejerce por sí mismo un cierto efecto inductor de la diferenciación de las MSCs a osteoblastos.
Para valorar la capacidad de proliferación, las MSCs se sembraron sobre el material añadiendo agarosa al fondo de los pocillos para evitar la adherencia y el crecimiento de las células en los espacios entre el disco y las paredes de los mismos. Los hallazgos en los diferentes períodos del estudio mostraron una buena adherencia de las células sobre la superficie de los discos de cerámica, dada la forma desplegada que exhibían. Este hecho, en coincidencia con Vitale-Brovarone et al.19, tiene lugar en un primer momento y es previo a la proliferación y diferenciación. Las células crecieron de forma exponencial, si bien en los primeros momentos su crecimiento fue algo más lento debido al período de adaptación al medio.
En cuanto a la citocompatibilidad del material, tanto la adherencia como la producción de OC son datos para considerar a la hora de valorar esta propiedad. En nuestro estudio, el hecho relevante de observar tanto una excelente adherencia y proliferación celular así como un incremento de la producción de OC constituye un indicador de biocompatibilidad.
ConclusionesA la vista de los resultados obtenidos podemos concluir:
- 1.
Tras el estudio realizado podemos concluir que las hMSCs son capaces de adherirse, proliferar y diferenciarse a osteoblastos sobre la cerámica 55 S.
- 2.
Al evaluar el efecto de ambos medios de cultivo sobre la cerámica 55S podemos concluir, que ambos promueven el crecimiento y diferenciación de las hMSCs a osteoblastos siendo superior el MO al MC para tales efectos.
Nivel de evidencia III.
Responsabilidades éticasProtección de personas y animales. Los autores declaran que los procedimientos seguidos se conformaron a las normas éticas del comité de experimentación humana responsable y de acuerdo con la Asociación Médica Mundial y la Declaración de Helsinki.
Confidencialidad de los datos. Los autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informado. Los autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Artículo presentado en el 47 Congreso SECOT combinado con el 11th Congreso EFFORT, Madrid 2010.