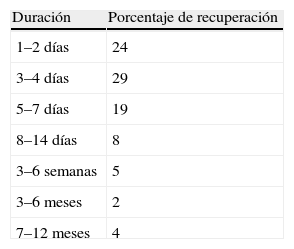
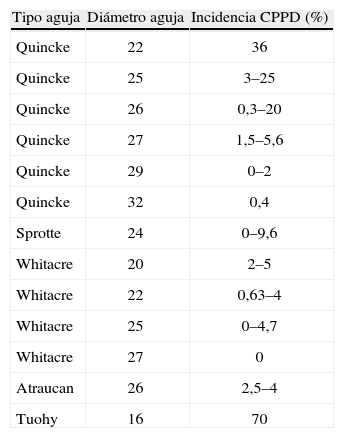
La cefalea postpunción dural es la complicación mayor más habitual tras la anestesia neuroaxial, y es especialmente frecuente en obstetricia. Suele ser una complicación benigna y autolimitada, pero sin tratamiento puede conducir a otras complicaciones más graves e incluso puede producir la muerte. Se han propuesto múltiples medios de profilaxis y tratamiento, pero en muchos casos la evidencia científica es insuficiente. Para su profilaxis tras una punción dural accidental la única medida eficaz es dejar el catéter en posición intradural; la morfina epidural también podría serlo. Una vez instaurado el cuadro clínico, debe prescribirse un tratamiento conservador durante las primeras 24horas. Si fracasa, la medida más efectiva continúa siendo el parche hemático epidural, que no se debe demorar más de 24–48horas para no prolongar el sufrimiento de la paciente. Si son necesarios más de dos parches, hay que descartar otra causa potencialmente grave de la cefalea.
Postdural puncture headache is the most common major complication following neuraxial anesthesia; this adverse event is particularly frequent in obstetrics. The headache is usually benign and self-limited but if left untreated can lead to more serious complications that may be life-threatening. Many treatments and prophylactic measures have been suggested, but evidence supporting them is scarce in many cases. After accidental dural puncture the only effective preventive measure is to leave the catheter inside the dura; epidural morphine infusion may also help. Once symptoms begin, treatment is conservative for the first 24hours. If this approach fails, the most effective intervention continues to be a blood patch, which should not be delayed beyond 24 to 48hours in order to avoid suffering. If more blood patches are required, other possible causes of headache should be ruled out.
Artículo
Comprando el artículo el PDF del mismo podrá ser descargado
Precio 19,34 €
Comprar ahora