La recombinación somática aleatoria de los receptores de célulasT facilita la variabilidad de respuesta frente a antígenos exógenos. Posteriormente a ella se da la tolerancia central, mecanismo dirigido a evitar la salida del timo de célulasT autorreactivas. Sin embargo, fallos en este proceso pueden inducir la aparición de autoinmunidad.
Materiales y métodosEsta revisión narrativa se llevó a cabo mediante una búsqueda de la literatura enfocada en describir conceptos relevantes y recientes de la tolerancia central de las célulasT.
ResultadosMúltiples grupos celulares hacen parte del microambiente tímico, entre los cuales las células epiteliales tímicas son las encargadas de dirigir el desarrollo de los timocitos, específicamente las células epiteliales tímicas medulares que dirigen el proceso de selección negativa.
ConclusionesLos factores que afectan a los timocitos, el microambiente tímico o la interacción entre estos pueden llevar al desarrollo de inmunodeficiencias o autoinmunidad.
Random somatic recombination of Tcell receptors facilitates the variability of response to foreign antigens. Then, central tolerance occurs, a mechanism designed to avoid exit of autoreactive Tcells from the thymus. However, failures in this process can induce the appearance of autoimmunity.
Materials and methodsThis narrative review was conducted through a literature search focused on describing relevant and recent concepts of central tolerance of Tcells.
ResultsMultiple cell groups are part of the thymic microenvironment, among them, thymic epithelial cells are responsible for directing development of thymocytes, especially medullary thymic epithelial cells that direct the negative selection process.
ConclusionsFactors that affect thymocytes, the thymic microenvironment, or interaction between them, can lead to development of immunodeficiencies and/or autoimmunity.
La función principal del sistema inmune es la protección de lo propio frente al peligro de lo extraño. Para ello, por medio de un proceso de recombinación somática aleatoria de segmentos de ADN, se obtiene una amplia diversidad de receptor de célulasT (TCR, por sus siglas en inglés) y de célulasB, que les permite tener reactividad frente a una cantidad ilimitada de antígenos exógenos. Sin embargo, la recombinación de dichos receptores puede ocasionar la formación de linfocitos autorreactivos y ocasionar lesiones por autoinmunidad1,2.
Uno de los mecanismos para disminuir el riesgo de lesiones por autorreactividad es la instauración de tolerancia inmunológica, definida como la ausencia de respuesta a un antígeno, inducida por la exposición a este. La tolerancia central o tímica pretende asegurar que los linfocitosT maduros que dejan el timo sean incapaces de responder frente a autoantígenos3. Los mecanismos de instauración de tolerancia no son infalibles, lo cual conlleva la presencia de enfermedades autoinmunes sistémicas u órgano-específicas en una de cada 15 personas en Estados Unidos4.
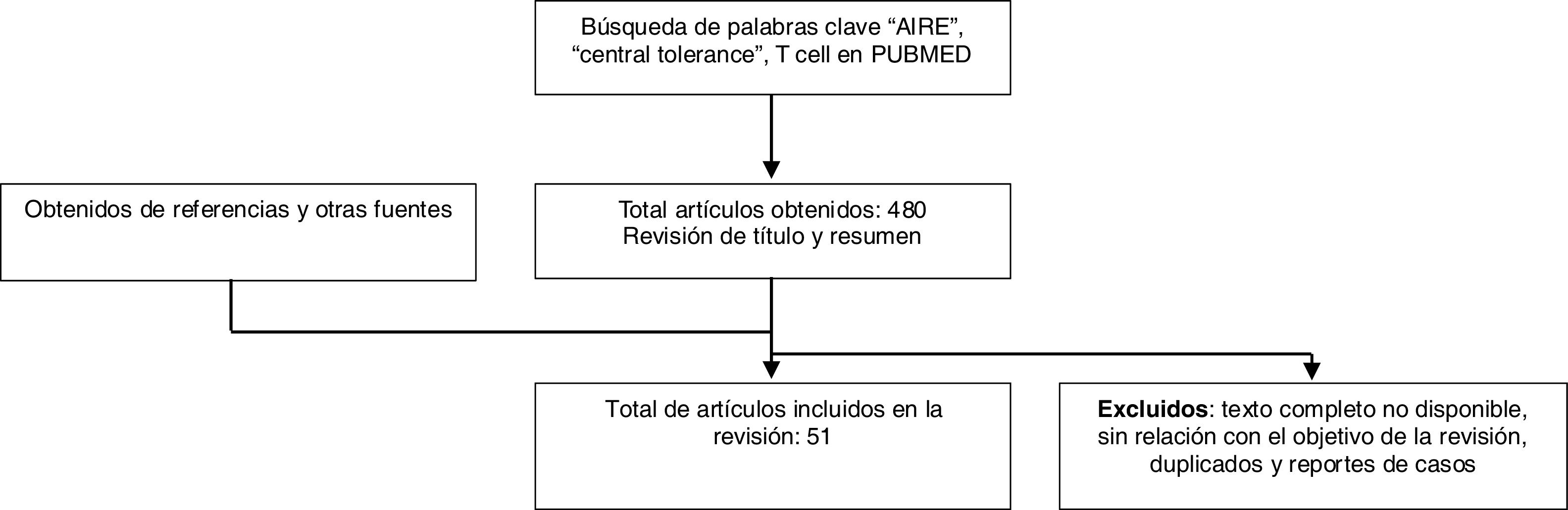
MetodologíaSe realiza una búsqueda de literatura en la base de datos PubMed, limitada a los últimos 5años, en la cual se tuvieron en cuenta artículos en inglés y en español. Las palabras clave utilizadas fueron: «AIRE», «central tolerance» y «T cell», que fueron combinadas con el término booleano «AND». La búsqueda arrojó un total de 480 artículos, los cuales incluían en su título principal o en su resumen las palabras clave. Mediante la revisión de resúmenes se seleccionaron 51 artículos. Se excluyeron los artículos que no tuvieran disponible el texto completo o no tuvieran relación con el objetivo de esta revisión, estudios duplicados y reportes de casos. Se revisaron algunas referencias bibliográficas de los artículos seleccionados (fig. 1). Esta revisión narrativa pretende describir conceptos relevantes y recientes de la tolerancia central de las célulasT y se llevó a cabo siguiendo los principios éticos para realizar investigación en Colombia, como reza en la Resolución 8430 de 1993.
ResultadosLa tolerancia central es un fenómeno inherente al desarrollo de los linfocitosT y tiene lugar en el timo, el cual, junto a la médula ósea, es considerado un órgano linfoide primario. El timo soporta el desarrollo y la diferenciación de varios tipos celulares, como los linfocitosT CD4+, los linfocitosT CD8+, las célulasT reguladoras, las célulasγδ y las célulasT invariantes asesinas naturales. Para ello son fundamentales los nichos estromales del microambiente tímico, compuestos de forma predominante por las células epiteliales tímicas (TEC, por sus siglas en inglés) y por otros grupos de células estromales como fibroblastos, células mesenquimatosas, pericitos y células endoteliales. Entre ellas, las TEC controlan de forma predominante y fundamental el desarrollo de los timocitos, desde su ingreso hasta que abandonan el timo como célulasT maduras5,6, siendo este el objetivo primordial de la función tímica. A continuación se realiza una descripción de los componentes celulares y funcionales involucrados en el mecanismo de tolerancia central.
TimocitosLos precursores de célulasT enfrentan un proceso de diferenciación que lleva semanas de duración, el cual inicia en la médula ósea, donde de forma temprana se expresa la especificidad linfoide, y finaliza en el timo, donde se comprometen al linaje de célulasT. Estos progenitores linfoides que se originan en la célula madre hematopoyética atraviesan un proceso progresivo de diferenciación al ingresar al timo en un estadio conocido como progenitor tímico temprano. La linfotoxina (eje LTα1β2/LTβR) producida por los timocitos simple positivo (SP) induce en las células endoteliales del portal tímico la expresión de moléculas de adhesión como selectinaP, ICAM-1 y VCAM-1, y en las TEC, la producción de las quimiocinas CCL19, CCL21, CCL25 y CXCL12, que facilitan el alojamiento tímico de las células progenitoras linfoides7. La subsecuente diferenciación de estas células progenitoras es mediada por la capacidad de expresar y responder a la señalización Notch8.
Los precursores de célulasT ingresan a la unión corticomedular tímica y progresivamente migran hacia la región subcapsular, guiados por una compleja red de quimiocinas, entre las que destaca la CCL25 (que es reconocida por el receptor CCR9), las cuales permiten la interacción con las células del estroma tímico y el progresivo desarrollo de los timocitos. Durante esta fase del desarrollo los timocitos inmaduros doble negativos (CD4− CD8−) reciben señales de supervivencia por citoquinas como la interleucina7, el factor estimulante de células madre (SCF, por sus siglas en inglés) y el ligando4, similar al delta (DLL4, por sus siglas en inglés), producidas por las TEC corticales (cTEC)8,9. Al alcanzar la región subcapsular, los timocitos doble negativos se encuentran en etapa3 (Linlo CD44lo, Kitlo, CD25+), en la que inician el rearreglo de los loci del TCR y logran la diferenciación a células doble positivas (DP) (CD4+ CD8+) de linaje αβ. Estas son las células más abundantes en el timo8 y se someten a la selección positiva y a la restricción del complejo mayor de histocompatibilidad (CMH) (que es mediada por cTEC) para posteriormente alcanzar el estado de linfocitoT SP (CD4+ o CD8+)9.
Los timocitos SP, posteriormente a la selección positiva, expresan el receptor CCR7, que, guiado por las quimiocinas CCL19 y CCL21, permite la migración hacia la médula tímica, donde se enfrenta a la selección negativa9 mediada por las células presentadoras de antígeno del timo. Todo este proceso, desde la selección positiva, su migración a la médula tímica, la selección negativa y la emigración de los linfocitosT vírgenes, tarda un tiempo relativamente corto, de 4 a 5días10.
Células presentadoras de antígenoLas TEC son células no hematopoyéticas que tienen su origen en el endodermo del tercer arco branquial y son el elemento estromal más abundante en el timo. De manera fundamental, estas células soportan la timopoyesis y la diferenciación de linaje de los linfocitosT11. Considerando su posición anatómica y sus cualidades funcionales, las TEC están clasificadas en dos tipos: las cTEC y las TEC medulares (mTEC). Las cTEC están involucradas predominantemente en el proceso de desarrollo y diferenciación de los timocitos, donde cumplen algunas funciones fundamentales, como el asentamiento de los progenitores linfoides, el compromiso de linaje de progenitores linfoides hacia célulasT, la expansión de timocitos inmaduros, la selección positiva y la restricción CMH de los timocitos DP6,12. Contemplando las múltiples funciones de las cTEC, se ha propuesto que existan diferentes subpoblaciones funcionales, y como ejemplo de ello se han descrito células nodriza tímicas que forman complejos multicelulares y favorecen el rearreglo de la cadena α del TCR6.
Las mTEC cumplen dos funciones fundamentales en la inducción de la tolerancia central: la selección negativa de las célulasT autorreactivas y la generación de célulasT reguladoras12. Estas funciones son facilitadas por su capacidad excepcional de expresar de forma promiscua antígenos restringidos a tejidos (TRA, por sus siglas en inglés) y presentarlos mediante moléculas CMHII a los timocitos SP12. La expresión de TRA se ve facilitada por la presencia de genes como el regulador autoinmune (AIRE, por sus siglas en inglés) y el gen de la proteína2 tipo dedo de zinc embrionario del prosencéfalo (FEZF2, por sus siglas en inglés)2. En conjunto, estos dos reguladores transcripcionales median el 60% de la expresión genética en mTEC murinos, siendo estas células capaces de expresar alrededor del 89% de los genes que codifican proteínas; esto es, aproximadamente 20.426 genes. Esta diversa expresión génica se encuentra apoyada en modificaciones postranscripcionales como el uso de empalmes alternativos y la expresión de retroelementos endógenos13.
El crecimiento y la diferenciación de las mTEC dependen de la actividad del factor de transcripción Forkhead Box N1 (FOXN1, por sus siglas en inglés), que en condiciones de deficiencia conduce a atimia y subdesarrollo de las TEC, que a su vez no pueden reclutar precursores hematopoyéticos14. La actividad de este factor de transcripción es regulada positivamente por las vía clásica y no clásica de las glicoproteínas WNT15. El desarrollo de las mTEC es dependiente de señales proporcionadas por los timocitos SP posteriores a la selección positiva, que de forma importante median la activación de la vía de señalización del factor nuclear kappaB (NF-κB), como es el caso de la linfotoxinaB, del ligando CD40 y de la vía RANK-RANKL6,14,16,17. El eje LTα1β2/LTβR estimula el desarrollo de la subpoblación mTEC FEZF2+ y, además, de las mTEC CCL21+7. La vía de señalización RANK-RANKL (unido a membrana) tiene la capacidad de activar la vías canónica y no canónica del NF-κB, que a su vez estimula la proliferación de las mTEC e incrementa la expresión del gen AIRE6. En línea con lo descrito, se ha documentado en modelos de ratones deficientes del componente RelB de NF-κB la disminución del recuento de mTEC y la presencia de manifestaciones de autoinmunidad18. Otros determinantes del desarrollo de las mTEC son la vía de señalización mTOR, STAT3 y el factor de transición de epitelio mesenquimatoso14.
La presentación antigénica en el timo y la regulación de la selección negativa no son exclusivas de las mTEC. Las células dendríticas intervienen en la presentación de antígenos ubicuos y transferidos por las mTEC, además de dirigir la selección negativa y la desviación clonal9,12,19. Las célulasB del timo actúan como células presentadoras de antígenos; sin embargo, mediante la coestimulación CD40 procedente de los timocitos, son licenciadas para la expresión de AIRE y permitir la expresión de TRA, de forma similar a lo descrito en las mTEC19,20.
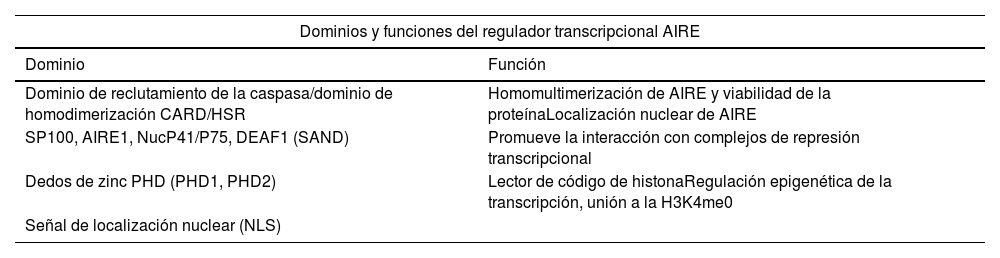
AIREEn el estudio del síndrome poliglandular autoinmune tipo1 se descubrió el gen AIRE, localizado en el cromosoma21 en la posición 21q22.321,22. Este gen está conformado por 14 exones y genera la expresión de una proteína de 545 aminoácidos, con un peso molecular de 57.727Da, que a su vez tiene cuatro dominios: CARD, SAND, PHD1 y PH2 (tabla 1), además de dos regiones de señal de localización nuclear y cuatro motivos LXLL23. AIRE se expresa solo en mTEChi(2) y es considerado un gen pleiotrópico, principalmente porque, a partir de esta única secuencia génica, logra el control de diferentes funciones, entre las que destacan: marcador funcional de diferenciación de mTEC, control de la expresión de antígenos tisulares periféricos, regulación de la diferenciación de célulasT reguladoras, además de mecanismos de tolerancia de célulasB, control de la adhesión timocito-mTEC y apoptosis en mTEC24.
Dominios del gen AIRE
| Dominios y funciones del regulador transcripcional AIRE | |
|---|---|
| Dominio | Función |
| Dominio de reclutamiento de la caspasa/dominio de homodimerización CARD/HSR | Homomultimerización de AIRE y viabilidad de la proteínaLocalización nuclear de AIRE |
| SP100, AIRE1, NucP41/P75, DEAF1 (SAND) | Promueve la interacción con complejos de represión transcripcional |
| Dedos de zinc PHD (PHD1, PHD2) | Lector de código de histonaRegulación epigenética de la transcripción, unión a la H3K4me0 |
| Señal de localización nuclear (NLS) | |
AIRE es una proteína de localización nuclear25 y se considera un factor de transcripción atípico, puesto que por sí mismo no tiene motivos de unión al ADN. Para promover la expresión promiscua de TRA requiere actuar asociado a múltiples proteínas. El dominio PHD1-AIRE tiene la capacidad de reconocer el marcador epigenético represivo histona no metiladaH3 lisina4 (H3K4); sin embargo, se necesita la integración de un complejo proteico para lograr la expresión génica26. Entre las proteínas asociadas se puede mencionar el complejo ATF7IP-MBD1, el cual, a su vez, se asocia a la histona metiltransferasa ESET, que permite reclutar dinucleótidos CpG metilados. Adicionalmente, AIRE interactúa con la ADN proteína cinasa que reconoce roturas de doble cadenas de ADN, donde se recluta AIRE, y se ha asociado al inicio de la transcripción. Finalmente, AIRE coopera con el factorB de elongación de la transcripción positivo (P-TEFb) para lograr la liberación de ARN polimerasa estancada y facilitar la elongación del ARN26.
La expresión del gen AIRE está regulada multifactorialmente. Destacan los receptores de familia del factor de necrosis tumoral, con la actividad regulatoria positiva del CD40 y la vía RANK2,25, que facilitan la expresión de este regulador en las mTEC maduras. AIRE interactúa con proteínas nucleares que ejercen control sobre su actividad, entre ellas la proteína desacetilasa SIRT1, que desacetila residuos de lisina en AIRE y permite la transcripción mediada por AIRE. Además, la interacción con la proteína de unión de CREB, que tiene actividad acetil transferasa, genera una regulación a la baja de la actividad de AIRE. La proteína HIPK2 disminuye la actividad de transactivación, dependiendo de cinasa26. Modelos humanos y murinos han documentado una actividad diferencialmente mayor del gen AIRE en mTEC de individuos masculinos, sin diferencias en el recuento celular o en la relación mTEC/cTEC con respecto al sexo femenino. Esta diferencia entre sexos parece depender de la activación del receptor de andrógenos27, que probablemente es un factor adicional que explique el mayor riesgo de autoinmunidad en el sexo femenino.
Por su rol principal en la expresión de TRA, AIRE es un factor determinante en la selección negativa de célulasT para el establecimiento de tolerancia central, pero además interviene en el desarrollo y la diferenciación de las mTEC, además de mediar la selección positiva y la diferenciación de timocitos autorreactivos hacia célulasT CD4+ reguladoras25. Las variaciones del gen AIRE impiden la presentación de TRA a los timocitos SP, al permitir que célulasT autorreactivas salgan a la periferia, con el consecuente potencial desarrollo de autoinmunidad23,28.
AIRE presenta variaciones genéticas en alrededor de una por cada 1.000 personas26. De forma clásica, se ha descrito que estas mutaciones son bialélicas, de carácter recesivo29 y están representadas en el clásico síndrome poliglandular autoinmune tipo1, que se caracteriza por la presencia de lesiones por autoinmunidad en diferentes órganos, con predominio de insuficiencia adrenal e hipoparatiroidismo, junto a la susceptibilidad a infecciones fúngicas por la producción de anticuerpos neutralizantes, sobre todo contra citoquinas como IL-17, IL-22, el receptor de IL-17 y, además, anticuerpos neutralizantes contra interferón tipoI, que predispone a infecciones virales, incluidas presentaciones graves de la infección por el virus SARS-CoV-230. Este síndrome puede acompañarse de otras manifestaciones de autoinmunidad, como la diabetes mellitus tipo1, la enfermedad tiroidea autoinmune, la hepatitis autoinmune, la anemia perniciosa y manifestaciones no inmunomediadas, como la distrofia ectodérmica, la hipoplasia de esmalte y la distrofia ungular31.
Las mutaciones puntuales monoalélicas de AIRE de tipo dominante negativo se han asociado a un incremento de la susceptibilidad a enfermedades autoinmunes de inicio tardío con un fenotipo atenuado y penetrancia incompleta31. Estas variaciones genéticas de AIRE se localizan primordialmente en los dominios SAND y PHD1, siendo la mutación finlandesa mayor (p.R257) la más frecuente a escala mundial32. Las manifestaciones clínicas de estas mutaciones son heterogéneas, pero pueden representarse en el síndrome poliglandular autoinmune tipo1 no clásico26,32.
Como hemos mencionado, la expresión de AIRE no es exclusiva de las células epiteliales tímicas. En modelos murinos y humanos se ha documentado de forma heterogénea su expresión en el bazo, en el tejido linfático, en el hígado embrionario, en los testículos, en los ovarios, en las células dendríticas y en los macrófagos. En dichos tejidos y células probablemente actúe con un rol regulador de la transcripción28. Las funciones de este gen en tejidos periféricos no son suficientemente claras; sin embargo, algunas células extratímicas que lo expresan son capaces de inducir tolerancia a célulasT periféricas autorreactivas28. AIRE también parece estar involucrado en la regulación de la expresión de receptores de reconocimiento de patrones y moléculas del CMH en células presentadoras de antígenos y en la regulación de la inducción y la diferenciación de las célulasT periféricas29.
FEZF2Existen diferentes TRA con expresión independiente de AIRE, lo que supone la presencia de diferentes reguladores de la expresión de TRA en el timo. De acuerdo con esta hipótesis, Takaba et al.33 documentaron la expresión específica e incrementada en mTEC de un regulador transcripcional llamado FEZF2, equiparable con el regulador AIRE, que se expresa en el 30% de las mTEClo y casi todas las mTEChi del timo de ratón, y, curiosamente, en las mTEC AIRE+. Además, en ratones Fezf2 knock-out (KO) se encontró una disminución significativa de la expresión de 16 genes en mTEC, en presencia de regulación normal de AIRE. Este hallazgo se acompañó de la infiltración inflamatoria en pulmón, hígado, riñón, intestino delgado, glándula salival, cerebro y testículos. El compromiso inflamatorio en ratones Fezf2 KO es más amplio y diferente al documentado en deficiencia de Aire KO y con una aparente mayor severidad. Sin embargo, al momento no hay enfermedades autoinmunes sistémicas u órgano-específicas asociadas a su variación o deficiencia.
El regulador FEZF2 contiene un dominio de homología1 grabado (EH1) y 6 dominios de dedo de zinc (ZF), que reconocen directamente motivos de ADN específicos. No se ha determinado qué moléculas interactúan con FEZF2 y cómo induce la expresión génica de TRA en cooperación con otros reguladores transcripcionales2. Mediante modelos murinos embrionarios de diferenciación cerebral se ha documentado que Fezf2 interactúa con los correpresores de la familia Groucho, y por medio de su actividad represora restringe la expresión de lhx2 y lhx9, que codifican dos reguladores negativos de la señalización WNT/βcatenina34. La expresión de este gen está regulada por LTβR33, en contraste con la regulación mencionada para el gen AIRE.
Presentación antigénica en el timoLa presentación de TRA tiene tres componentes fundamentales: la expresión antigénica en el timo, el procesamiento de antígenos para la disposición de péptidos y la presencia de moléculas CMH para el anclaje de los péptidos derivados de TRA35. La expresión promiscua de genes por parte de las mTEC, como fuente de TRA, y su capacidad de presentación antigénica a los timocitos, de forma directa o mediante la transferencia de TRA a las células dendríticas, son el mecanismo más conocido durante el proceso de selección negativa36. Sin embargo, hay otras fuentes de antígenos infrecuentemente mencionadas. Algunos autoantígenos (no antígenos extraños) periféricos pueden introducirse al microambiente tímico por parte de células dendríticas migratorias inmaduras (no activadas), que además tienen la capacidad de hacer la presentación antigénica e inducir la deleción clonal de timocitos autorreactivos37. En el caso de los antígenos ubicuos, estos son producidos de forma espontánea por diferentes células residentes en el timo y son presentados de forma predominante en la corteza y en la unión corticomedular por las células dendríticas19. Por otro lado, pequeños antígenos periféricos podrían ingresar al timo por difusión directa38 y son presentados por células dendríticas. Una quinta forma de adquisición de antígenos periféricos en el timo fue descrita por Vollmann et al.38, quienes documentaron que los antígenos periféricos tipo péptidos macromoleculares son captados por células dendríticas perivasculares conocidas como células dendríticas transendoteliales.
La presentación de antígenos en la médula tímica conduce a la supervivencia de los timocitos SP no autorreactivos. En sentido opuesto, los timocitos autorreactivos son dirigidos a dos destinos que definen la tolerancia central: la deleción clonal y la desviación clonal (da origen a las célulasT reguladoras). De esta manera, se generan los repertorios de célulasT no autorreactivas y célulasT reguladoras25,39. Se ha propuesto que el balance entre estos destinos para los timocitos SP se encuentra mediado por la afinidad de la unión del TCR al complejo CMHII-autopéptido. La activación del TCR conduce a la supervivencia del timocito cuando se logra un bajo y prolongado flujo de calcio con baja actividad ERK, como también a la muerte celular cuando la actividad ERK es rápida y robusta11. En la actualidad se sabe que otros factores, más allá de la intensidad de la señal del TCR, están involucrados, incluyendo el tipo de célula presentadora de antígenos, las citoquinas en el microambiente tímico y las señales de coestimulación39. Recientemente se ha documentado que la coestimulación B7-CD28 es necesaria para la deleción clonal y para la generación de célulasT reguladoras, para lo cual son necesarios diferentes dominios citoplasmáticos del CD28; por ejemplo, para la generación de célulasT reguladoras es imprescindible el dominio PYAP pero no el dominio YMNM, y en el caso de la deleción clonal son necesarios otros dominios hoy no definidos39.
La desviación clonal media la producción de célulasT reguladoras, y para ello este subtipo de células debe enfrentar dos pasos fundamentales. En primer lugar, inducida por la actividad del TCR, se produce una regulación positiva del receptor de interleucina2, y además de GITR, OX40, TNFR2, lo que genera el precursor de célulaT reguladora CD4+ FOXP3-CD25+. En segundo lugar, este progenitor se enfrenta a una conversión mediada por citoquinas, debido a la expresión del factor de transcripción FOXP3, lo que genera la célulaT reguladora CD4+FOXP3+CD25+, que finalmente emigra del timo5. Las célulasT reguladoras tímicas se caracterizan por su capacidad de suprimir la activación de linfocitosT CD4+ o CD8+, de disminuir la expresión de ligandos coestimuladores por las células presentadoras de antígenos, y por la secreción de citoquinas antiinflamatorias4.
La interacción entre mTEC y los timocitos va más allá de la deleción clonal y la formación de célulasT reguladoras. Así como las mTEC tienen la capacidad de afectar el desarrollo de los timocitos, la evidencia existente demuestra que los timocitos SP tienen la capacidad de inducir reguladores transcripcionales en los mTEClo, que conducen a su diferenciación a estadios maduros e incrementa la expresión de TRA, quimiocinas y moléculas de adhesión relacionadas con el desarrollo de los timocitos, fenómeno conocido como diafonía tímica40. En concordancia con esto, de forma independiente a la expresión de TRA, las alteraciones en la interacción CMHII-TCR facilitan la formación de timocitos maduros autorreactivos que pueden ocasionar autoinmunidad40, como se ha documentado tanto en muestras tímicas de modelos de ratones como en humanos deficientes del CMHII, en los que es relevante la disminución del volumen de la médula del timo, una disminución de expresión de moléculas asociadas con la maduración de las mTEC, una atenuación de la expresión de TRA dependientes de AIRE y una menor expresión de componentes de la vía de señalización NF-κB relacionada con el desarrollo de las mTEC41.
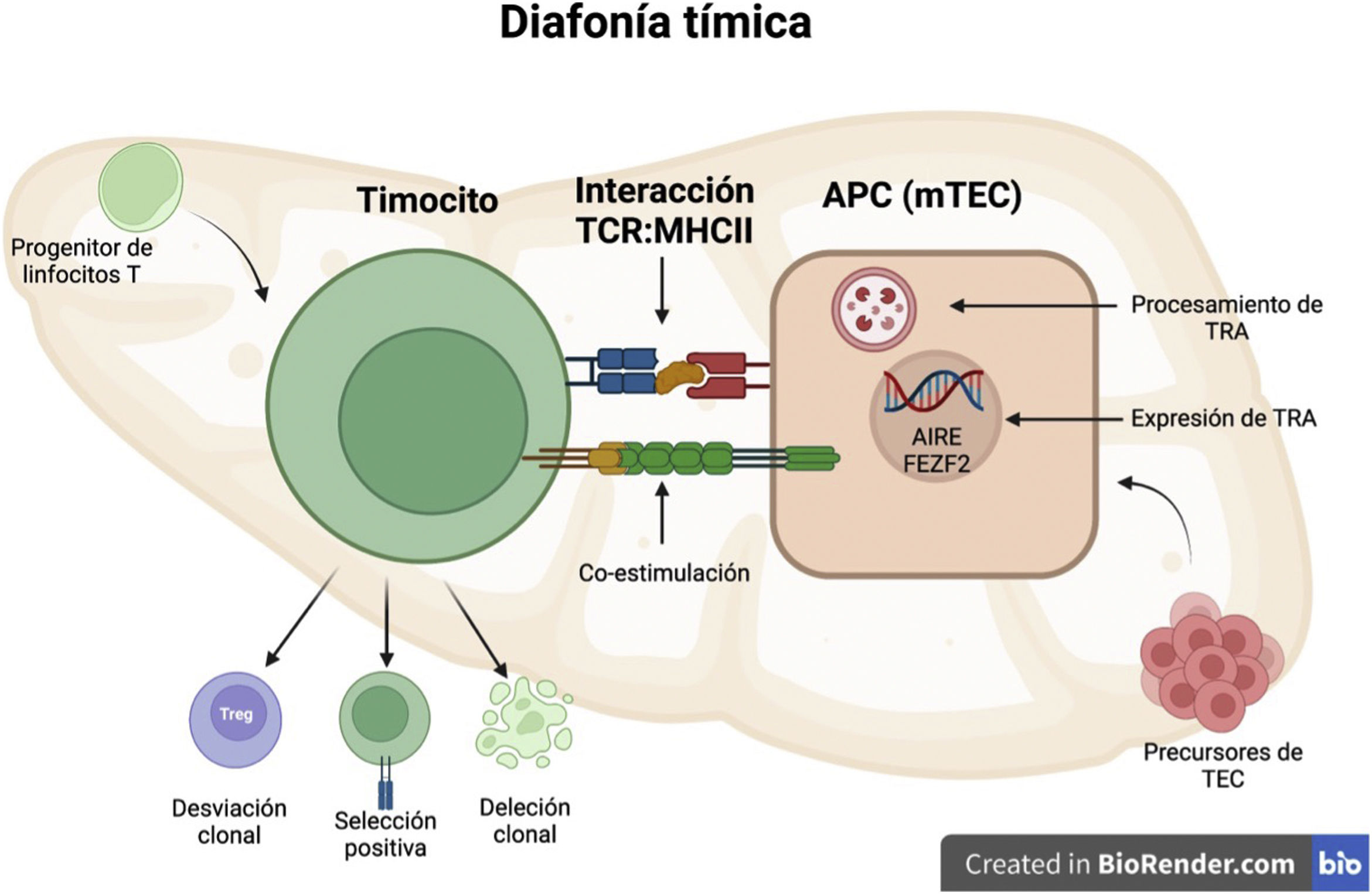
Factores que alteran la tolerancia centralLas alteraciones de la tolerancia central van más allá de las variaciones de los genes AIRE y FEZF2 que afectan la producción de los TRA. Resumiendo todos los conceptos ilustrados a lo largo del artículo, podremos decir que múltiples factores afectan la diafonía tímica (fig. 2), lo que altera sus componentes, como lo son: los timocitos (desarrollo, diferenciación y respuesta a señalización TCR); las células presentadoras de antígenos y microambiente tímico (desarrollo, maduración de los timocitos, capacidad de expresión de TRA, procesamiento de antígenos y expresión de moléculas CMH), y la interacción del complejo CMHII-auto péptidos (deficiencias o ausencias del CMH), lo que conlleva en diferentes proporciones a deficiencias inmunológicas asociadas a linfocitosT, así como a manifestaciones de autoinmunidad.
La diafonía tímica hace referencia a la relación bidireccional entre las APC del timo y los timocitos en desarrollo, que va más allá de la selección negativa y regula el desarrollo y la diferenciación de ambos grupos de células.
APC: célula presentadora de antígenos.
Imagen creada con BioRender.com.
El timo inicia su desarrollo y su función en la vida fetal y alcanza su mayor volumen y producción antes del primer año de vida. Posteriormente a ello, disminuye la función tímica de forma rápida entre el primer y el octavo año de vida, seguido por un deterioro progresivo hasta la vejez42. Probablemente, asociado a este progresivo deterioro de la estructura y de la función tímica, el envejecimiento está asociado con detrimento de la función inmune, lo que representa, en un progresivo estado de inmunodeficiencia, la presencia de inflamación crónica y el mayor riesgo de autoinmunidad, evidente en ancianos43. La involución del timo, que se relaciona con una disminución de la expresión de TRA y un proceso de selección negativa menos eficiente, está mediada por factores como cambios en el microambiente tímico y el deterioro del desarrollo de las célulasT43. En modelos murinos, el envejecimiento remodela el epitelio tímico, disminuye la diferenciación de células precursoras hacia mTEC, atenúa la expresión promiscua de genes44 y, además, está asociado con una selección negativa defectuosa de las célulasT policlonales, por pérdida de la eficiencia de la deleción clonal de los timocitos SP autorreactivos45. Se ha propuesto la capacidad de regeneración del timo, pero las alteraciones funcionales en la selección negativa no mejoraron cuando se logró retrasar la atrofia tímica en ratones transgénicos45. La disminución de la selección negativa mediada por el envejecimiento se compensa con una mayor producción de célulasT reguladoras42.
Cambios tempranos en la estructura y en la función tímica pueden verse relacionados con un incremento del riesgo de autoinmunidad y de infecciones graves, como en el caso de individuos con aplasia tímica y en el síndrome de DiGeorge, en los que hay una estructura y una función tímica preconcepcional alterada. Por el contrario, cuando se logra un desarrollo tímico adecuado al final de la gestación, no se evidencia un incremento de dicho riesgo, al menos en el mediano plazo, como es el caso de la timectomía neonatal o temprana asociada a cirugía cardiovascular42. De forma similar, las infecciones virales en etapas tempranas de la vida (gestacional y posnatal) por virus timotrópicos se han relacionado con defectos en la inmunidad mediada por célulasT. En modelos murinos se ha encontrado una asociación entre la infección por virus timotrópico roseolavirus murino en temprana etapa posnatal, con la aparición de gastritis autoinmune en etapas tardías de la vida, sin documentarse infección crónica46. Modelos in vitro de ratones han relacionado la infección por el enterovirus Coxsackievirus B4 (en etapa tanto embrionaria como posnatal) con alteraciones que disminuyen la expresión del factor de crecimiento similar a la insulina2, y secundario a ello, un nexo con la aparición de diabetes mellitus tipo1 en ratones47.
Las alteraciones en el procesamiento antigénico en las células presentadoras de antígenos del timo pueden verse reflejadas en defectos de la tolerancia central47. La autofagia independiente de inanición en las mTEC contribuye al procesamiento de antígenos endógenos para su anclaje en las moléculas del CMH clase II, y su alteración puede llevar a la infiltración inflamatoria de tejidos periféricos48. Un ejemplo de estas anomalías es la variación del gen CLEC16A, que puede modificar la selección negativa y conducir a la aparición de diabetes mellitus tipo135,48.
Las moléculas del CMH y el TCR son los elementos centrales en la presentación antigénica, tanto en el timo como en la periferia. Por ello, variaciones en cualquiera de sus componentes disminuyen la afinidad de unión CMH-TCR y alteran la tolerancia central. Por ejemplo, una molécula CMH menos afín por un péptido endógeno puede no presentarlo al timocito SP, lo que conduce a una subsecuente autorreactividad periférica35. La señalización del TCR puede variar cuando hay alteraciones en su regulación, como es el caso de las variaciones de los genes PTPN2 y PTPN22, que, asociadas a pérdida de su función, disminuyen la actividad fosfatasa e incrementan la estimulación TCR, lo que se ha relacionado con cambios en la eficacia de la tolerancia central35.
De forma importante, los procesos de diferenciación de los timocitos y los procesos de selección positiva y negativa dependen tanto de la intensidad de la activación del TCR como del tiempo de unión. El represor transcripcional capicúa (CIC, por sus siglas en inglés), inicialmente documentado en Drosophila melanogaster y ampliamente conservado en mamíferos, regula la vía de señalización RTK-MAPK, aguas abajo del receptor TCR49. Previamente, se ha documentado que variaciones de CIC generan fenotipos de autoinmunidad en modelos murinos, probablemente por hiperactivación de las célulasT periféricas50. Sin embargo, se ha sugerido que este gen media la diferenciación y la selección de linfocitosT. En un estudio de modelos murinos, Kim et al.51 demostraron que CIC regula el desarrollo de los timocitos doble negativos y el proceso de regulación positiva y negativa, especialmente en el estadio doble positivo, asociado a una significativa atenuación de la señalización TCR.
ConclusionesLa tolerancia central es un mecanismo fundamental para la prevención de la autorreactividad y de enfermedades autoinmunes. Sin embargo, no es un mecanismo infalible, puesto que la recombinación aleatoria de los TCR que le da variedad de respuesta frente a millares de agentes extraños, también lo hace susceptible a la autoinmunidad. Su función está cimentada en la presentación de antígenos a los timocitos en la médula del timo. Las células del estroma tímico generan un microambiente ideal para el desarrollo de las célulasT, y las TEC son el componente estromal más abundante en este órgano. La capacidad excepcional de las mTEC para generar TRA y presentarlos a los timocitos permite el proceso de selección negativa, que además es posible por la presencia de los reguladores transcripcionales AIRE y FEZF2. Sin embargo, estos no logran explicar toda la expresión promiscua de genes en el timo, por lo que probablemente existan factores transcripcionales por investigar y describir. Más allá de esto, debe reconocerse la existencia de tres componentes fundamentales para la tolerancia central: los timocitos, el microambiente tímico (células presentadoras de antígenos y demás componentes estromales) y la interacción TCR:CMH. Múltiples mecanismos congénitos o adquiridos y de naturaleza metabólica, infecciosa, o incluso natural, que comprometan el funcionamiento de cualquiera de estos ejes alteran la tolerancia central y favorecen la autorreactividad. El envejecimiento como proceso natural conlleva un deterioro tanto estructural como funcional de los componentes del timo, entre los cuales existe un deterioro de la selección negativa que no es susceptible de reversión o ralentización con el retraso de la atrofia tímica. Las alteraciones en el proceso de tolerancia central pueden contribuir, de forma predominante, a la aparición de enfermedades órgano-específicas, pero no son suficientes para su aparición, pues existen varios puntos de control dentro de la tolerancia inmune periférica.
FinanciaciónNinguna.
Contribución de los autoresTodos los autores estuvieron involucrados en la concepción del trabajo, la elaboración del borrador inicial, la edición y la versión final aprobada.
Conflicto de interesesNinguno.