La anemia hemolítica autoinmune (AHAI) por crioaglutininas secundaria a lupus eritematoso sistémico (LES) es una manifestación infrecuente. No existen cohortes o series de casos que permitan evaluar las características de este grupo de pacientes.
ObjetivoDescribir las características clínicas y serológicas de pacientes con LES y anemia hemolítica por crioaglutininas.
Materiales y métodosPresentamos 2 casos con LES que debutaron con AHAI por crioaglutininas, su perfil clínico, inmunológico y respuesta al tratamiento inmunosupresor.
ResultadosSe describen 11 casos reportados en la literatura desde el año 1980 hasta 2023.
ConclusiónLa AHAI por crioaglutininas en el LES es infrecuente, con clínica similar respecto a formas idiopáticas, y no suele asociarse a manifestaciones o compromiso orgánico grave.
Cold agglutinin autoimmune haemolytic anaemia (AIHA) secondary to systemic lupus erythematosus (SLE) is a rare manifestation. There are no cohorts or case series that allow us to evaluate the characteristics of this group of patients.
ObjectiveTo describe the clinical and serological characteristics of patients with systemic lupus erythematosus (SLE) and cold agglutinin hemolytic anemia.
Materials and methodsWe present two cases with SLE that debuted with cold agglutinin AHAI, their clinical and immunological profile and response to immunosuppressive treatment.
ResultsEleven cases reported in the literature from 1950 to 2023 are described.
ConclusionCold agglutinin AHAI secondary to SLE is rare, with similar clinical features compared to idiopathic forms and usually not associated with manifestations or serious organic involvement.
Las crioaglutininas son autoanticuerpos que hacen parte de las AHAI mediadas por anticuerpos fríos. Se describen 2 entidades: enfermedad por crioaglutininas, causada por un trastorno linfoproliferativo de bajo grado de células B; y el síndrome por crioaglutininas cuando está asociado a otras enfermedades como lupus eritematoso sistémico (LES) o infecciones por Mycoplasma pneumoniae, Epstein-Barr, hepatitis C y neoplasias, entre otras1,2. Las crioaglutininas en suero sin evidencia de enfermedad pueden ser detectables hasta en el 0,3% de la población adulta con títulos bajos, usualmente inferiores a 1/64 diluciones, y rara vez por encima de 1/256, razón por la cual el diagnóstico requiere títulos por encima de 1/64 diluciones3.
Con la exposición al frío, las crioaglutininas (usualmente anticuerpos de tipo IgM) se unen al antígeno I de la membrana del eritrocito y causan aglutinación. El complejo antígeno/anticuerpo se une al componente C1 del complemento con formación de C3b. Cuando la temperatura en sangre sube alrededor de 37°C, los anticuerpos IgM se separan del complejo, pero el componente C3b permanece en la membrana del eritrocito con la posterior destrucción de este por el sistema fagocítico mononuclear, principalmente en el hígado (hemólisis extravascular). En eritrocitos sobrevivientes se escinde C3b de la membrana, y deja un gran número de moléculas C3d en la superficie celular. Estos mecanismos explican por qué la prueba de antiglobulina directa monoespecífica (DAT) es fuertemente positiva para C3d3,4. La hemólisis intravascular es el resultado de la formación de complejo de ataque a la membrana (MAC)1. La amplitud térmica se define como la temperatura más alta a la que reacciona la crioaglutinina con el antígeno. En general, la patogenicidad depende más de la amplitud térmica que de los títulos. Si esta supera los 28 o 30°C, los eritrocitos se aglutinan en la circulación periférica, incluso a temperatura ambiente3,5.
Las manifestaciones clínicas se relacionan con la severidad de la anemia hemolítica, con palidez, ictericia y esplenomegalia, y suelen desencadenarse por la exposición al frío, asociado a acrocianosis, isquemia y necrosis por fenómenos vasooclusivos en dedos, nariz u oídos6. La AHAI por crioaglutininas asociado a LES es infrecuente y solo se describe en reportes de casos. Se describen 2 casos clínicos y se hace revisión de la literatura.
Materiales y métodosSe realizó una revisión de la literatura de casos con diagnóstico de lupus que cumplió con criterios ACR 1997 y ACR/EULAR 2019 según la fecha de publicación y AHAI por crioaglutininas, en PubMed, Embase y Science Direct, en idioma inglés, desde el año 1950 hasta diciembre del año 2023. Se emplean las siguientes terminologías descritas por Berentsen et al., a efectos de unificación: anemia leve: hemoglobina (Hb) mayor a 10g/dl; moderada: 8 a 10g/dl; severa: menor a 8g/dl7; respuesta completa (RC): ausencia de anemia y cualquier signo de hemólisis activa; respuesta parcial (RP): incremento de la hemoglobina mayor o igual a 2g/dl, mejoría de los síntomas clínicos, sin necesidad de terapia transfusional; no respuesta (NR), cuando no cumple criterios para RC o RP3. El diagnóstico de LES con criterios clínicos e inmunológicos: anticuerpos antinucleares (ANA), anticuerpos nucleares extractables (ENA), anticuerpos a ADN (anti-DNA), se basó en los criterios de clasificación ACR/EULAR 20198.
ResultadosCaso 1Paciente femenina de 76 años con diagnóstico de LES y anticuerpos para síndrome antifosfolípido positivos desde el 2016, quien comenzó con alopecia difusa, sin Raynaud o acrocianosis, leucopenia y anemia hemolítica autoinmune, y los siguientes estudios inmunológicos: ANA: 1/320 patrón moteado, anti-DNA: 1/40, ENAS (-), C3: 55,5, C4: <2,9, Coombs directo: 4+, anticoagulante lúpico: 2,23 (<1,2), anticuerpos anticardiolipinas IgM: 249,44, IgG: 28,9, anti-β2glicoproteína 1 IgG: 1,76, IgM: 28,6. Se inició manejo inmunosupresor con prednisolona 50mg/vía oral/cada 24h y azatioprina 50mg/vía oral/cada 8h, sin mejoría clínica importante y recaídas de la anemia hemolítica; requirió hasta 4 hospitalizaciones al año, con necesidad de hemoderivados. Fue valorada por hematología en el año 2019, que ordenó manejo con rituximab 375mg/m2/semanal/4 dosis, sin datos claros de respuesta a dicho manejo. En el año 2020 fue hospitalizada nuevamente por crisis hemolítica, con reporte de hemograma que mostró Hb: 4,9g/dl, hematocrito (Hto): 15,3, volumen corpuscular medio (VCM): 138, lactato deshidrogenasa (LDH): 859, reticulocitos: 20,5%, bilirrubina total: 4,25, bilirrubina directa: 0,42. Sin embargo, hemogramas del año 2016 al comienzo del LES mostraron Hb: 5,9, Hto: 13, VCM: 151, con aglutinación y fenómeno de Rouleaux en el extendido de sangre periférica, por lo que se sospechó ante dichos cambios una anemia hemolítica mediada por crioaglutininas. Se tomó Coombs fraccionado: IgG: 4+, IgA−, IgM: 3+, C3c−, C3d: 3+, y crioaglutininas: 1/32. Se realizó estudio de médula ósea sin evidencia de infiltración neoplásica, así como estudios de extensión: esofagogastroscopia y colonoscopia total normales, tomografía axial computarizada (TAC) de abdomen con esplenomegalia, TAC de tórax normal. Estudios para hepatitis C, hepatitis B, VDRL y VIH negativos. Se inició manejo con ciclofosfamida, recibió 8 dosis de 500mg/mensuales, con respuesta parcial por Hb de 9,3g/dl, pero sin nueva necesidad de hospitalización. Finalmente, se ordenó nueva dosis de rituximab, 1g/al día 0 y un 1g/al día 14, con solo aplicación de la primera dosis, con lo que se lograron niveles de Hb: 10,3g/dl, considerando respuesta parcial sostenida. En el año 2021 la paciente falleció por neumonía asociada a COVID.
Caso 2Paciente femenina de 29 años, con 6 meses de evolución de artritis en metacarpofalángicas, interfalángicas proximales, codos y hombros. Se realizó diagnóstico inicial de artritis reumatoide y se inició manejo con metotrexato, sin adherencia a este, pulsos de metilprednisolona (no se cuenta con dosis recibida, aplicación extrainstitucional). Posteriormente, refirió pérdida de peso, caída del cabello, úlceras orales no dolorosas, ictericia, disnea y acrocianosis. Al examen físico con adenopatías cervicales, epitrocleares e inguinales con evidencia en paraclínicos de anemia severa con Hb: 4,2g/dl, sin hematocrito inicial, VCM: 148, Coombs directo: 3+, LDH: 430, reticulocitos: 15,7%. Los estudios de hepatitis C, hepatitis B y VIH fueron negativos. Dado que el extendido de sangre periférica demostró aglutinación y fenómeno de Rouleaux, se sospechó posiblemente anemia hemolítica por anticuerpos fríos. Se tomó Coombs fraccionado: IgG: 3+, IgM: 3+, C3d: 3+, y finalmente crioaglutininas positivas con títulos 1/128. El perfil inmunológico mostró: ANA: 1/160 patrón citoplasmático, anti-DNA: 124,8 (<200), ENA (<20): anti-Ro: 64,2, anti-La: 1,28, anti-Sm: 83,5, anti-RNP: 121,3, C3: 50,9, C4: 1,5, anti-β2glicoproteína 1 IgM: 65,89, IgG: 9,9, anticardiolipina IgG: 13,08, IgM: 119,83. Se consideró una AHAI por crioaglutininas, asociado a LES de novo. Estudios de extensión: TAC de abdomen con esplenomegalia, TAC de tórax normal, biopsia de adenopatías epitrocleares derechas sin evidencia de malignidad y estudios de médula ósea negativos. Se inició manejo con prednisolona 5mg/al día, hidroxicloroquina 200mg/día y rituximab 1g/intravenoso/2 dosis con buena evolución y niveles de Hb sostenidos en 11g/dl. En el seguimiento a los 9 meses se consideró respuesta completa, sin necesidad de nuevas dosis de biológico.
DiscusiónA la fecha hay pocos reportes de pacientes con AHAI por crioaglutininas secundario a LES. El primer caso fue descrito por Nair et al. en 19979, y en nuestra búsqueda de la literatura encontramos 11 casos más hasta la fecha. A continuación, se describen las características de esta serie de pacientes (tabla 1).
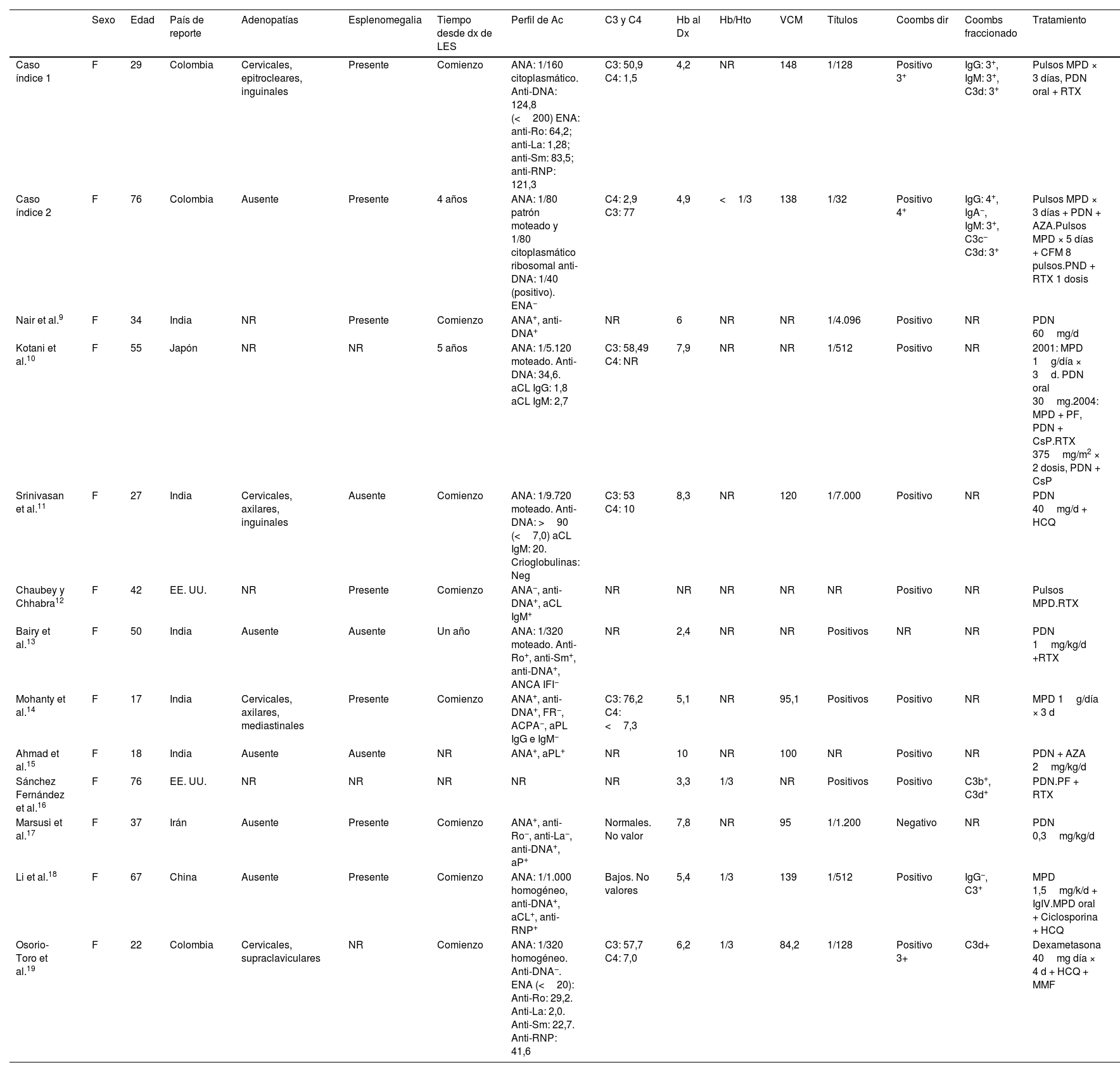
Descripción de pacientes con LES y AHAI por crioaglutininas
| Sexo | Edad | País de reporte | Adenopatías | Esplenomegalia | Tiempo desde dx de LES | Perfil de Ac | C3 y C4 | Hb al Dx | Hb/Hto | VCM | Títulos | Coombs dir | Coombs fraccionado | Tratamiento | |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Caso índice 1 | F | 29 | Colombia | Cervicales, epitrocleares, inguinales | Presente | Comienzo | ANA: 1/160 citoplasmático. Anti-DNA: 124,8 (<200) ENA: anti-Ro: 64,2; anti-La: 1,28; anti-Sm: 83,5; anti-RNP: 121,3 | C3: 50,9 C4: 1,5 | 4,2 | NR | 148 | 1/128 | Positivo 3+ | IgG: 3+, IgM: 3+, C3d: 3+ | Pulsos MPD × 3 días, PDN oral + RTX |
| Caso índice 2 | F | 76 | Colombia | Ausente | Presente | 4 años | ANA: 1/80 patrón moteado y 1/80 citoplasmático ribosomal anti-DNA: 1/40 (positivo). ENA− | C4: 2,9 C3: 77 | 4,9 | <1/3 | 138 | 1/32 | Positivo 4+ | IgG: 4+, IgA−, IgM: 3+, C3c− C3d: 3+ | Pulsos MPD × 3 días + PDN + AZA.Pulsos MPD × 5 días + CFM 8 pulsos.PND + RTX 1 dosis |
| Nair et al.9 | F | 34 | India | NR | Presente | Comienzo | ANA+, anti-DNA+ | NR | 6 | NR | NR | 1/4.096 | Positivo | NR | PDN 60mg/d |
| Kotani et al.10 | F | 55 | Japón | NR | NR | 5 años | ANA: 1/5.120 moteado. Anti-DNA: 34,6. aCL IgG: 1,8 aCL IgM: 2,7 | C3: 58,49 C4: NR | 7,9 | NR | NR | 1/512 | Positivo | NR | 2001: MPD 1g/día × 3d. PDN oral 30mg.2004: MPD + PF, PDN + CsP.RTX 375mg/m2 × 2 dosis, PDN + CsP |
| Srinivasan et al.11 | F | 27 | India | Cervicales, axilares, inguinales | Ausente | Comienzo | ANA: 1/9.720 moteado. Anti-DNA: >90 (<7,0) aCL IgM: 20. Crioglobulinas: Neg | C3: 53 C4: 10 | 8,3 | NR | 120 | 1/7.000 | Positivo | NR | PDN 40mg/d + HCQ |
| Chaubey y Chhabra12 | F | 42 | EE. UU. | NR | Presente | Comienzo | ANA−, anti-DNA+, aCL IgM+ | NR | NR | NR | NR | NR | Positivo | NR | Pulsos MPD.RTX |
| Bairy et al.13 | F | 50 | India | Ausente | Ausente | Un año | ANA: 1/320 moteado. Anti-Ro+, anti-Sm+, anti-DNA+, ANCA IFI− | NR | 2,4 | NR | NR | Positivos | NR | NR | PDN 1mg/kg/d +RTX |
| Mohanty et al.14 | F | 17 | India | Cervicales, axilares, mediastinales | Presente | Comienzo | ANA+, anti-DNA+, FR−, ACPA−, aPL IgG e IgM− | C3: 76,2 C4: <7,3 | 5,1 | NR | 95,1 | Positivos | Positivo | NR | MPD 1g/día × 3 d |
| Ahmad et al.15 | F | 18 | India | Ausente | Ausente | NR | ANA+, aPL+ | NR | 10 | NR | 100 | NR | Positivo | NR | PDN + AZA 2mg/kg/d |
| Sánchez Fernández et al.16 | F | 76 | EE. UU. | NR | NR | NR | NR | NR | 3,3 | 1/3 | NR | Positivos | Positivo | C3b+, C3d+ | PDN.PF + RTX |
| Marsusi et al.17 | F | 37 | Irán | Ausente | Presente | Comienzo | ANA+, anti-Ro−, anti-La−, anti-DNA+, aP+ | Normales. No valor | 7,8 | NR | 95 | 1/1.200 | Negativo | NR | PDN 0,3mg/kg/d |
| Li et al.18 | F | 67 | China | Ausente | Presente | Comienzo | ANA: 1/1.000 homogéneo, anti-DNA+, aCL+, anti-RNP+ | Bajos. No valores | 5,4 | 1/3 | 139 | 1/512 | Positivo | IgG−, C3+ | MPD 1,5mg/k/d + IgIV.MPD oral + Ciclosporina + HCQ |
| Osorio-Toro et al.19 | F | 22 | Colombia | Cervicales, supraclaviculares | NR | Comienzo | ANA: 1/320 homogéneo. Anti-DNA−. ENA (<20): Anti-Ro: 29,2. Anti-La: 2,0. Anti-Sm: 22,7. Anti-RNP: 41,6 | C3: 57,7 C4: 7,0 | 6,2 | 1/3 | 84,2 | 1/128 | Positivo 3+ | C3d+ | Dexametasona 40mg día × 4 d + HCQ + MMF |
aCL: anticardiolipina; AHAI: anemia hemolítica autoinmune; ANA: anticuerpos antinucleares; Anti-DNA: anticuerpos contra el ácido desoxirribonucleico; aPL: anticuerpos antifosfolípidos; AZA: azatioprina; CFM: ciclofosfamida; CsP: ciclosporina; ENA: anticuerpos nucleares extractables; F: femenino; FR: factor reumatoide; Hb: hemoglobina; HCQ: hidroxicloroquina; Hto: hematocrito; IgIV: inmunoglobulina intravenosa; MMF: micofenolato mofetil; MPD: metilprednisolona; NR: no registrado; PDN: prednisolona; RTX: rituximab; VCM: Volumen corpuscular medio.
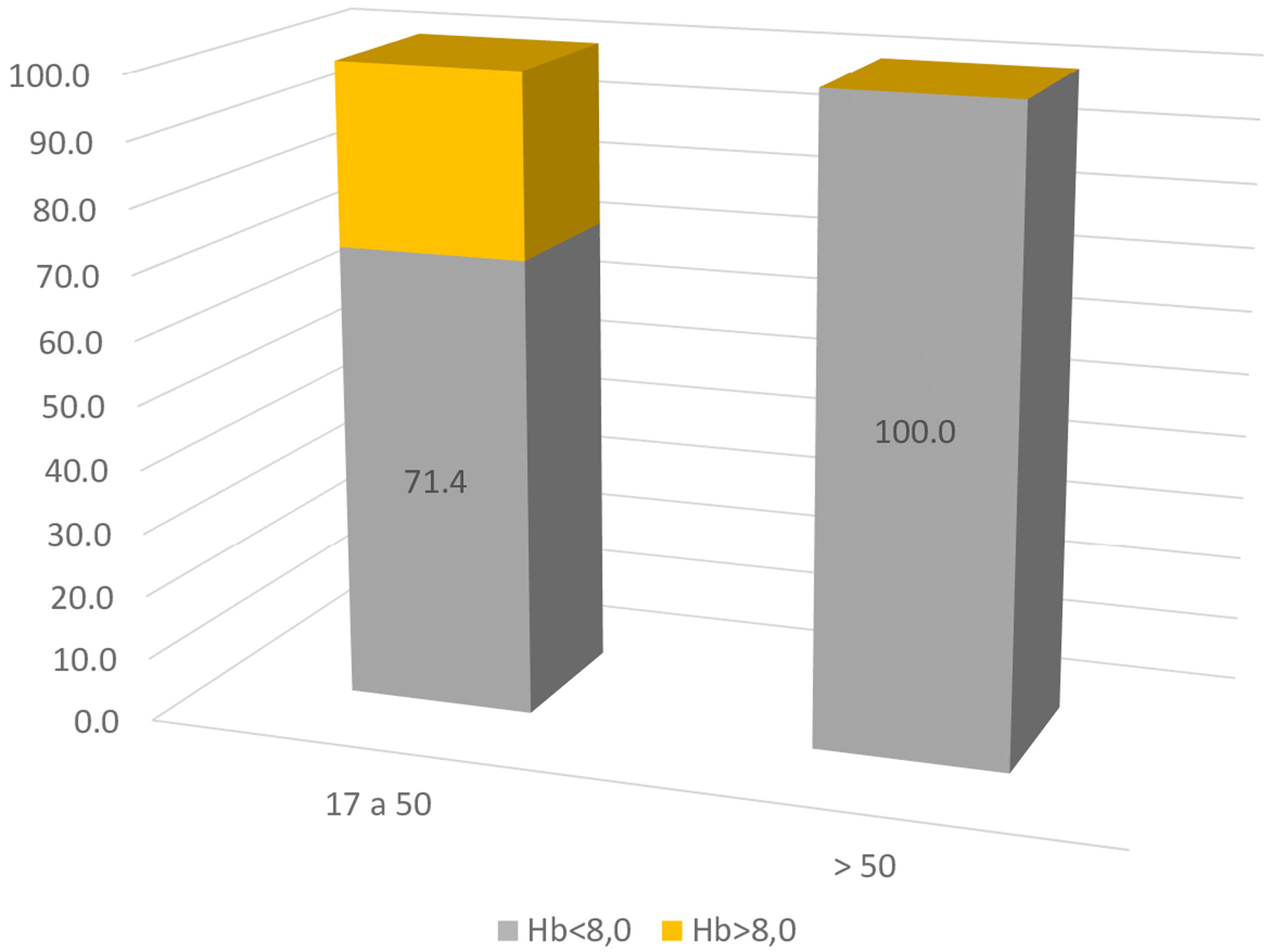
Todos los casos fueron mujeres, la mediana de edad fue de 42 años (entre 17 y 77). Fue el comienzo del LES en el 75% de los casos. En el resto de las pacientes, esta se desarrolló en los primeros 5 años del diagnóstico (promedio de 2,5 años). Manifestaciones clínicas como adenopatías periféricas y esplenomegalia se describieron en el 33 y 62%, respectivamente. Hallazgos distintos a la AHAI fueron: mucocutáneas (rash malar, fotosensibilidad, alopecia, úlceras orales) en el 88,8%; articulares (poliartritis o poliartralgias) en el 66,6%; hematológicas (leucopenia, trombocitopenia) en el 44,4% y serositis en el 11,1%. Solo hubo un reporte de compromiso renal, con nefritis lúpica clase II. Ninguno tuvo compromiso pulmonar o neurológico. Los parámetros biológicos e inmunológicos son escasos, pero de los datos descritos, el 90% tuvieron ANA+ (11/12) patrón moteado y homogéneo, 81,8% anti-DNA+ (9/11). Los ENA solo son descritos en 6 pacientes con anti-Ro, anti-Sm y anti-RNP positivos. La hipocomplementemia estuvo presente en el 87,5% (7/8), con datos incompletos, aunque con predominio de C4. El 83,3% de los pacientes (10/12) ingresaron con anemia severa y el 16,6% con anemia moderada (rango entre 2,4-10g/dl, promedio 6,2g/dl), sin embargo, al discriminar la severidad de la anemia por el rango de edad, el 100% de los pacientes mayores de 50 años tuvo anemia severa al ingreso (fig. 1). No hubo casos de LES juvenil.
La relación Hb/Hto, descrita en 4 casos, fue de 1/3 o menor, y el VCM varió de 84,2 a 148 (promedio: 114,8). Los títulos de crioaglutininas descritos en 8/13 pacientes fueron todos por encima de 1/64, excepto el caso índice 2 con un valor de 1/32, que pudieron estar modificados por el uso de inmunosupresión (pulsos de esteroide y ciclofosfamida) previamente a la toma de dicha prueba, pero considerados positivos por los hallazgos típicos del hemograma y el comportamiento refractario a las terapias. Un paciente tuvo la prueba de Coombs directo negativa, con datos muy escasos respecto al Coombs fraccionado. Se tuvo reporte de aspirado de médula ósea en 4 casos, 2 de los cuales fueron reportados como normales, otro con hiperplasia de células nucleadas y otro con cambios madurativos de la línea mieloide e hiperplasia megacariocítica. También biopsia de ganglios en 3 casos, una descrita como negativa para malignidad y 2 con hiperplasia reactiva.
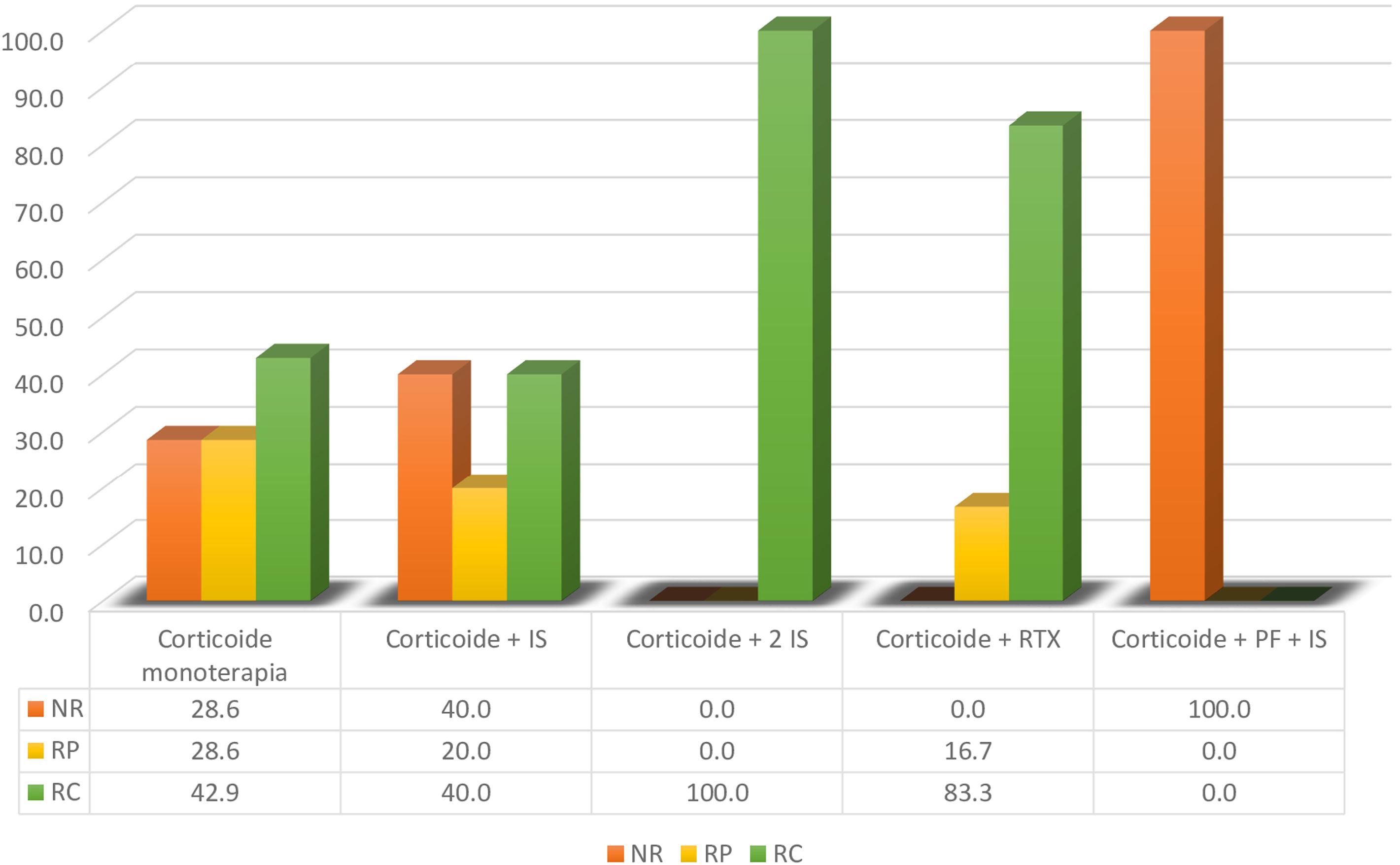
La terapia inmunosupresora de primera línea en todos los pacientes fueron los glucocorticoides (monoterapia en 3 casos). Otros inmunosupresores fueron: ciclosporina (2 casos), azatioprina (un caso), hidroxicloroquina (2 casos), micofenolato mofetil (un caso) e inmunoglobulina endovenosa (un caso). El rituximab fue el único biológico descrito en 6 casos. Las tasas de respuesta pueden ser muy discutibles, por el corto tiempo de seguimiento en algunos casos, los cuales van desde 3 días hasta 36 meses (fig. 2). Se logró mayor tasa de respuesta completa con el uso de rituximab (5 con RC y uno con RP), llamativamente sin la necesidad de otros inmunosupresores distintos al corticoide en 5 de los 6 casos descritos. Los demás tratamientos tuvieron respuesta parcial en menos del 50% de los esquemas de tratamiento evaluados. Solo 2 casos que recibieron doble inmunosupresión, además del corticoide, tuvieron respuesta completa.
No se describen manifestaciones asociadas a las crioaglutininas, distintas a la anemia hemolítica inmune, salvo un único caso reportado de una paciente con LES embarazada que desarrolló oligohidramnios con muerte fetal.
Los 2 casos índices, al igual que los 11 publicados previamente, reportan las características clínicas asociadas a enfermedad por anticuerpos fríos (acrocianosis, fenómeno de Raynaud, lívedo, desencadenante con la exposición al frío), así como anemia hemolítica. Comparativamente, los casos actuales se asociaron a evidencia más clara de aglutinación en el hemograma, evidente por sus VCM más elevados, relación Hb/Hto menor de 1/3 y principal consumo de C4, con respecto a los otros casos. Así mismo, se determinó una tasa de respuesta completa al manejo con RTX, especialmente en el caso 2, con refractariedad a inmunosupresores convencionales, durante su seguimiento en 4 años, lo cual no fue posible evaluar prospectivamente en el resto de los casos publicados. Por otro lado, ambos tienen estudios de médula ósea, con cambios inespecíficos, pero descartando un proceso linfoproliferativo, propio de la enfermedad por crioaglutininas, descritos solo en 2 casos más.
ConclusionesLa AHAI por crioaglutininas asociado al LES es una manifestación infrecuente, que afecta notoriamente a mujeres en edad media de la vida (mediana de 42 años), puede hacer parte del debut de la enfermedad, hasta en el 75% de los casos o desarrollarse durante los primeros 5 años del diagnóstico de lupus. No hay casos en lupus juvenil descritos a la fecha. Los pacientes por encima de los 50 años tienen tasas más elevadas de anemia severa al ingreso y se asoció en especial a compromiso mucocutáneas, articular, serositis y otras citopenias. Solo un caso reportó compromiso renal no grave, por nefritis lúpica clase II. Finalmente, la respuesta al tratamiento parece ser más favorable con el uso de rituximab, como se ha descrito en la enfermedad por crioaglutininas primaria, incluso en ausencia de otras terapias inmunosupresoras distintas al corticoide.
Las debilidades de esta publicación son el subregistro de esta entidad, así como la ausencia de múltiples datos en los casos descritos y la falta de seguimiento a largo plazo. Por otro lado, pruebas como la amplitud térmica no son fácilmente disponibles en nuestro medio para evaluar la importancia de dichos autoanticuerpos incluso a títulos bajos. Como fortaleza de este estudio se destaca que es la serie más grande de casos descrita en la literatura y que a pesar de las limitantes descritas previamente, es de valiosa importancia para consolidar información de este grupo de pacientes, de manera tal que permita mejorar el abordaje diagnóstico, el enfoque terapéutico, el pronóstico y la calidad de vida de pacientes con lupus que desarrollan estas manifestaciones.
Responsabilidades éticasLos autores declaran que este artículo no contiene información personal que permita identificar a los pacientes, por lo que no se consideró necesario el consentimiento informado. El reporte del caso clínico cumple con la normativa vigente en investigación bioética y no se consideró necesario la autorización del comité de ética de la institución, ya que fue un reporte retrospectivo y no se modificó o intervino en el manejo de los pacientes; no se publicó información personal.
FinanciaciónNo hubo fuentes de financiación para este trabajo.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.