La pericarditis constrictiva es una entidad clínica que se manifiesta con signos y síntomas de insuficiencia cardiaca diastólica, causada por un pericardio anormalmente engrosado y rígido, o ambos, y disminución consecuente del llenado ventricular debido a menor distensibilidad. Dentro de las causas de pericarditis constrictiva está la inflamación por infección (viral, micobacterial o fúngica), enfermedades del tejido conectivo o cirugía cardiaca, entre otros. La ecocardiografía transtorácica de dos dimensiones (2D) y el modo Doppler constituyen la primera herramienta diagnóstica en la evaluación de insuficiencia cardiaca y pueden identificar pericarditis constrictiva en la mayoría de pacientes mediante técnicas en movimiento real y hallazgos hemodinámicos. Asimismo, la tomografía computarizada y la resonancia magnética proveen información adicional para el diagnóstico y manejo de la pericarditis constrictiva, y son particularmente útiles cuando los hallazgos ecocardiográficos no son concluyentes. La evaluación hemodinámica por cateterismo cardíaco ocasionalmente puede aportar información adicional en casos en los que las imágenes no-invasivas demuestran hallazgos sugerentes o no concluyentes de pericarditis constrictiva.
Constrictive pericarditis is a clinical condition that demonstrates signs and symptoms of diastolic heart failure, caused by an abnormally enlarged and rigid pericardium, and a subsequent decrease in ventricular filling due to lower distensibility. Among the causes of constrictive pericarditis are the inflammation due to infection (viral, mycobacterial, or fungal), connective tissue diseases, or cardiac surgery. Two-dimensional (2-D) transthoracic ultrasound and in the Doppler mode is the main diagnostic tool in the evaluation of heart failure. It can also identify constrictive pericarditis in the majority of patients by means of real-time movement techniques and haemodynamic findings. Likewise, computed tomography and magnetic resonance provide additional information for the diagnosis and management of constrictive pericarditis, and are particularly useful when the cardiac ultrasound findings are inconclusive. The haemodynamic evaluation by cardiac catheterisation can occasionally provide additional information in cases in which the non-invasive images show suggestive of inconclusive findings of constrictive pericarditis.
La pericarditis constrictiva es una entidad clínica que se caracteriza por dificultad en el llenado diastólico ventricular debido a la compresión del corazón causada por un pericardio anormalmente engrosado y rígido. Puede originarse por inflamación del pericardio ocasionada por infección (viral, micobacterial o fúngica), o enfermedades del tejido conectivo (artritis reumatoide, lupus). Otras causas diversas incluyen cirugía cardiaca, irradiación cardiaca, neoplasias, trauma, medicamentos, asbestosis y uremia1. Pese a la mejor optimización de los métodos diagnósticos, la mayoría de casos siguen siendo idiopáticos2.
A diferencia del taponamiento, en el que la compresión del corazón se produce a lo largo de toda la duración de la diástole, en la pericarditis constrictiva el llenado diastólico ventricular es normal en el primer tercio de la diástole, pero significativamente limitada en los últimos dos tercios de ésta, que es justamente cuando el corazón se ve limitado a expandirse al hacer contacto con el pericardio característicamente rígido y, por tanto, inelástico e inextensible. Normalmente, el pericardio se puede estirar para adaptarse y acomodarse a cambios en el volumen cardiaco durante diástole. Sin embargo, cuando ocurre constricción, el pericardio rígido bloquea esta adaptación fisiológica del pericardio e impide el llenado ventricular adecuado.
Hay otros cambios normales con la respiración que se ven afectados con constricción del pericardio. Bajo situaciones normales, la presión intratorácica disminuye durante la respiración y produce un aumento en el retorno venoso al corazón. Cuando hay constricción, el pericardio rígido no se expande para acomodar el aumento de volumen, de modo que aumenta la presión de llenado del ventrículo derecho (VD) con expansión de su volumen a expensas del volumen del ventrículo izquierdo (VI). Al mismo tiempo, la presión intratorácica disminuida conlleva reducción de la presión venosa pulmonar, si bien la presión de llenado del VI permanece intacta, así que hay una disminución del llenado del VI producto de la disminución de la gradiente de presión transpulmonar. Como resultado, el septo interventricular se mueve hacia el VI con la inspiración y hacia el VD con la espiración. Dada la rigidez del pericardio, cualquier asimetría entre los ventrículos, por más leve que sea, puede conducir a cambios rápidos en la presión diferencial entre ambos lados del septo (“interdependencia ventricular”), y por tanto, cambiar de posición muy abruptamente en respuesta a estos cambios, llevando a lo que se conoce como “rebote septal”. De igual manera, el pericardio rígido también produce disociación entre las presiones intracardiacas e intratorácicas, ya que aísla el corazón de los cambios en la presión intratorácica que se producen con la respiración bajo situaciones normales.
Miocardiopatía restrictivaA menudo se confunde la pericarditis constrictiva en clínica con la miocardiopatía restrictiva, la cual es una enfermedad intrínseca del miocardio y/o la matriz intercelular, que resulta en una falla en la relajación y aumento de la rigidez del VI por sí mismo. Por tanto, la miocardiopatía restrictiva se caracteriza por disminución de los volúmenes diastólicos o sistólicos del VI (aunque también el VD puede verse afectado) además de una pared ventricular rígida pero con grosor normal3. Entre las etiologías de la miocardiopatía restrictiva, existen procesos infiltrativos (por ejemplo: amiloidosis, sarcoidosis, enfermedad de Gaucher), enfermedades de depósito (hemocromatosis, enfermedad de Fabry, enfermedad de almacenamiento de glucógeno), fibrosis endomiocárdica debido a infestación parasitaria o leucemia con predominio eosinofílico o medicamentos como serotonina, ergotamina, agentes de mercurio y busulfán.
En miocardiopatía restrictiva, las presión diastólica final del ventrículo izquierdo se eleva debido a un aumento de rigidez del miocardio, con disminución consecuente de la relajación miocárdica. Esto causa un aumento en las presiones de la aurícula izquierda, lo cual eleva de forma retrógrada las presiones en la arteria y la vena pulmonar. Con la progresión de la enfermedad ocurre falla del corazón derecho, y además aumenta la presión diastólica final del ventrículo derecho y subsecuente presión venosa central. En estos casos avanzados de falla biventricular se da una igualdad de las presiones diastólicas de ambos ventrículos, lo cual conduce a insuficiencia cardiaca diastólica, o con fracción de eyección preservada4. Es así que pacientes con miocardiopatía restrictiva muestran típicamente síntomas de insuficiencia cardiaca y congestion venosa. Si bien la hipertensión, la diabetes y la enfermedad coronaria son los principales factores de riesgo para insuficiencia cardiaca con fracción de eyección preservada, 10 a 15% de casos se deben a miocardiopatía restrictiva5.
La diferenciación entre pericarditis constrictiva y miocardiopatía restrictiva continúa siendo uno de los principales desafíos clínicos; sin embargo, el diagnóstico temprano termina siendo crucial para el pronóstico. Por ejemplo, pacientes con pericarditis constrictiva pueden ser tratados exitosamente con pericardiectomía, mientras que, por otro lado, la miocardiopatía restrictiva sin tratamiento tiene pronóstico muy pobre6. Es así que un diagnóstico temprano no solo ayuda a mejorar síntomas, sino que también previene daño de órgano blanco y mejora la sobrevida.
Presentación clínicaAl evaluar pacientes con síntomas de congestión venosa tales como disnea y edema periférico, la historia clínica, en particular los antecedentes médicos, desempeña un papel predominante. Por ejemplo, si se sospecha cardiopatía, algunos de los antecedentes clave que se deben indagar incluyen historia previa de cirugía de bypass coronario, pericarditis, trauma o enfermedad del tejido conectivo.
El examen físico, tanto de pericarditis constrictiva como de miocardiopatía restrictiva, muestra signos de congestión venosa, tales como presión venosa yugular elevada, crépitos pulmonares, ascitis, edema periférico o signo de Kussmaul (ausencia de disminución de la presión yugular venosa con la inspiración). De otra parte, el pulso paradójico (pulsus paradoxus), caracterizado por una caída en la presión sistólica mayor a 10mm Hg durante inspiración, ocurre en menos del 20% de pacientes con pericarditis constrictiva. El “knock” pericárdico, sonido de tono alto que se escucha temprano en diástole, se ha asociado con el cese abrupto del llenado diastólico y se reporta en el 47% de pacientes con pericarditis constrictiva7. Es importante resaltar que el examen físico no ayuda a diferenciar ambas entidades.
Presión venosa centralTanto la pericarditis constrictiva como la miocardiopatía restrictiva muestran hallazgos similares en presión venosa central, observándose una pendiente aguda de la onda “y” con rápido ascenso de la presión diastólica por restricción del llenado ventricular, lo cual ha sido descrito como el “signo de la raíz cuadrada”. Cuando ocurre depleción de volumen se puede dar una “normalización” de la presión venosa yugular, enmascarando los signos de elevación de presión de llenado de VD.
ElectrocardiografíaNo hay signos electrocardiográficos patognomónicos para diagnosticar pericarditis constrictiva. Se encuentran frecuentemente cambios inespecíficos del segmento T o la onda T, así como fibrilación auricular. También se ha descrito en pericarditis constrictiva ondas P melladas (“P mitral”), que se encuentra clásicamente en estenosis mitral reumática, posiblemente debido a crecimiento de la aurícula izquierda hacia el seno oblicuo, una zona en donde no se halla pericardio.
Radiografía de tóraxEn casos de pericarditis constrictiva con pericardio calcificado, la calcificación es marcada y difusa en la radiografía de tórax. Si bien es cierto que la calcificación del pericardio ayuda a diagnosticar pericarditis constrictiva, este hallazgo sólo ocurre en 25-30% de pacientes con pericarditis constrictiva. Adicionalmente, no todos los pacientes con pericardio calcificado tienen pericarditis constrictiva, y la prevalencia real de pericarditis constrictiva clínica en pacientes con calcificación pericárdica se desconoce.
Pruebas de laboratorioEs común observar elevaciones leves en niveles de creatinina y de enzimas hepáticas, sobretodo fosfatasa alcalina. Particularmente, los niveles de péptido natriurético cerebral (BNP) son menores en pericarditis constrictiva (<200 pg/ml) en comparación con la miocardiopatía constrictiva. Sin embargo, en casos de pericarditis constrictiva con enfermedad miocárdica subyacente (como enfermedad cardiaca por radiación), estos hallazgos de laboratorio pueden ser menos determinantes.
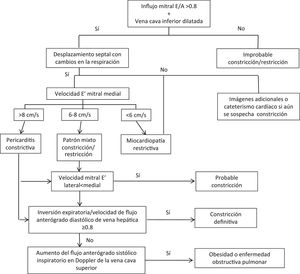
EcocardiografíaProvee información no solo de tipo hemodinámico/fisiológico, sino también anatómico. Por tanto, constituye el paso inicial más importante en la evaluación de pacientes con congestión venosa ya que ayuda a excluir causas obvias de falla cardiaca derecha. En caso de que la función derecha esté preservada, aumenta la sospecha de constricción pericárdica. Con ayuda de parámetros identificados con ecografía transtorácica (explicados a continuación) se puede establecer un algoritmo diagnóstico para pericarditis constrictiva (fig. 1).
Imágenes anatómicasEn pericarditis constrictiva, las imágenes bidimensionales (2D) pueden mostrar engrosamiento del pericardio. Infortunadamente, la sensibilidad de la ecografía transtorácica (ETT) para detectar dicho cambio es baja8, aunque la ecografía transesofágica (ETE) obtiene imágenes de mejor resolución. Múltiples estudios han demostrado que un grosor del pericardio de más de 4mm es altamente sugerente de pericarditis constrictiva. Sin embargo, es necesario tener en cuenta que alrededor del 20% de los casos de pericarditis constrictiva pueden ocurrir con pericardio de grosor normal8, por lo que el pericardio de grosor normal no descarta pericarditis constrictiva.
Por otro lado, la ecografía 2D puede encontrar aurículas marcadamente dilatadas en miocardiopatía restrictiva, mientras que en pericarditis constrictiva esta dilatación es leve ya que está limitada por el pericardio rígido. De manera similar, hay hallazgos propios de entidades que pueden dar pistas sobre el diagnóstico. Por ejemplo, en enfermedades infiltrativas como amiloidosis, se puede encontrar engrosamiento del septo interatrial; en fibrosis endomiocárdica, se observan lesiones apicales en forma de masas en el VI.
La dilatación auricular con ventrículos normales, junto con la dilatación de vena cava inferior y venas hepáticas sugiere pericarditis constrictiva, aunque son hallazgos no específicos. Sin embargo, el hallazgo más específico de pericarditis constrictiva que se observa en la ecocardiografía 2D es el desplazamiento del septo hacia el VI durante inspiración y hacia el VD durante espiración, causado por la variabilidad en el retorno venoso y la exageración en la dependencia interventricular9.
Hallazgos hemodinámicosComo se mencionó anteriormente, la presentación clínica de la pericarditis constrictiva y la miocardiopatía restrictiva es muy similar; no obstante, la patofisiología y las alteraciones hemodinámicas difieren. En ambas entidades hay reducción de la distensibilidad del VI. La capacidad de relajación del miocardio está afectada en miocardiopatía restrictiva, pero es normal en pericarditis constrictiva, y por tanto, los pacientes con esta última presentan dependencia interventricular acentuada y disociación entre las presiones intratorácicas e intracardiacas. Estas diferencias pueden ser evaluadas a través de distintos métodos ecocardiográficos que se explican a continuación.
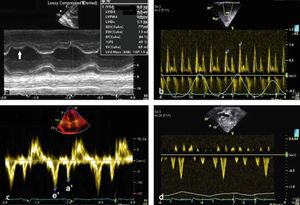
Modo MEn pericarditis constrictiva, el modo M puede identificar movimiento posterior abrupto del septo en diástole temprana con la inspiración, causada por la disminución en el llenado del VI debido a la disminución en el gradiente vena pulmonar – aurícula izquierda.
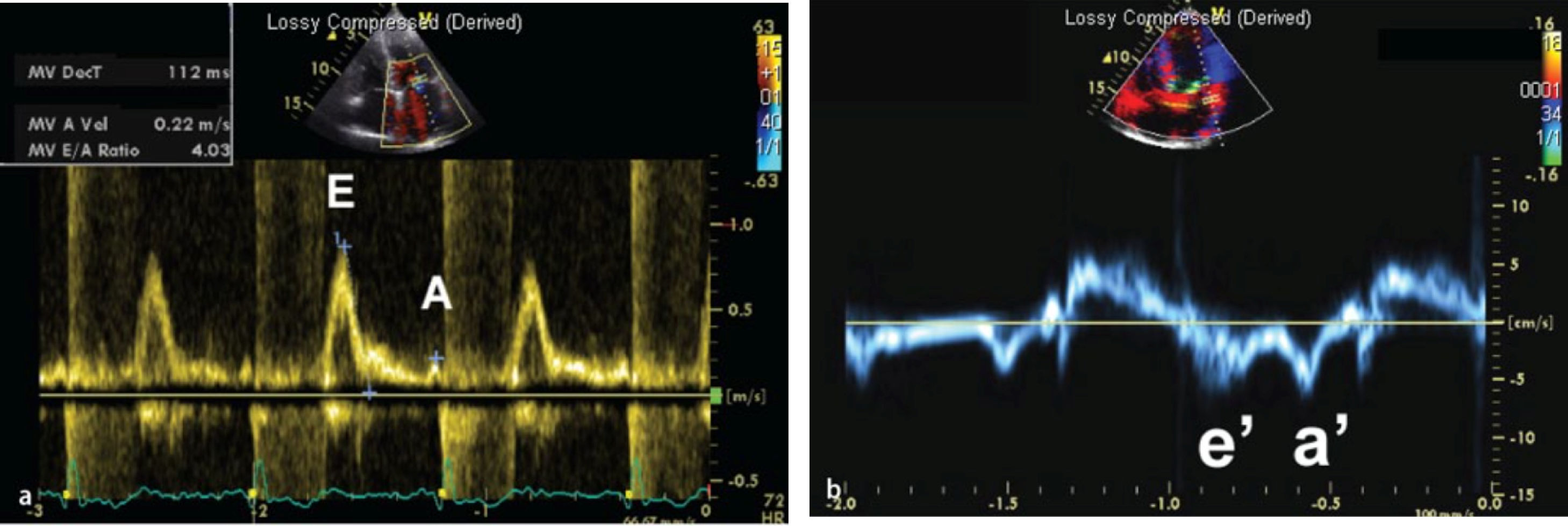
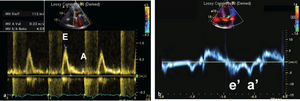
Modo DopplerLa ecocardiografía, además de estudiar el grosor del pericardio, permite hacer un estudio hemodinámico mediante el modo Doppler. Ya que la pericarditis constrictiva y la miocardiopatía restrictiva comparten muchas alteraciones y patrones hemodinámicos, el modo Doppler muestra hallazgos similares. El modo Doppler transvalvular muestra restricción del influjo mitral o del patrón de llenado ventricular, medidos con la velocidad mitral E, con notable dominancia E y corto tiempo de desaceleración (fig. 2). Estos hallazgos indican rápido llenado temprano y se ven tanto en pericarditis constrictiva como en miocardiopatía restrictiva. Sin embargo, el modo Doppler puede ayudar a diferenciar entre pericarditis constrictiva y miocardiopatía restrictiva a través de los siguientes hallazgos:
Cambios con respiración en presión intratorácica y llenado ventricularLa variación con la respiración en la velocidad de llenado ventricular en miocardiopatía restrictiva es usualmente mínima (<10%), mientras que en pericarditis constrictiva se observa mayor variación (30-40%). Un estudio que incluyó 30 pacientes, 19 con pericarditis constrictiva y 11 con miocardiopatía restrictiva, encontró que una variación de ≥10% tenía sensibilidad de 84% y especificidad de 91% para predecir pericarditis constrictiva10.
Es importante tener en cuenta que hay ocasiones en las que no se encuentra variación con la respiración, como por ejemplo en pacientes con presión de aurícula izquierda muy elevadas. Otros casos de constricción “oculta”, pueden requerir fluidos para demostrar estas variaciones respiratorias clásicamente descritas en pericarditis constrictiva11. De manera similar, identificar cambios con la respiración podría ser difícil en pacientes con fibrilación auricular. Si bien se puede encontrar variación significativa en pacientes con taponamiento cardiaco, EPOC, derrames pleurales o disfunción severa de ventrículo derecho, esta variación tiende a ser más gradual en lugar de ocurrir más abruptamente como en pericarditis constrictiva.
Flujo venoso hepáticoEl flujo venoso hepático ayuda a distinguir entre pericarditis constrictiva y miocardiopatía restrictiva. En pericarditis constrictiva, hay un aumento en el flujo venoso hepático reverso con la espiración, debido a que el VD tiene menor compliance a medida que se expande el VI. Por el contrario, en miocardiopatía restrictiva, hay un aumento del flujo venoso hepático reverso con la inspiración (fig. 2).
Velocidad de flujo de regurgitación pulmonarDado el patrón característico de presión diastólica del VD en pacientes con pericarditis constrictiva, las velocidades en el pico de diástole temprana y punto mínimo de diástole tardía de la onda continua Doppler de regurgitación pulmonar son menores en pericarditis constrictiva en comparación con la miocardiopatía restrictiva y en pacientes normales12.
Tiempo de tránsito de modo M colorEl Doppler modo M color es una técnica que brinda un mapa de velocidad espacio-temporal. El cursor del modo M se alinea con la dirección principal del flujo mitral durante el estudio en las vistas de dos y de cuatro cámaras. Esta técnica demuestra un tránsito excesivamente rápido en el flujo de sangre desde el orificio mitral hacia el ápex en pacientes con pericarditis constrictiva; sin embargo, dicho tránsito es mucho más lento en pacientes con miocardiopatía restrictiva debido a la rigidez observada durante la diástole temprana10.
Modo Doppler tisularLas imágenes de Doppler tisular de las velocidades miocárdicas y en particular de las mecánicas longitudinales se han convertido en una herramienta crítica para la diferenciación fisiológica entre pericarditis constrictiva y miocardiopatía restrictiva. Esta además se puede usar junto con el Doppler tradicional para elaborar un mejor diagnóstico.
La velocidad de Doppler tisular en diástole temprana en el anillo mitral (E’) está disminuida en miocardiopatía restrictiva (<8cm/s) debido a una reducción intrínseca en la contracción y relajación del miocardio. Por otro lado, esta se encuentra aumentada (>12cm/s) en pericarditis constrictiva ya que el movimiento longitudinal del miocardio está elevado debido al movimiento radial limitado. Mientras que estos puntos de corte son altamente específicos para diagnosticar miocardiopatía restrictiva y pericarditis constrictiva, valores entre 8 y 12cm/s usualmente no son diagnósticos. Además, la sensibilidad de la velocidad E’ es modesta (figs. 2a)10,13,14.
Hallazgos ecocardiográficos en pericarditis constrictiva. A: Modo M en el que se evidencia movimiento anormal del septo (flecha). B: Doppler transmitral que muestra variación con la respiración. C: Doppler tisular del anillo lateral con E’>12 cm/s. D: Inversión del flujo venoso hepático con la espiración.
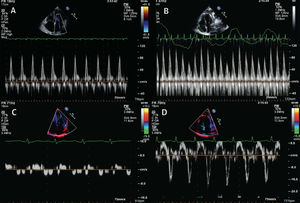
Imágenes de Doppler pulsado de la afluencia en ventrículo izquierdo (A y B) y velocidades miocárdicas en Doppler tisular de las paredes basolaterales (C y D) obtenidas de pacientes con miocardiopatía restrictiva (A y C) y PC (B y D). En constricción, hay una variabilidad respiratoria significantiva y velocidades miocárdicas en diástole temprana exageradas (E0).
Hallazgos ecocardiográficos en miocardiopatía restrictiva. A: Doppler transmitral que muestra alta velocidad en sístole temprana (onda E), tiempo de desaceleración corto (112 ms) y onda A diminuta, consistente con función auricular disminuida. B: Doppler tisular del anillo lateral con E’ reducida a <5 cm/s.
En comparación con individuos normales, las velocidades de los anillos mitral lateral y tricuspídea están relativamente disminuidas en pacientes con pericarditis constrictiva (“anular reversus”). Esta reducción puede ser producto de la adhesión lateral del pericardio, mientras que el movimiento longitudinal del anillo septal se encuentra intacto15. Estas alteraciones mecánicas no se observan en miocardiopatía restrictiva. Es así que se puede usar el radio entre las velocidades laterales y septales (tanto mitral como tricuspídea), el cual se encuentra reducido en pacientes con pericarditis constrictiva en comparación con aquellos con miocardiopatía restrictiva, y podría orientar el diagnóstico y diferenciar ambas entidades16,17. Es importante tener en cuenta que algunos factores pueden reducir significativamente la sensibilidad de este marcador, tales como calcificación del anillo mitral o disfunción miocárdica segmental o global.
La onda sistólica (S) también puede ayudar a diferenciar entre pericarditis constrictiva y miocardiopatía restrictiva, ya que valores menores a 5cm/s sugieren miocardiopatía restrictiva.
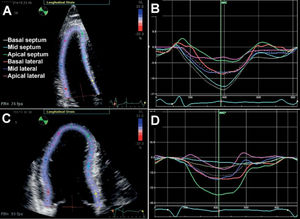
Método rastreo del moteadoEl método rastreo del moteado (speckle tracking en inglés) es una técnica relativamente reciente, desarrollada sobre ecocardiografía bidimensional, que permite detectar pequeñas diferencias en la textura o moteado a través del tiempo, pudiendo determinar el porcentaje de acortamiento de la fibra muscular. Es así como ayuda a diferenciar entre pericarditis constrictiva y miocardiopatía restrictiva al obtener información de la mecánica del miocardio tan detallada. Como se mencionó anteriormente, la miocardiopatía restrictiva y la pericarditis constrictiva presentan diferentes características mecánicas a través de los ejes. Por un lado, la primera tiene mecánica longitudinal anormal, mientras que en la segunda solo se afectan las mecánicas de torsión y circunferencial. Estas diferencias pueden ser observadas y medidas cuantitativamente a través del método de rastreo del moteado (fig. 5).
Deformación longitudinal del ventrículo izquierdo en pericarditis constrictiva y miocardiopatía restrictiva observada a través de método rastreo del moteado. Las paredes basales del septo y lateral muestran mecánica longitudinal normal en pericarditis constrictiva (A y B), pero reducida en miocardiopatía restrictiva (C y D). Por otro lado, el acortamiento longitudinal del ápice está reducido en pericarditis constrictiva (B), mientras que está preservado en miocardiopatía restrictiva (D).
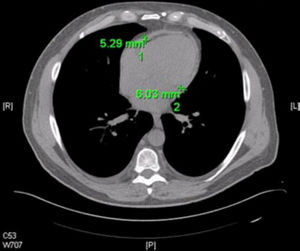
Se conoce que tanto la TC como la resonancia magnética cardiaca (RM) son más sensibles que la ETT para detectar incremento del grosor del pericardio8,18. En un reporte de casos de 143 pacientes con pericarditis constrictiva confirmada mediante cirugía, se demostró engrosamiento pericárdico en 86% de ellos mediante TC (8). Sin embargo, como se mencionó anteriormente, se puede observar engrosamiento del pericardio sin haber constricción. Igualmente, se puede encontrar constricción en pericardio de grosor normal (fig. 6)8.
Tomografía computarizada que muestra engrosamiento circunferencial del pericardio en pericarditis constrictiva. El grosor normal del pericardio es <2mm. Grosor mayor a 4 cm se considera sugerente de pericarditis constrictiva. Sin embargo, el grosor normal no excluye el diagnóstico de esta.
Dentro de los hallazgos en TC se incluyen dilatación de la vena cava inferior, calcificación del pericardio, deformidad de los contornos ventriculares y angulación del septo ventricular. Así mismo, la TC puede examinar el movimiento que transmite el corazón al parénquima pulmonar adyacente. Por ejemplo, cuando se observa que las estructuras pulmonares inmediatamente adyacentes no pulsan correctamente durante el ciclo cardiaco, en la presencia de engrosamiento pericárdico (regional o global), la sospecha de pericarditis constrictiva es alta19.
Otros hallazgos sugerentes de pericarditis constrictiva incluyen deformación del VD de tipo estrechamiento y tubular, lo cual se da debido a un aplanamiento de la superficie lateral del ventrículo, y es de forma tubular, en lugar de cónica, que se da por constricción del pericardio. Además, se puede observar enderezamiento del septo interventricular en pericarditis constrictiva, lo cual no se evidencia en miocardiopatía restrictiva ya que la capacidad de llenado está reducida en ambos ventrículos. Sin embargo, la TC no permite evaluar cambios inducidos por respiración ya que las imágenes se adquieren en 1 a 4 ciclos cardíacos.
Resonancia magnética cardiacaJunto a la TC, la resonancia magnética (RM) tiene mayor sensibilidad en comparación con el ETT para detectar engrosamiento del pericardio, con una sensibilidad de 93%18. Las secuencias turbo espín eco, especialmente con técnicas de saturación de la grasa, secuencias de inversión con TAU corto son útiles para visualizar edema e inflamación pericárdicos20. Al igual que la TC, la RM puede arrojar hallazgos anatómicos tales como engrosamiento pericárdico, dilatación de la vena cava inferior y/o apariencia tubular o aplanada de los ventrículos21. Sin embargo, en comparación con la TC, la RM es menos sensible para detectar calcificaciones, pero es mejor para distinguir entre engrosamiento, efusión y distensibilidad del pericardio22.
La RM de tiempo real facilita además la evaluación de la variación con la respiración del movimiento del septo ventricular. La excursión del septo ventricular, definido como la diferencia máxima entre la posición del septo ventricular en inspiración y espiración, y normalizado por el diámetro biventricular, ayuda a discriminar entre pericarditis constrictiva y miocardiopatía restrictiva con un punto de corte de 11,8%23.
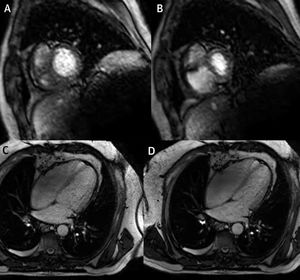
La RM tiene también la ventaja de brindar información hemodinámica y fisiológica con cine-RM y realce tardío de gadolinio (RT). Las secuencias de cine-RM de baja resolución en tiempo real pueden detectar rebote del septo, así como interdependencia interventricular1; mientras que en miocardiopatía restrictiva se observa una tendencia hacia disminución de la excursión del septo relacionada a la respiración, la cual puede estar relacionada con aumento de la rigidez del miocardio, hecho que impide aun más el movimiento del septo23. Las secuencias de cine-RM también permiten cuantificar cambios en el área biventricular durante respiración, lo que ha demostrado ser un marcador objetivo, exacto y reproducible para detectar interdependencia interventricular en pericarditis constrictiva24 (fig. 7).
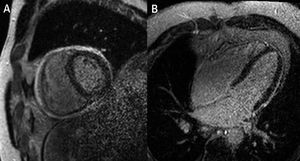
Resonancia magnética en tiempo real – imágenes obtenidas en diástole tardía en un paciente con pericarditis constrictiva. Imágenes obtenidas durante espiración (A y C) y durante inspiración (B y D), que muestran los cambios en los volúmenes de VD y VI debido a interdependencia ventricular exagerada.
El realce tardío de gadolinio (RT) constituye una herramienta adicional importante para evaluar enfermedad pericárdica. Este se observa en casos de inflamación continua del pericardio, mas no en casos de pericardio fibrosado y cicatrizado25. Asimismo, se puede encontrar RT en el miocardio en procesos inflamatorios o infiltrativos que pueden producir miocardiopatía restrictiva, tales como enfermedad de Fabry o amiloidosis cardiaca. El patrón de RT también puede ayudar a identificar etiologías de miocardiopatía restrictiva; por ejemplo, se encuentra RT global o subendocárdico en amiloidosis cardiaca26.
Otros hallazgos en la RM pueden ayudar al diagnóstico de pericarditis constrictiva. En un estudio se encontró que el radio de volumen de la aurícula izquierda/derecha es significativamente mayor en pacientes con pericarditis constrictiva en comparación con RM; un radio de 1,32 tenía sensibilidad de 82,6% y especificidad de 86,4% para diagnosticar pericarditis constrictiva27.
Cateterismo cardíacoLa evaluación hemodinámica invasiva puede proveer información hemodinámica útil en casos en los que el diagnóstico es incierto. Por ejemplo, puede observarse la respuesta a un aumento en la precarga (infusión endovenosa rápida de 1L de suero salino) si la presión media de la AD es menor a15mm Hg. Entre los hallazgos clásicos de pericarditis constrictiva están el incremento de presión de llenado con igualdad de las presiones diastólicas tardías (<5mm Hg de diferencia), prominentes ondas de llenado rápido diastólico en VI y VD (≥5mm Hg, signo de la raíz cuadrada), presión sistólica del VD <55mm Hg y presión diastólica tardía del VD ≥1/3 de presión sistólica del VD. También se puede observar el signo “invasivo” de Kussmaul, el cual representa una falla de disminución de presión en la aurícula derecha durante la inspiración.
Un abordaje más moderno para la evaluación invasiva hemodinámica de pericarditis constrictiva se basa en hallazgos dinámicos o asociados a la respiración. La disociación entre las presiones intratorácicas-intracardiacas se puede evaluar a través de mediciones simultáneas de la presión capilar (en cuña) de la arteria pulmonar y de la presión del VI. Una diferencia de más de 5mm Hg entre las gradientes inspiratorias y espiratorias entre la presión capilar pulmonar y la presión diastólica temprana del VI presenta sensibilidad del 93% y especificidad del 81% para pericarditis constrictiva28. También se puede evaluar el aumento de la interdependencia ventricular a través de medidas simultáneas de cambios en las presiones del VD y del VI a través del ciclo respiratorio. En otras entidades se observan cambios en las presiones del VD y del VI en tándem (concordancia ventricular). En pericarditis constrictiva, el volumen del VD aumenta durante la inspiración a expensas del volumen del VI (discordancia ventricular). Es así que se puede calcular el “índice de área sistólica” (el cual se obtiene dividiendo el área sistólica del VD y del VI) en inspiración y espiración. Un radio del índice en inspiración/espiración ≥1,1 tiene sensibilidad de 97% y exactitud predictiva de 100% para pericarditis constrictiva29. La angiografía coronaria también puede proveer información importante; por ejemplo, puede mostrar fijación de las arterias coronarias distales30.
ConclusiónLa pericarditis constrictiva es una enfermedad que puede ser tratada exitosamente una vez diagnosticada. El clínico debe tener un alto índice de sospecha cuando los pacientes acuden con síntomas de falla cardiaca, en especial aquellos con historia de cirugía cardiaca u otra condición que cause inflamación o trauma del pericardio. Actualmente, la ecocardiografía es la herramienta de base para la evaluación inicial de la pericarditis constrictiva (tabla 1), sin embargo ningún parámetro ecocardiográfico es suficiente para distinguir entre pericarditis constrictiva y miocardiopatía restrictiva. El rol de otras modalidades de imágenes como la TC y la RM, junto con estudios hemodinámicos, permiten obtener mayor información para el diagnóstico y manejo de la pericarditis constrictiva.
Características hemodinámicas y ecocardiográficas de la pericarditis constrictiva y la miocardiopatía restrictiva
| Característica | Pericarditis constrictiva | Miocardiopatía restrictiva |
|---|---|---|
| Pulso paradójico | Presente en 1/3 de los casos | Ausente |
| Knock pericárdico | Presente | Ausente |
| Curva y descendente prominente en JVP | Presente | Variable |
| Presión de llenado de lado izquierdo y derecho | Equilibrados por debajo de 5mm Hg | Presión de lado izquierdo es al menos 3-5mm Hg mayor que en el derecho |
| Presión de llenado >25mm Hg | Infrecuente | Frecuente |
| Presión sistólica del ventrículo derecho>50mm Hg | No | Común |
| Signo de la raíz cuadrada | Presente | Variable |
| Radio presión final diástole/sistólica en ventrículo derecho | ≥0,33 | <0,3 |
| Variación discordante con la respiración en las presiones pico sistólicas ventriculares | Las variaciones están fuera de fase | Las variaciones están dentro de la fase |
| Engrosamiento pericárdico | Usualmente aumentado | Normal |
| Tamaño auricular | Crecimiento leve, usualmente de la aurícula izquierda | Crecimiento de ambas aurículas, usualmente severo |
| Grosor de la pared ventricular | Normal | Usualmente elevada |
| Rebote septal | Presente | Ausente |
| Insuficiencia tricúspide o mitral | Usualmente ausente o leve | Usualmente presente |
| Influjo mitral | E inspiratorio menor a E espiratorio (≥25% cambio). | No variación respiratoria en la velocidad E. |
| Influjo tricúspide | E inspiratorio mayor a E espiratorio (≥40% cambio). | Variación respiratoria leve en la velocidad E (≤15%) |
| Onda Doppler pulsado de la vena hepática | Disminución del flujo anterógrado con espiración; inversión marcada del flujo diastólico el cual aumenta con espiración en comparación con inspiración. | Flujo anterógrado sistólico menor que el diastólico; inversión del flujo diastólico en la vena hepática es más prominente con inspiración. |
Ninguno.