El objetivo de este estudio es mostrar los resultados inmediatos y alejados de la exenteración pélvica total (EPT) en el manejo de tumores primarios de recto localmente avanzados. Se describe una alternativa técnica en los casos de EPT supraelevador. La EPT puede ser la única oportunidad de curación en pacientes con tumores pélvicos de gran volumen.
Material y métodoSe incluyen tumores T4 por la estadificación clínica o los hallazgos operatorios sometidos a una EPT con intención curativa.
ResultadosEn un periodo de 16años se intervienen con esta técnica 10 pacientes, 6 de los cuales recibieron radioquimioterapia neoadyuvante. La técnica clásica se empleó en 3 pacientes y la EPT supraelevador, en 6. El promedio de hospitalización fue de 36días (rango, 18-97) y la morbilidad alcanzó el 80%. El estudio de la pieza operatoria confirmó un tumor T4 en 6 pacientes, T3 en 3 y T0 en uno. Los 6 pacientes con neoadyuvancia son 1 ypT0N0M0, 2 ypIIA, 2 ypIIC y 1 ypIIIB. El resto eran 2 pIIC y 2 pIIIC. En el seguimiento hay 5 pacientes vivos entre 30 y 180meses, y 3 fallecen por metástasis a distancia sin recidiva local.
ConclusiónLa EPT es una intervención asociada a una elevada morbilidad y larga estadía hospitalaria. La EPT supraelevador protegida mediante una ileostomía transitoria evitó una colostomía definitiva en 6 de 10 casos. La ileostomía urinaria muestra resultados funcionales satisfactorios en el largo plazo. La sobrevida prolongada en la mitad de los pacientes justifica la indicación de la técnica en casos seleccionados.
To report the results of total pelvic exenteration (TPE) in patients with locally advanced primary rectal tumors.
Material and methodWe report 10 patients with stage 4 rectal tumors subjected to a potentially curative TPE in a period of 16years.
ResultsSix patients received also adjuvant chemoradiotherapy. A classic technique was used in 3 patients and a supra-elevator technique in 6. Mean hospitalization length was 36 days, and 80% of patients had complications. The pathological study of the surgical piece confirmed a T4 tumor in 6 patients, T3 in 3 and T0 in one. Among patients who received chemoradiotherapy, one was in stage ypT0N0M0, 2 in ypIIA, 2 in ypIIC, one in ypIIIB, 2 in pIIC and 2 in pIIIC. During follow up 3 patients survived between 30 and 180months and three died due to distant metastases without local relapse.
ConclusionTPE requires long hospital stays and has a high rate of complications. Supra-elevator TPE protected with a transitory ileostomy avoided definitive colostomy in 6 of 10 cases. Urinary ileostomy had satisfactory long term functional results. The prolonged survival of half of the patients justifies the use of this surgical technique
Los tumores primarios de recto localmente avanzados se adhieren a los órganos pelvianos adyacentes en alrededor del 25% de los pacientes, y aproximadamente en la mitad de ellos se comprueba una infiltración neoplásica1. La resección multivisceral en block con el fin de conseguir una resección R0 se considera el estándar en el manejo quirúrgico de estos pacientes, lo que implica realizar algún tipo de exenteración pélvica, procedimiento agresivo asociado a una elevada morbilidad2. La exenteración pélvica total (EPT) original incluía la resección del ano-recto con el aparato esfinteriano, parte del sigmoides, la vejiga, el tercio inferior de los uréteres, la próstata y las vesículas seminales en el hombre, y los órganos reproductivos femeninos, el drenaje linfático pelviano y del espacio obturatriz, además del peritoneo pelviano. Bricker3 popularizó en 1951 la EPT clásica para los tumores pélvicos avanzados, proponiendo una derivación urinaria confeccionada con una asa desfuncionalizada de íleon terminal (ileal conduit) exteriorizada a la derecha de la línea media y una colostomía terminal en el flanco izquierdo. La incorporación de las suturas mecánicas, mejores imágenes y un mayor conocimiento de los factores predictivos de la recidiva local permitió una modificación de la técnica con conservación del aparato esfinteriano anorrectal (EPT supraelevador) en forma progresiva desde la década de los noventa4, lo que reduce el carácter mutilante de la intervención original.
El objetivo de este trabajo es dar a conocer los resultados inmediatos y alejados de la técnica de la EPT en un grupo seleccionado de pacientes portadores de un tumor primario de recto localmente avanzado. Se difunde una alternativa técnica de protección de una anastomosis colorrectal ultrabaja para los pacientes que son candidatos a una EPT supraelevador.
Material y métodoSe trata de una revisión retrospectiva de una serie de casos. Los datos fueron obtenidos de una base de registro prospectivo de cáncer primario del recto. Se incluyen todos los pacientes sometidos a una EPT por un adenocarcinoma primario de recto cuya estadificación clínica e imágenes y/o los hallazgos intraoperatorios sugirieran un tumor T4 con compromiso de la vejiga y/o la próstata y/o las vesículas seminales. Se consideran los tumores localmente avanzados en ausencia de metástasis a distancia y con un seguimiento potencial mínimo de 3años. Se excluyen los pacientes tratados por una recidiva local de un cáncer de recto, los intervenidos con EPT por otra causa etiológica u otros tipos de exenteración pélvica. La morbilidad se estratificó según la clasificación de Clavien-Dindo (C-D)5. Para la estadificación final (patológica) se empleó la clasificación TNM 2010 (7.ª edición)6.
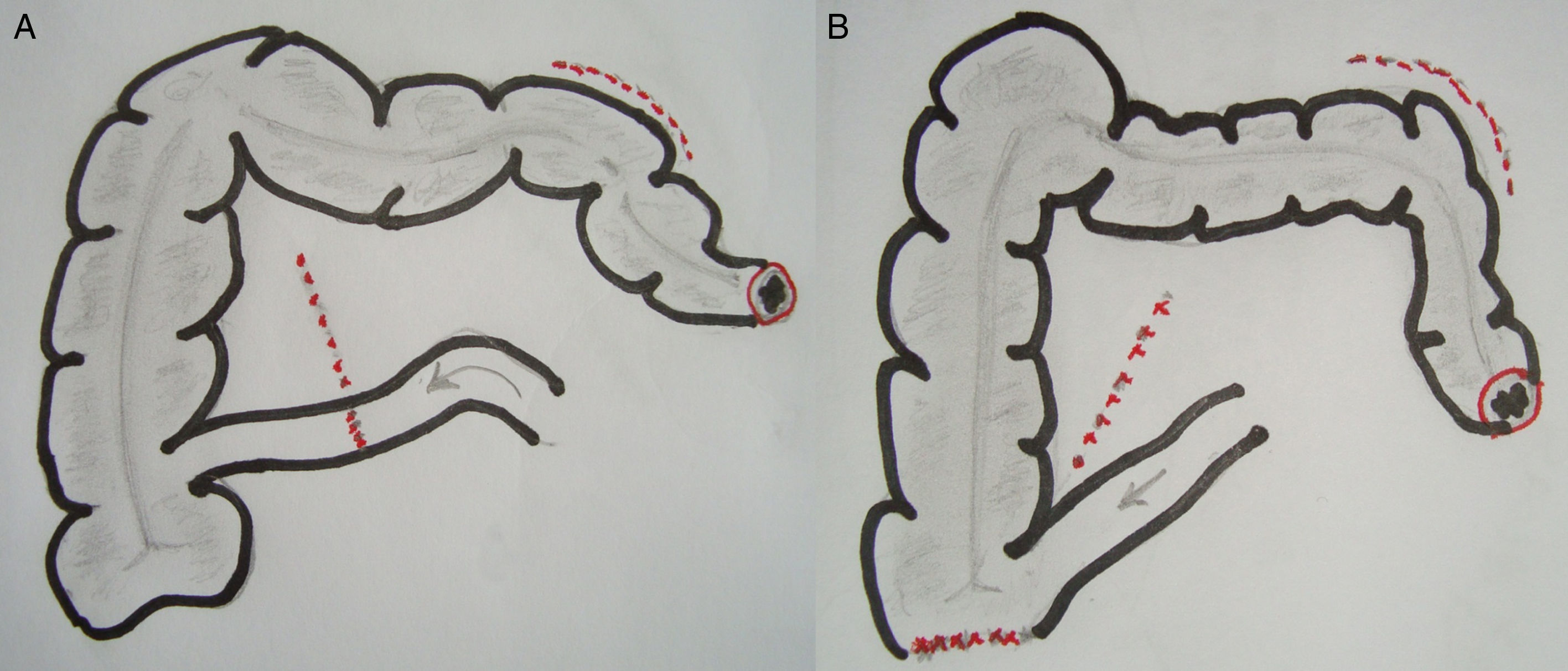
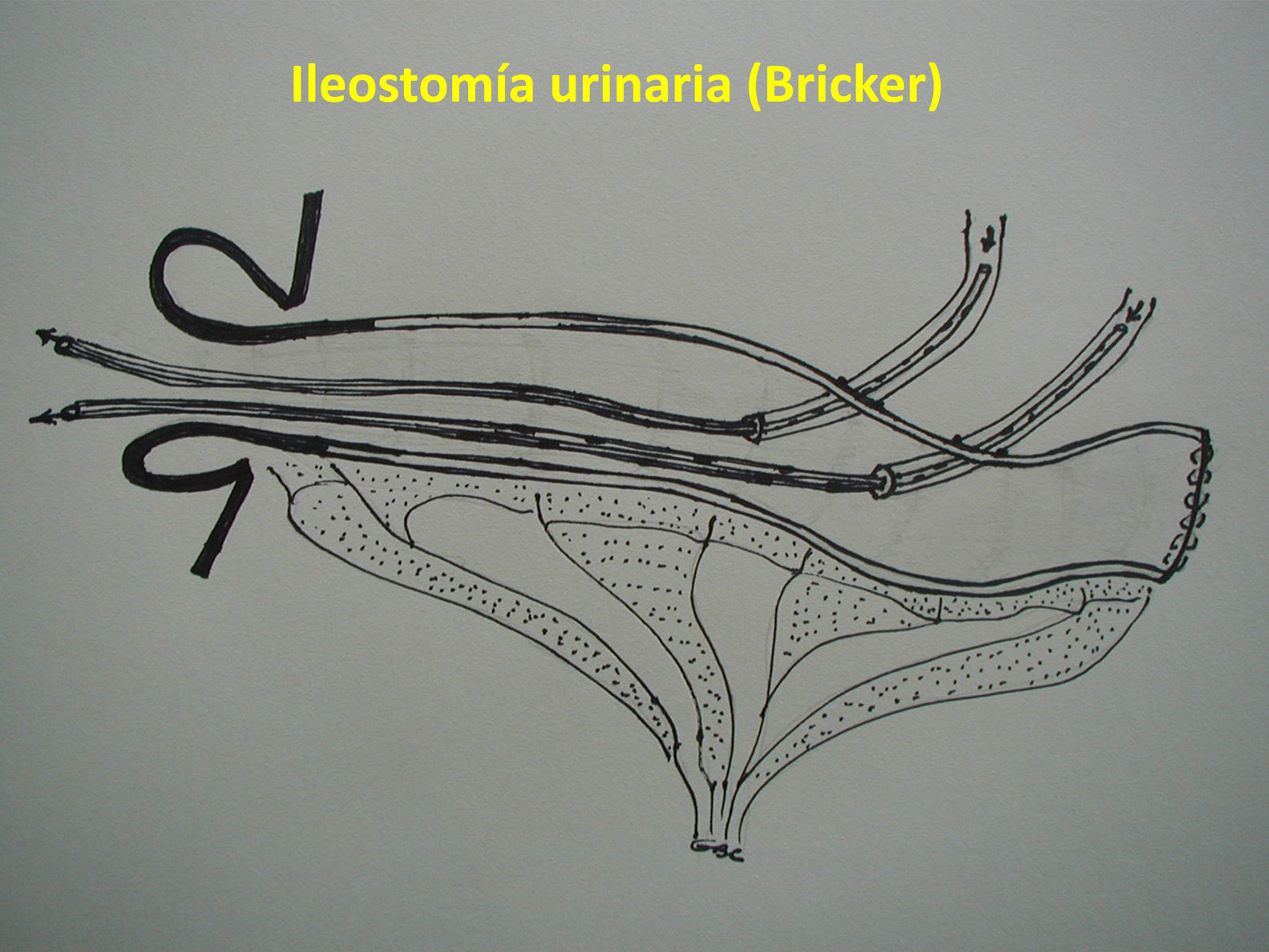
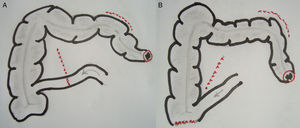
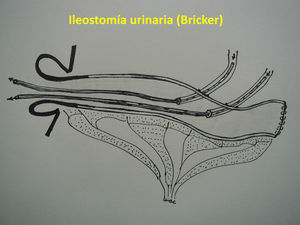
Técnica quirúrgica: alternativasEPT clásica: ya definida, con un tiempo abdominal y un tiempo perineal, que corresponde a una resección abdominoperineal del anorrectosigmoides (RAP) más la vejiga, la próstata y las vesículas seminales en block (y los genitales internos en la mujer). La reconstrucción del tránsito intestinal se efectuó mediante una entero-enteroanastomosis terminoterminal en los casos con intestino sano (fig. 1A). En los casos de compromiso tumoral y/o daño actínico del íleon terminal se resecó el segmento comprometido, restituyendo el tránsito intestinal mediante una ileo-ascendoanastomosis terminal funcional (fig 1B). La reconstrucción urinaria se realizó en todos los casos mediante una ileostomía urinaria, sin anastomosis directa entre los uréteres y la pared intestinal, técnica detallada previamente7 (fig. 2).
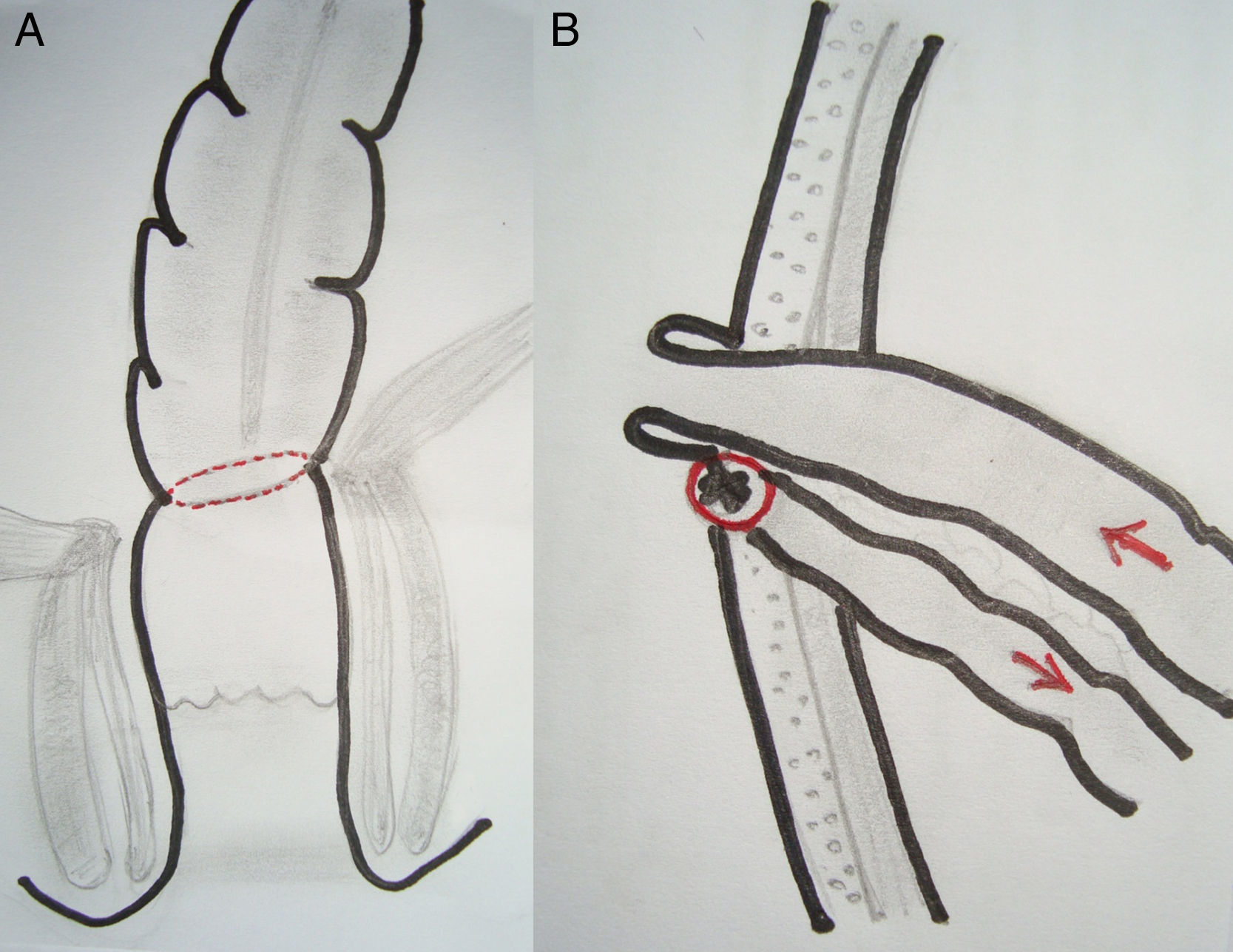
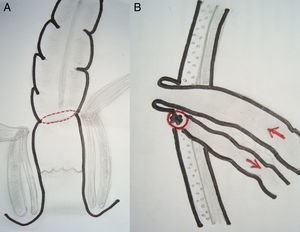
EPT supraesfinteriana: resección en block del rectosigmoides y órganos urinarios con conservación del aparato esfinteriano y anastomosis colorrectal ultrabaja (RAUB: <5cm del margen anal) con resección total del mesorrecto. La modificación propuesta en estos casos de RAUB consiste en la protección de la anastomosis mediante una ileostomía terminal, evertida, protruida y madurada, aprovechando el cabo proximal del segmento de íleon aislado para confeccionar la ileostomía urinaria. El cabo distal del íleon se exterioriza por la misma contraabertura de la ileostomía terminal, que también es madurada pero sin protrusión, lo que facilita posteriormente la reconstitución del tránsito intestinal (fig. 3).
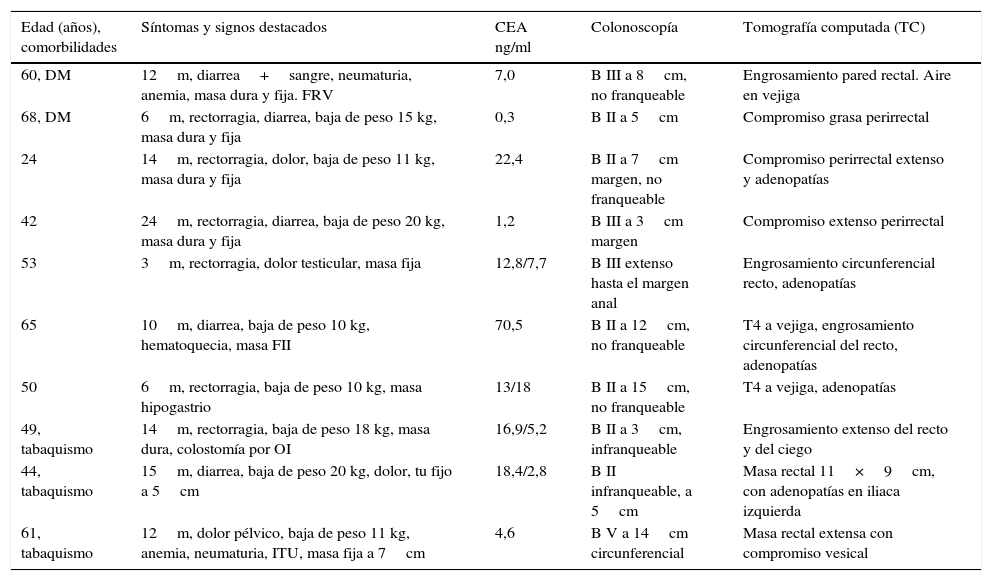
ResultadosEn un periodo de 16 años se efectuaron 10 EPT por cáncer primario del recto, lo que representa el 3% de los pacientes sometidos a una resección radical por esta causa, todos del género masculino, con un promedio etario de 52años (rango, 24-68). Cinco pacientes tenían una o más enfermedades asociadas, destacando el tabaquismo con limitación del flujo aéreo en 4 casos y la diabetes mellitus en 2. Los síntomas más destacados fueron la baja de peso en 9 pacientes (8 de ellos entre 10 y 20kg), la pérdida de sangre por el ano en 8 casos, la diarrea en 4 y la anemia en 4. Al tacto rectal se palpó una masa rectal fija y dura en 8 casos y una masa abdominal baja en 2. Todos los pacientes fueron clasificados como ASA2. La albúmina promedio de la serie fue de 3,2g/dl (rango, 3-3,8). El CEA preoperatorio fue mayor de 5ng/ml en 7 pacientes, fluctuando entre 0,3 y 70,5ng/ml. La colonoscopia mostró un BormannII o III infranqueable en 7 pacientes con un borde inferior entre el margen anal y 15cm de altura (que corresponden a 5 lesiones de recto inferior, 2 de recto medio y 3 de recto superior). La biopsia endoscópica demostró un adenocarcinoma MD en 7 casos y BD en 3. La tomografía computada reveló una masa rectal extensa con invasión del tejido adiposo adyacente en todos los casos, compromiso vesical en 4 casos (uno con neumaturia) y adenopatías perirrectales y/o en regiones ilíacas en 5 (tabla 1).
Presentación clínica y estudio preoperatorio
| Edad (años), comorbilidades | Síntomas y signos destacados | CEA ng/ml | Colonoscopía | Tomografía computada (TC) |
|---|---|---|---|---|
| 60, DM | 12m, diarrea+sangre, neumaturia, anemia, masa dura y fija. FRV | 7,0 | B III a 8cm, no franqueable | Engrosamiento pared rectal. Aire en vejiga |
| 68, DM | 6m, rectorragia, diarrea, baja de peso 15 kg, masa dura y fija | 0,3 | B II a 5cm | Compromiso grasa perirrectal |
| 24 | 14m, rectorragia, dolor, baja de peso 11 kg, masa dura y fija | 22,4 | B II a 7cm margen, no franqueable | Compromiso perirrectal extenso y adenopatías |
| 42 | 24m, rectorragia, diarrea, baja de peso 20 kg, masa dura y fija | 1,2 | B III a 3cm margen | Compromiso extenso perirrectal |
| 53 | 3m, rectorragia, dolor testicular, masa fija | 12,8/7,7 | B III extenso hasta el margen anal | Engrosamiento circunferencial recto, adenopatías |
| 65 | 10m, diarrea, baja de peso 10 kg, hematoquecia, masa FII | 70,5 | B II a 12cm, no franqueable | T4 a vejiga, engrosamiento circunferencial del recto, adenopatías |
| 50 | 6m, rectorragia, baja de peso 10 kg, masa hipogastrio | 13/18 | B II a 15cm, no franqueable | T4 a vejiga, adenopatías |
| 49, tabaquismo | 14m, rectorragia, baja de peso 18 kg, masa dura, colostomía por OI | 16,9/5,2 | B II a 3cm, infranqueable | Engrosamiento extenso del recto y del ciego |
| 44, tabaquismo | 15m, diarrea, baja de peso 20 kg, dolor, tu fijo a 5cm | 18,4/2,8 | B II infranqueable, a 5cm | Masa rectal 11×9cm, con adenopatías en iliaca izquierda |
| 61, tabaquismo | 12m, dolor pélvico, baja de peso 11 kg, anemia, neumaturia, ITU, masa fija a 7cm | 4,6 | B V a 14cm circunferencial | Masa rectal extensa con compromiso vesical |
B: Bormann; DM: diabetes mellitus; FII: fosa ilíaca izquierda; FRV: fístula rectovesical; ITU: infección del tracto urinario; m: meses.
Seis pacientes recibieron neoadyuvancia con un esquema de radioquimioterapia preoperatoria de 45Gy en 5 semanas (25 sesiones), más una sobreimpresión para alcanzar 50,4Gy en la pelvis, asociado a quimioterapia con 5-FU y leucovorina en infusión continua durante la primera y la quinta semanas del tratamiento radiante. En los primeros 3 pacientes de la serie no existía este protocolo terapéutico, y en un paciente ulterior (número 6) no se sospechó el compromiso vesical avanzado (la cistoscopia fue informada como normal) y la decisión de EPT fue intraoperatoria.
Las diferentes opciones técnicas de la EPT y la morbilidad se aprecian en la tabla 2. La ileostomía urinaria se ubicó a la izquierda en 3 casos y a la derecha en los otros 7. En el primer paciente de la serie la anastomosis colorrectal ultrabaja no fue protegida. En los 5 pacientes restantes se exteriorizó el cabo proximal del íleon seccionado como ileostomía terminal más fístula mucosa del cabo distal con el fin de proteger la anastomosis baja, ubicada en lado contrario de la ileostomía urinaria (fig. 3). En el tercer paciente de la serie el vaciamiento pélvico lateral incluyó la resección de un segmento de la arteria ilíaca externa izquierda comprometida con revascularización inmediata.
Detalles técnicos y morbilidad mayor
| Caso | Tipo de reconstrucción y ostomas | Complicación/días de hospitalización |
|---|---|---|
| 1 | RAUB mecánica. Entero-enteroanastomosis. Ileostomía urinaria a derecha | Dehiscencia de sutura. Reoperación: Hartmann. 57 días |
| 2 | RAUB mecánica. Ileostomía terminal en asa derecha. Ileostomía urinaria a izquierda | Ileo, diabetes descompensada. 23 días |
| 3 | RAP. Ileo-ascendoanastomosis t-l manual. Ileostomía urinaria derecha. Colostomía terminal a izquierda | Filtración de orina. Reoperación: aseo. 33 días |
| 4 | RAP. Ileo-ascendoanastomosis terminal-funcional mecánica. Ileostomía urinaria derecha. Colostomía sigmoidea a izquierda | Satisfactoria. 32 días |
| 5 | RAP. Entero-enteroanastomosis manual. Ileostomía urinaria a derecha. Colostomía sigmoidea a izquierda | Satisfactoria. Infección periné. 18 días |
| 6 | RAUB mecánica. Ileostomía terminal+fístula mucosa a izquierda (de protección). Ileostomía urinaria a derecha | Dehiscencia parcial (CP). Manejo médico. 22 días |
| 7 | RAUB mecánica. Ileostomía terminal+fístula mucosa a izquierda (de protección). Ileostomía urinaria a derecha | Dehiscencia parcial (CP). Manejo médico. 33 días |
| 8 | Panproctocolectomía por cáncer de recto irradiado+cáncer de ciego avanzado+poliposis múltiple. Ileostomía terminal a derecha. Ileostomía urinaria a izquierda | Colección pélvica (bajo malla de Vicryl). NIH. IRA. 97 días |
| 9 | RAUB mecánica. Ileostomía terminal+fístula mucosa a izquierda (de protección). Ileostomía urinaria a derecha | Dehiscencia parcial (CP). Manejo médico. 24 días |
| 10 | RAUB mecánica. Ileostomía terminal+fístula mucosa a derecha (de protección). Ileostomía urinaria a izquierda | Dehiscencia parcial (CP). Manejo médico. 27 días |
CP: colección pélvica; IRA: insuficiencia renal aguda; NIH: neumonia intrahospitalaria; RAP: resección abdominoperineal del anorrectosigmoides; RAUB: resección anterior ultrabaja.
En un paciente se realizó una panproctocolectomía total con ileostomía terminal por doble cáncer avanzado de recto y de ciego en el contexto de una poliposis adenomatosa. En los 3 pacientes sometidos a una RAP (Bricker «clásico») la ileostomía urinaria se ubicó en el flanco derecho y la colostomía sigmoidea terminal se exteriorizó en el flanco izquierdo, restableciendo el tránsito intestinal mediante una ileo-ascendoanastomosis terminolateral mecánica en 2 casos y una entero-enteroanastomosis terminoterminal manual en el caso restante (fig. 1).
El promedio de hospitalización fue 36días (rango, 18-97). Dos pacientes debieron ser reoperados en el postoperatorio reciente (C-D IIIB), uno por dehiscencia de sutura que se convierte a una operación tipo Hartmann (número 1) y otro por filtración de orina que requiere un aseo y la inserción de un tutor descompresivo en el interior del asa desfuncionalizada (número 3). Los 5 pacientes con una anastomosis protegida presentan evidencias de dehiscencia de sutura parcial que se maneja en forma médica con los drenajes y antibióticos (C-D II), y un paciente sometido a una RAP prolonga su estadía por infección de la herida perineal (C-D II), lo que da una morbilidad global del 90%. Dos pacientes requirieron nutrición parenteral total por compromiso nutricional severo, y la depresión clínica fue manifiesta y severa en 6 casos.
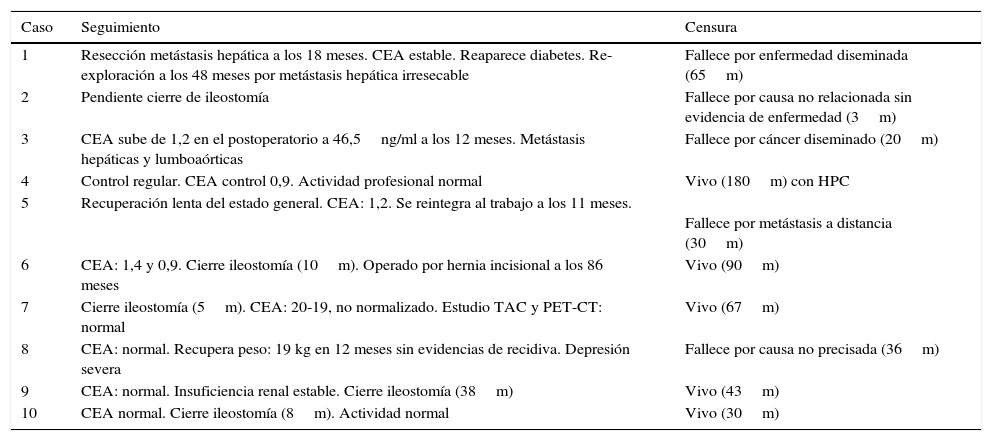
El estudio de la pieza operatoria confirmó una resección R0 en todos los pacientes, 6 pacientes tenían un tumor T4, 3 eran T3, y uno, T0 (respuesta patológica completa), con compromiso linfonodal en 3 casos. Solo uno de los 6 pacientes sometidos a neoadyuvancia presentó compromiso linfonodal. De los 6 pacientes con neoadyuvancia, la estadificación patológica muestra un paciente ypT0N0M0 (respuesta patológica completa), 2 pacientes en estadio ypIIA, 2 en estadio ypIIC y otro en estadio ypIIIB. Los pacientes sin radioquimioterapia preoperatoria correspondían a un estadio IIC en 2 casos y IIIC en los otros 2 (tabla 3). Ningún paciente recibió adyuvancia. En 4 de los 5 pacientes con una anastomosis baja protegida con una ileostomía se reconstituyó el tránsito con éxito a los 5, 8, 10 y 38meses de la intervención primaria, respectivamente, uno de los cuales es intervenido a los 86meses por una hernia incisional (el paciente número 1 con un Hartmann y el paciente número 2 con una ileostomía no fueron sometidos a una reconstitución). En el seguimiento oncológico de los pacientes con controles hematológicos y por imágenes se comprobó que no hubo deterioro de la función renal ni la necesidad de procedimientos adicionales en la vía urinaria. En el seguimiento a largo plazo ningún paciente presentó una recidiva local, y al corte del estudio hay 5 pacientes vivos entre 30 y 180meses, 3 fallecen por metástasis a distancia sin recidiva local (uno con sobrevida de 65meses), uno fallece por un accidente vascular encefálico a los 3meses y otro por causa no precisada a los 30meses (tabla 4).
Estudio histopatológico y estadificación
| Caso Bormann | Tipo histológico y TT | Linfonodos+total | TNM (7.ª ed) |
|---|---|---|---|
| 1. B III | Adenocarcinoma BD, fistulizado a próstata. T4 | 7/17 | III C |
| 2. B II | Adenocarcinoma BD, compromiso pared vesical (muscular pr). PV. T4 | 0/9 | II C |
| 3. B II | Adenocarcinoma MD con áreas indiferenciadas, CASa. PV. T3 | 10/21 | III C |
| 4. B III | Adenocarcinoma BD adherido a vejiga, próstata y vesículas seminales. T4 | 0/21 | yII Ca |
| 5. B II | Adenocarcinoma viable, infiltra próstata. PV. T4 | 1/5 | yIII Ba |
| 6. B V | Adenocarcinoma MD, mucina 5%, fistulizado a vejiga T4 | 0/30 | II C |
| 7. B II | Áreas necróticas y retracción hasta el TAPR. RPC. T0 | 0/9 | yT0N0a |
| 8. B III | Adenocarcinoma MD, T3 adherido a vejiga y vesículas seminales. Poliposis múltiple +cáncer ciego | 0/18 | yII Aa |
| 9. B II | Adenocarcinoma mucinoso, adherido a vejiga. T3 | 0/11 | yII Aa |
| 10. B III | Adenocarcinoma MD, infiltración vejiga y vesícula seminal. PN. T4 | 0/15 | yII Ca |
BD: bien diferenciado; CAS: células anillo de sello; MD: moderadamente diferenciado; PN: permeación neural; PV: permeación vascular; RPC: respuesta patológica completa; TAPR: tejido adiposo perirrectal; TT: debe decir factor T.
Seguimiento a largo plazo
| Caso | Seguimiento | Censura |
|---|---|---|
| 1 | Resección metástasis hepática a los 18 meses. CEA estable. Reaparece diabetes. Re-exploración a los 48 meses por metástasis hepática irresecable | Fallece por enfermedad diseminada (65m) |
| 2 | Pendiente cierre de ileostomía | Fallece por causa no relacionada sin evidencia de enfermedad (3m) |
| 3 | CEA sube de 1,2 en el postoperatorio a 46,5ng/ml a los 12 meses. Metástasis hepáticas y lumboaórticas | Fallece por cáncer diseminado (20m) |
| 4 | Control regular. CEA control 0,9. Actividad profesional normal | Vivo (180m) con HPC |
| 5 | Recuperación lenta del estado general. CEA: 1,2. Se reintegra al trabajo a los 11 meses. | Fallece por metástasis a distancia (30m) |
| 6 | CEA: 1,4 y 0,9. Cierre ileostomía (10m). Operado por hernia incisional a los 86 meses | Vivo (90m) |
| 7 | Cierre ileostomía (5m). CEA: 20-19, no normalizado. Estudio TAC y PET-CT: normal | Vivo (67m) |
| 8 | CEA: normal. Recupera peso: 19 kg en 12 meses sin evidencias de recidiva. Depresión severa | Fallece por causa no precisada (36m) |
| 9 | CEA: normal. Insuficiencia renal estable. Cierre ileostomía (38m) | Vivo (43m) |
| 10 | CEA normal. Cierre ileostomía (8m). Actividad normal | Vivo (30m) |
HPC: hernia paracolostómica; m: meses.
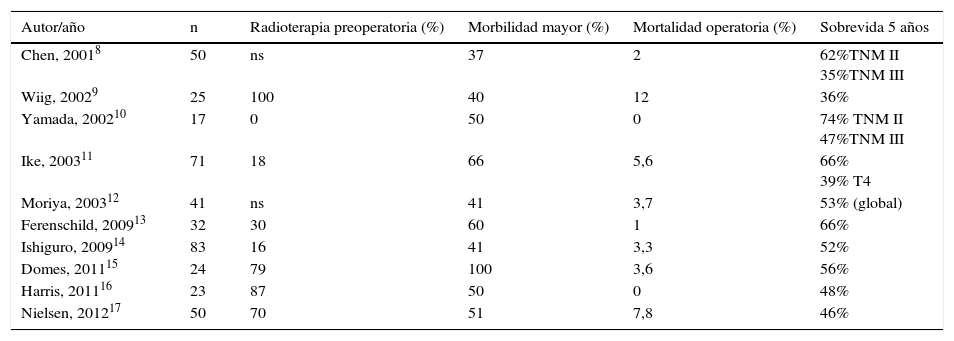
Lograr una resección completa del tumor con un margen patológico claro es un objetivo claro en el manejo de los pacientes con un tumor primario de recto localmente avanzado. En los tumores que comprometen órganos adyacentes (T4b en la 7.ª edición de la clasificación TNM, 2010), alcanzar una resección completa (R0) significa ampliar los límites de la resección y escalar a una intervención de alta complejidad. Sin duda, la EPT es una intervención de envergadura mayor que provoca en los pacientes un gran impacto tanto en lo físico como en lo psicológico. Sin embargo, puede ser la única posibilidad de curación en un porcentaje bajo de pacientes portadores de un tumor primario de recto localmente avanzado. Los resultados obtenidos en esta pequeña serie son similares a los reportados en la literatura en términos de morbilidad y sobrevida a largo plazo. En la literatura especializada las series publicadas son muy heterogéneas y no hay estudios prospectivos. Como la mayoría son series pequeñas, se analizan los pacientes sometidos a una EPT por un tumor primario en conjunto con los casos de EPT por una recidiva local, las series tienen porcentajes muy variables de neoadyuvancia y se incluyen otras causas de tumores pélvicos que tienen un comportamiento biológico distinto, lo cual hace difícil establecer comparaciones y sacar conclusiones2. Lo que está claro en la actualidad es que la EPT es un procedimiento complejo asociado a una elevada morbilidad, con una mortalidad operatoria controlada (tabla 5)2,8-17. El enfrentamiento de estos tumores con un equipo multidisciplinario y la discusión en el seno de un comité oncológico son requisitos básicos para tratar estos pacientes que serán sometidos a un procedimiento de alta complejidad.
Series EPT por cáncer de recto primario (2001-2012)
| Autor/año | n | Radioterapia preoperatoria (%) | Morbilidad mayor (%) | Mortalidad operatoria (%) | Sobrevida 5 años |
|---|---|---|---|---|---|
| Chen, 20018 | 50 | ns | 37 | 2 | 62%TNM II 35%TNM III |
| Wiig, 20029 | 25 | 100 | 40 | 12 | 36% |
| Yamada, 200210 | 17 | 0 | 50 | 0 | 74% TNM II 47%TNM III |
| Ike, 200311 | 71 | 18 | 66 | 5,6 | 66% 39% T4 |
| Moriya, 200312 | 41 | ns | 41 | 3,7 | 53% (global) |
| Ferenschild, 200913 | 32 | 30 | 60 | 1 | 66% |
| Ishiguro, 200914 | 83 | 16 | 41 | 3,3 | 52% |
| Domes, 201115 | 24 | 79 | 100 | 3,6 | 56% |
| Harris, 201116 | 23 | 87 | 50 | 0 | 48% |
| Nielsen, 201217 | 50 | 70 | 51 | 7,8 | 46% |
ns: no señalado.
El uso de radioquimioterapia neoadyuvante con el fin lograr una resección R0 y mejorar el control locorregional está bien establecido en la literatura especializada respecto de los tumores localmente avanzados2,9,18-20. Este concepto es rebatido por la escuela japonesa, que privilegia las resecciones ampliadas sin neoadyuvancia, procedimiento que incluye una linfadenectomía pélvica lateral, con resultados similares en cuanto a recidiva local y sobrevida, pero con un aumento significativo de la morbilidad mayor, lo que se ha corregido en parte con la preservación de los plexos autónomos21. En nuestra experiencia, la mayoría de los pacientes con un tumor primario localmente avanzado fueron sometidos a radioquimioterapia preoperatoria, agregando la disección pélvica lateral en los pacientes que tienen compromiso linfonodal en la exploración quirúrgica, lo que se efectuó en 2 casos en esta serie.
La morbilidad de la EPT fluctúa entre el 37 y el 100% (tabla 5), y depende de los criterios empleados para definir las complicaciones. Si incluimos la depresión, en nuestra serie la morbilidad alcanza el 100%. Respecto de la clasificación de Clavien-Dindo, 2 pacientes fueron reoperados y, por tanto, están en la categoría C-D IIIB. Un buen indicador de la morbilidad asociada a esta intervención es el número de días de la hospitalización primaria, cifra que en esta serie es de 36días como promedio (rango, 18-97), similar a lo reportado en la literatura2,8-17. Un paciente sometido a una panproctocolectomía total por un cáncer doble en el contexto de una poliposis prolongó excesivamente la estadía hospitalaria con varios reingresos, debido a una colección pélvica de difícil manejo, favorecida por la instalación de una malla en el estrecho superior con el fin de evitar la obstrucción intestinal. Este es un problema no resuelto en el manejo de estos pacientes, porque las alternativas son la confección de un colgajo muscular para cubrir la zona, lo que prolonga y complejiza el procedimiento2,4. Se estima que el tiempo de hospitalización se triplica y la mortalidad se quintuplica en los pacientes con un IMC menor de 18,5, comparado con los de peso normal o con sobrepeso22, deterioro nutricional presente en la mayoría de nuestros pacientes (tabla 1). Considerando la magnitud de los requerimientos energéticos y el íleo postoperatorio frecuente luego de una EPT, es conveniente que los pacientes reciban nutrición parenteral total los primeros días de la intervención, seguida de una nutrición mixta hasta que logren tolerar una alimentación enteral completa.
En esta serie no hubo mortalidad operatoria, cifra que en las series recientes fluctúa entre el 0 y el 5% (tabla 5), lo que se debe a una mejor selección de los pacientes y a la experiencia adquirida en centros especializados. Algunas series diferencian la mortalidad antes de 30días de la mortalidad intrahospitalaria11,14-17,23, lo que se explica por la mejora continua en el manejo del paciente crítico, pero ambas cifras son sumatorias para obtener un reflejo real de la mortalidad asociada con esta intervención.
La resección en block de un cáncer colorrectal que compromete un órgano adyacente es un paradigma que no ha sido desafiado en la práctica quirúrgica actual. La resección R0 previene la diseminación tumoral, mientras que la presencia de bordes quirúrgicos comprometidos se asocia con una menor sobrevida24. En la revisión de la pieza quirúrgica, alrededor del 40% de los casos revelan un compromiso de vecindad de tipo inflamatorio, cifra que podría ser mayor por el efecto de la radioquimioterapia neoadyuvante, como se muestra en esta serie y en otras11,14. Esto demuestra la dificultad en alcanzar un diagnóstico preciso sobre el grado de invasión tumoral aun con las imágenes más sofisticadas. Por este motivo, en los últimos años se han planteado, en pacientes sin compromiso vesical, técnicas más conservadoras, como la resección de la próstata y de las vesículas seminales sin cistectomía25.
Considerando la envergadura de la cirugía radical, la habitual aplicación de radiación preoperatoria y lo avanzado de los tumores, creemos que la EPT supraelevador con una anastomosis ultrabaja requiere de una ostomía de protección en forma rutinaria. Dado que la ileostomía urinaria se confecciona con un segmento del íleon terminal excluido del tránsito intestinal, lo más seguro es aprovechar esta sección como ileostomía de protección, dejando ambos cabos juntos para facilitar el cierre en el futuro mediato (fig. 3). Aunque la dehiscencia es frecuente aun en estos casos protegidos, el manejo médico es adecuado en la mayoría de los pacientes, los que finalmente logran una reconstitución intestinal y evitan una colostomía definitiva.
En esta serie pequeña no hemos tenido recidiva local, cifra que en la literatura especializada fluctúa entre el 4,8 y el 61%2,9-17. La supervivencia a 5años de los pacientes sometidos a una EPT por un adenocarcinoma primario de recto promedia el 50% (rango, 31-77) (tabla 5), similar a nuestra experiencia. Entre los factores pronósticos se señalan como relevantes los márgenes quirúrgicos, la permeación vascular y el compromiso linfonodal11-15. En el estudio de Harris et al.16 hubo una diferencia significativa en la sobrevida a 5años en los pacientes T4 con y sin ganglios metastásicos, lo que realza el valor pronóstico del compromiso ganglionar en este tipo de tumores16.
En conclusión, la EPT puede ser una alternativa terapéutica radical para el 3 al 5% de los tumores primarios del recto localmente avanzados, intervención que se asocia a una elevada morbilidad y una larga estadía hospitalaria, una mortalidad actualmente controlada (promedio 2,2%) y una sobrevida a largo plazo de alrededor del 50%, lo que justifica su empleo en pacientes seleccionados con un riesgo quirúrgico razonable. Como una forma de optimizar una resección R0 y mejorar el control locorregional, es razonable un manejo multidisciplinario que se inicia con radioquimioterapia neoadyuvante para estos pacientes con tumores localmente avanzados. En el 60% de nuestros casos fue posible realizar una EPT supraelevador, evitando una colostomía definitiva y la morbilidad de la herida perineal. La ileostomía urinaria con la técnica descrita ha superado la prueba del tiempo y no muestra complicaciones alejadas debido a estenosis o mal funcionamiento. La EPT provoca en el paciente un impacto muy severo en lo físico, en lo psicológico y en la esfera urogenital que puede progresar a una depresión que es necesario manejar idealmente en forma profiláctica. Por otra parte, los estudios de calidad de vida confirman que los pacientes sometidos a esta intervención obtienen puntajes similares a la población general cuando esta evaluación se realiza en el seguimiento a mediano o a largo plazo26.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.