Describir los resultados de la embolización portal hepática (EPH) preoperatoria con lipiodol y gelatina absorbible para generar hipertrofia hepática y permitir la hepatectomía derecha en pacientes con tumores hepáticos e hígado remanente futuro insuficiente.
Materiales y métodosEntre marzo de 2002 y abril de 2014, en 18 pacientes candidatos a hepatectomía derecha se realizó EPH con lipiodol y esponja de gelatina absorbible mezclada con contraste yodado. La estimación de los volúmenes hepáticos preembolización se hizo por tomografía computada con contraste endovenoso. Los pacientes fueron abordados mediante punción percutánea bajo guía ecográfica, seguida de angiografía. El control de la hipertrofia con estimación del volumen se realizó a la cuarta semana posembolización y el seguimiento se llevó a cabo ambulatoriamente o mediante historia clínica.
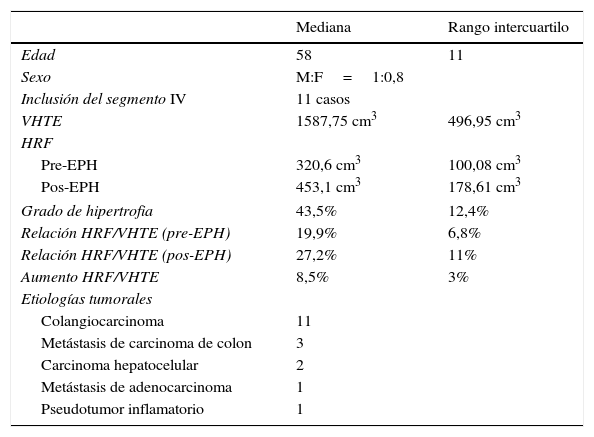
ResultadosLa mediana de edad fue de 58 años (relación hombre/mujer de 1:0,8) y el volumen hepático total estimado (mediana) de 1587,75 cm3. La estimación previa del volumen hepático y su relación con la porción futura remanente pre-EPH fue de 19,9%, mientras que el promedio absoluto de crecimiento del parénquima hepático remanente futuro pos-EPH se encontró entre los 306,2 y 475,2 cm3, con un 43,5% de aumento. La mediana de incremento de la relación volumen hepático total y la porción remanente pos-EPH fue de 8,5% (p<0,001). Como complicaciones, se registró un hematoma y una necrosis aséptica.
ConclusiónLa EPH con lipiodol y esponja de gelatina absorbible es un procedimiento seguro y efectivo, que surge como alternativa a otros materiales de embolización.
To evaluate outcomes of preoperative hepatic portal vein embolisation with lipiodol and absorbable gelatin in order to generate liver hypertrophy and enable right hepatectomy in selected patients with liver tumours and future insufficient residual liver.
Materials and methodsPortal vein embolisation (PVE) with lipiodol and absorbable gelatin sponge mixed with iodine based contrast was performed in 18 patient candidates for right hepatectomy between March 2002 and April 2014. The pre-embolisation liver volume evaluations were performed by computed tomography with intravenous contrast. Patients underwent an ultrasound-guided percutaneous puncture, followed by angiography. The controls of hypertrophy and volume estimation were performed in the 4th week after portal embolisation. The patients were followed-up on an outpatient basis or by using their medical records.
ResultsThe median age was 58 years, with a 1:0.8 male: female ratio. The total estimated liver volume, excluding the tumour, of all patients evaluated prior to surgery was 1587.75 cm3 (median). The previous estimated liver volume and its relation to the future remaining portion before PVE was 19.9%. The absolute median growth of future residual liver parenchyma post-PVE was 306.2 to 475.2 cm3, being an increase of 43.5%, and the mean growth of liver volume and remaining portion ratio post-PVE was 8.5% (P<.001). Complications were one haematoma and one aseptic necrosis.
ConclusionThe selection of patients is of paramount importance, and PVE with lipiodol and absorbable gelatin in our environment is a safe and effective procedure.
En los últimos decenios, los tumores malignos primarios hepáticos han aumentado su incidencia y el hígado sigue siendo un sitio común de metástasis de otros tumores primarios1. Su resección quirúrgica es la primera elección terapéutica curativa2. Los avances en las técnicas de cirugía hepatobiliar y la capacidad regenerativa del hígado permiten una resección de la mayor parte del órgano. No obstante, las hepatectomías de gran volumen o aquellas en pacientes con función hepática insuficiente incrementan la morbimortalidad perioperatoria2,3.
Una forma de mejorar los resultados perioperatorios y la supervivencia ha sido hipertrofiar preventivamente una porción sin metástasis del hígado y aumentar, así, la función del futuro hígado remanente. Esto se logra mediante la ligadura quirúrgica de las ramas de la vena porta o a través de técnicas de embolización portal hepática (EPH)4–9.
Con estos procedimientos los pacientes con insuficiente parénquima remanente normal inicialmente irresecable resultan beneficiados, en particular con la embolización percutánea guiada por imágenes, en la que se ocluyen los vasos portales segmentarios de manera preoperatoria. Esta evita las complicaciones posquirúrgicas relacionadas con la ligadura quirúrgica, a la vez que aumenta el número de candidatos a la resección curativa. Asimismo, debe considerarse el tamaño y complejidad de la resección hepática y las características del paciente (edad y comorbilidades), ya que pueden afectar tanto a la hipertrofia como al resultado perioperatorio10,11.
En primer lugar, se debe evaluar la enfermedad hepática subyacente para determinar el volumen necesario del hígado remanente futuro (HRF). Los pacientes con un hígado sano no requieren una masa de HRF tan grande como aquellos con cirrosis11. Además, pueden sobrevivir a la resección de hasta el 90% del hígado, mientras que en los cirróticos es poco probable la supervivencia a una resección mayor del 60% del parénquima funcional.
Si bien el volumen mínimo absoluto del hígado necesario para mantener una función hepática aceptable después de la resección no está claramente establecido, varios autores consideran que, en pacientes con un hígado subyacente normal, probablemente sea suficiente un volumen hepático del 25%, mientras que en pacientes con un hígado subyacente enfermo el mínimo sea del 40%4,7,10,12. El análisis de la volumetría hepática por tomografía computada (TC) y las características clínicas del paciente determinan la necesidad y el posible beneficio de la embolización portal hepática, según el HRF.
En la actualidad se han publicado varias series de EPH con diferentes agentes embolizantes. Sin embargo, no hay datos claros que inclinen la balanza entre el etanol absoluto, el cianoacrilato, el pegamento de fibrina, el alcohol de polivinilo (PVA) y la embolización de pequeñas partículas con o sin coils, por lo que las preferencias determinan la elección del material embolizante.
El objetivo de este trabajo es presentar nuestra experiencia en la embolización portal hepática, utilizando lipiodol combinado con gelatina absorbible, en tanto constituyen materiales accesibles por su disponibilidad y costo, de uso ampliamente difundido para la quimioembolización arterial hepática, aunque poco difundidos para la técnica de embolización portal hepática.
Materiales y métodosEn el período comprendido entre marzo del 2002 y abril del 2014, se realizó una EPH a 27 candidatos a hepatectomía derecha sin quimioterapia previa, con hígado normal y HRF menor del 25% o hígado cirrótico y HRF menor del 40%. Todos los pacientes firmaron el consentimiento informado y el Comité Central de Ética en Investigación de nuestra institución aprobó el procedimiento y la publicación resguardando la confidencialidad de los pacientes.
De los 27 casos solo 18 fueron embolizados con lipiodol y gelatina absorbible como únicos agentes embolizantes. Se incluyeron únicamente pacientes con tumores primarios o secundarios con contraindicación para cirugía hepática resectiva por volumen hepático normal remanente insuficiente en relación con el volumen hepático total estimado por TC.
Los pacientes fueron considerados como casos no quirúrgicos cuando poseían un volumen hepático remanente futuro menor del 25% si eran no cirróticos y menor del 40% si lo eran. Antes de la embolización, 8 pacientes con colestasis obstructiva tuvieron drenajes percutáneos de la vía biliar. No se incluyeron pacientes con enfermedad intrahepática diseminada y/o extrahepática que no pudieran beneficiarse con la embolización, o aquellos con coagulopatía incorregible, entre otras enfermedades (tabla 1). También se excluyeron los pacientes con seguimiento incompleto o los embolizados con otros materiales, además del lipiodol y la gelatina absorbible.
Criterios de exclusión
| • Pacientes con enfermedad intrahepática diseminada |
| • Concentración de protrombina<60% |
| • Bilirrubina total>3mg/dL |
| • Plaquetas ≤ 50.000 cel/ml |
| • Clasificación Child-Pugh grados B y C |
| • Hipertensión portal/invasión tumoral portal ipsilateral |
| • Insuficiencia renal |
| • Infección sistémica/sepsis |
Todos los casos fueron seguidos en su evolución clínica (no quirúrgicos, hepatectomía, trasplante hepático u óbito) mediante la consulta ambulatoria e historia clínica.
Volumetría tomográficaLa estimación de los volúmenes hepáticos fue realizada por TC con contraste endovenoso en las fases arterial, portal y venosa. Las adquisiciones se tomaron con un tomógrafo helicoidal con detector simple (Siemens Somatom AR, Alemania) y multidetector de 16 filas (Toshiba Aquilion 16, Japón). A través de la adquisición volumétrica del parénquima hepático en cortes de 5 o 10mm, se obtuvieron los volúmenes basales estimados preembolización y los de control de hipertrofia a la cuarta semana posembolización.
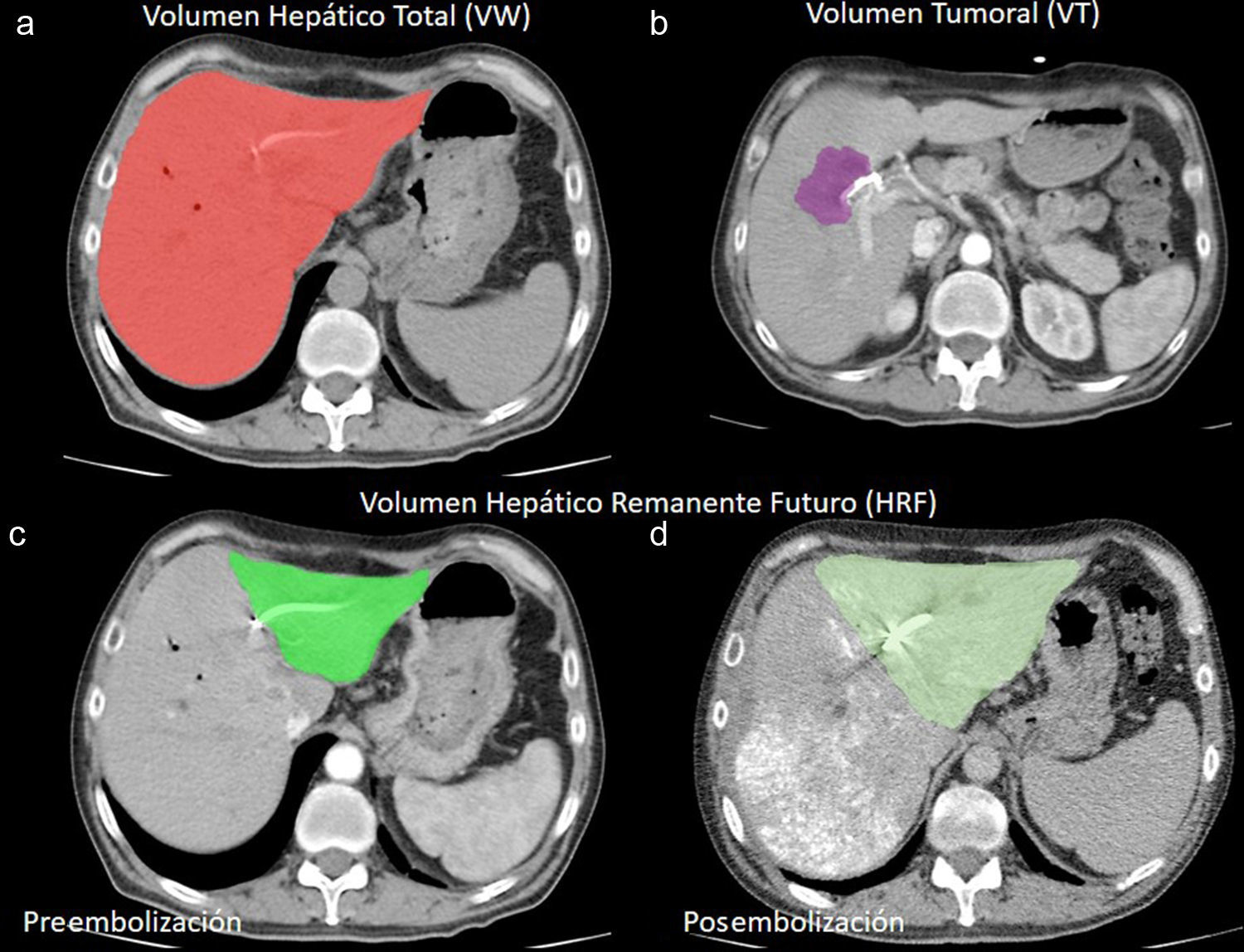
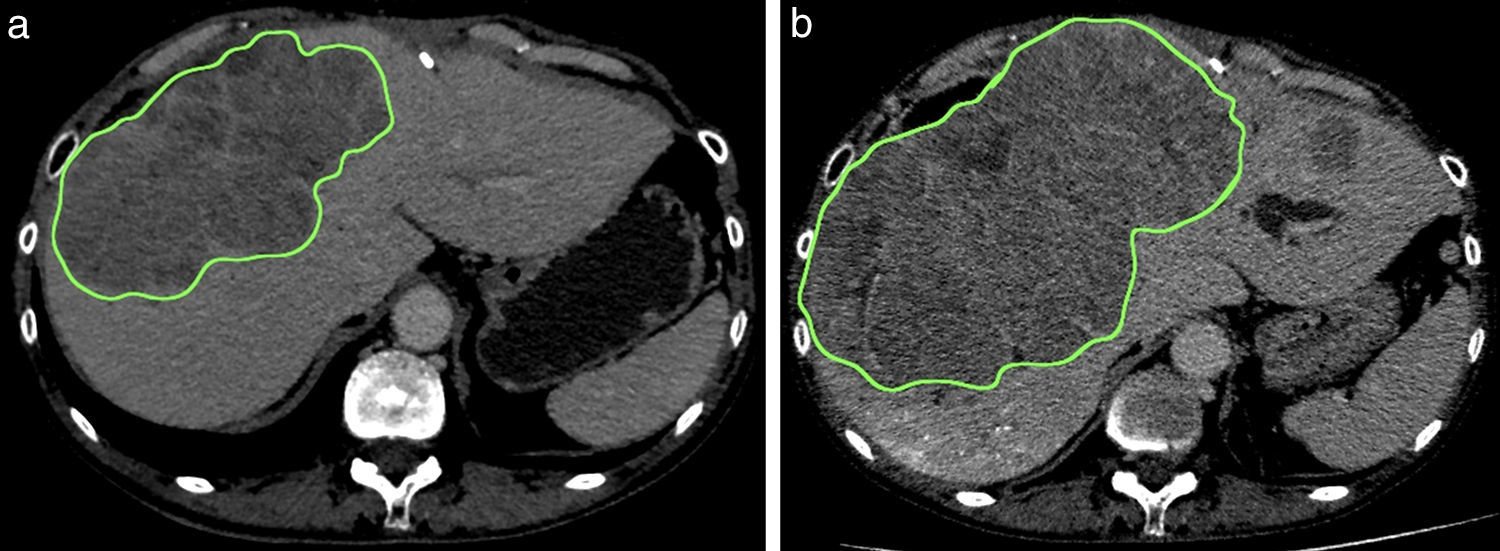
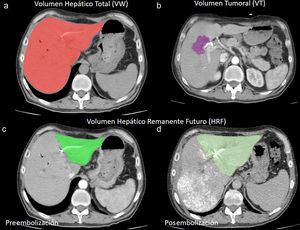
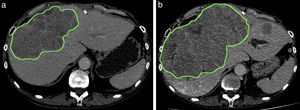
Las volumetrías hepáticas se calcularon de acuerdo con el método de Heymsfield, cuando las adquisiciones fueron realizadas en el tomógrafo helicoidal simple, o mediante un software (OsiriX Imaging Software, Pixmeo SARL), cuando se llevaron a cabo con el tomógrafo multidetector13. Para la volumetría se delimitaron las áreas de interés de los segmentos o lóbulos requeridos en forma manual y se registraron en cm2 (fig. 1).
(a) Medición del volumen hepático total estimado, registrando el área de la región de interés (ROI) en cm2. (b) Se toma el volumen hepático incluyendo la masa tumoral y luego se sustrae el volumen tumoral medido en forma separada. Se observa el volumen hepático remanente futuro (c) pre y (d) posembolización portal hepática.
El volumen del HRF se calculó definiendo los bordes en forma manual, de acuerdo con los requisitos del cirujano (inclusión o exclusión del segmento IV), y posteriormente se obtuvo el índice del HRF en relación con el volumen hepático total estimado (VHTE). Esto es, HRF/VHTE.
La selección de pacientes para el tratamiento quirúrgico se determinó en base al análisis de la volumetría tomográfica, con nuevas mediciones de HRF (determinadas antes de la cirugía).
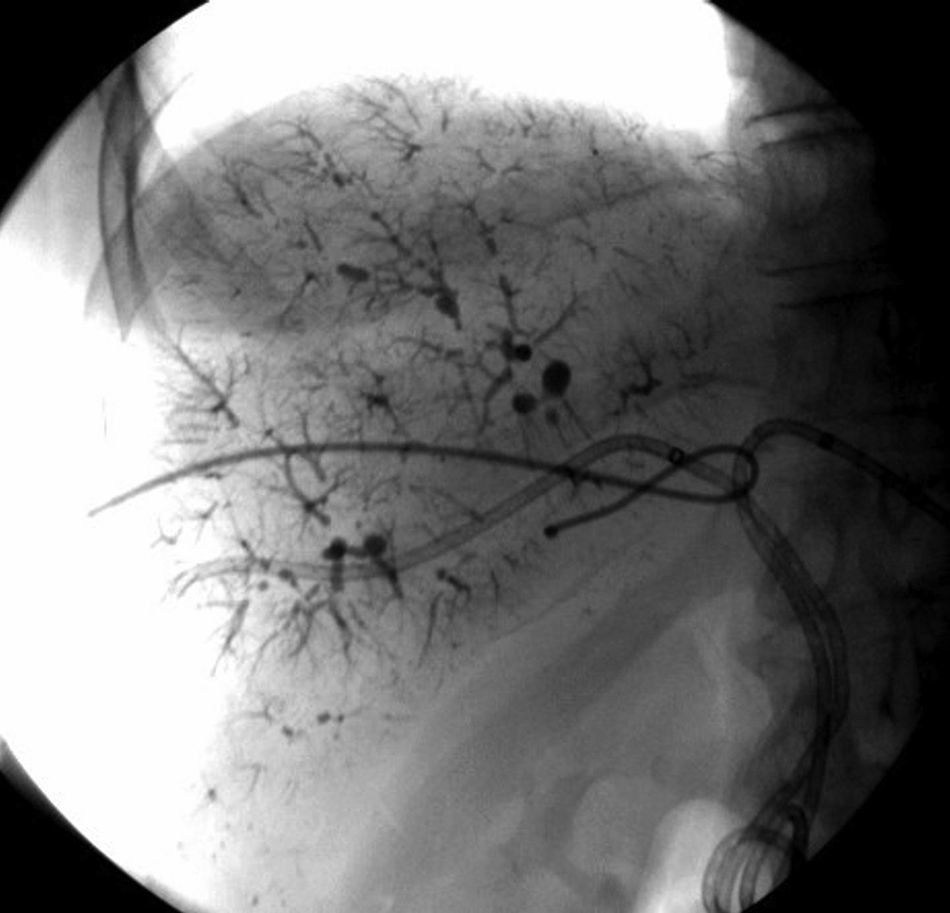
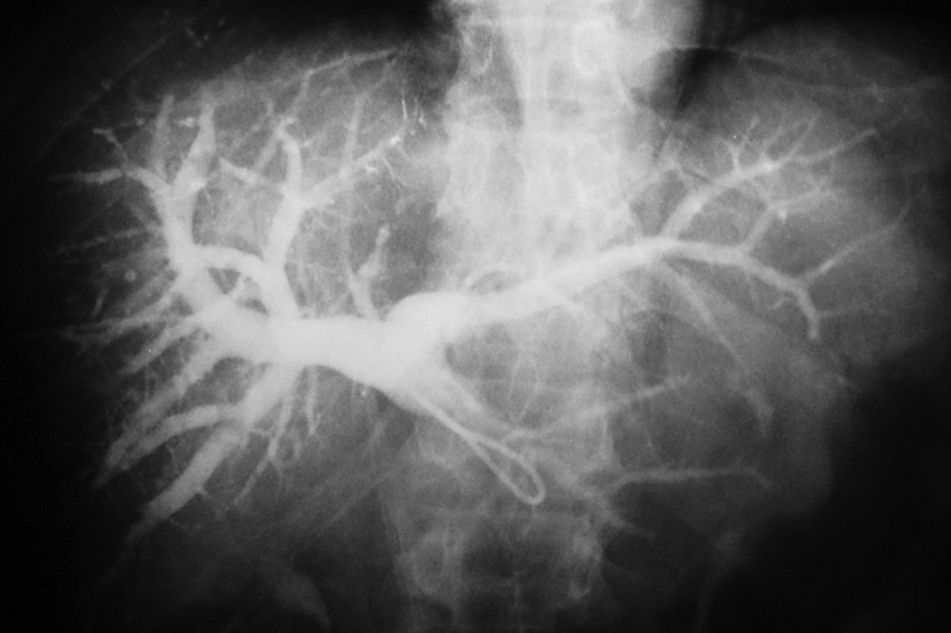
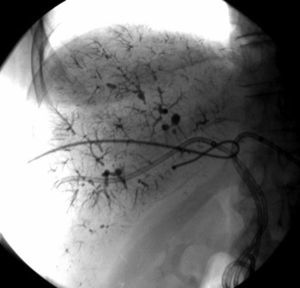
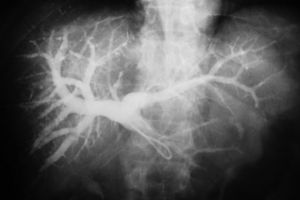
Técnica de embolización portal hepáticaPrevia antisepsia y anestesia local, se llevó a cabo una punción percutánea transparietal con aguja fina bajo guía ecográfica de la vena porta derecha o izquierda. Bajo control radioscópico, se cateterizó la rama portal correspondiente con un introductor valvulado de 5 Fr y, a través de este, se introdujo un catéter Simmons 5 Fr o Cobra 5 Fr, según los segmentos a embolizar.
Luego de la portografía retrógrada, se cateterizaron las diferentes ramas portales y se procedió a la embolización de los segmentos requeridos para la hipertrofia de los segmentos remanentes. Se utilizó lipiodol (lipiodol ultrafluido de Laboratorios Guerbet, París, Francia) más una esponja de gelatina absorbible (Spongostan Standard - Ethicon) mezclada con contraste yodado no iónico, como materiales embolizantes principales.
Análisis estadísticoLas variables cuantitativas se describieron con mediana y rango intercuartilo, mientras que las categóricas se determinaron con proporciones y valores absolutos.
Para la comparación pareada de los volúmenes de HRF pre y posembolización se utilizó la prueba de Wilcoxon Signed Rank. Además, se evaluó la relación entre sexos y la inclusión del segmento IV en la embolización con la hipertrofia mediante la prueba U de Mann-Whitney. Se consideró un p menor de 0,05 como estadísticamente significativo.
El análisis estadístico de los datos obtenidos se llevó a cabo con el software SPSS Statistical Package 17.0 (SPSS Inc., EE.UU.).
ResultadosLas características basales de los pacientes, el volumen hepático estimado (excluyendo el tumor), las etiologías tumorales y los volúmenes se mencionan en la tabla 2. La mayoría de los procedimientos fueron realizados en forma ambulatoria, a excepción de 2 pacientes que se encontraban internados para el control posdrenaje de la vía biliar (fig. 2). Diecisiete pacientes fueron embolizados desde la vena porta derecha y un paciente desde la vena porta izquierda. Once (61%) requirieron la inclusión del segmento IV en la embolización, de acuerdo con el plan de hepatectomía.
Demografía y volúmenes hepáticos
| Mediana | Rango intercuartilo | |
|---|---|---|
| Edad | 58 | 11 |
| Sexo | M:F=1:0,8 | |
| Inclusión del segmento IV | 11 casos | |
| VHTE | 1587,75 cm3 | 496,95 cm3 |
| HRF | ||
| Pre-EPH | 320,6 cm3 | 100,08 cm3 |
| Pos-EPH | 453,1 cm3 | 178,61 cm3 |
| Grado de hipertrofia | 43,5% | 12,4% |
| Relación HRF/VHTE (pre-EPH) | 19,9% | 6,8% |
| Relación HRF/VHTE (pos-EPH) | 27,2% | 11% |
| Aumento HRF/VHTE | 8,5% | 3% |
| Etiologías tumorales | ||
| Colangiocarcinoma | 11 | |
| Metástasis de carcinoma de colon | 3 | |
| Carcinoma hepatocelular | 2 | |
| Metástasis de adenocarcinoma | 1 | |
| Pseudotumor inflamatorio | 1 | |
VHTE: volumen hepático; HRF: hígado remanente futuro; EPH: embolización portal hepática.
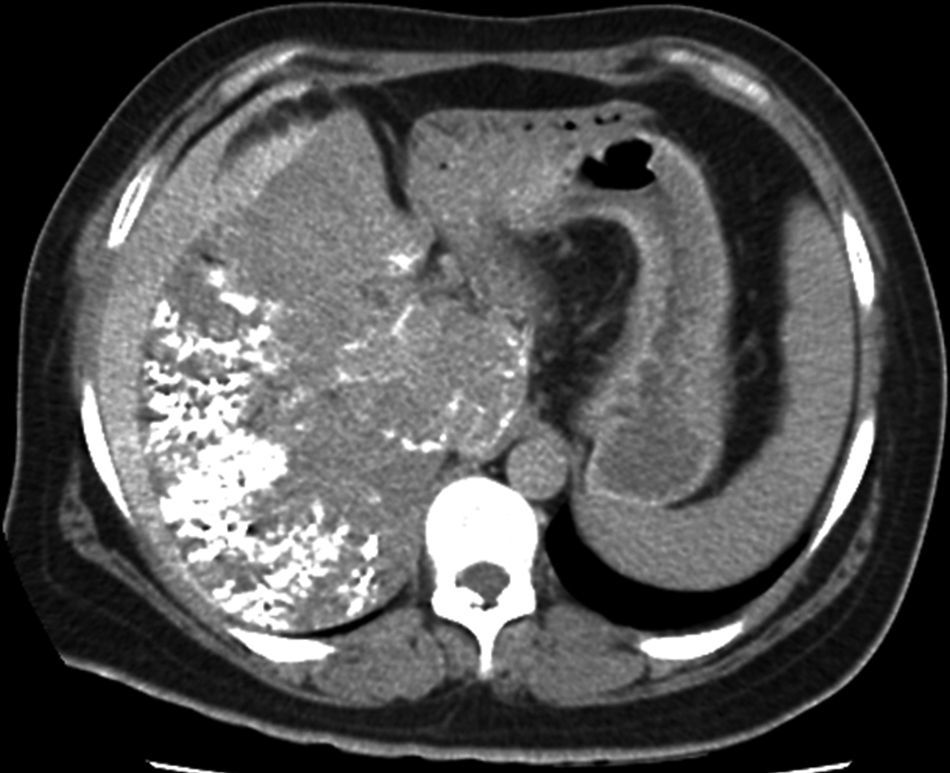
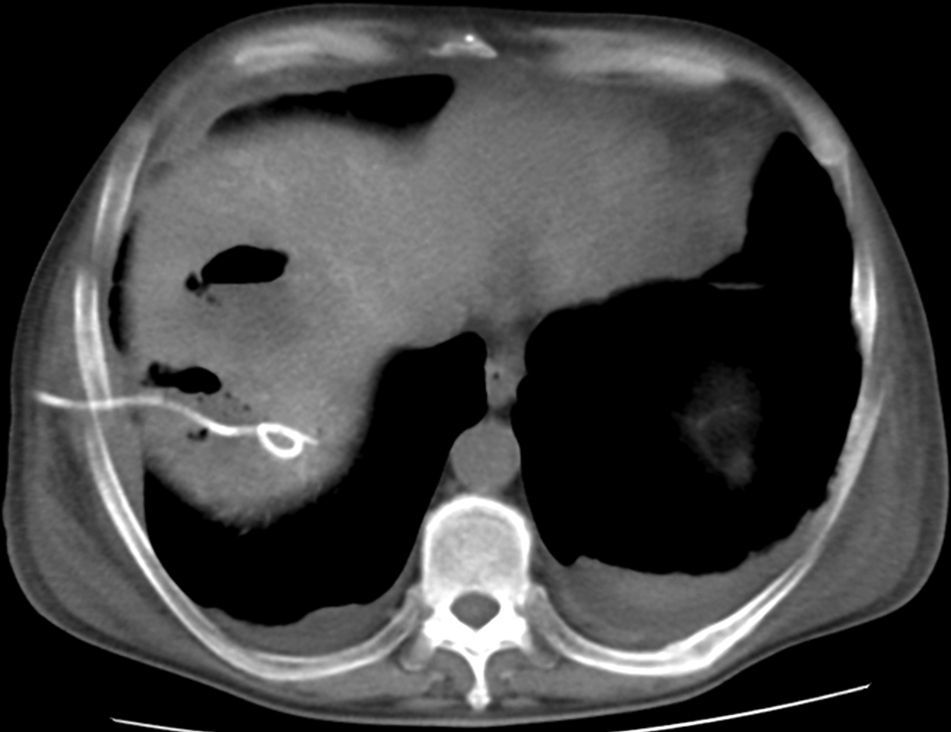
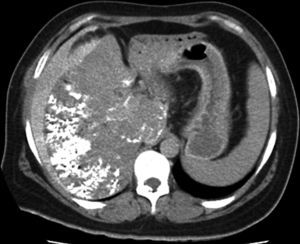
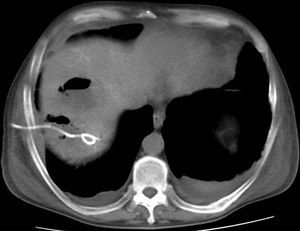
Cinco pacientes refirieron dolor en el sitio de la punción, por lo que fueron tratados en forma sintomática. En relación con el procedimiento, se puede mencionar como complicación inmediata, en un solo paciente, un hematoma subcapsular hepático autolimitado, que requirió internación por 72 horas (fig. 3); mientras que como complicación tardía (posterior a las 4 semanas) se registró una necrosis aséptica hepática en un paciente con un tumor pseudoinflamatorio. Esta fue tratada mediante drenaje percutáneo bajo guía tomográfica (fig. 4).
Luego del procedimiento, los pacientes ambulatorios estuvieron en observación durante 4 horas antes del alta.
La estimación previa del volumen hepático y su relación con la porción futura remanente antes de la EPH fue del 19,9%. Por su parte, las medianas de volumen de HRF pre y posembolización fueron de 306,2 y 475,2 cm3 (respectivamente), representando un incremento del 43,5% (p<0,001) del mismo y un aumento de la relación volumen hepático y porción remanente posterior al EPH del 8,5%.
Quince pacientes alcanzaron un HRF suficiente para hepatectomía (83%), mientras que 3 (17%) no fueron intervenidos debido a un estado nutricional deficitario en el caso del tumor pseudoinflamatorio con necrosis aséptica y a una hipertrofia insuficiente en 2 casos de cirrosis con hepatocarcinoma celular (HCC). Estos últimos dos presentaron, además, sobrecrecimiento tumoral con diferentes evoluciones. En el primer caso, por la hipertrofia hepática insuficiente, se le hicieron 2 quimioembolizaciones transarteriales hepáticas más el tratamiento con sorafenib (fig. 5). A los 9 meses, se le practicó el trasplante hepático con un período de supervivencia de 22 meses. El explante hepático nativo evidenció necrosis total de los tumores tratados. En cuanto al segundo caso, la paciente tuvo una hemocromatosis con una relación HRF/VHTE posembolización portal hepática del 37% (insuficiente para hepatectomía), que se asoció a un sobrecrecimiento tumoral del 30,9%. Falleció a los 2 meses del procedimiento (fig. 6).
Embolización portal hepática con lipiodol más esponja de gelatina absorbible y alcohol de polivinilo en un paciente masculino con cirrosis hepática y hepatocarcinoma celular. Mostró una hipertrofia insuficiente para la hepatectomía ampliada. El hígado remanente futuro pos-EPH fue de 859,70 cm3, mientras que la relación HRF/volumen total estimado pos-EPH fue de 36,7%. Grado de hipertrofia: 3,5%.
Sobrecrecimiento tumoral pos-EPH en una paciente con cirrosis secundaria a hemocromatosis y hepatocarcinoma celular asociado, que fue sometida a una embolización portal hepática preoperatoria. Falleció a los 2 meses por el avance de la enfermedad. (a) El volumen tumoral inicial era de 414,99 cm3 y (b) el posembolización fue de 543,24 cm3.
En nuestro trabajo, conseguimos una mediana de hipertrofia del 43,5% del parénquima hepático remanente en el control a las 4 semanas, en su mayoría en pacientes sin antecedentes de hepatopatía crónica.
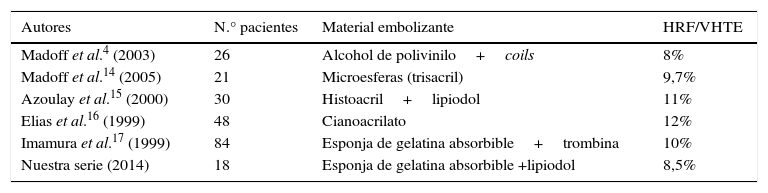
En todos los casos se utilizó la mezcla de lipiodol con gelatina absorbible y en 15 pacientes se alcanzó un volumen suficiente para obtener el remanente hepático mínimo necesario para la cirugía resectiva. Cabe destacar que el aumento de la relación entre el volumen hepático estimado y el hígado remanente futuro fue semejante al obtenido por Madoff et al.3, quienes habían hecho la embolización con partículas de PVA y coils (tabla 3)4,14–18.
Resultados comparativos con otros estudios
| Autores | N.° pacientes | Material embolizante | HRF/VHTE |
|---|---|---|---|
| Madoff et al.4 (2003) | 26 | Alcohol de polivinilo+coils | 8% |
| Madoff et al.14 (2005) | 21 | Microesferas (trisacril) | 9,7% |
| Azoulay et al.15 (2000) | 30 | Histoacril+lipiodol | 11% |
| Elias et al.16 (1999) | 48 | Cianoacrilato | 12% |
| Imamura et al.17 (1999) | 84 | Esponja de gelatina absorbible+trombina | 10% |
| Nuestra serie (2014) | 18 | Esponja de gelatina absorbible +lipiodol | 8,5% |
HRF: hígado remanente futuro;VHTE: volumen hepático.
El material utilizado para embolizar la vena porta es un tema de debate. Entre estos, se destaca la embolización completa con cianoacrilato, un material de embolización permanente y definitiva que garantiza una hipertrofia satisfactoria6. Sin embargo, su administración presenta desventajas debido a su propiedad adherente. Al respecto, otros autores sugieren agentes de fácil administración, como el PVA, que puede usarse en combinación con coils, generando una oclusión definitiva14. Si bien no está demostrado que la embolización permanente y definitiva sea necesaria para lograr la hipertrofia, es levemente mayor el volumen hipertrofiado en un lapso menor de tiempo6,19.
Desde hace más de 20 años, existen publicaciones sobre estudios experimentales de embolización de la vena porta con lipiodol mezclado con fibrina, trombina o cianoacrilato en animales, series con gelatina absorbible y un solo caso reportado de embolización portal con lipiodol más gelatina absorbible20,21. La elección de esta última combinación como material de embolización se debe a su fácil preparación, buen control en su administración (comparado con otros materiales), su disponibilidad y costo accesible.
La ventaja de la embolización con lipiodol se presenta en la visualización de las ramas embolizadas durante los controles tomográficos tempranos, además de que el material es limpiado de los vasos portales en 2-3 días y de los sinusoides en una semana. Luego de 15 días de la inyección selectiva, el lipiodol no se detecta en las vénulas portales y solo unas pocas gotas pueden permanecer en los vasos sinusoides22. Por otro lado, la gelatina absorbible es menos eficiente por las recanalizaciones después de 3-4 semanas debido a su propiedad de embolización transitoria. De todos modos, esta podría ser suficiente si se considera que la regeneración hepática presenta picos dentro de las primeras 2 semanas pos-EPH y los estudios realizados en cerdos han demostrado que el pico de regeneración ocurre dentro de los 7 días después de la EPH con replicación del 14% de los hepatocitos23.
En el presente, no se ha definido con exactitud el volumen mínimo necesario para la función hepática luego de la resección. Sin embargo, se ha estandarizado un 25% para pacientes con hígado normal y un 40% para aquellos con hígado enfermo3,8,24–26. Algunos autores han reportado en casos con tumor de Klatzkin una hipertrofia del 33 al 44% en el área no embolizada a las 2 semanas, mientras que otros mencionan una hipertrofia media del 38% en hígados cirróticos5,27. Por su parte, de Baere et al.6 consiguió un 64% con cianoacrilato luego de 5-6 semanas en 10 pacientes con hígados no cirróticos.
La inclusión de pacientes con cirrosis y HCC requiere un análisis aparte, así como su estrategia terapéutica. En los casos de HCC candidatos a hepatectomía, se ha sugerido que la EPH puede ser aún más eficiente cuando se combina con quimioembolización transarterial hepática, dado que ambos procedimientos actuarían teóricamente en forma sinérgica. En nuestra serie, se realizó la EPH a dos pacientes cirróticos con HCC, pero la hipertrofia fue insuficiente con un HRF menor del 40%. Uno de ellos fue tratado con EPH y dos sesiones de quimioembolización transarterial hepática, además de la administración de sorafenib; y el otro fue sometido solo a EPH, pero cursó con sobrecrecimiento tumoral del 30,9% y falleció a los 2 meses del procedimiento.
Al respecto, Ogata et al.28 reportaron un aumento significativo del índice de la hipertrofia del HRF después de la quimioembolización transarterial hepática más EPH, en comparación con la EPH aislada. Otros autores, a su vez, han establecido que la quimioembolización transarterial hepática y la EPH secuencial antes de la resección hepática mayor son factibles y seguras, con un buen resultado, alta tasa de necrosis tumoral y posiblemente mejor pronóstico28–30.
Entre las limitaciones de este estudio, se mencionan el reducido número de pacientes y la falta de comparación de la eficacia entre el material embolizante utilizado y otros. No obstante, hay autores que también han reportado series pequeñas y, además, nuestro propósito radicaba en reportar la experiencia con un material poco utilizado pero de fácil preparación y uso, por lo que evaluar las eficacias excedería los objetivos planteados.
Asimismo, otra limitación destacable es la naturaleza retrospectiva de nuestro trabajo y el uso de base de datos secundarias, con los problemas que esto conlleva en la completitud y fiabilidad de la información recolectada. Finalmente, también cabe mencionar la falta de un seguimiento prolongado de los pacientes que permita comparar su sobrevida con la publicada en la literatura.
ConclusiónLa EPH provoca la hipertrofia del hígado, permitiendo incluir pacientes con parénquima insuficiente que de otro modo serían excluidos para la cirugía hepática resectiva de neoplasias malignas. Este procedimiento con lipiodol y gelatina absorbible resultó seguro y efectivo en nuestro medio, con resultados similares a otros materiales embolizantes conocidos.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores del trabajo declaran no tener ningún conflicto de intereses, excepto el Dr. Kozima que declara como posible conflicto de interés ser miembro de la Comisión Directiva de la SAR.