El acretismo placentario ha aumentado debido al incremento de la cirugía uterina previa (en particular las cesáreas). La conducta ha evolucionado de un abordaje quirúrgico radical a un tratamiento conservador.
Caso clínicoGestante de 26,1 semanas que ingresó por rotura prematura de membranas. A los 3 días se realizó una cesárea por riesgo de pérdida de bienestar fetal apreciando acretismo placentario, dejando un fragmento en el lecho cornual. Dada la ausencia de sangrado se decidió adoptar una conducta expectante. El control clínico posterior fue correcto. Los seguimientos ecográfico e histeroscópico observaron una reducción progresiva del tamaño placentario desapareciendo a los 5 meses posparto.
DiscusiónEl manejo óptimo de la placenta acreta sigue siendo discutido en la literatura médica. En casos seleccionados, deberíamos ofrecer la posibilidad de realizar un tratamiento conservador, reduciendo la morbilidad y preservando la fertilidad de la paciente.
Placental accreta has increased because of the greater use of prior uterine surgery, especially cesarean section. Treatment has evolved from a radical surgical approach to conservative management.
Case reportA woman at 26.1 weeks of pregnancy was admitted to hospital because of premature rupture of membranes. Three days after a cesarian section was performed for suspected fetal distress, we observed placenta accreta. A fragment of placenta was left in the cornual bed. Given the absence of bleeding, an expectant attitude was adopted. Subsequent follow-up showed no abnormalities. Ultrasound and hysteroscopic monitoring showed a progressive reduction of placental size until its disappearance at 5 months postpartum.
DiscussionThe optimal management of placenta accreta remains controversial in the literature. In selected cases, we should offer the possibility of conservative treatment, reducing morbidity and preserving the fertility of the patient.
La placenta acreta se define como la implantación anormal de la placenta en la cual el villi placentario está sujeto en el miometrio. Se considera una placenta increta si invade el miometrio y percreta si atraviesa la serosa uterina, pudiendo afectar a órganos vecinos.
Se han descrito múltiples factores de riesgo para el desarrollo de la placenta acreta, de los cuales el más importante es la cirugía uterina previa con implantación placentaria a nivel de la cicatriz1–5. Por este motivo, debido al aumento del número de cesáreas, su incidencia se ha visto incrementada en las últimas décadas de 0,8/1.000 partos en 1980 a 3/1.000 en la década pasada6,7. Otros factores de riesgo descritos han sido la edad materna, la multiparidad, otros tipos de cirugía uterina previa, el síndrome de Asherman, la ablación endometrial, la presencia de miomas uterinos, los trastornos hipertensivos del embarazo y el tabaco8.
El diagnóstico precoz y la valoración multidisciplinaria son necesarios para el manejo óptimo de este trastorno y la planificación de la conducta a seguir2.
Este diagnóstico raramente se efectúa durante la gestación, siendo muchas veces efectuado intraparto (intraoperatorio en cesáreas) por la imposibilidad del alumbramiento, acompañado frecuentemente de hemorragia masiva que causa una gran morbimortalidad, desde la transfusión sanguínea o la coagulopatía al ingreso en una unidad de cuidados intensivos (UCI) o la histerectomía periparto. El diagnóstico definitivo es anatomopatológico.
El tratamiento de la placenta acreta ha evolucionado mucho en los últimos años, pasando de un planteamiento completamente intervencionista y radical (histerectomía) tras el parto o la cesárea9 a un tratamiento conservador, dejando la placenta total o parcialmente in situ si el estado hemodinámico de la paciente y el sangrado lo permiten y existe un deseo genésico posterior.
Dentro de este tratamiento conservador destacan la conducta expectante, la embolización arterial uterina y el tratamiento con metotrexato.
Presentamos un caso de placenta acreta en el que se optó por una conducta expectante, destacando el seguimiento posterior y que tuvo una evolución favorable.
Caso clínicoPaciente de 36 años, secundigesta, con un parto eutócico a las 41 semanas de un niño sano de 2.810g.en el año 2002. Como antecedentes presentaba bronquitis asmática e intervención quirúrgica por atresia esofágica al año de vida.
A las 26,1 semanas de gestación, acudió a nuestro centro de referencia derivada de un hospital comarcal por rotura prematura de membranas precoz. El curso de gestación había sido correcto hasta ese momento.
La paciente refería hidrorrea e hipogastralgia de unas horas de evolución, motivo por el cual había consultado al servicio de urgencias. En la exploración física se confirmó la amniorrexis (aguas claras).
En el momento del ingreso presentaba una longitud cervical de 25mm y un oligoamnios leve en la ecografía. El registro cardiotocográfico era reactivo con presencia de dinámica uterina subclínica. Se cursó un análisis de sangre y un sedimento urinario que resultaron normales y se inició maduración pulmonar con betametasona intramuscular, antibioticoterapia y tratamiento tocolítico con atosiban.
Durante el ingreso, los resultados analíticos permanecieron dentro de la normalidad. El control ecográfico mostró unas biometrías fetales correspondientes a 25,2 semanas, con líquido amniótico normal y una placenta normoinserta lateral derecha. La fluxometría Doppler umbilical y de la arteria cerebral media fueron normales.
A las 26,4 semanas, coincidiendo con inicio de un dolor abdominal brusco y metrorragia leve, se apreció bradicardia fetal en la auscultación que se recuperó espontáneamente. En la ecografía no se visualizaron imágenes indicativas de desprendimiento de placenta. El test no estresante mostró la presencia de desaceleraciones variables de forma persistente, con ausencia de variabilidad.
Ante la sospecha de un riesgo de pérdida de bienestar fetal y la imposibilidad de realizar controles bioquímicos, se indicó una cesárea con anestesia raquídea, naciendo un varón de 850g, Apgar 8-9-10 y pH de arteria umbilical de 7.20 y de vena umbilical de 7.33, que fue trasladado a la unidad de cuidados intensivos de neonatología.
La cesárea fue realizada según la técnica de Joel-Cohen, practicándose una histerotomía segmentaria transversal. Tras la extracción fetal y la administración oxitócica, se realizó alumbramiento manual con gran dificultad para localizar un plano de separación cornual derecha, que indicaba un posible acretismo en esta localización, y en el que se apreció una serosa uterina normal. Se realizó una separación parcial de la placenta, siendo los fragmentos remitidos al servicio de anatomía patológica. Un fragmento de tejido placentario fue dejado in situ. Se informó a la paciente de la situación y de las posibles opciones terapéuticas, y aceptó una conducta conservadora. No existió hemorragia severa intra ni postoperatoria y se finalizó la intervención sin otras incidencias.
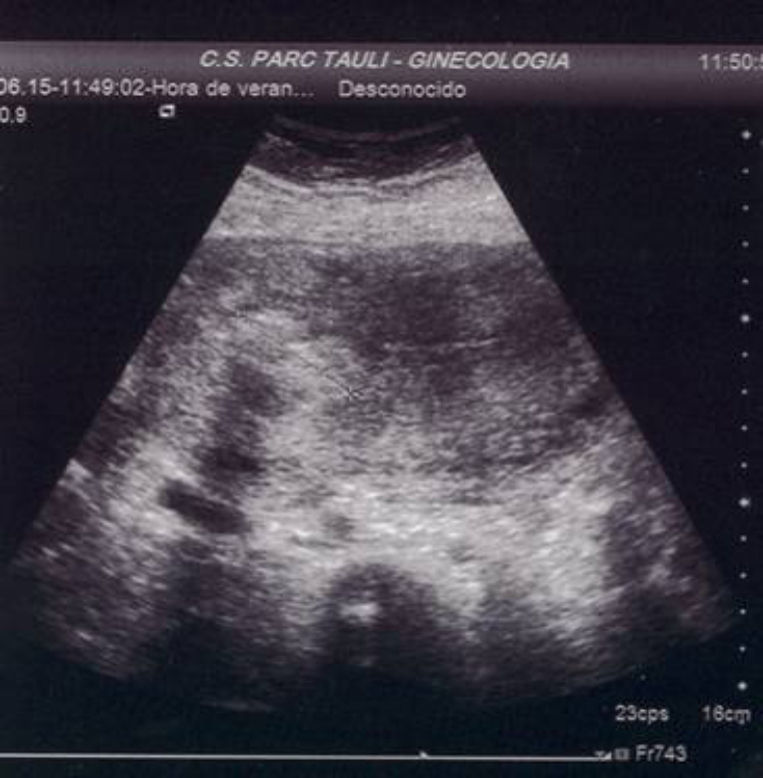
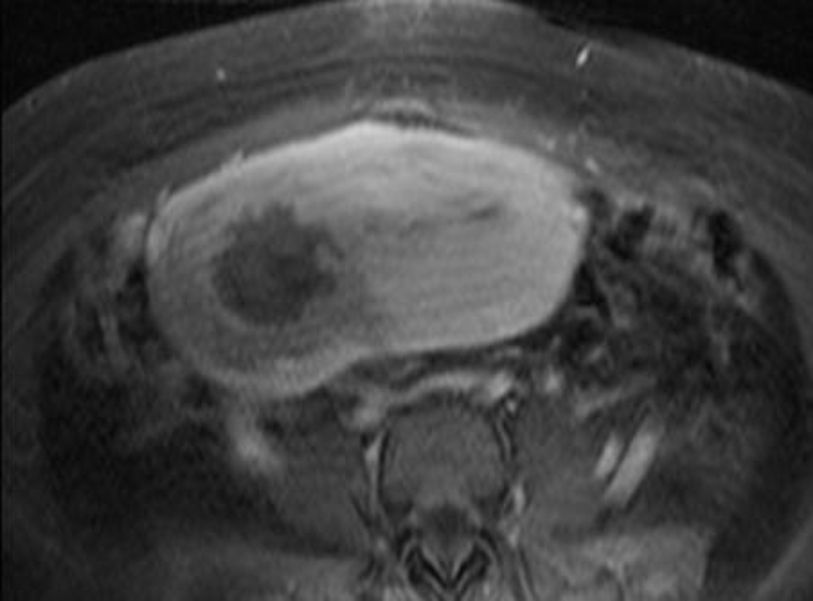
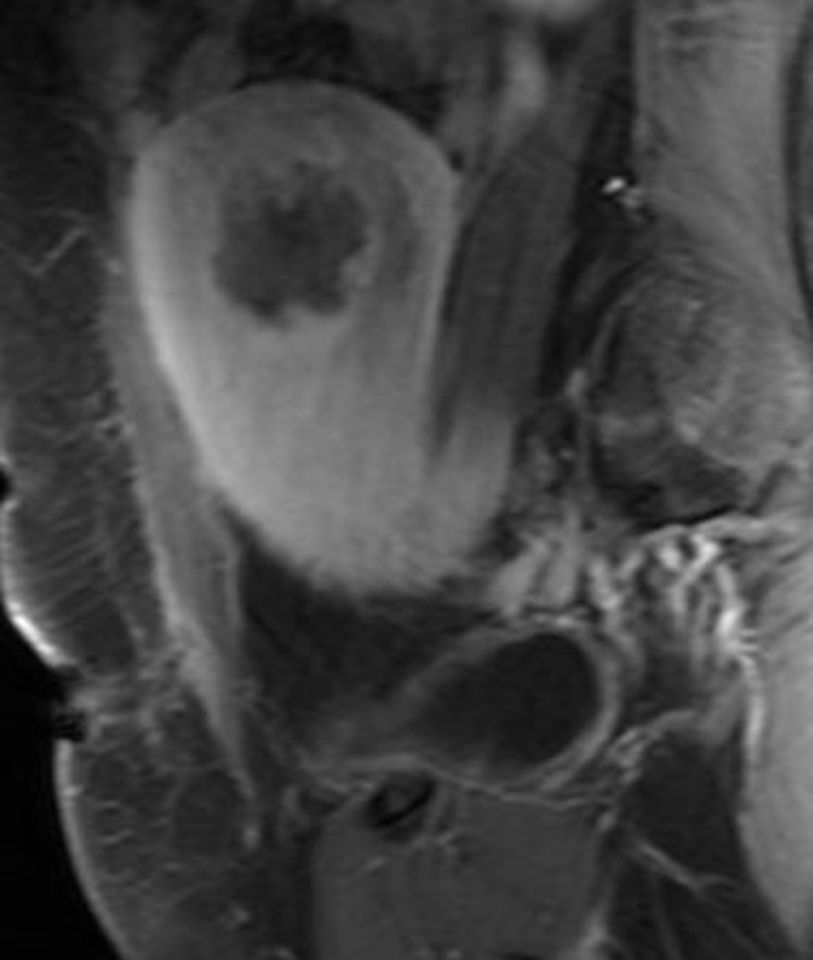
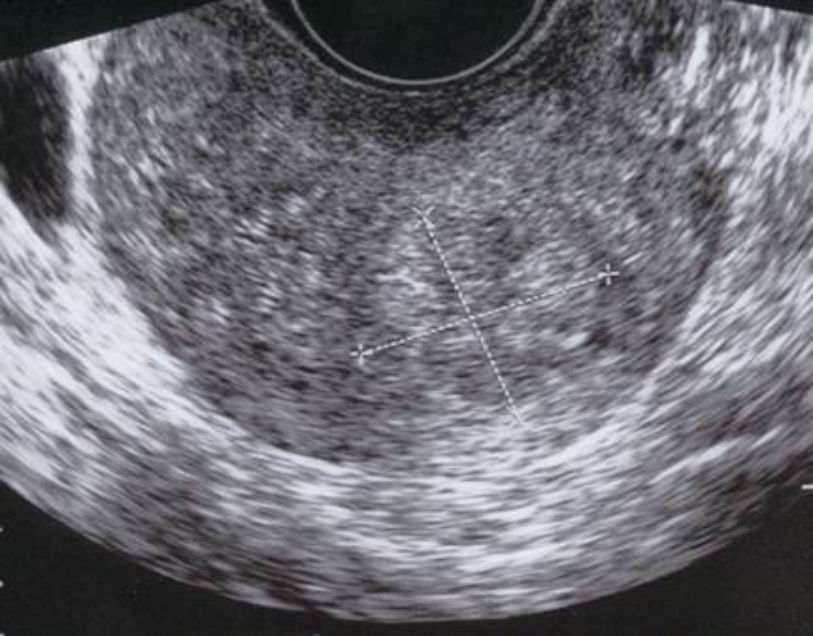
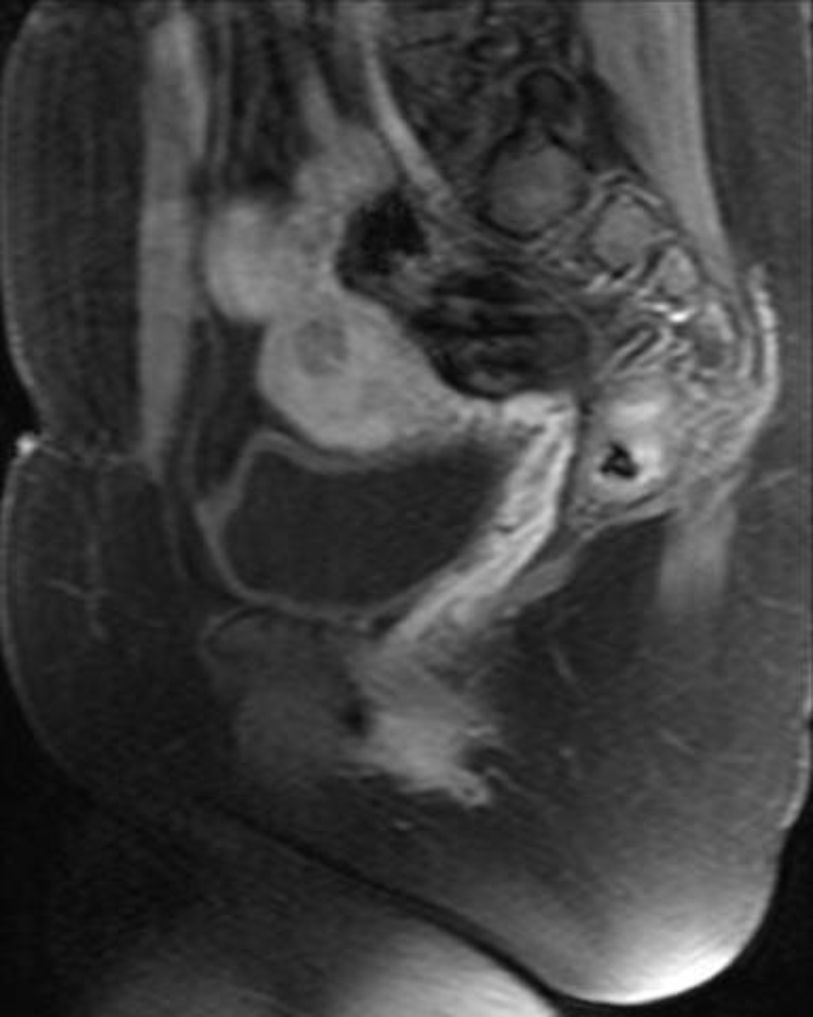
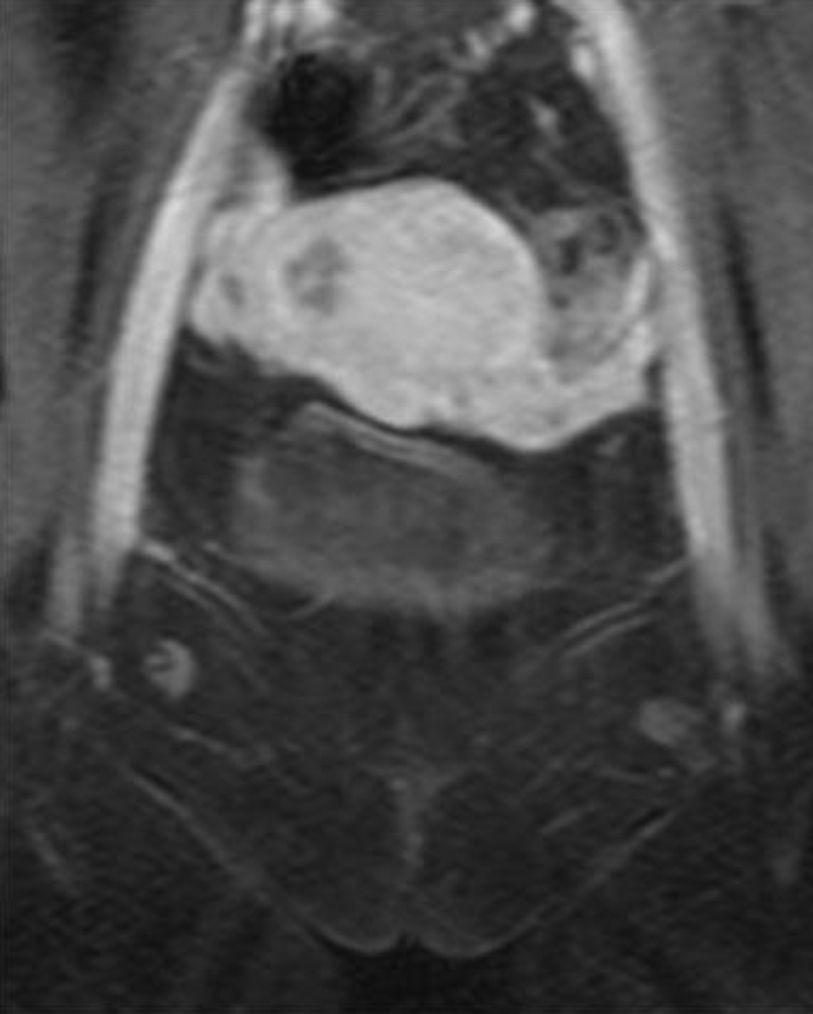
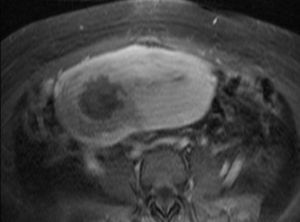
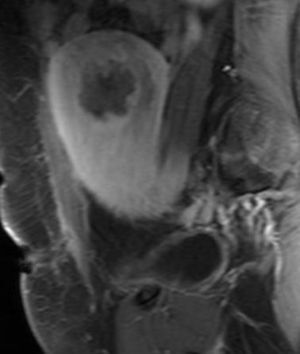
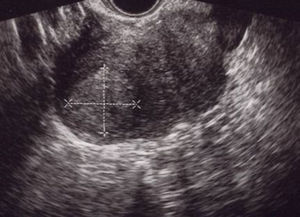
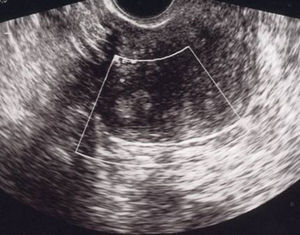
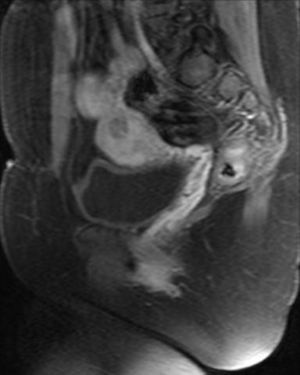
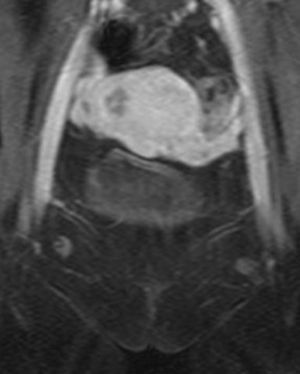
A las 24horas de la cesárea, se realizó un control ecográfico donde se apreció una imagen hiperrefringente de 37mm en el cuerno uterino derecho compatible con la retención del fragmento placentario, sin invasión de la serosa y con banda de miometrio libre (fig. 1). La determinación de la porción beta de la hormona gonadotropina coriónica (β-hCG) a las 72 h postintervención fue de 743 mU/ml. El mismo día, se practicó una resonancia magnética (RM) que informó de la presencia de una imagen nodular con efecto de masa de unos 5-6cm, con bordes irregulares a nivel cornual derecho. Tras la administración de contraste, se observaron 2 zonas de captación, una avascular central más próxima a la cavidad endometrial y otra con captación tardía informada como cambios inflamatorios o placenta vascularizada, y que llegaba a contactar parcialmente con la serosa (figs. 2 y 3).
El curso posterior fue correcto, sin fiebre ni sangrado vaginal excesivo. El cuarto día poscesárea le fue dada el alta a su domicilio siguiendo con cobertura antibiótica (cefuroxima por vía oral) durante 7 días.
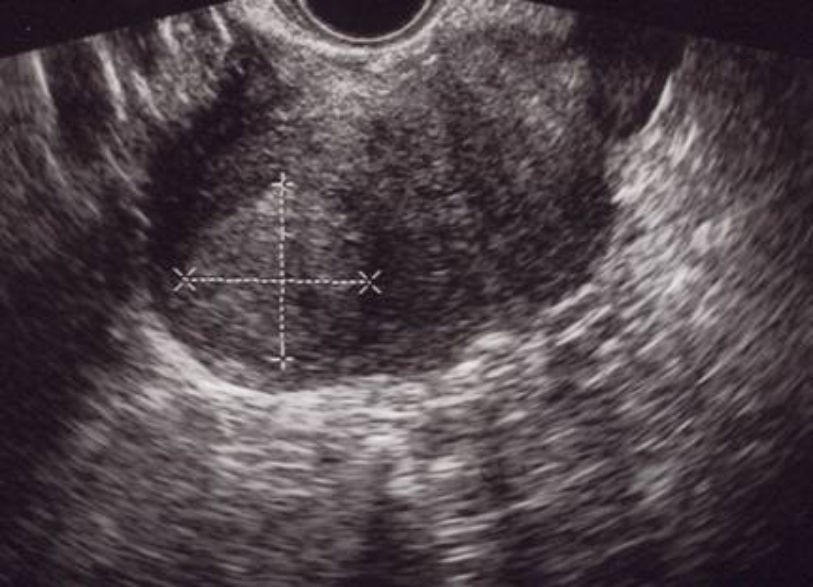
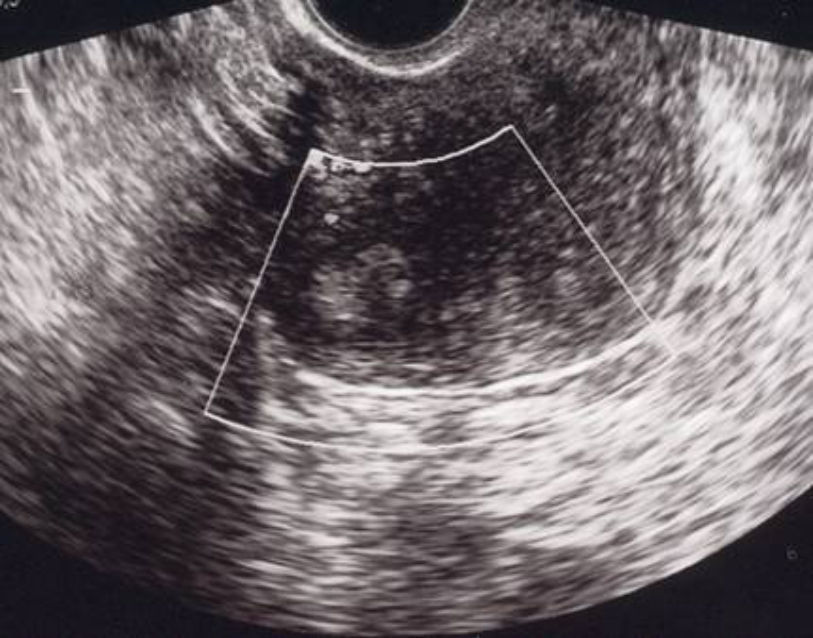
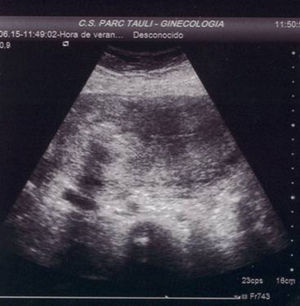
A los 21 días poscesárea, fue visitada en consultas externas. El estado general era bueno, sin referir fiebre, dolor abdominal o leucorrea. La determinación de β-hCG resultó negativa, en el hemograma no se apreció leucocitosis y la ecografía mostró una imagen nodular cornual derecha, bien delimitada, de 30×36mm sin mapa color a 3mm de la serosa uterina (fig. 4). El resultado anatomopatológico informó de la presencia de fibras miometriales en íntima relación con las vellosidades placentarias, compatible con acretismo. Ante la evolución favorable se siguió con conducta expectante.
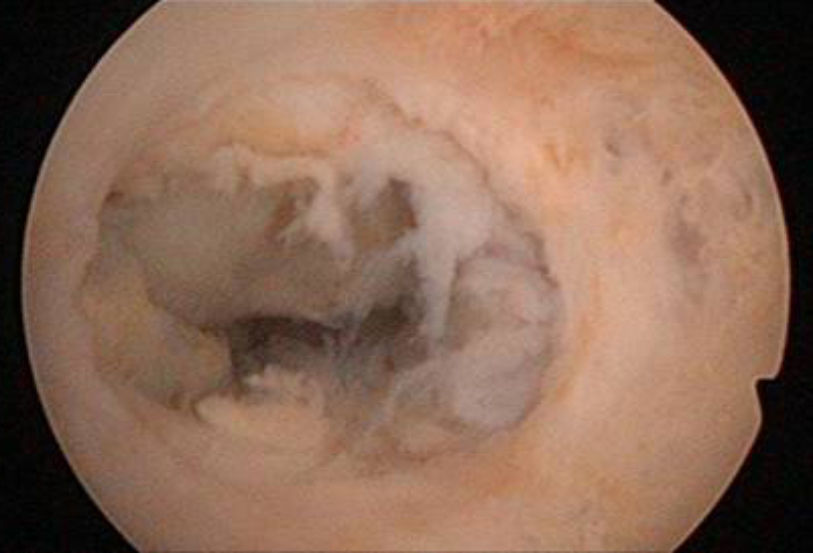
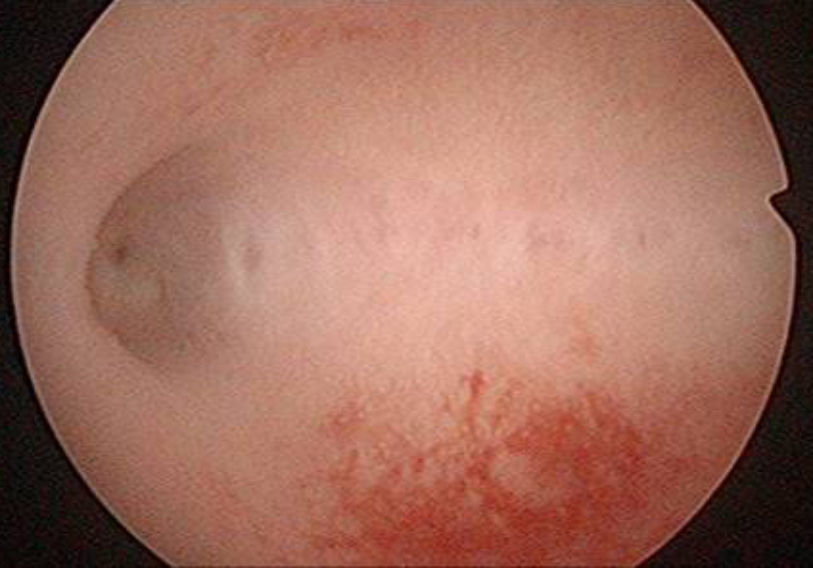
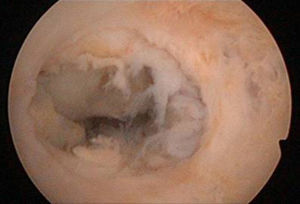
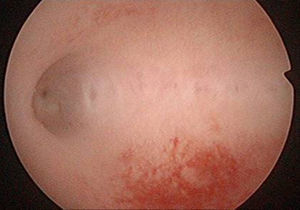
A los 47 días de la intervención, se realizó una histeroscopia diagnóstica, objetivando una seudocavidad en cuerno uterino derecho con material indicativo de restos placentarios de 1,5-2cm (fig. 5), practicándose biopsia dirigida que corfimó el diagnóstico.
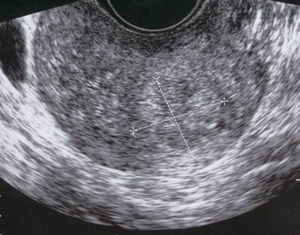
A los 2 meses, la paciente permanecía asintomática y la imagen ecográfica se había reducido de tamaño, siendo en aquel momento de 23×20mm (fig. 6).
Tres meses después del parto, la mujer presentó una primera menstruación normal. El control ecográfico informó de una imagen residual de 17×14mm (fig. 7).
Un mes más tarde la RM practicada informó de la presencia de una imagen nodular intramural de 15mm, hipointensa, mal delimitada en cuerno uterino derecho, avascular, en contacto con la cavidad endometrial y separada de la serosa (figs. 8 y 9).
A los 5 meses de la cesárea la histeroscopia mostró una cavidad uterina normal (fig. 10).
A los 6 meses poscesárea a la paciente le fue dada el alta de nuestro servicio con resolución completa del proceso.
DiscusiónEl manejo óptimo del acretismo placentario sigue siendo controvertido, dependiendo de la hemorragia y del deseo genésico posterior. Las opciones terapéuticas permiten un tratamiento quirúrgico clásico (histerectomía) o un tratamiento conservador. Aunque muchas veces es un hallazgo casual inesperado, la posibilidad de un diagnóstico antenatal permite una planificación de la conducta a seguir.
Cuando existen factores de riesgo, la exploración antenatal ecográfica cuidadosa buscando la interfase entre la placenta y el miometrio permite la sospecha de esta entidad. Wong describe criterios ecográficos que utilizando una puntuación ofrecen una sensibilidad y una especificidad del 89 y 98%, respectivamente10. De modo similar, Shih considera la presencia de una serie de características ecográficas para describir la placenta acreta, increta o percreta, añadiendo criterios que utilizan el Doppler color y el 3D power Doppler, con una sensibilidad del 97% y una especificidad del 92%11.
Ante la sospecha ecográfica, la evaluación mediante RM permite completar el estudio. Aunque se han publicado resultados muy diversos, la RM parece tener ventajas en la evaluación de la topográfica de la alteración placentaria y del grado de invasión miometrial y supera a la ecografía en la valoración de la placenta de localización posterior12, describiendo una sensibilidad del 88% y una especificidad del 100% para la detección de acretismo13. Las nuevas técnicas de RM pueden mejorar la valoración de la afectación miometrial focal en la placenta increta, actualmente difícil de diagnosticar con RM convencional14.
También han sido publicados algunos marcadores bioquímicos que podrían ser útiles para la identificación de la placenta acreta y su posterior monitorización, como la alfafetoproteína y la creatincinasa6,15. Recientemente se han descrito 3 marcadores biológicos como posible herramienta diagnóstica y para el seguimiento después de un tratamiento conservador: las células libres de ADN fetal, el ARNm placentario y los microarray ADN16.
El tratamiento quirúrgico radical (histerectomía) suele realizarse por la aparición de hemorragia severa o recurrente, aunque a veces se puede planificar de forma programada.
Con la intención de reducir la hemorragia intraoperatoria ante la sospecha diagnóstica de acretismo placentario, se han propuesto varias técnicas. Preoperatoriamente, se ha descrito la colocación de catéteres, con o sin balón, en las arterias ilíacas internas o arterias uterinas para su oclusión en caso de hemorragia3. En el intraoperatorio, se ha descrito la ligadura y la embolización de las arterias hipogástricas de forma profiláctica para reducir la pérdida hemática con resultados contradictorios9,17–20. Además, según estudios publicados, la morbilidad puede reducirse de forma significativa dejando la placenta en situ en comparación con la extracción de la misma después de la extracción fetal20,21.
Dado que la histerectomía presenta una elevada morbilidad y un riesgo potencial de muerte, además de finalizar la vida reproductiva de la mujer y para minimizar estas complicaciones, existe la posibilidad de realizar un tratamiento conservador.
Definimos el tratamiento conservador como la decisión de dejar la placenta in situ, parcial o totalmente, con preservación uterina .El riesgo de histerectomía posterior estimado varía de un 10 a un 85% según las series7,22.
En la literatura médica se han descrito posibles complicaciones derivadas de la presencia del tejido placentario en su lecho de implantación como necrosis uterina, fístula, infección, sepsis, hemorragia y coagulopatía intravascular diseminada23.
Han sido publicados múltiples procedimientos asociados al tratamiento conservador, como la embolización de las arterias ilíacas internas, ligadura de las arterias uterinas24,25, compresión uterina con balón26,27.
La administración de metotrexato, folato-antagonista, se ha propuesto para reducir la vascularización de la masa placentaria debido a su efecto contra la proliferación del trofoblasto. Existe una dispersión considerable de resultados según las series. Algunas describen una expulsión del tejido placentario entre 5 y 18 días posterior a su administración en función de la vía (oral o intravenosa)28–30, aunque otras series señalan un fracaso del tratamiento, requiriendo cirugía por sangrado importante. Actualmente, no existen diferencias significativas en los resultados entre el uso de metotrexato o no, aunque podría haber una resolución más rápida con la administración de este. Además, aunque no suelen aparecer con dosis bajas, debemos considerar las complicaciones derivadas de la administración de metotrexato en estas pacientes, como mielosupresión, alopecia, diarrea, náuseas y vómitos, dermatitis, hepatitis, insuficiencia renal y fibrosis pulmonar31.
Algunos autores proponen la extracción placentaria posparto en un periodo variable entre 2 semanas y 2 meses cuando ésta deja de estar vascularizada utilizando el índice de pulsatilidad en ecografía Doppler como marcador de degeneración placentaria, aunque en otras series dicha asociación no se ha visto demostrada32.
Ampliando las opciones conservadoras, en 2009, Morgan publicó la utilización con éxito de mifepristona y misoprostol para la expulsión de la placenta retenida en casos de acretismo33.
El seguimiento posterior mediante β-hCG en suero fue publicado por Matsumura et al.32 que apreciaron valores decrecientes en mujeres tratadas con tratamiento conservador. En nuestro caso, los niveles de β-hCG han sido de utilidad para la monitorización inicial de la paciente junto con las pruebas de imagen.
Dada la estabilidad hemodinámica, la ausencia de sangrado y el deseo genésico posterior, tras la información exhaustiva a la paciente y con su consentimiento, optamos por una conducta expectante.
El seguimiento de esta paciente fue realizado con la combinación de las pruebas de imagen (ecografía, RM e histeroscopia), apreciando la reducción y posterior desaparición del fragmento placentario.
ConclusionesAnte el diagnóstico intraparto de acretismo placentario, en algunos casos existe la posibilidad de realizar un tratamiento conservador, permitiendo reducir la morbilidad y mantener la fertilidad de la paciente.
En el caso que presentamos, la conducta expectante ha sido supervisada mediante seguimiento clínico, monitorización analítica (β-hCG) y pruebas de imagen (ecografía, RM, histeroscopia), apreciando una solución completa de este trastorno.
La ausencia de complicaciones en este seguimiento permitió la continuación de la conducta expectante.
A pesar de ello, creemos que probablemente en la literatura médica existe un sesgo de publicación, relatando en estudios retrospectivos y con un número reducido de casos, aquellos que han evolucionado correctamente sin señalar los que precisan un tratamiento quirúrgico.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.