El cáncer de mama es la neoplasia más frecuente en la mujer. El tratamiento conservador implica el tratamiento adyuvante con radioterapia. Alrededor del 60% de los pacientes con cáncer reciben radioterapia durante el curso de su enfermedad. Los sarcomas son tumores raros y corresponden al 0,03-0,8% de toda la patología tumoral. Su origen es controvertido siendo asociado a traumatismos, exposición a agentes químicos, linfedema crónico y radioterapia. El porcentaje de sarcomas radioinducidos supone el 0,1-0,4% de los mismos. Ya en 1904 Perthes y posteriormente Cahan describieron la asociación de radioterapia como desencadenante en la patogénesis de los sarcomas. El mejor conocimiento actual de la biología aporta nuevos indicios sobre su origen. La distancia temporal entre la exposición a la radiación y la aparición del sarcoma es el criterio principal que ha sido modificado por la mayor parte de los investigadores, y está entre 3-10 años. El tratamiento de elección, sigue siendo la cirugía con amplios márgenes de seguridad. Respecto al tratamiento adyuvante, la radioterapia y quimioterapia tienen un efecto limitado. El pronóstico es desfavorable, con una supervivencia global a los 5 años, que oscila del 17-58%, significativamente menor que la de los sarcomas de partes blandas de novo. Debido al escaso número de casos recogidos en la literatura, es difícil definir el protocolo de actuación más correcto, por lo que pretendemos ofrecer una revisión de las manifestaciones clínicas, técnicas de imagen, tratamiento y pronóstico de los sarcomas radioinducidos, aportando a la vez 2 nuevos casos de sarcomas radioinducidos tras neoplasia mamaria.
Breast cancer is the most common neoplasm in women. Conservative treatment involves adjuvant therapy with radiotherapy. About 60% of cancer patients receive radiotherapy during the course of their disease. Sarcomas are rare tumors and account for 0,03-0,8% of all tumoral disease. Their origin is controversial and has been associated with trauma, exposure to chemicals, radiation and chronic lymphedema. The percentage of radiation-induced sarcomas represents the 0.1-0.4% of these tumors. As early as 1904, Perthes, and later Cahan, described the association of radiotherapy as a trigger in the pathogenesis of sarcomas.
Greater current knowledge of biology provides new clues to the origin of sarcomas. The time interval between radiation exposure and the appearance of a sarcoma is the main criterion that has been modified by most researchers and is between 3 and 10 years. The treatment of choice is still surgery with wide safety margins. Regarding adjuvant treatment, radiotherapy and chemotherapy have limited effect. Prognosis is poor, with an overall 5-year survival ranging from 17% to 58%, significantly lower than that of de novo soft tissue sarcomas. Due to the small number of cases reported in the literature, it is difficult to define the most appropriate protocol. Consequently, our aim is to provide a review of the clinical manifestations, imaging techniques, treatment and prognosis of radiation-induced sarcomas and to report two new cases of radiation-induced sarcomas after breast cancer.
Los sarcomas radioinducidos (SRI) de partes blandas constituyen una entidad clínica poco frecuente.
El tratamiento conservador del cáncer de mama implica el tratamiento adyuvante con radioterapia, siendo este el tratamiento de elección en el 60% de los tumores de mama operables, y siendo a su vez, el cáncer de mama la neoplasia más frecuente en la mujer y cuya incidencia va en progreso.
Los tumores de partes blandas (sarcomas) corresponden al 0,03-0,8% de toda la patología tumoral1.
Las causas del origen de los sarcomas son siempre controvertidas. Asociados a traumatismos, también se describe la exposición a agentes químicos (fenoxiácidos), linfedema crónico y radioterapia.
La radioterapia ha demostrado desempeñar un papel desencadenante en la patogénesis de los sarcomas, ya en 1904 Perthes describió tal asociación, posteriormente Cahan et al. definió los SRI como lesiones de histología diferente a la de los sarcomas no radioinducidos, que se desarrollaban en el campo de aplicación previa de radioterapia, tras un periodo de latencia superior a 4 años2,3. En la revisión de la base de datos SEER, Huang et al. mostraron un incremento de 16 veces en la frecuencia de angiosarcomas en paciente de radioterapia frente a los casos control y el doble para cualquier tipo de sarcoma frente a controles4.
El mejor conocimiento actual de la biología de estos tumores aportan nuevos indicios sobre su origen, así los estudios genéticos en alguna variedad de sarcomas revelan la presencia de traslocaciones cromosómicas que determinan una predisposición genética, mediante la pérdida de genes supresores (RB1 y p53), la activación de oncogenes, y en definitiva, de mecanismos que protegen la integridad del genoma5,6 y que determinarían una susceptibilidad a desarrollar este tipo de tumores.
Según un estudio de revisión reciente de Mertens et al.7 acerca de los cambios citogenéticos en los SRI, observa una mayor frecuencia de pérdida del gen 3p21-pter que en los sarcomas esporádicos, así mismo el estudio de Nakanishi et al.5 describe también una mayor frecuencia de mutaciones de p53, y Mayer et al.8 analizan los genes implicados en la señalización del p53 para el control de ciclo celular y apoptosis en respuesta a la radiación en linfocitos primarios. Así mismo Heyman et al.9 observaron que mutaciones del p53 conferían mayor radiosensibilidad y que familias con el síndrome de Li-Fraumeni tenían un riesgo más elevado de segunda enfermedad radioinducida10. Los factores de riesgo conocidos son el tratamiento a edad temprana y los factores relacionados con el tratamiento en sí, que incluyen las altas dosis de radiación y la administración simultánea de quimioterapia con agentes alquilantes. Así mismo el riesgo de cáncer disminuye con el aumento de la edad en el momento de la exposición.
Los SRI constituyen una entidad clínica poco frecuente, suponen el 0,1-0,4% de todos los pacientes sometidos a radioterapia para tratar una neoplasia previa, y suponen alrededor del 3% del total de sarcomas. El mayor porcentaje de neoplasias asociadas a radioterapia aparece en la enfermedad de Hodgking, cáncer de faringe y esófago, cáncer de pulmón y mama; así en pacientes con cáncer de mama, los sarcomas son los tumores radioinducidos más frecuentes, seguidos del carcinoma pulmonar y esófago.
La frecuencia de los SRI ha aumentado, dado que el screening del cáncer de mama en la población general ha dado como resultado un diagnóstico precoz, que ha permitido el incremento de la supervivencia y la posibilidad de ser tratadas mediante cirugía conservadora de la mama que conlleva radioterapia adyuvante de la misma11,12. La IMRT (RT con intensidad modulada) permite modular la intensidad de los distintos haces de radiación, y disminuir así la dosis del tejido sano circundante, aunque exponen más cantidad de tejido sano a radioterapia a bajas dosis, pudiendo incrementarse la incidencia de SRI13.
Aunque en las neoplasias radioinducidas no ha conseguido establecerse la existencia de una clara relación dosis-respuesta, es mayoritariamente aceptado que los carcinomas aparecen en tejidos sometidos a bajas dosis de radiación, mientras que los sarcomas son inducidos en tejidos que reciben altas dosis, dentro o en la vecindad de los campos de radiación.
El periodo de latencia transcurrido desde el tratamiento con radioterapia hasta la aparición del nuevo tumor es variable en las distintas series, entre 3 y 20 años.
Este tipo de sarcomas se puede originar en tejidos blandos o hueso. Progresan localmente y avanzan regionalmente a través de estructuras vecinas, infiltran músculos vecinos, tendones, elementos vasculares y pueden llegar a infiltrar al hueso y ocasionar fracturas patológicas.
Presentación de los casosPresentamos 2 casos de pacientes con cáncer de mama, sometidas a tratamiento quirúrgico conservador con posterior tratamiento radioterápico, en cuyo período de seguimiento desarrollan un SRI (sarcoma pleomórfico indiferenciado de pared torácica y angiosarcoma).
Primer casoPaciente de 74 años con antecedente de carcinoma bilateral mamario; carcinoma ductal infiltrante de mama derecha de 2,3cm, grado II, con márgenes libres, receptores de estrógenos y progesterona negativos, c-erb-B2 positivo. Un ganglio positivo de 16. Estadio pT2a pN1a pMo, y carcinoma ductal infiltrante de mama izquierda de 1,4cm, grado II, con márgenes libres, receptores de estrógenos y progesterona positivos, c-erb-B2 negativo. Treinta y ocho ganglios negativos. Estadio PT1c pNo pMo.
Se trató mediante tumorectomía amplia y linfadenectomía bilateral, quimioterapia adyuvante (FEC 75×6 ciclos), radioterapia (irradiación sobre PTV1: mama derecha y PTV2: mama izquierda con fotones de 6 MV procedentes del acelerador lineal. El PTV1 se trató con dos campos tangenciales, interno y externo, administrándose 50Gy, isodosis del 98%, d. máxima: 55,6Gy, d. ICRU: 51Gy, d. mínima: 50Gy. El PTV2 se trató con dos campos tangenciales, interno y externo, administrándose 50Gy, isodosis del 98%, d. máxima: 55,6Gy, d. mínima ICRU: 51Gy, d. mínima: 49,5Gy. A continuación se llevó a cabo la sobreimpresión de PTV3: cuadrante afecto de mama izquierda con margen de seguridad, a través de un campo directo con electrones de 18 MeV procedentes del acelerador lineal, administrando una dosis de 10Gy. El fraccionamiento fue de 2Gy 50Gy/día, 5 días/semana. La tolerancia fue regular, presentando dermitis grado 3. Dosis total PTV1: 50Gy, PTV2: 50Gy, PTV3: 60Gy) y hormonoterapia (tamoxifeno 2 años e inhibidores de la aromatasa 4 años).
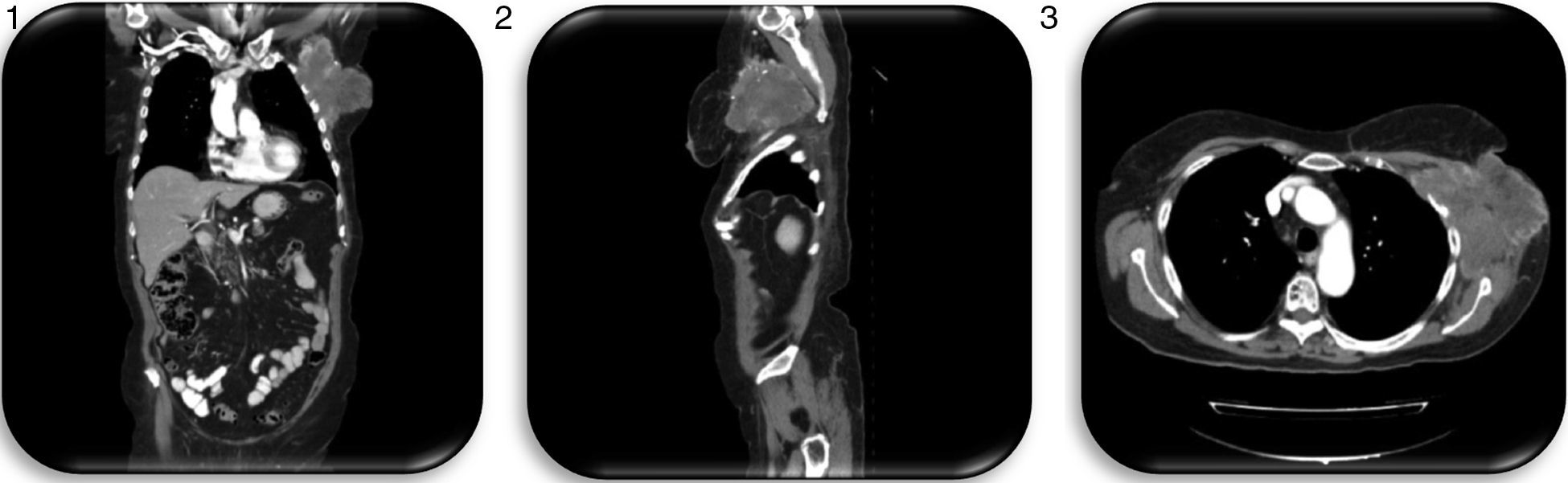
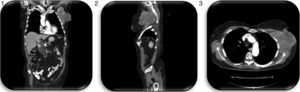
En el sexto año de seguimiento, ante la sospecha de recidiva axilar al presentar una masa en la pared torácica por debajo de la axila izquierda de 11×6cm, de consistencia pétrea, adherida a planos profundos, se realizan biopsias percutáneas que resultan negativas, y TAC torácica que demuestra una masa axilar izquierda de 11,4×11,3×10,5cm, con cambios necróticos centrales, que alcanza planos cutáneos y musculares de la región escapular, contactando con los vasos subclavios y protruyendo a través de 4 espacios intercostales, produciendo destrucción focal de los arcos costales 3.° y 4.°; así como un pequeño foco nodular en la pleura costal posterior izquierda sugestivo de un implante pleural metastásico, y varias opacidades nodulares subcentimétricas en el parénquima de ambos pulmones, igualmente por probable extensión tumoral (figs. 1–3).
La TAC abdominopélvica no presenta signos de extensión tumoral y el PET-TAC describe una imagen hipermetabólica que sugiere infiltración metastásica ganglionar, que se extiende a musculatura adyacente y a pared costal, con adelgazamiento cortical en 3.° y 4.° arcos costales, lo que no permite descartar infiltración ósea.
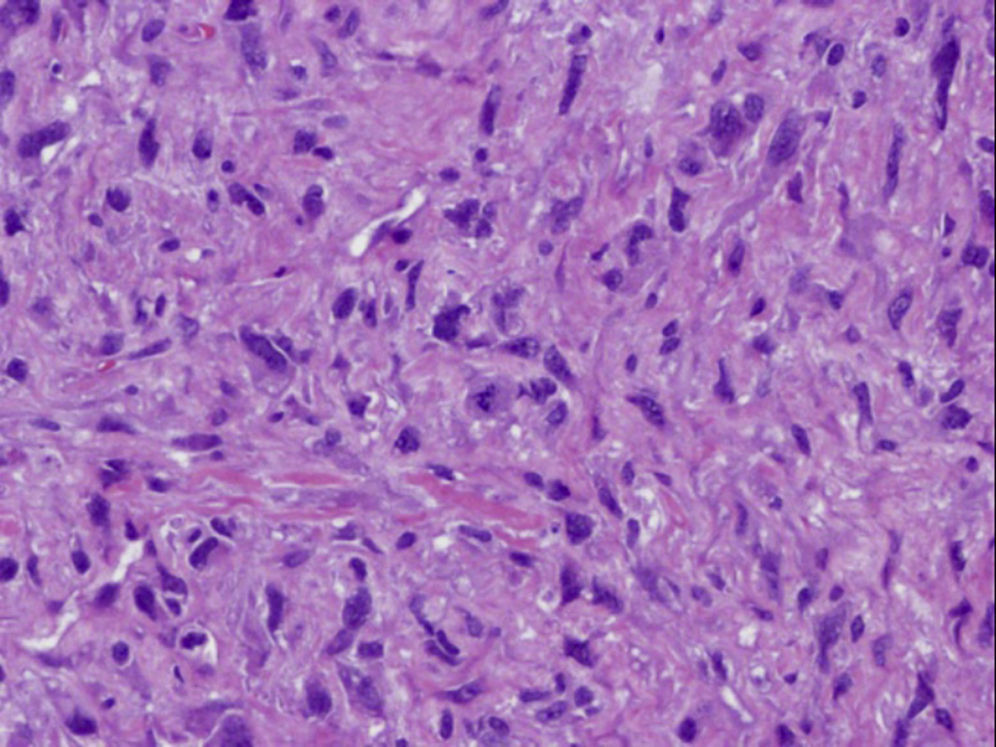
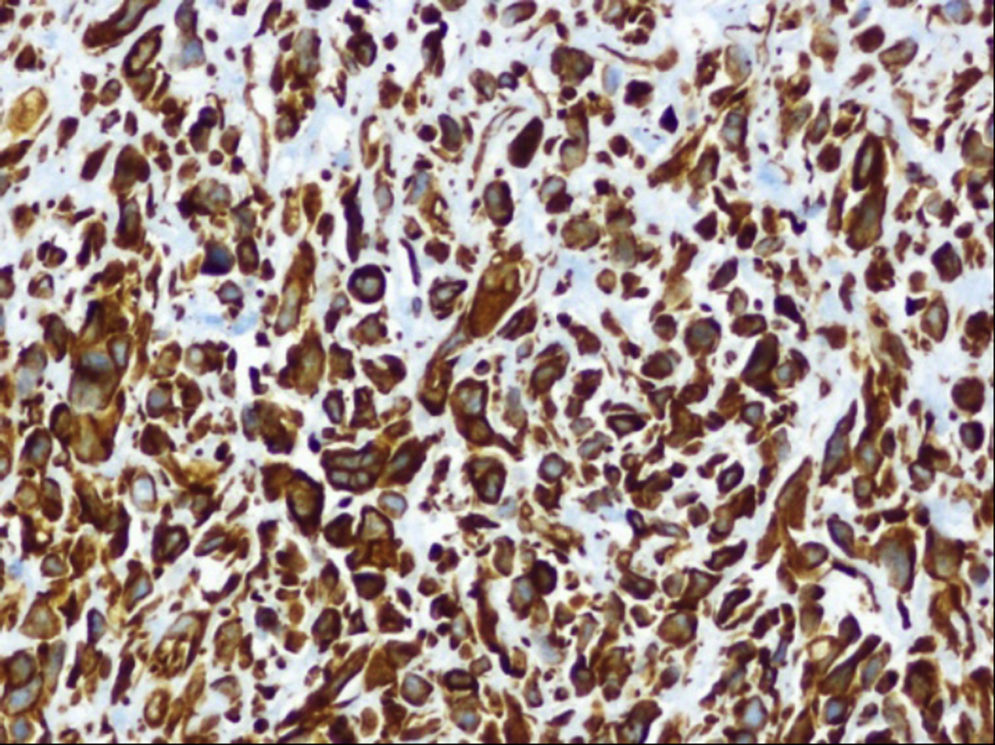
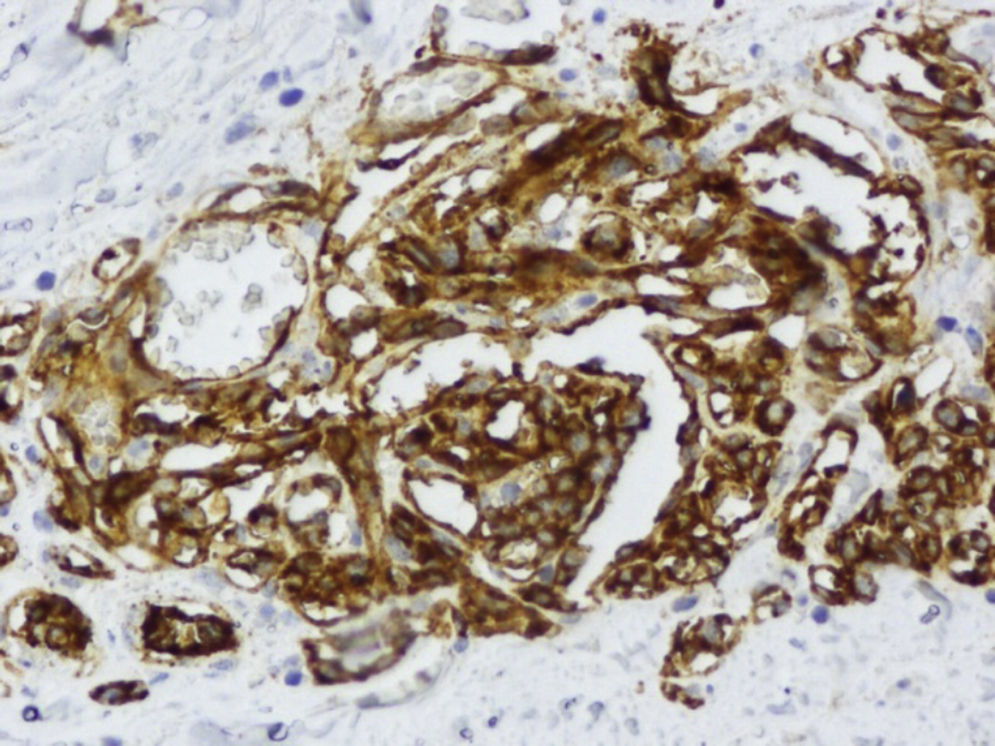
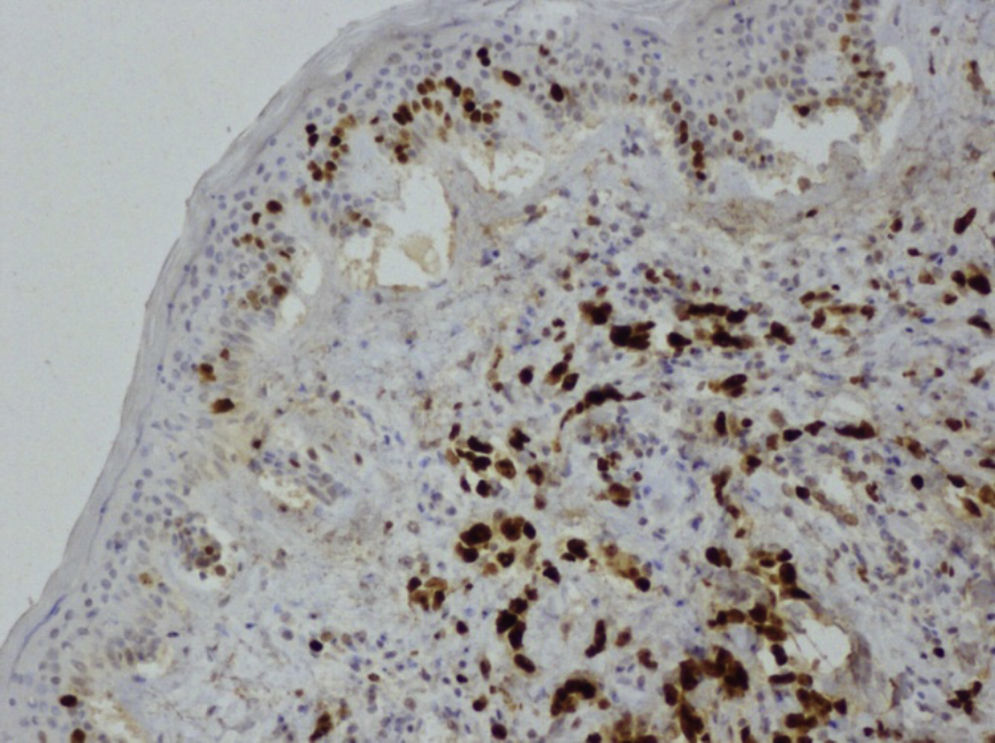
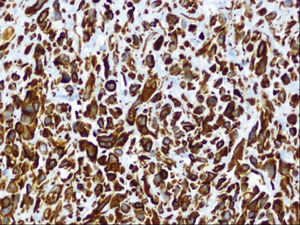
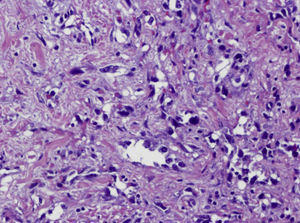
Ante las reiteradas biopsias percutáneas negativas, se decide la realización bajo anestesia de biopsia excisional, cuya anatomía patológica es de sarcoma pleomórfico indiferenciado (fibrohistiocitoma maligno pleomórfico), con estudio inmunohistoquímico que demuestra positividad para vimentina y negatividad para el resto de marcadores estudiados (Ck AE1/AE3, actina, desmina, S-100 y CD 34) y actividad proliferativa medida con Ki67 del 60% (figs. 4 y 5).
Tras estos hallazgos y siendo considerado irresecable por su extensión y localización, se decide tratamiento con quimioterapia (ADR liposómica+IFM), y cirugía dependiendo de la respuesta al tratamiento previo.
Tras ello, la paciente presenta progresión tumoral en región axilar y pared torácica y aparición de implante pleural y metástasis pulmonares. Posteriormente presentó insuficiencia renal, diabetes insípida nefrogénica y aplasia medular que conllevó el éxitus.
Segundo casoPaciente de 55 años en seguimiento tras tratamiento por un carcinoma ductal infiltrante de mama izquierda, con 2 nódulos en CSE, de 2,5 y 1,5cm, márgenes de resección libres, grado histológico 2, grado nuclear 2, grado mitótico 1 (2 mitosis/10 CGA), sin necrosis, componente intraductal extenso de tipo cribiforme, respuesta linfoplasmocitaria con invasión linfática. Receptores de estrógenos y progesterona positivos y c-erbB-2 negativo. Doce ganglios negativos. Estadio pT2a pNo pMo.
Recibió tratamiento quirúrgico conservador (mediante tumorectomía amplia de mama izquierda y linfadenectomía axilar), quimioterapia (AC x 4 ciclos), radioterapia (irradiación sobre volumen glandular mamario izquierdo mediante 2 campos tangenciales, interno y externo, con fotones de 6MV en la unidad de acelerador lineal, administrándose 50Gy, y sobreimpresión del lecho tumoral a través de un campo directo con electrones de 10 Mev en acelerador lineal hasta una dosis de 10Gy, el fraccionamiento fue de 2Gy/día, 5 días/semana. La tolerancia fue buena, presentando epitelitis G1-G2) y hormonoterapia (tamoxifeno 2 años e inhibidores de la aromatasa 4 años).
En el séptimo año de seguimiento se aprecia una lesión cutánea en línea intercuadrántica interna de mama izquierda de 1,5cm, eritematosa oscura y ligeramente sobreelevada. Se realiza biopsia-punch que da como diagnóstico tejido cutáneo infiltrado por angiosarcoma de grado intermedio. Se realiza estudio de extensión mediante técnicas de imagen (Rx tórax, ecografía hepática y gammagrafía ósea) y marcadores tumorales que resultan negativos.
La TAC revela lesión en riñón izquierdo de 36mm a descartar hipernefroma.
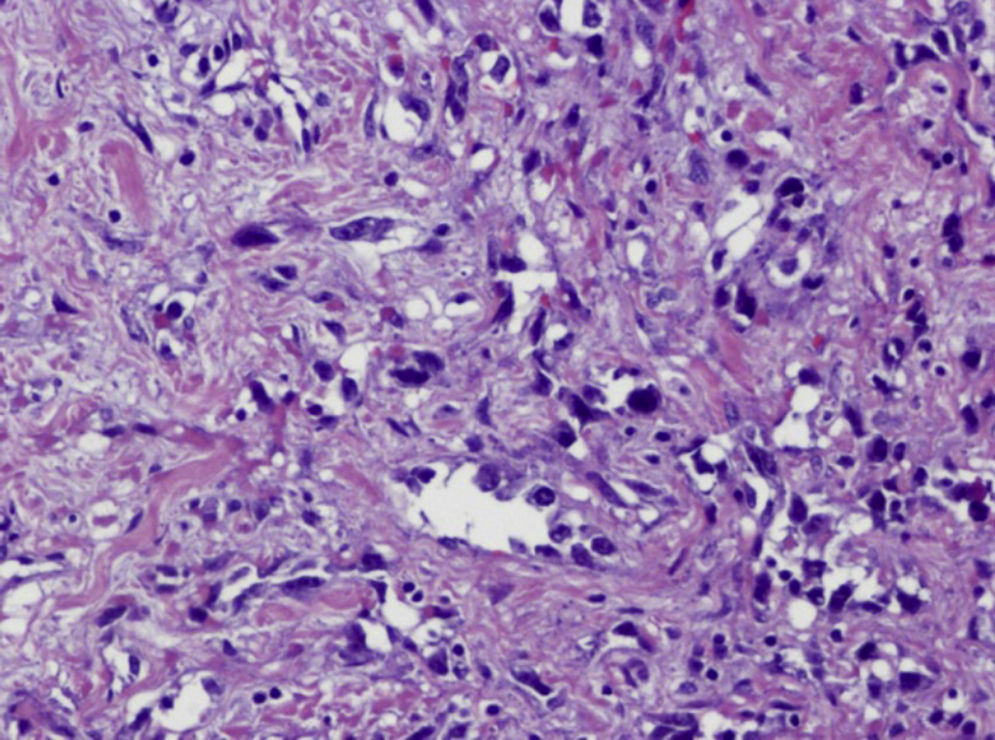
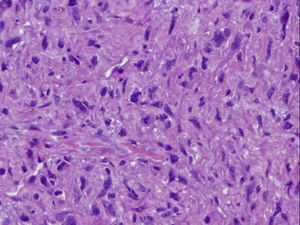
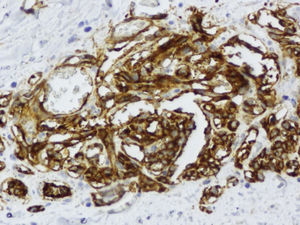
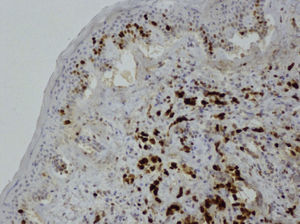
Se decide mastectomía total simple izquierda cuyo informe anatomopatológico informa de angiosarcoma de 5cm (figs. 6–8), márgenes libres, y quimioterapia (caelyx-ciclofosfamida x 4 ciclos seguido de tatotere x 4 ciclos) como tratamiento complementario. A los 11 meses presenta recaída local en cicatriz de mastectomía, se realiza resección de cicatriz, estando afecta toda la pieza y siendo positivos los márgenes quirúrgicos.
Se solicitó un PET-TAC en el que se visualizaba en pared torácica a nivel de lecho de la mastectomía una lesión compatible con recidiva tumoral. Además la lesión ya conocida en riñón izquierdo no presentaba actividad y era estable respecto a TAC previo.
Comentado el caso en el Comité de Tumores se decidió remitir a centro de referencia donde se le realizó resección de segmento de pared torácica anterior izquierda junto con pared costal de 4.ª y 5.ª costilla izquierda, y posterior cobertura con prótesis de goretex y prótesis costales. A su vez también se realizó reconstrucción del defecto con colgajo dorsal ancho izquierdo. La anatomía patológica de la pieza informaba de un fragmento de 2,2cm de angiosarcoma de mama de alto grado, con bordes libres.
Como tratamiento adyuvante se optó por taxol semanal x 4 más gemcitabina.
Posteriormente se intervino de la lesión renal que resultó ser un carcinoma de células claras, de 4cm, grado 1, sin afectación de la cápsula renal ni fascia de Gerota. Bordes libres.
Actualmente la paciente está libre de enfermedad tras 26 meses.
DiscusiónLos SRI nunca han sido definidos de forma bien establecida. Los criterios generalmente aceptados para el diagnóstico propuestos por Cahan y modificados por Arlen et al.9,10 son:
- -
El tejido sobre el que asienta el tumor debe ser normal (genética y metabólicamente) antes de la exposición.
- -
Debe haber un periodo de latencia entre la radiación y la aparición del tumor, la existencia de tratamiento previo con radioterapia al menos 3 años antes del desarrollo del sarcoma.
- -
Que el sarcoma se origine dentro del campo de radioterapia.
- -
Confirmación mediante biopsia del tumor irradiado y el nuevo tumor.
- -
La existencia de una histología diferente entre el sarcoma y el tumor primario que requirió radioterapia.
La distancia temporal entre la exposición a la radiación y la aparición del sarcoma es el criterio principal que ha sido modificado por la mayor parte de los investigadores, y está entre 3-10 años. Aunque estudios más recientes tienden a que períodos de latencia inferiores pueden ser suficientes para confirmar el diagnóstico de SRI.
Para confirmar el diagnóstico es obligada la realización de biopsia con aguja gruesa, que permitirá distinguir el diagnóstico de sarcoma, de una recidiva de la neoplasia maligna previa y los cambios posquirúrgicos o posradioterápicos; además determinará el subtipo y el grado histológico del sarcoma.
Los SRI incluyen todos los subtipos histológicos de sarcoma, pero su frecuencia varía con respecto a la observada en los de novo. Los tipos histológicos varían en las distintas series, pero en conjunto, el más frecuente es el histiocitoma fibroso maligno (70%), que es el sarcoma más frecuente en la población general y caracterizado por su gran variedad de patrones histopatológicos, lo que dificulta su diagnóstico, clasificación y nomenclatura14; el 2.° tipo histológico más numeroso es el angiosarcoma (el intervalo medio de latencia es de 10 años, más corto que el intervalo que existe entre la aparición de linfedema y el desarrollo de un angiosarcoma- S. Stewart-Treves).
Los hallazgos mediante técnicas de imagen no son patognomónicos, y son difíciles de distinguir de una recidiva del tumor primario previo, no obstante, la RM y la TAC son las técnicas de imagen de elección en la evaluación y seguimiento, y para buscar una posible diseminación a distancia de la enfermedad.
Los factores pronósticos más importantes son diagnóstico precoz y tratamiento, una resección amplia con márgenes libres puede alcanzar una remisión prolongada.
Se mencionan entre los factores pronósticos negativos: el tamaño tumoral, el grado histológico y márgenes positivos tras resección. Con tasas de supervivencia a 5 años más baja que la de pacientes con sarcomas de partes blandas de novo.
Un reciente estudio del Memorian Sloan Kettering Cancer Center sugiere, mediante análisis multivariante ajustado a la edad, tamaño tumoral, profundidad de localización y el estado de los márgenes, que los SRI son per se un factor pronóstico asociado a una peor evolución comparado con los sarcomas convencionales. Su agresividad es independiente del tipo histológico y depende del grado tumoral y el estadio en el momento del diagnóstico; siendo la mayoría de alto grado (superior al 80% en la mayoría de las series), con extensas áreas de necrosis y un alto índice mitótico y de diagnóstico en estadios avanzados (elevado tamaño y profundidad de la lesión).
Debido al escaso número de casos recogidos en la literatura, es difícil definir el tratamiento más correcto.
El tratamiento de elección es la cirugía; sin embargo, muchas veces son tumores irresecables por su extensión o su localización profunda. Un gran tamaño tumoral y la presencia de márgenes de resección positivos tras la cirugía son los responsables de unas altas tasas de recidiva local (situada en torno al 45%) y de una corta supervivencia (a los 5 años de un 20-58%).
El estudio de las tres mayores series de casos de SRI reveló la dificultad en la obtención de márgenes quirúrgicos libres tras cirugía. Hecho que es importante ya que un margen quirúrgico positivo reduce la supervivencia a la mitad.
Además, la tendencia de los SRI a la localización central frente a la periférica conlleva una menor accesibilidad quirúrgica traducida en menos resultados de resección quirúrgica con márgenes libres que contribuye al mal pronóstico.
Destacar que la irradiación previa desdibuja los planos anatómicos y tumorales, impidiendo distinguir los verdaderos márgenes del tumor, y que la existencia de pseudocápsula no representa un margen de seguridad oncológica porque tiene evaginaciones tumorales. Esto refuerza aún más la necesidad de realizar resecciones amplias y agresivas, siendo en ocasiones necesaria la reconstrucción con cirugía plástica mayor, que iría desde la realización de injertos y colgajos de piel y transferencia libre de tejidos. Debido a la alta incidencia de SRI multifocal tras tratamiento del cáncer de mama, el cirujano podría considerar la extirpación completa del área irradiada y no únicamente del tumor.
La quimioterapia tiene un efecto limitado. Su utilización como neoadyuvancia es a fin de mejorar el control local de la enfermedad y erradicar la enfermedad metastásica subclínica, y de forma paliativa. La utilización de doxorrubicina como agente único, continúa siendo el tratamiento de elección en la mayoría de los casos de enfermedad metastásica.
El paclitaxel y las drogas antiangiogénicas como el sorafenib y el sunitinib, han demostrado alguna eficacia en el tratamiento de los angiosarcomas. La trabectidina es un nuevo compuesto que actúa inhibiendo el ciclo celular en el punto de transición de la fase G2 a la fase M, siendo una interesante opción en aquellos pacientes que recibieron quimioterapia con antraciclinas para otros tumores primarios como los linfomas o los carcinomas de mama.
La existencia de terapia previa puede reducir las posibilidades de tratamiento radioterápico, puesto que con frecuencia es imposible repetir su aplicación a altas dosis por su toxicidad, y no ha demostrado prolongar la supervivencia. La radioterapia tiene una eficacia limitada, pero ha sido utilizada para los casos en los que el tumor alcanza los bordes de la resección o cuando se desestima la cirugía, como ocurre en nuestro primer caso.
El pronóstico es desfavorable, con una supervivencia global a 5 años que oscila del 17-58%, significativamente menor que la de los sarcomas de partes blandas de novo.
Un seguimiento estrecho del paciente debe ser mantenido por su alto porcentaje de recidiva, recomendándose controles cada 3 meses los 2 primeros años y cada 6 hasta los 5 años.
ComentariosLos futuros estudios centrados en el análisis de las características de los tumores primarios, y del carcinoma de mama en particular, podrán ser de ayuda en la identificación de los factores que predisponen al desarrollo de un SRI, con el objeto de realizar una mejor selección de los pacientes que recibirán radioterapia.
Otro aspecto a investigar es el relativo al estudio genético del SRI, que podría arrojar alguna luz sobre los mecanismos responsables de la génesis de los sarcomas.
La cirugía con márgenes libres continúa siendo la primera opción terapéutica para la enfermedad localizada aunque con altas tasas de recidiva local y baja supervivencia.
Por último destacar que la mayor parte de los pacientes con cáncer reciben radioterapia y la importancia de esta en el desarrollo de un SRI décadas tras la administración de la la misma.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores han obtenido el consentimiento informado de los pacientes y/o sujetos referidos en el artículo. Este documento obra en poder del autor de correspondencia.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.