INTRODUCCIÓN
La rotura prematura de membranas en edad gestacional previable (RPMpv) --se entiende como previable antes de las 24 semanas de gestación-- es una complicación obstétrica muy infrecuente (menos del 1% de los casos)1 pero de manejo complejo. En aproximadamente un 60% de las RPMpv se producirá un aborto espontáneo en la primera semana de amniorrexis1. Sin embargo, a partir de la primera semana el cuadro clínico puede estabilizarse, aunque existe el riesgo de complicaciones maternas y de una elevada morbimortalidad perinatal. La mortalidad neonatal es del 33-54% y principalmente se relaciona con la prematuridad, la sepsis y el desarrollo de hipoplasia pulmonar1.
Los principales contribuyentes al mal resultado perinatal en el caso de RPMpv son la hipoplasia pulmonar, la severidad y persistencia del oligoamnios, y la prematuridad2-5. La hipoplasia pulmonar letal raramente ocurre en roturas de membranas más allá de las 24 semanas, probablemente porque la fase crítica del desarrollo pulmonar (fase canalicular) tiene lugar entre las semanas 17 y 24 de gestación3. La hipoplasia pulmonar va a depender de la edad gestacional (EG) en el momento de la amniorrexis, del oligoamnios severo y persistente, y del intervalo desde la amniorrexis hasta el momento del parto2-5. El oligoamnios severo se relaciona con un peor pronóstico de la gestación2 y la prematuridad va a ser un factor crucial en la evolución del recién nacido. En el seguimiento de los recién nacidos a los 2 años de vida, el riesgo de secuelas neurológicas mayores es del 6-44%6. No obstante, no hay suficiente bibliografía sobre los resultados neurológicos a largo plazo y, en general, vendrán marcados por la presencia de infección y por el grado de prematuridad en el momento del parto.
No existe consenso sobre el manejo obstétrico óptimo de dichas gestaciones ni referencia en la bibliografía acerca de los riesgos y beneficios de la opción expectante domiciliaria frente al ingreso hospitalario continuado hasta el momento del parto. Los malos resultados perinatales descritos en la bibliografía, con una supervivencia global de entre el 40 y el 60%2,5-15 podrían justificar la interrupción legal del embarazo (ILE). Sin embargo, los avances en el manejo perinatal, como el uso antenatal de corticoides16 y antibióticos17 y la terapia posnatal con surfactante, estrategias de ventilación más efectivas y la mejora de la nutrición neonatal, han mejorado discretamente la supervivencia de los recién nacidos.
El objetivo de este estudio será describir los resultados perinatales de las RPMpv en nuestro centro. Ello puede ser de utilidad en el manejo de esta complicación y para asesorar de manera objetiva a los padres sobre el pronóstico de estas gestaciones.
PACIENTES Y MÉTODOS
Se incluyeron en el estudio las gestaciones con RPM antes de las 24,0 semanas de gestación. El diagnóstico de RPM se realizó mediante exploración vaginal con espéculo estéril en la que se evidenció hidrorrea y se comprobó la presencia de líquido amniótico en la vagina mediante determinación de pH alcalino. En caso de no presentar hidrorrea evidente en el momento de la exploración o pH dudoso, se evaluó ecográficamente la columna máxima de líquido amniótico (Cmáx) (se considera oligoamnios una Cmáx < 2 cm) y en caso de persistir la duda diagnóstica, se realizó amniocentesis con instilación de fluoresceína en la cavidad amniótica, y se comprobó la salida de colorante por la vagina antes de 1 h. Se excluyeron las gestaciones que tras 1 semana de ingreso abortaron espontáneamente o presentaron signos de infección intraamniótica, y las que presentaron un cuadro de hidrorrea autolimitada relacionada con un procedimiento invasivo.
La EG se estableció en función de la última menstruación o por ecografía de primer trimestre en caso de discordancia superior a 1 semana. En todos los casos, se realizó una medición ecográfica de Cmáx, hemograma, PCR y cultivos endocervicales para descartar infección subyacente. La analítica se repitió de forma diaria los primeros 3 días del ingreso; cada 48 h, el resto de la semana, y una vez por semana hasta el momento del parto si no aparecían cambios clínicos.
Se ingresó a las pacientes con reposo absoluto (respetando la deambulación para higiene personal) durante 1 semana y cobertura antibiótica intravenosa durante 5 días (ampicilina 1 g/6 h y gentamicina 80 mg/8 h). En caso de presentar un cultivo positivo, se confirmó mediante antibiograma la correcta cobertura antibiótica, y se reajustó la pauta en los casos necesarios.
A la semana del ingreso hospitalario, las pacientes estables clínica y analíticamente y con oligoamnios o hidrorrea persistente fueron incluidas en nuestra serie. A las pacientes con Cmáx < 1 cm de forma persistente en el control semanal se les propuso: a) actitud no intervencionista (conducta expectante), o b) amniopatch18. A las pacientes que presentaron Cmáx ≥ 1 cm se les propuso inicialmente conducta expectante. El comité de interrupciones de nuestro centro aceptó la ILE ante la solicitud de la paciente cuando la Cmáx fue persistentemente < 2 cm.
Las pacientes que decidieron proseguir la gestación, iniciaron deambulación en las siguientes 24-48 h. Ante la ausencia de cambios clínicos, se dieron de alta y se siguieron ambulatoriamente mediante un control clínico, analítico y ecográfico semanal hasta la semana 26-27 de gestación, en la que ingresaron de forma electiva para control clínico y cardiotocográfico diarios, y analítica y seguimiento ecográfico 2 veces por semana.
Si había cambios clínicos (aumento o cambios en el flujo vaginal, dinámica uterina, etc.) se repitieron los cultivos, cada 2 semanas si la paciente había presentado algún cultivo positivo anterior o cada 5-6 semanas ante la ausencia de cambios clínicos. Sólo se reinstauró tratamiento antibiótico ante la evidencia de algún cultivo positivo. En caso de presencia de estreptococo beta, Streptococcus agalactiae, se administró además tratamiento intraparto según protocolo habitual.
Se administró betametasona (12 mg intramuscular/24 h/2 días) para maduración pulmonar fetal a partir de las 24 semanas y dosis de recuerdo si había sospecha de parto inminente (hasta un máximo de 5 dosis). Se instauró tratamiento tocolítico intravenoso (desde el año 2003, atosiban para intolerancia al ritrodine s/o gestaciones gemelares) en las pacientes que presentaron contracciones uterinas después de la semana 24 sin criterios clínicos de corioamnionitis o desprendimiento de placenta. Se utilizó ritodrine intravenoso de primera elección, y en caso de intolerancia (taquicardia materna, palpitaciones, opresión torácica, etc.), nifedipino como tocolítico de primera línea y se reservó, desde el año 2003, atosibán para gestaciones gemelares y/o antecedentes de diabetes insulinodependiente y/o patología cardíaca. Se dejó evolucionar el parto en las pacientes que presentaron dinámica uterina incoercible y se indujo el parto ante signos de infección o tras objetivar fallecimiento fetal. Se finalizó la gestación ante la sospecha de pérdida del bienestar fetal después de la semana 24.
En caso de persistir hidrorrea a lo largo de la gestación, se practicó una amniocentesis para comprobar madurez pulmonar (Abbott TDx-FLM assay) en la semana 31-32, y se finalizó la gestación de forma electiva en los casos en los que se confirmó madurez pulmonar (TDx-FLM ≥. 40 mg/ml). En caso de valores inferiores, se administró una nueva dosis de rescate de 12 mg de betametasona y se indicó la finalización de acuerdo con los neonatólogos en un intervalo ≤ 1 semana.
Las pacientes en las que la clínica de hidrorrea cedió espontáneamente, con controles ecográficos de líquido amniótico repetidamente normales, se trataron como gestaciones normales y se dejó evolucionar el parto a término.
Se estudiaron las variables maternas: edad, paridad, existencia de algún procedimiento invasivo, EG en el momento de la amniorrexis, lapso de tiempo desde la RPM hasta el parto y finalización de la gestación por sospecha o evidencia clínica de corioamnionitis. Se estudiaron las variables fetales: peso, EG al parto, diagnóstico de hipoplasia pulmonar y presencia de deformidades esqueléticas. Se cuantificó el número de fallecimientos fetales y neonatales así como las secuelas a medio plazo (máximo seguimiento: 3 años). En las gestaciones gemelares se analizaron los resultados del recién nacido con rotura de la membrana amniótica.
El diagnóstico anatomopatológico de hipoplasia pulmonar se basó en una ratio peso pulmonar/peso corporal < 0,012. En neonatos vivos, el diagnóstico de hipoplasia se realizó por criterios radiológicos que incluían pulmones pequeños, con diafragmas elevados y parrilla costal reducida.
El diagnóstico de corioamnionitis se realizó ante la asociación de 2 o más de los siguientes criterios: fiebre materna (≥ 38 °C), taquicardia fetal o materna, irritabilidad uterina, leucocitosis > 15.000, alteración bioquímica o cultivo positivo de líquido amniótico o líquido amniótico maloliente o purulento.
Las pruebas de la *2, la t de Student y la U de Mann-Whitney se utilizaron para la comparación de variables cualitativas, cuantitativas con distribución normal y cuantitativas con distribución no normal, respectivamente. El nivel de significación se estableció en el 5% bilateral y los datos se analizaron mediante el programa estadístico SPSS 10.0.
RESULTADOS
Entre diciembre de 2000 y julio de 2004 se incluyó a 50 pacientes con el diagnóstico de RPM antes de las 24 semanas de gestación que no abortaron espontáneamente tras 1 semana de ingreso y que presentaban oligoamnios o hidrorrea persistente.
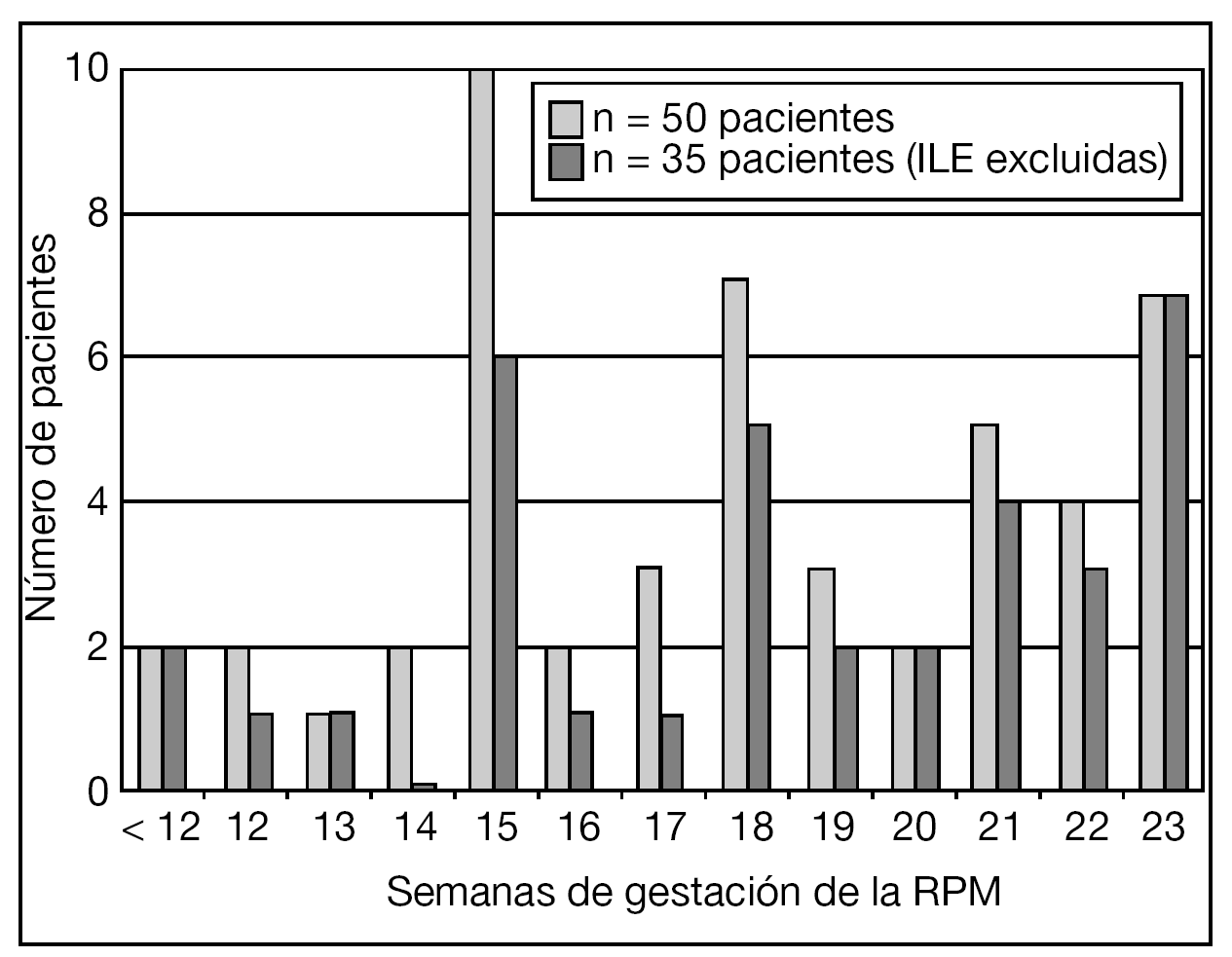
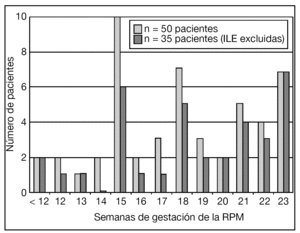
La distribución de la EG en el momento de la RPM de las pacientes incluidas en el estudio se muestra en la figura 1. La gestación era gemelar en 5 de estas pacientes: en 3 se objetivó RPM de la bolsa del primer gemelo y en 2, del segundo. En 23 (42%) pacientes había el antecedente de procedimiento invasivo: 9 amniocentesis, 11 biopsias coriales y 3 cerclajes cervicales "en caliente". En 6/16 (37,5%) pacientes con antecedente de procedimiento invasivo y que prosiguieron la gestación, el intervalo desde el procedimiento hasta la RPM fue ≥ 2 semanas.
Figura 1.Distribución de la edad gestacional (EG) en el momento de la rotura prematura de membranas (RPM) de las pacientes incluidas en el estudio. ILE: interrupción legal del embarazo.
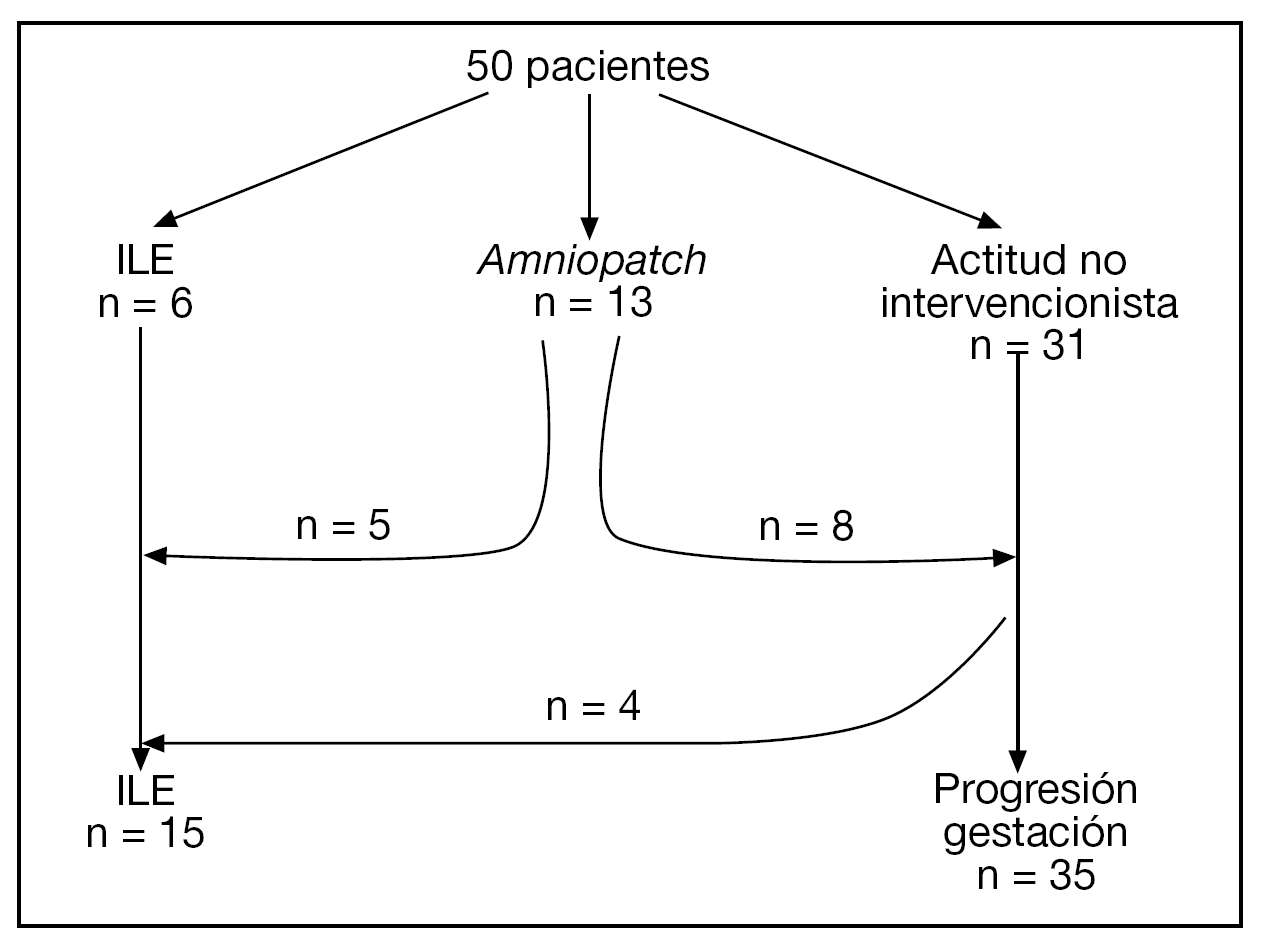
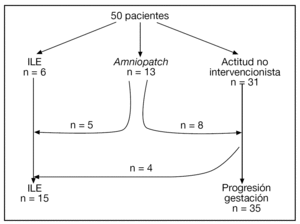
El diagrama de flujo de las pacientes se muestra en la figura 2. Ante la persistencia de Cmáx < 2 cm, 15/50 (30%) pacientes optaron por una ILE. No hubo diferencias significativas en cuanto a las características basales entre las gestaciones que se acogieron a ILE y las que prosiguieron la gestación, excepto en cuanto a la Cmáx (tabla 1).
Figura 2.Diagrama de flujo de las pacientes incluidas en el estudio.
En 13 (26%) casos, las pacientes optaron por un amniopatch. Existía el antecedente de un procedimiento invasivo en un 53,8% (7/13) y se consiguió recuperar Cmáx ≥ 1 cm en 7/13 (53,9%) casos. En 6/13 casos se produjo un fallecimiento anteparto (entre la 12,5 y la 25,1 semanas) y 2/13 casos alcanzaron las 30 semanas de gestación. En 1 caso se finalizó la gestación a las 30,3 semanas por el hallazgo de un patrón patológico en el registro cardiotocográfico. Tras cesárea urgente, se obtuvo un recién nacido de 1.100 g con Apgar 1 y 2 al minuto y a los 5 min, respectivamente, y pH de arteria de 7,06. El neonato murió a las 24 h de vida por hipoplasia pulmonar y fallo multiorgánico. En el segundo caso se finalizó la gestación a las 30,6 semanas ante la sospecha clínica de corioamnionitis. El seguimiento neurológico es normal a los 4 meses de vida.
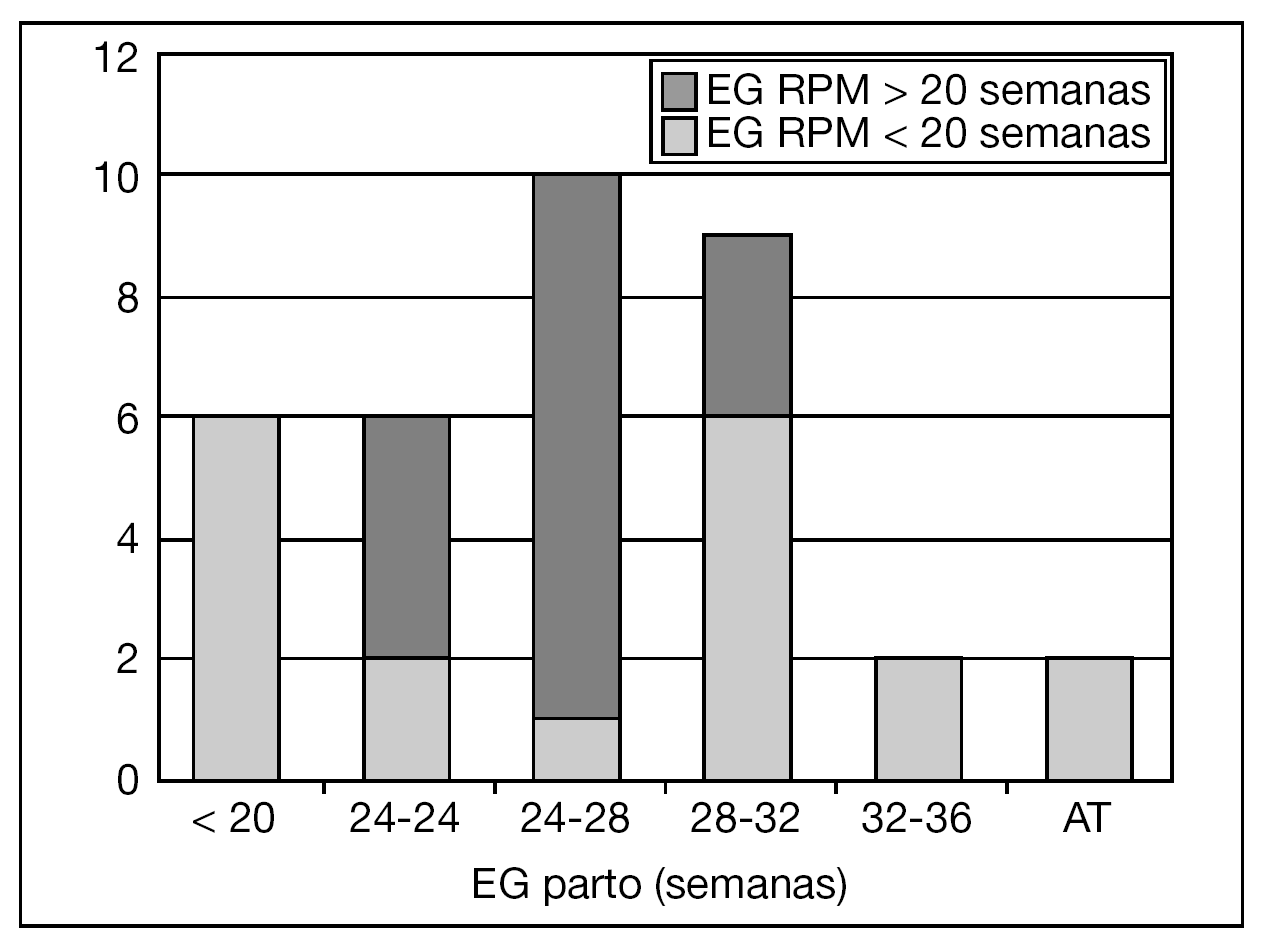
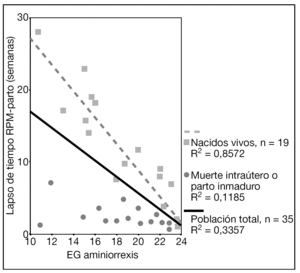
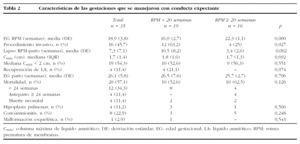
Los resultados perinatales de los 35 casos que rechazaron la ILE y decidieron proseguir la gestación, con la diferenciación de si la RPM tuvo lugar antes o después de las 20 semanas de gestación, se muestran en la tabla 2. La distribución de la EG en el momento del parto de estas 35 pacientes se muestra en la figura 3. El lapso de tiempo entre la RPM y el parto mostró una relación inversa y significativa (R = 0,579; p = 0,01) con la EG de la amniorrexis (fig. 4). No hubo diferencias en los resultados perinatales entre las gestaciones con RPM espontánea o iatrogénica, excepto por la EG en la RPM (20,2 ± 3,1 y 17,2 ± 3,1, respectivamente; p = 0,02). En 12 (34,3%) pacientes se indicó tocólisis en algún momento de la gestación y en 8 (22,9%) hubo la sospecha clínica o analítica de corioamnionitis, lo cual indujo a la finalización de la gestación. En 4 (11,4%) casos cedió el cuadro clínico de hidrorrea y la gestación se dejó evolucionar, y en 2 el parto fue ≥ 37 semanas.
Figura 3. Distribución de la edad gestacional (EG) en el momento del parto de las 35 pacientes que prosiguieron la gestación. AT: A término.
Figura 4. Gráfica que muestra la relación entre la edad gestacional (EG) de la amniorrexis y el lapso de tiempo entre la rotura prematura de membranas (RPM) y el parto.
El peso y la EG al parto de los 19 casos de recién nacidos vivos se muestran en la tabla 3. El lapso de tiempo entre la RPM y el parto también mostró una relación inversa y significativa (R = 0,925; p = 0,01) con la EG de la amniorrexis (fig. 4). La vía del parto fue la cesárea en 13/19 (68,4%) gestaciones. No hubo morbilidad materna relevante.
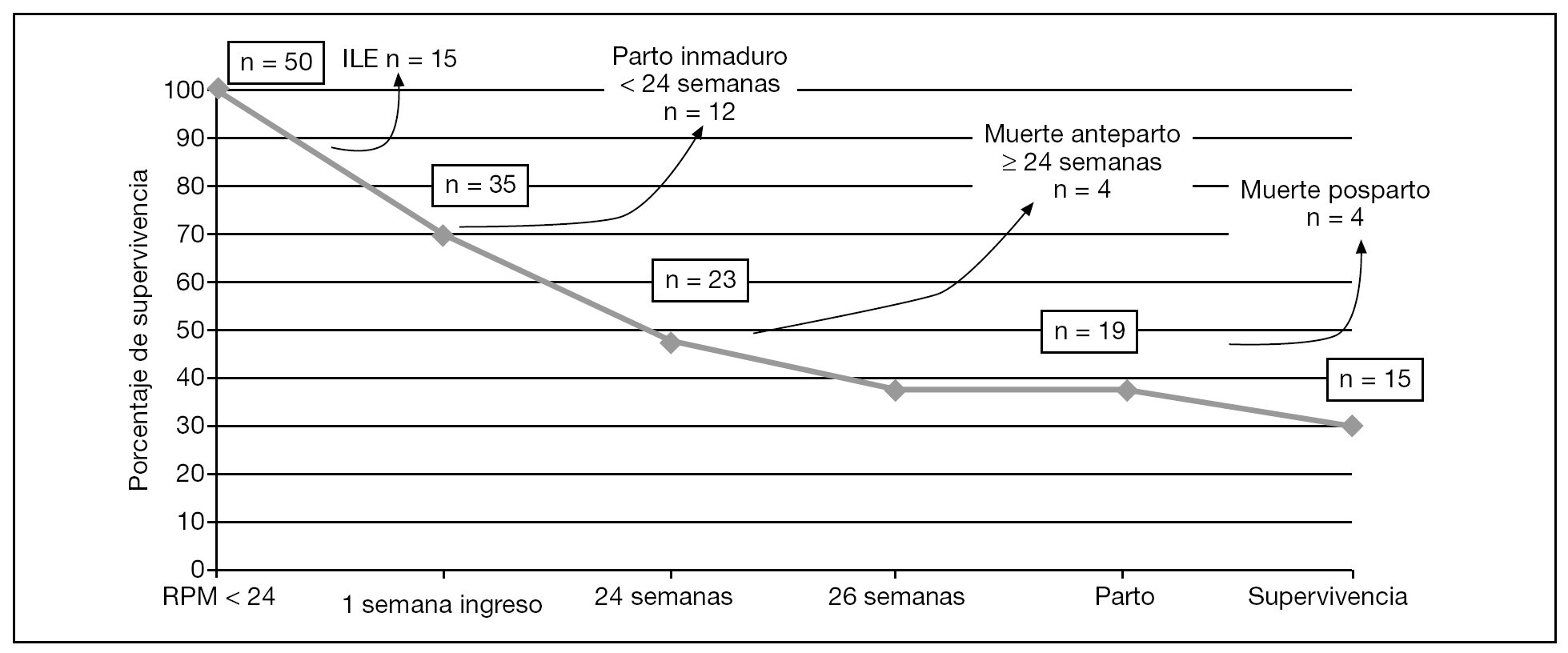
La representación esquemática de la supervivencia de estas 35 gestaciones se muestra en la figura 5. Las 4 muertes anteparto se dieron entre las 24,2 y 25,1 semanas de gestación. En 3 casos de muerte neonatal, el diagnóstico anatomopatológico confirmó hipoplasia pulmonar (4/35; 11,4%) y en 1 el diagnóstico fue clínico. Tres de los 4 casos de hipoplasia pulmonar presentaron de forma mantenida en las diferentes exploraciones ecográficas columnas de líquido amniótico < 2 cm. En los 3 casos de muerte posnatal inmediata, la RPM se produjo antes de las 22 semanas.
Figura 5. Representación esquemática de la supervivencia de las pacientes que se incluyeron en el estudio. ILE: interrupción legal del embarazo; RPM: rotura prematura de membranas.
El pronóstico actual de las gestaciones complicadas con RPMpv sigue siendo globalmente malo. La supervivencia neonatal en nuestra serie fue del 42,9% (15/35) y del 65,2% (15/23) cuando la gestación alcanzó las 24 semanas. El porcentaje de supervivencia de los nacidos vivos fue de un 78,9% (15/19). Únicamente 1 recién nacido (1/35, 2,9%) presentó deformaciones esqueléticas (luxación congénita de rodilla) relevantes.
DISCUSIÓN
La supervivencia de las gestaciones complicadas con RPM precoz oscila entre el 40 y el 60%. La supervivencia global en nuestra serie es del 42,9%. Cabe destacar, sin embargo, que en la bibliografía es difícil encontrar datos comparables a nuestro estudio, puesto que en la mayoría de los trabajos se incluyen, de manera global, los resultados de gestaciones en las que la RPM se produjo antes de la semana 26 o 281,5-15 y cuyo pronóstico difiere notablemente de la RPMpv. En las series que presentan resultados de pacientes con RPM anterior a las 25 semanas, la supervivencia es de alrededor de un 40-50%5-15, comparable a la presentada en este trabajo, y en el grupo de gestaciones que sobrepasan las 24 semanas, nuestros resultados, con una supervivencia del 65,2% (15/23), son también similares a los presentados por otros autores5,8.
En nuestra serie, el 30% de pacientes solicitaron una ILE por presentar un oligoamnios severo y persistente. Cinco de estas pacientes presentaron Cmáx < 1 cm. Dado que la bibliografía refiere una mortalidad del 91%12 en las gestaciones con RPM anterior a las 25 semanas y oligoamnios < 1 cm durante un lapso de tiempo de 14 días, cabe pensar que, si se hubieran dejado a su evolución natural, este grupo habría presentado un 90% de mortalidad, sin modificar sustancialmente el porcentaje de supervivencia.
Respecto a la utilización del amniopatch, nuestra tasa de supervivencia ha sido muy baja (1/13, 7,7%), aunque el porcentaje de éxito, se entiende como tal recuperar columnas de líquido amniótico >= 1 cm, es del 53,9% (7/13). La bibliografía presenta resultados mucho más exitosos, de hasta un 90,9% de éxito en el sellado de membranas y un 42,8% de supervivencia19. Estas diferencias pueden explicarse por dos factores: por una parte, en nuestra serie de casos, el amniopatch se practicó de forma indiscriminada cuando la RPM fue espontánea o iatrogénica. La bibliografía reciente sugiere que el amniopatch es una técnica ineficaz en las amniorrexis espontáneas. Esto se debe posiblemente a la localización y severidad del defecto, y por la presencia de inflamación, infección u otros procesos patológicos que interfieren en el mecanismo de "sellado" de las membranas18,19. A la luz de la bibliografía, en el momento actual se ha dejado de realizar amniopatch en RPM espontáneas. Por otra parte, esta técnica se aplica en los casos más extremos y de peor pronóstico, con oligoamnios severo < 1 cm durante al menos 7 días. Ello también puede explicar que nuestros resultados sean peores que cuando los criterios de aplicación de la técnica son menos restrictivos.
En el análisis del grupo de 35 gestaciones que optaron finalmente por una conducta expectante, cabe destacar la relación inversa entre la EG de la amniorrexis y el lapso de tiempo hasta el parto. El lapso de tiempo fue significativamente mayor en las gestaciones con RPM previa a la semana 20. Este grupo presento además una supervivencia mayor que, seguramente debido al limitado número de casos, no fue estadísticamente significativa. Estos hallazgos coinciden con los referidos por otros autores2,5, que refieren que el período de latencia tiene un efecto protector de la mortalidad perinatal, pero discrepa de otros que no encuentran correlación entre la EG de la amniorrexis y el período de latencia8. Por otra parte, aunque en el grupo de RPM antes de las 20 semanas existe un número significativamente mayor de procedimientos invasivos, ello no explica los mejores resultados, puesto que no se observaron diferencias significativas cuando se compararon los resultados de las RPM espontáneas y de las iatrógenas. Tampoco explican estos mejores resultados diferencias en la cantidad de líquido amniótico, puesto que Cmáx fue similar en ambos grupos. Estos resultados son contrarios a los publicados por diferentes autores, en los que se muestra una mayor supervivencia cuando la RPM se produce en EG más tardías2,8. Sin embargo, estas últimas series contienen un número muy bajo de pacientes por debajo de la semana 20, mientras que en nuestra serie, un 54% (19/35) de las pacientes presentaron la RPM antes de la semana 20. Cabe pensar que en este grupo de pacientes, la etiología de la RPM pueda ser diferente del grupo en que la RPM es posterior a las 20 semanas, donde probablemente la etiología infecciosa tendría un papel más relevante y probablemente condiciona un final del embarazo más cercano.
En cuanto al grupo de recién nacidos vivos, cabe destacar un 31,6% de prematuridad muy extrema y un 73,7% en los que la EG al parto fue < 32 semanas. Puesto que la necesidad de cuidados intensivos neonatales para mejorar el pronóstico neonatal va a ser obligado en la mayoría de los casos, una vez se alcance la viabilidad, estas gestaciones deben ser controladas en centros que dispongan de esta infraestructura.
El diagnóstico de hipoplasia pulmonar en nuestra serie fue de un 11,4% (4/35) y es comparable al referido en la bibliografía, donde oscila entre el 1,1 y el 28%2-6,9,10,12-14 dependiendo de la población estudiada y de los criterios utilizados para su definición. Aunque la hipoplasia pulmonar no ha resultado ser una complicación frecuente, cabe remarcar que probablemente algunas gestaciones que fueron finalizadas mediante ILE hubieran presentado potencialmente una hipoplasia pulmonar. En nuestra serie, 3 de los 4 casos se presentaron en gestaciones en las que Cmáx fue persistentemente < 2 cm, y éste es el valor que utiliza la mayoría de autores para definir el oligoamnios severo5. En la serie de Vergani et al, el 100% de casos de hipoplasia pulmonar presentaban oligoamnios < 2 cm, por lo que sugieren como punto de corte la Cmáx de 2 cm para la predicción de hipoplasia pulmonar, con una sensibilidad y valor predictivo negativo del 100%5.
La prevalencia de la corioamnionitis en nuestra serie es del 22,9%, mientras que en la bibliografía oscila entre el 25 y el 46%6,11. El uso sistemático de antibióticos de amplio espectro, utilizados en nuestra serie, puede explicar estas diferencias, puesto que la mayoría de autores no refieren profilaxis antibiótica sistemática o sólo cobertura de Streptococcus agalactiae3,4,6,8,9,11-13. Los antibióticos reducen el porcentaje de infección materna, retrasan el parto, reducen el porcentaje de infecciones neonatales, el riesgo de distrés respiratorio y secuelas neurológicas mayores así como la mortalidad antenatal y neonatal17. Por ello, en las últimas series, la mayoría de autores utilizan antibióticos durante la primera semana de amniorrexis, cuando el riesgo de infección es mayor5,9-11,14. Otro aspecto a destacar es la baja frecuencia de corioamnionitis clínica en nuestro grupo, aunque se administraron corticoides sistemáticamente a todas las pacientes que superaron las 24 semanas y 3 o más dosis de corticoides en un 22,9% (8/35) de casos. Diferentes autores han sugerido un aumento del riesgo de corioamnionitis en las gestaciones complicadas con RPM si se utilizan de manera sistemática dosis repetidas de corticoides. Lee et al refieren un 49% de corioamnionitis en el grupo en que se utilizaron dosis repetidas y un 31% en el que se administró una tanda única16, porcentajes que se hallan muy por encima de nuestra cifra total de corioamnionitis (23%). Sin embargo, a la luz de la bibliografía reciente, en el momento actual se tiende a ser todavía más restrictivos en la utilización de dosis repetidas de corticoides en este grupo de pacientes. Únicamente se utilizan dosis de recuerdo ante la desestabilización del cuadro (aparición de dinámica uterina, metrorragia) que sugiera una finalización inminente.
A pesar de que la mayoría de gestaciones se mantuvieron con líquido amniótico reducido a lo largo de la gestación, cabe destacar el bajo porcentaje de deformaciones esqueléticas resultantes. En nuestra serie sólo se observó un caso de luxación congénita de rodilla (1/35; 2,9%), lo cual es concordante con la bibliografía donde la mayoría de autores refiere un porcentaje muy bajo de deformaciones, entre el 0 y el 3,7%3,5,6,9-11,13. Sólo un autor refiere un porcentaje mayor, del 25%, sin que se detalle el tipo de lesiones resultantes12.
A modo de conclusión, el pronóstico actual de las gestaciones complicadas con RPMpv sigue siendo globalmente malo. Sin embargo, en la información dirigida a los padres, cabe diferenciar el pronóstico dependiendo de las semanas que alcance la gestación. Se excluyen las gestaciones con peor pronóstico susceptibles de ILE y una vez alcanzada la viabilidad, la supervivencia es del 65,2% y de un 78,9% para los nacidos vivos. El porcentaje de alteraciones esqueléticas es muy bajo (2,9%) y sin secuelas neurológicas mayores relevantes. No obstante, se debe ser cautos a la hora de valorar los resultados a largo plazo ya que el seguimiento de algunos de estos neonatos es aún corto en nuestra serie.