En un relativamente elevado porcentaje de los casos en que se observan diferentes complicaciones obstétricas en el embarazo, existe algún tipo de malformación mülleriana tras la causa de estas complicaciones. Diferentes estudios han tratado de establecer una incidencia de estas anomalías en la población con el fin de poder tener un control más claro sobre su impacto reproductivo. Sin embargo, al hablar de malformaciones anatómicas en el tracto genital femenino nos encontramos ante una gran variedad de anomalías, en las cuales se observan diferentes grados de impacto reproductivo, desde una gran propensión al aborto recurrente en diferentes fases del embarazo hasta casos en que las mujeres afectadas son completamente asintomáticas y fértiles. En esta revisión hablaremos acerca del pronóstico reproductivo que presentan las diferentes clases de malformaciones müllerianas, así como de su origen, diagnóstico y posibles tratamientos.
A significant percentage of the patients with obstetric complications have a type of abnormality known as Müllerian malformations. Many studies have tried to establish the incidence of these abnormalities to determine their impact on human reproduction.
However, anatomical malformations of the female genital tract encompass a wide variety of anomalies, with distinct impacts on reproduction, ranging from a high propensity to recurrent abortion in different phases of pregnancy to a complete absence of symptoms and complete fertility. The present review summarizes the reproductive prognosis of Müllerian malformations, as well as the origin, diagnosis and treatment of these entities.
Las denominadas malformaciones müllerianas son un grupo de anomalías congénitas que resultan de alteraciones en el desarrollo embrionario del conducto de Müller que posteriormente originará todo el aparato urogenital femenino y que, por tanto, afectan a los tubos mesonéfricos. Esas alteraciones pueden deberse a un desarrollo insuficiente del conducto de Müller, a una formación anómala de éste o a una fusión incompleta de los tubos mesonéfricos.
Las causas que dan lugar a estas malformaciones fueron objeto de estudio durante años y se ha observado un patrón poligénico de herencia1,2, además de posibles efectos ambientales, como la exposición durante el desarrollo embrionario a radiaciones ionizantes, infecciones intrauterinas o tóxicos de efecto teratogénico, como el dietilbestrol (DES)3.
Muchas pacientes que presentan problemas de infertilidad, abortos recurrentes y diversas complicaciones obstétricas presentan algún tipo de malformación mülleriana3,4. En estas pacientes suelen presentarse problemas de fertilidad a causa de la consecuente hipovascularización del septo, disminución de la cavidad uterina y aumento de su irritabilidad. Es conocido que la fisiopatología de los trastornos de reproducción en pacientes con malformaciones uterinas incluye: a) un defecto de la vascularización del tabique que impediría una correcta implantación y el buen desarrollo del cigoto; b) constricción de la cavidad uterina que dificultaría un desarrollo normal y adecuado del embarazo; c) la incompetencia cervicoístmica que obstacularizaría el mantenimiento de una correcta gestación; d) la presencia de una mayor decidualización endometrial, y e) la pérdida de la masa muscular miometrial4.
Sin embargo, se ha visto que el hecho de que una mujer tenga algún tipo de malformación mülleriana no conlleva que necesariamente presente problemas de infertilidad5. Así, debido al hecho de que mujeres que pueden ser portadoras de algún tipo de malformación mülleriana pueden ser, a la vez, clínicamente fértiles y completamente asintomáticas de su anomalía, sumado al hecho de la inexactitud diagnóstica, hasta ahora ha supuesto un gran reto poder abarcar la incidencia real de estas malformaciones en la población en general.
Diversos estudios han intentado determinar la incidencia real de estas anomalías, tanto en mujeres infértiles como fértiles, así como en la población femenina en general, y se ha obtenido resultados dispares. Sin embargo, parece ser que la prevalencia de estas anomalías está en torno al 3% en la población de mujeres con problemas de fertilidad y alrededor del 1% en la población femenina en general6–12.
En este artículo hablaremos acerca de los diversos tipos de malformaciones müllerianas que se han clasificado según la American Society Reproductive Medicine (ASRM)13, así como de su incidencia, métodos diagnósticos, posibles tratamientos e impacto reproductivo que cada una conlleva.
EMBRIOLOGÍA DEL CONDUCTO DE MÜLLERLos sistemas reproductores masculino y femenino son idénticos hasta la sexta semana de gestación, ya que ambos están formados por un par de tubos paramesonéfricos o de Müller, y un par de mesonéfricos o de Wolff. Es entonces cuando, en ausencia del gen SRY (sex-determining región Y) del cromosoma Y, que transcribe la hormona antimülleriana que induce la desaparición de los conductos de Müller, los conductos de Wolff degeneran, y se mantienen sólo los de Müller en las mujeres. Paralelamente a la degeneración de los conductos de Wolff, los de Müller se desarrollan bidireccionalmente, dando su parte proximal unas primitivas trompas de Falopio y la parte distal conectando, por un lado, con la uretra y, por otro, formando lo que será la cavidad vaginal y el útero, separadas ambas por un septo14.
En la semana nueve de gestación, el útero se encuentra dividido por un septo, que degenera gracias a un proceso apoptótico inducido por el gen bcl2 (B-cell lymphoma)15. Se ha observado que la ausencia de este gen en las células septales en hembras de ratón knockout produce la prevalencia de este septo en el adulto, y esto podría explicar parte de la etiología del útero septado en humanos. Por otro lado, existen dos teorías acerca de la regresión septal. La primera propone una regresión unidireccional, en la que el septo retrocede en sentido caudal-craneal, mientras que la segunda habla de una regresión bidireccional en la que el proceso se da simultáneamente en ambas direcciones, caudal y craneal16.
Ya en la semana doce de gestación se da por finalizada la formación de la cavidad uterina. Por otra parte, el canal vaginal se sigue alargando hasta el tercer o quinto mes de desarrollo, cuando interfiere con los conductos urogenitales y se forma el himen17–19.
Debido a su origen común, se han asociado diferentes anomalías en el desarrollo del sistema urogenital con malformaciones uterinas y vaginales, y viceversa. Por su parte, los ovarios derivan de las crestas gonadales, por lo que malformaciones en el útero o la vagina no suelen estar asociadas a anomalías en el desarrollo ovárico19. Lo mismo ocurre con las trompas de Falopio, que derivan de la parte proximal del conducto de Müller, a diferencia del útero, que deriva de la parte distal.
CLASIFICACIÓN DE LOS DIFERENTES TIPOS DE MALFORMACIONES MÜLLERIANASLa primera clasificación de las malformaciones müllerianas que se propusieron, en 1979, Buttram y Gibbons20 se basó en la agénesis e hipoplasia y posibles defectos en la fusión vertical y lateral del canal uterino, con el fin de agruparlas en clases clínicas que tuvieran similares manifestaciones clínicas, tratamiento y prognosis21. Sin embargo, esta clasificación fue revisada y modificada en 1988 por un comité de la ASRM. De esta forma, la clasificación de la ASRM en 7 clases es la más empleada clínicamente en la actualidad para agrupar los diferentes tipos de malformaciones del conducto de Müller (fig. 1).
Sin embargo, esta clasificación es sólo orientativa desde el punto de vista clínico y pueden existir casos en que la malformación observada no se ajuste por completo a una sola clase, sino presente aspectos de más de una clase en concreto. Es en estos casos en los que la clasificación de la ASRM pierde interés, es más preciso hacer una descripción particular de la anomalía observada en lugar de intentar encuadrarla en una de las clases preestablecidas.
TÉCNICAS DIAGNÓSTICAS Y TERAPÉUTICASRespecto a las técnicas diagnósticas que se emplean para la detección de estas anomalías, la técnica más empleada suele ser la histerosalpingografía (HSG), por su rapidez y economía. Sin embargo, esta técnica da lugar a dudas a la hora de diagnosticar un útero septado o bicorne, además de conllevar una exposición a la radiación ionizante de los rayos X22,23.
De esta forma, la alternativa a la que más se acude en la diagnosis es la histerosonografía, que se realiza en la fase secretora del ciclo menstrual por la introducción de una solución salina en la cavidad uterina para aumentar el contraste. Aun así, esta técnica sigue teniendo el mismo inconveniente que la anterior en cuanto a que sólo permite delimitar la cavidad uterina, lo que da lugar a confusión en casos de útero septado o bicorne24–26.
La tercera técnica que se emplea en la diagnosis es la resonancia magnética (RM), que ofrece una imagen nítida del aparato reproductor femenino y permite diagnosticar, de una manera increíblemente efectiva, cualquier problema anatómico, pero es realmente cara25,27,28.
Por fin, la última técnica que se puede emplear en el diagnóstico de estas anomalías, en caso de no poder optar a la RM, suele ser la laparoscopia, que también es muy efectiva, pero se trata de una técnica mucho más invasiva29.
Tanto la HSG30–32 como la ecografía transvaginal siguen teniendo vigencia para su diagnóstico preciso, y no se necesitan otros métodos más caros y complicados. El tratamiento es siempre quirúrgico. La vía abdominal, con la clásica metroplastia de Strassman modificada, ha quedado reservada sólo para los úteros didelfos o bicornes no unidos; la cirugía por excelencia es la histeroscópica que, utilizando un anza de corte, secciona el tabique y une ambas cavidades. Esta cirugía es ambulatoria; a las pocas horas el paciente esta en su casa y se reintegra a su actividad diaria al día siguiente de su intervención. Si bien esto es una gran ventaja de la cirugía histeroscópica, la mayor de ellas es que el útero mantiene su integridad y, de esta manera, preserva su capacidad para albergar un embarazo sin riesgos prácticamente al mes siguiente de haber sido operado. Es por eso que creemos que ante una intervención relativamente sencilla, sin mayores riesgos para la paciente, con mínimo impacto en el entorno de la mujer, debería, en primer lugar, implementarse de rutina y de ninguna manera hacer uso de otra técnica invasiva y, en segundo lugar, convendría que se implementara en forma profiláctica en aquellas mujeres jóvenes a las que se les diagnostica una malformación uterina por casualidad y que aun no están con deseo de embarazarse33.
Así pues, encontramos en la histeroscopia, además de una prueba diagnóstica, un tratamiento que no conlleva las complicaciones de la metroplastia.
Años atrás, el diagnóstico de estas pacientes con problema de fertilidad debido a malformaciones uterinas se realizaba con técnicas tradicionales, como la corrección abdominal de Strassman, Jones o Tompkins. Normalmente, estos procedimientos precisan realizar una incisión abdominal y de las paredes uterinas con anestesia general, que normalmente requiere de una larga estancia en el hospital y un período de recuperación34.
Los nuevos procedimientos endoscópicos no se usan solamente para evaluar el tipo y el tamaño de la fusión de los conductos müllerianos, sino también como tratamiento. De modo que se puede quitar el septo de una manera relativamente fácil sin tener que recurrir a la cirugía mayor34,35.
La metroplastia abdominal es el método más usado para la corrección del útero bicorne o didelfo. La técnica de Strassman aún sigue siendo la más utilizada para la unificación de los cuernos uterinos en estos casos35. La histeroscopia releva la metroplastia en la corrección del útero septado36.
A continuación, hablaremos de una forma más enfatizada de los distintos tipos de malformaciones müllerianas según la ASRM y de su impacto en la fertilidad de las pacientes, así como de su prevalencia en la población, su diagnóstico y posible tratamiento.
AGENESIA E HIPOPLASIA MÜLLERIANAEs el resultado del fracaso de los conductos paramesonéfricos en desarrollarse. La ASRM agrupa en su clase I a las malformaciones que incluyen la agenesia y la hipoplasia de los conductos de Müller, de los cuales se derivan el útero y los dos tercios superiores de la vagina y que forman, aproximadamente, entre el 5 y el 10% de las anomalías de estos conductos37.
Se conocen 5 variantes que pueden presentar:
- 1.
Ausencia de vagina con útero normal.
- 2.
Ausencia de cuello con útero y vagina normales.
- 3.
Agenesia del cuerpo uterino o útero rudimentario, con trompa y vagina normales.
- 4.
Ausencia exclusiva de trompas.
- 5.
Combinaciones de las anteriores.
La forma más común es el síndrome de Mayer-Rokitansky-Küster-Hauser, en el cual se combinan la agenesia del útero, del cuello uterino y de la porción superior de la vagina.
Las pacientes con el síndrome de Mayer-Rokitansky-Kuster Hauser son 46XX, tienen ovarios normales y un patrón hormonal normal, pero tienen agenesia de útero o útero rudimentario, como consecuencia del fracaso de desarrollo del bulbo sinovaginal38. Además, presentan trompas de Falopio y, por lo general, tienen ausencia de los dos tercios superiores de la vagina. Es probable la presencia de mamas y desarrollo púbico normal, así como de testosterona sérica y valores de estradiol en valores normales femeninos, por lo que los caracteres sexuales secundarios están presentes, lo que refleja una función ovárica normal39.
La HSG no tiene ningún papel en la evaluación agenesia e hipoplasia mülleriana. La ecografía sirve para evaluar la condición renal, los ovarios normales y la ausencia de útero, y es primera modalidad escogida en la evaluación para estas anomalías40,41. Sin embargo, la evaluación de un remanente uterino puede ser difícil, dado que las asas intestinales que recubren la pelvis pueden afectar a la ventana acústica, por lo que el uso de US y la RM es, a menudo, complementario, dado que estas imágenes obtenidas por RM ofrecen una mejor caracterización de la agenesia y la hipoplasia uterina y vaginal.
Los síntomas dependerán de la presencia o la ausencia de endometrio funcional; la completa agenesia en la pubertad se manifiesta con amenorrea primaria asociada o no a dolor pélvico severo. En las pacientes cuyo útero tenga endometrio funcional, junto a una agenesia vaginal, se producirá un efecto obstructivo, lo que causará hematometra. En estas pacientes, el tratamiento no quirúrgico correctivo consistirá en el método de dilatación vaginal, mientras que la reconstrucción vaginal puede realizarse con un stent, mediante un procedimiento41 modificado Abbe-McIndoe. Las pacientes que presentan las anormalidades propias de la clase I son diagnosticadas a edad temprana por pediatras o por especialistas en endocrinología debido a la amenorrea primaria que manifiestan.
En general, el poco o escaso potencial reproductivo para estas pacientes con hipoplasia dependerá del grado de hipoplasia y la presencia de endometrio funcional.
ÚTERO UNICORNEEl útero unicorne es un tipo de malformación uterina congénita en que sólo se desarrolla uno de los conductos de Müller, mientras que el otro no se desarrolla normalmente. Se considera que su incidencia está en el 20%, dentro de las anomalías de los conductos müllerianos37. Se conocen cuatro variantes que puede presentar:
- 1.
Con cuerno uterino rudimentario canalizado y en comunicación con el hemiútero.
- 2.
Con cuerno uterino rudimentario canalizado, pero sin comunicación con el hemiútero.
- 3.
Con cuerno uterino rudimentario sin cavidad endometrial.
- 4.
Sin cuerno uterino rudimentario.
En relación con su incidencia, sabemos que un útero unicorne puede desarrollarse aislado en el 35% de las pacientes, aunque por lo general se encuentra asociado con grados variables de un cuerno rudimentario uterino que le acompaña. Un cuerno rudimentario sin endometrio se ha descrito en el 33% de los casos y con presencia endometrial en un 32%. Un cuerno rudimentario se define como «comunicado» si hay correspondencia con el endometrio del cuerno contra lateral (10% de los casos), mientras que se definirá como «no comunicado» si no hay tal relación (22% de los casos)20,28,42.
Comparado con el útero didelfo, la tasa de aborto espontáneo está aumentada y la de supervivencia fetal, disminuida, ya que la tasa de aborto espontáneo alcanza el 50%. Los índices de natalidad de recién nacidos prematuros llegan al 15% y de supervivencia fetal tan sólo al 40%43–46.
El útero unicorne conlleva importantes problemas reproductivos por la alteración de la vascularización uterina y la disminución de la masa muscular miometrial. Las mujeres con esta malformación muestran tasas altas de cesárea por distocia dinámica o fetal. Una mayor tasa de embarazo ectópico obedece a dos factores: la vascularización anormal, que ofrece mayor provisión sanguínea para el embrión en las trompas de Falopio, y la mayor posibilidad de transmigración de esperma u óvulos al lado contralateral47.
El útero unicorne puede presentar un cuerno rudimentario no comunicado, en el que puede ocurrir transmigración de gametos, además de la implantación del embarazo en el remanente embriológico, por lo que podría comportarse como un embarazo ectópico de alto riesgo, con muchas complicaciones obstétricas37.
La extirpación del cuerno no comunicado está indicada, no sólo para el alivio sintomático, sino también porque el embarazo extrauterino puede ocurrir en el cuerno mediante la migración espermática transperitoneal, donde el 89% de los embarazos que ocurren en este cuerno uterino termina en rotura48. A diferencia del caso en el cual el cuerno rudimentario se presenta sin endometrio, en éste la intervención quirúrgica es rara vez indicada.
A través de HSG y de la inspección mediante espéculo se demuestra un pequeño cérvix, así como el deficiente desarrollo del cuerno, más aun cuando este último está comunicado; al aplicar el material de contraste se visualiza claramente. La HSG permite la visualización de una o de las dos cavidades uterinas; este examen no es suficiente por sí solo para clasificar el tipo de malformación, debido a que no visualiza los contornos externos del útero, además de que no permite visualizar claramente cuando el cuerno rudimentario se presenta no comunicado49,50. Mediante US, las imágenes del útero unicorne aparecen, aunque la forma característicamente asimétrica elipsoide es difícil de apreciar42. La presencia de un cuerno con hipoplasia puede simular un cérvix prominente y confundir las conclusiones; su identificación puede ser difícil de distinguir de otros tipos de úteros duplicados, por lo que el uso imágenes tridimensionales puede ayudar en la caracterización de la anomalía. En imágenes de RM, el útero unicorne aparece curvo y alargado, el contorno externo uterino asume forma de fusiforme, estrechamente elíptico y con los extremos muy agudos, lo que reduce el volumen uterino y hace una configuración asimétrica característica25,28.
ÚTERO DIDELFOLa unión lateral incompleta de los conductos de Müller conduce a la duplicación del útero. El útero didelfo forma parte de estas anomalías y es el resultado del fracaso completo de estos conductos al fusionarse en la línea media. Cada conducto de Müller desarrolla su propio hemiútero o hemicuerpo uterino, además de su cérvix, y ninguna comunicación está presente entre las cavidades duplicadas.
El útero didelfo se encuentra agrupado en la clase III, dentro de los cinco trastornos de la fusión lateral simétrica de los conductos de Müller, según la clasificación de la ASRM13. La incidencia de esta anomalía es, aproximadamente, del 5% de las anomalías de los conductos müllerianos37.
El estudio clínico visual a través de la HSG muestra dos canales endocervicales separados sin comunicación entre ellos, donde cada hemiútero acaba en una solitaria trompa de Falopio. Del mismo modo, el uso de US permite realizar la evaluación inicial de la morfología y la permeabilidad del canal endometrial, en que se deberán realizar cortes, no sólo en los planos axiales y sagitales, sino también ortogonales a lo largo del eje axial del útero para visualizar mejor el contorno externo; en este caso se obtienen imágenes uterinas divergentes, con una hendidura del fundus grande y cavidades endometriales uniformemente separadas, sin pruebas de comunicación entre ellas.
La RM ha reportado una exactitud en el diagnóstico muy elevada, ya que permite obtener imágenes claras del contorno interno y externo del útero y de la anatomía uterina en múltiples planos, y describe en el útero didelfo dos úteros separados con ápices ampliamente divergentes, dos cérvix separados y, por lo general, un tabique vaginal longitudinal que pudiera causar deformidad marcada del útero. En cada útero, el radio y el ancho en la relación endometrio/miometrio están conservados como en la anatomía uterina normal37,51.
Mediante RM el aspecto de los úteros didelfos consiste en el doble y separado útero, acompañado del cérvix y la vagina superior. Los hematometrocolpos derechos concomitantes se deben a la obstrucción del tabique vaginal y pueden detectarse sólo por esta técnica. La pista para la diagnosis la proporciona la presencia de un endometrio doble; uno aparece generalmente muy condensado debido al hematometra. Por otra parte, el hematometra y los hematocolpos son fácilmente reconocibles por la intensidad creciente de la señal en imágenes cargadas. Las imágenes sagitales o coronales pueden ser muy útiles para la demostración del tabique vaginal, obstruyendo el cérvix. Tanto la US como la RM tienen la capacidad de detectar la masa, pero solamente la RM puede demostrar la malformación y el tabique vaginal, que habían determinado los hematometrocolpos.
El útero didelfo no obstructivo es, en general, asintomático, mientras que aquel útero con obstrucción vaginal unilateral puede hacerse sintomático y manifestar dismenorrea, endometriosis y adherencias pélvicas, que son reportadas como secundarias a un flujo de menstrual retrógrado en este subconjunto de pacientes con obstrucción.
La tasa de aborto espontáneo en esta anormalidad uterina alcanza el 45%37, el porcentaje de partos prematuros ronda el 38%37, los nacimientos a término logran un 20%8 y la supervivencia fetal está en el 55%37.
Se ha propuesto, por tanto, la metroplastia de Strassman, técnica que consiste en la sección de los dos cuernos uterinos por su parte media en sus ejes longitudinales, donde la incisión debe ser lo suficientemente profunda como para exponer las cavidades uterinas. Se debe respetar la porción intersticial de las salpinges; la incisión inferior se debe prolongar lo suficiente para unir ambos lados y dejar un canal cervical único. Una vez removida la porción del útero, se procede a la reunificación entres planos con puntos interrumpidos. El tamaño final de la cavidad uterina en apariencia no es trascendente para el futuro reproductivo, aunque la simetría uterina es de suma importancia. Casi siempre la cavidad reconstruida es de menor tamaño que la de un útero normal51.
Este procedimiento quirúrgico es de elección para la unificación de ambas cavidades en úteros externamente divididos, como alternativa resolutiva en pacientes con abortos espontáneos recurrentes y embarazos prematuros; sin embargo, los beneficios de la intervención son contradictorios y las ventajas permanecen confusas, ya que no se han realizado pruebas controladas43.
ÚTERO BICORNETiene como origen la fusión incompleta de los cuernos uterovaginales en el fundus del útero y actualmente representa el 10% de las malformaciones müllerianas.
Las pacientes con útero bicorne y sin otras causas de infertilidad de origen extrauterino presentan ciertos problemas a la hora de concebir.
Estas pacientes presentan una tasas de aborto espontáneo entre un 28 y un 35%4,52, tasas de nacimientos prematuros comprendidas en un rango del 14 al 23% y un porcentaje de supervivencia fetal de alrededor de un 60%4,52,53.
Las tasas de aborto espontáneo y parto prematuro se han calculado observando también si el grado de fusión de los cuernos afecta a estos porcentajes y, efectivamente, se observó que éstos estaban aumentados en las mujeres que presentaban un útero bicorne completo frente las que lo tenían parcial4.
El útero bicorne consiste en dos cuernos simétricos que se fusionan, con comunicación con las cavidades endometriales normalmente en el istmo uterino.
La grieta del útero bicorne completo se extiende hasta la zona interna cervical, mientras la grieta de la configuración parcial tiene una longitud variable. La primera está asociada a la duplicación del cérvix, aunque se mantiene cierto grado de comunicación entre los cuernos uterinos. Se han descrito hasta 6 tipos de úteros bicornes54.
El septo superior vaginal longitudinal está asociado en un 25% a la malformación bicorne.
Normalmente, la intervención quirúrgica en estas pacientes no está indicada y la duración de las sucesivas gestaciones es cada vez mayor con cada embarazo.
En mujeres con un historial de aborto recurrente a las que no se les ha asociado otras causas de infertilidad, se aboga por practicarles una metroplastia de Strassman55.
La metroplastia de Strassman fue descrita en el año 1907 y está indicada especialmente en el útero bicorne.
El útero bicorne es la anomalía mülleriana con una asociación más evidente con la incompetencia cervical, por eso una reposición profiláctica de la matriz cervical en determinadas y seleccionadas pacientes ha supuesto un incremento en la tasa de supervivencia fetal56.
ÚTERO SEPTADOEs la más común de las anomalías müllerianas; supone un 55% de todas ellas7,8,11.
Es el resultado es un fallo de la reabsorción del septo uterovaginal tras la fusión de los conductos paramesonefríticos.
Durante muchos años, las consecuencias reproductivas asociadas con el diagnóstico de las anomalías müllerianas estaban basadas en un impreciso diagnóstico realizado por un análisis incompleto de la morfología uterina, por lo tanto, la mayoría de los úteros bicornes identificados por HSG serían diagnosticados actualmente como úteros septados20.
El útero septado está asociado con algunos los peores resultados reproductivos de este tipo de malformaciones.
La prevalencia del septo en aquellas pacientes con abortos espontáneos y de repetición (3 o más pérdidas) está muy bien documentada, con una tasa de aborto que oscila entre el 26 y el 94%4,8,12,57.
Se define como aborto recurrente más de 3 abortos consecutivos, aunque a algunos autores les basta con sólo 2 pérdidas consecutivas22.
La etiología del aborto recurrente es muy amplia, desde causas conocidas como anomalías cromosómicas parentales, patologías uterinas, desórdenes endocrinos, factores inmunológicos, infajan algunas causas relacionadas con anomalías cromosómicas fetales, con la receptividad endometrial y con factores genéticos22.
Dentro de las patologías uterinas, como una de las causas conocidas de aborto de repetición, se encuentran las anomalías congénitas uterinas, de las cuales la más frecuente es el útero septado22.
Aunque aún hacen falta más estudios, algunos autores sugieren que el incremento de abortos en mujeres con un útero septado puede deberse a una defectuosa implantación del feto7.
Fedele et al50 usaron microscopia de barrido para comparar biopsias endometriales obtenidas del septo con muestras obtenidas de la pared lateral en la fase preovulatoria. Encontraron que el endometrio septal presentaba un crecimiento defectuoso debido, probablemente, a una reducción de la sensibilidad a las hormonas esteroideas.
Otra de las causas por las que el útero septado puede estar asociado al aborto recurrente o de repetición es la naturaleza fibrosa y avascular que tradicionalmente algunos autores le han atribuido, aunque esto se ha puesto en entredicho, ya que por técnicas de resonancia magnética se vio que el septo es normalmente de naturaleza miometral25,28.
Otro estudio reveló, tras estudiar muestras obtenidas por histeroscopia metroplástica, que todos los septos parciales contenían tejido miometrial, mientras que los que eran completos en la parte de arriba hay evidencia de miometrio y en la parte baja el tejido es de origen fibroso58.
En un estudio prospectivo anterior, que analizaba muestras de origen septal y no septal mediante biopsias, se demostró que hay un incremento en el tejido muscular en detrimento del tejido conectivo en el septo59. Los autores hipotetizaron que esa disminución en el tejido conectivo puede tener como resultado una defectuosa implantación, mientras que ese incremento de la masa muscular tiene como consecuencia un aumento de la contractibilidad del tejido que puede predisponer a la paciente a presentar un aborto espontáneo.
Otra de las causas que pueden asociar al útero septado con problemas de infertilidad es el hecho de que está asociado con la patogénesis de la endometriosis, ya que aumenta el flujo retrógrado de la menstruación60,61. Desde el análisis morfológico, el estrechamiento producido por el septo en la cavidad uterina también puede ser, junto a la baja respuesta a las hormonas del endometrio septal y su naturaleza muscular, una de las causas de los bajos resultados reproductivos del útero septado46.
Con todo esto podemos decir que, en general, pacientes con defectos uterinos presentan mayores tasas de aborto repetitivo que en pacientes con un útero normal. De hecho, hay muchos estudios que indican un severo perjuicio en el papel reproductivo de las mujeres que principalmente presentaban útero septado antes de tratarlas mediante técnicas histeroscópicas62,63.
Aparte del fenómeno del aborto recurrente, el útero septado presenta los peores resultados obstétricos de las malformaciones müllerianas, con unas tasas de nacimientos prematuros que oscilan entre el 9 y el 33% (pooled data 20%) y unos porcentajes de supervivencia fetal que van del 10 al 75% (pooled data 33%)4,9,12,22,57,64.
La longitud del septo no parece tener influencia alguna en los resultados reproductivos65.
Los resultados reproductivos mejoran en las pacientes con útero septado tras quitar el septo, con disminuciones en el porcentaje de aborto espontáneo del 88 al 5,9% tras una metroplastia histeroscópica.
La metroplastia histeroscópica está asociada con una disminución significativa de abortos y partos prematuros en las pacientes tratadas66,67.
Las técnicas histeroscópicas han reemplazado a la cirugía abierta, permiten una recuperación rápida, ausencia de cicatriz miometrial y adherencias pélvicas, una menor frecuencia de sinequias (adherencias intrauterinas que pueden ocasionar amenorrea e infertilidad) y de otras complicaciones, y mayor probabilidad de que el embarazo culmine en un parto normal. Está indicada en los úteros septos y subseptos. El procedimiento se realiza en fase proliferativa precoz, lo cual permite una mejor evaluación de la cavidad uterina, además se indica profilaxis con antibioticoterapia de amplio espectro. La intervención consiste en realizar la sección del tabique que divide la cavidad uterina, que se puede realizar con tijeras, bisturí o con láser, iniciando en la porción distal del septo, a media distancia entre la pared anterior y posterior del útero, y se continúa hacia el fondo uterino hasta que se observan las fibras musculares y se obtienen una cavidad distendida uniformemente. En el postoperatorio se indica tratamiento hormonal con estrógenos y progestágenos en un ciclo de 21 días, para favorecer la restauración de la mucosa endometrial, especialmente si ha recibido tratamiento con análogos. Se realiza una histeroscopia control después de que se presenta la primera menstruación para valorar la morfología de la cavidad y liberar las posibles sinequias laxas si éstas se produjeron68.
Se especula que la presencia de úteros malformados en las mujeres perjudica el papel reproductivo por el incremento en la incidencia de abortos tempranos o tardíos y un aumento de las complicaciones obstétricas4, aunque cada tipo de malformación tiene un impacto diferente en cuanto a los resultados de embarazo52. De este modo, aunque muchos autores han encontrado que las mujeres con el útero septado presentan los resultados reproductivos más pobres69, otros sostienen que sus tasas de embarazo no son tan malas y, por lo tanto, la metroplastia no es tan razonable, con la excepción de algunos casos específicos70.
A la metroplastia histeroscópica se asocian unas tasas menores de abortos y partos prematuros. El decrecimiento en estos casos es bastante significativo en las pacientes tratadas con esta técnica66,67.
De hecho, en una revisión de 329 pacientes con útero septado que se embarazaron tras la histeroscopia, sólo 60 de los 366 embarazos acabaron en aborto (16,4%) y sólo 25 en partos prematuros (6,8%). Estas tasas son considerablemente más bajas que las observadas en el grupo de pacientes sintomáticos con útero septado antes de tratarlos, que presentaban unas tasas de aborto del 86,4% y de partos prematuros del 9,8%. Es más, presentan tasas más bajas que las observadas en la población sin tratar con el útero septado, lo que indica que el tratamiento histeroscópico del útero septado mejora la prognosis de pacientes con un útero septado asintomático62.
Por otra parte, hay una importante mejora en el resultado del embarazo tras la histeroscopia del septo; 279 (76,2%) de los 366 embarazos acabaron en partos a término y 268 (83,2%) tuvieron como resultado un recién nacido vivo (RNV). Estas tasas de alumbramiento y de RNV son significativamente más altas que las observadas en el grupo de pacientes sintomáticas con útero septado antes del tratamiento.
Finalmente, parece ser que el tratamiento con metroplastia histeroscópica de las pacientes sintomáticas con útero septado está asociado con una importante mejora en sus resultados reproductivos. Además, parece pronosticar un embarazo a término y buenas tasas de RNV.
Útero septado frente a bicorneUn útero septado suele tratarse quitando el septo por histeroscopia, mientras que el útero bicorne necesita de otro tipo de tratamiento, ya que raramente requiere de una intervención quirúrgica, aunque en pacientes con aborto recurrente durante el segundo y tercer trimestre55 se debe considerar una metroplastia de Strassman, quitando un trozo del aspecto medial del cuerno uterino con la posterior unificación de las dos cavidades.
Por esta razón, es muy importante la realización de un diagnóstico correcto, ya que tanto las implicaciones clínicas como de la intervención son ampliamente diferentes para cada una de las anomalías49.
El diagnóstico definitivo entre útero bicorne frente a útero septo o subsepto se debe establecer mediante la imagen de la cavidad uterina estudiada por histeroscopia o HSG, y la imagen del contorno externo mediante laparoscopia; esta última aporta el diagnóstico definitivo, ya que evidencia en el útero bicorne (el que presenta un cuello con dos hemiúteros y cada uno de éstos con una trompa) la presencia de una muesca o división en el contorno externo del fondo uterino, a diferencia del útero septo o subsepto (un cuello con una cavidad uterina dividida en forma completa o parcial por un tabique), que posee un contorno externo normal37.
La HSG de un útero septado puede utilizarse para medir el tamaño y la extensión del septo. De todas maneras, la precisión de diagnóstico mediante HSG para diferenciar un útero septado de uno bicorne es del 55%71.
Un ángulo entre los cuernos uterinos menor de 75° sugiere un útero septado, mientras que uno mayor de 105° es más consistente cuando hablamos de un útero bicorne71,72. Sin embargo, la mayoría de ángulos entre los cuernos no se encuentra en este rango y hay un considerable solapamiento de los datos37.
Cuando mediante imágenes obtenidas mediante HSG (el ángulo de divergencia no es indicativo) el diagnóstico no es definitivo, se recurre técnicas de US (fig. 2).
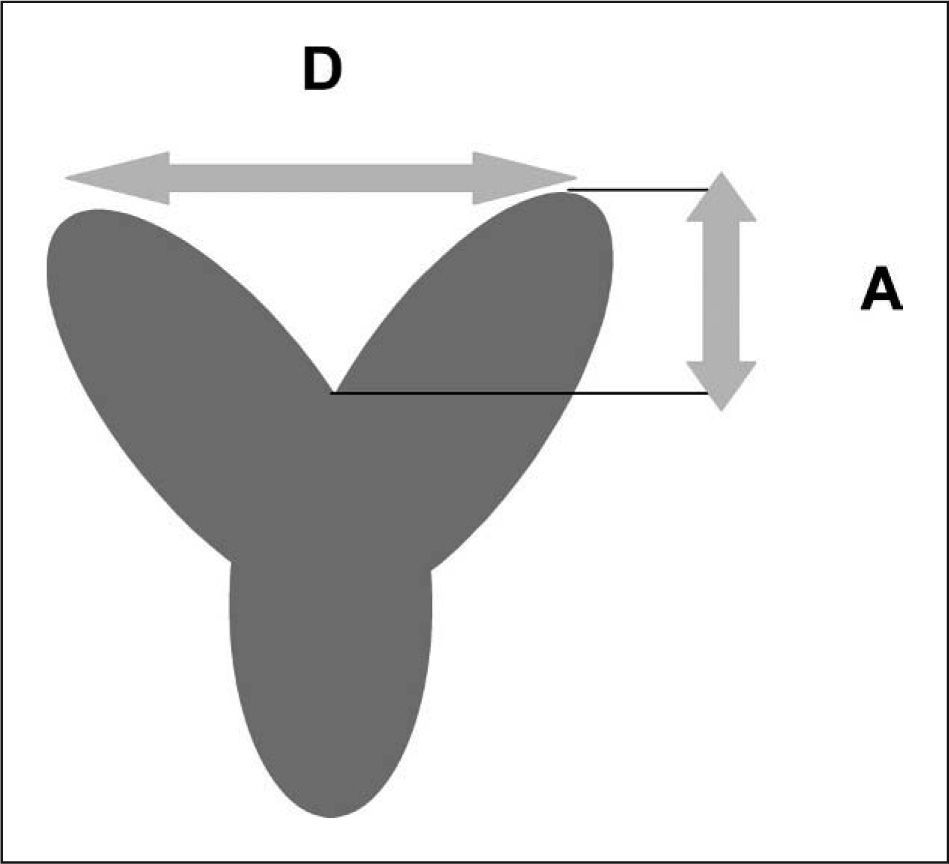
Criterio de diferenciación por ultrasonografía entre un útero septado y otro bicorne. A) Cuando el ápice (3) del contorno externo fundal tiene lugar por debajo de una línea recta entre la ostia tubal (1, 2) o B) cuando el ápice es < 5mm el útero es bicorne. C) Cuando el ápice es > 5mm por encima de la línea, el útero es septado.
Se caracteriza por una ligera indentación del endometrio hacia el fundus del útero como resultado de una casi completa absorción del septo uterovaginal.
Su clasificación es problemática, ya que no está claro si esta variante puede clasificarse como una anomalía o como una variante anatómica de la forma normal uterina.
En principio, la clasificación de Buttram y Gibson estableció que el útero arcuato era una variante del bicorne; la revisión posterior de esta clasificación ya que en los pocos estudios hechos se han obtenido buenos y malos resultados73,74.
Se piensa que la configuración arcuata es generalmente compatible con una gestación normal, con una tasa de parto del 85%73.
A pesar de lo dicho anteriormente, y una vez excluidos los factores extrauterinos, la corrección por histeroscopia debe considerarse en determinados pacientes con pérdida recurrente que tienen una prominente configuración del miometrio fundal.
Se ha propuesto que cuando la ratio es menor de un 10% entre la altura de la indentación fundal (A) y la distancia entre los ápices de los cuernos (D), calculada basándose en técnicas de HSG, no se esperan resultados adversos reproductivos (fig. 3)7,74.
De todas formas, aún no se ha definido la profundidad de la técnica para distinguir la configuración arcuata de un septo ancho (configuración septado).
DEFECTOS UTERINOS SECUNDARIOSExposición a dietilestilbestrolEl DES es un estrógeno sintético que actúa como «disruptor endocrino», que se definen como un grupo de sustancias químicas de diferente origen, estructura y uso, exógenas al organismo, naturales o sintéticas, que interfieren con la producción, liberación, transporte, metabolismo, unión, acción biológica o eliminación de las hormonas responsables del mantenimiento de la homeostasis y regulación del desarrollo75.
La exposición en útero a DES mostró estar asociada a carcinoma vaginal, por lo que el empleo esta medicina (fármaco) fue abandonado bruscamente en 1971. La incidencia de carcinoma celular en estas mujeres es de 0,14-1,4/1.000 mujeres expuestas76.
Además, estudios clínicos muestran que las mujeres expuestas experimentan mayores tasas abortos espontáneos y recurrentes, partos prematuros y otras complicaciones de obstétricas76.
Las anomalías estructurales uterinas, de cérvix y de vagina se describieron posteriormente, mostrando así su potencial impacto reproductivo76. El 79% de las mujeres expuestas tiene anormalidades uterinas descubiertas en imágenes de HSG77, como una configuración característica en «forma de T» de la cavidad uterina, que representa la anormalidad más comúnmente asociada, presente en el 31% de estas mujeres77,78. Otras anomalías uterinas incluyen un pequeño útero hipoplásico y bandas de constricción, que es un agrandamiento del segmento uterino más distal, que hace la cavidad estrecha e irregular. Se forman márgenes irregulares del endometrio, alteraciones en su superficie, grosor endometrial y defectos intraluminales77,78. Las anomalías de las trompas de Falopio incluyen alteraciones y deformidades de las fimbrias además de su estenosis. Las anomalías cervicales ocurren en el 44% de los casos e incluyen hipoplasia, además de seudopólipos78–80.
Las mujeres expuestas están predispuestas a la incompetencia cervical, secundaria no sólo por cambios estructurales, sino además por alteraciones histológicas como la disminución de la proporción de colágeno y músculo liso además de la disminución de la elastina cervical78.
Con relación a las imágenes por HSG, la hipoplasia y la estenosis cervical pueden dificultar la inserción de cánula en el canal endocervical. Estas imágenes radiográficas incluyen un canal estrecho e irregular, con el segmento superior uterino acortado, y se evidencia la «forma de T» característica.
El diagnóstico definitivo y específico no es posible por imágenes obtenidas mediante US; la configuración de T clásica, así como las bandas de constricción, son difíciles de caracterizar81,82. Las imágenes de RM muestran hipoplasia uterina, la configuración de T de la cavidad y claramente bandas de constricción, que caracterizan por imagenología el cuadro clínico. La exposición a DES muy raras veces se ha documentado en la población española; esta observación es poco relevante ya que es dependiente del empleo de una medicación en un país en concreto, por lo que el subregistro del impacto reproductivo es importante y, sobre todo, desconocido en esta anomalía estructural.
Septo vaginal transversoEl septo vaginal transverso divide la vagina en dos segmentos, proximal y distal, reduce su largo funcional y obstruye, parcial o totalmente, la salida del flujo menstrual. Es una de las anomalías más infrecuentes del tracto reproductivo y su incidencia exacta se desconoce. Esta patología se debe a una alteración de la fusión vertical de los conductos de Müller y el seno urogenital, lo que resulta en una falta de canalización de los tejidos del bulbo sinovaginal. Ocurre con más frecuencia en la unión del tercio superior y medio de la vagina. En relación con su histología, el septo consiste en una estroma de tejido conjuntivo con fibras musculares, vasos sanguíneos, nervios y epitelio, por ambos lados, y generalmente de tipo estratificado escamoso, aunque también se han descrito con epitelio de transición y cuboide40,83. Se manifiesta con amenorrea primaria en la pubertad, acompañada de dolor pélvico cíclico, causado por la retención de sangre y distensión de vagina. Al examen hay una masa en la pelvis que puede ser secundaria a hematocolpos o hematometra. Generalmente, no se aprecia abultamiento en el introito, a diferencia de lo que se observa en el himen imperforado. Al tacto rectal se palpa la ubicación y el ancho del tabique y las características del tumor pélvico40.
El septo vaginal transverso puede estar presente en cualquiera de las anormalidades müllerianas, aunque está frecuentemente asociado con el útero didelfo. Si es incompleto, puede ser asintomático o presentarse con dismenorrea, irregularidades menstruales, dispareunia y, en algunos casos, imposibilidad de mantener relaciones sexuales. La HSG tiene un papel poco relevante en la evaluación de tabique transversal. Mediante US el hematometrocolpos se manifiesta como una vagina distendida y un endometrio de apariencia variable; se aprecia una masa cística con ecos difusos de bajo nivel84. La RM es una modalidad importante para definir la complejidad de la anomalía, especialmente cuando la US es limitada debido al campo visual y la distorsión de la anatomía normal debida a hematometrocolpos. La capacidad de captar imágenes en varios planos en RM es crucial para anomalías complejas, donde existe distorsión marcada de la anatomía uterovaginal37.
El septo vaginal transverso es una patología poco frecuente, pero se la debe tener presente, diagnosticarla y tratarla oportunamente para evitar complicaciones, como endometriosis, adherencias pélvicas, daño irreparable de las trompas o tratamientos quirúrgicos inadecuados. Debería sospecharse de pacientes que han alcanzado desarrollo puberal completo, que cursan con amenorrea primaria, dolor pélvico cíclico o progresivo, abdomen doloroso, tumoración pélvica y abdominal además del hallazgo de una vagina corta o inexistente. Se hace indispensable completar el examen con un tacto rectal que evidenciará la presencia de un tabique y/o de una tumoración, que puede extenderse de la pelvis al abdomen para completar el estudio con exámenes visuales. La falta de abultamiento en el introito realiza el diagnóstico diferencial con un himen imperforado. La presencia de dolor y de tumoración abdominopélvica lo diferencia del síndrome de Rokitanski85.
Existen diferentes técnicas quirúrgicas para solucionar esta patología. La elección de ésta dependerá de la ubicación del tabique, de su grosor y, en ocasiones, de hallazgos intraoperatorios. La incisión simple es útil para la descompresión inmediata en el recién nacido. El resultado funcional óptimo se obtiene con la escisión quirúrgica del tabique. Si es fino, puede resecarse y luego hacer anastomosis de los bordes de la mucosa. Si es alto y ancho es más dificultoso, y se requiere una disección más extensa y movilización de la mucosa vaginal para permitir la anastomosis85.
CONCLUSIONESUna malformación uterina por sí misma no es una razón para someterse a un tratamiento de reproducción asistida. Las posibilidades de que se produzca un embarazo en pacientes con malformaciones uterinas infértiles sin tratar, excepto portadoras de septo, parecen ser similares a las de la población infértil general aunque, por norma, las mujeres con malformaciones uterinas sometidas a fecundación in vitro (FIV) o inyección intracitoplasmática de espermatozoides (ICSI) presentan unas tasas de implantación bajos.
El útero septado es la malformación uterina con peor pronóstico. Las tasas de embrazo con útero septado que han sido previamente operadas siguen mostrando una tendencia a la pérdida fetal mayor que en el caso de mujeres con el útero unicorne o didelfo. Sin embargo, Lavergne et al86 encontraron que la tasa de implantación en mujeres con útero septado que se han sometido con anterioridad a un tratamiento quirúrgico antes de un tratamiento de reproducción asistida (TRA) es mayor que en las pacientes que no se han sometido. Los defectos de maduración del endometrio septal encontrados en los ciclos naturales pueden perjudicar la capacidad de recibir al óvulo fecundado en la cavidad uterina50. Por lo tanto, quitar ese septo no sólo elimina ese sitio «incómodo» para la implantación y puede mejorar la función endometrial. La metroplastia no contrarresta la infertilidad, pero puede mejorar la prognosis del embarazo tras un TRA; además, reduce la tasa de cesárea, lo que es potencialmente beneficioso. Este tipo de cirugía es bastante segura, tiene una baja morbilidad y su uso está recomendado antes de someterse a un TRA.
En cuanto al útero didelfo, puede ser considerado como un útero unicorne duplicado y el embarazo tiene lugar, normalmente, en uno de los cuernos. El grupo con útero unicorne y didelfo parece que tiene un mayor porcentaje de llevar un embarazo a término y la tasa más baja de aborto espontáneo, comparándolo con las mujeres con útero bicorne o septado, tras el uso de FIV87. Aunque la histeroscopia metroplástica no está indicada para mejorar la fertilidad en parejas infértiles con estas malformaciones uterinas, sí que se indica para aumentar las probabilidades de quedarse embarazada87. Las indicaciones a seguir en estos tratamientos de reproducción asistida aplicados a estas personas con malformaciones son las mismas que en casos de cavidades uterinas normales.
Por su parte, apenas se ha visto que el útero arcuato influya en la fertilidad femenina, por lo que, poco a poco, se tiende a considerarlo más una variante morfológica y no un problema del desarrollo mülleriano.
El embarazo es posible en mujeres con agenesia vaginal mediante recuperación de oocitos, posterior FIV y transferencia de los embriones.
Las pacientes expuestas a DES experimentan mayores tasas de aborto, embarazo ectópico y parto pretérmino debido a la asociación con anomalías genitales uterinas y extrauterinas.
El papel de la FIV en las pacientes con malformaciones uterinas requiere mayor evaluación mediante estudios que involucren mayor número de pacientes. Las tasas de implantación y las tasas de embarazo clínico son aún inciertas, aunque equivaldrían al 50% de las observadas en mujeres sometidas a FIV sin anomalías uterinas.
Por último, debemos añadir que la histeroscopia es un procedimiento diagnóstico y terapéutico, seguro y a la vez versátil que representa en este momento el patrón de oro para el estudio de patologías endometriales y uterinas.