Comparar las concentraciones plasmáticas de homocisteína en preeclámpticas, eclámpticas y normotensas en el pre y posparto.
MétodosSe incluyó a 30 pacientes con preeclampsia leve (grupo A), 30 pacientes con preeclampsia severa (grupo B) y 30 pacientes con eclampsia (grupo C). El grupo control fue seleccionado por tener edad e índice de masa corporal similares con los grupos en estudio y consistió en 35 embarazadas normotensas (grupo D). Las muestras de sangre se recolectaron en todas las pacientes antes del parto y las muestras de seguimiento posparto se recolectaron a los 7 días y a las 6 semanas en todos los grupos.
ResultadosSe observaron diferencias estadísticamente significativas entre los controles y los 3 grupos de estudio con respecto al peso de los recién nacidos (p<0,05). Las concentraciones plasmáticas más altas en el preparto se observaron en el grupo de pacientes eclámpticas seguido por las preeclámpticas severas. Los 3 grupos en estudio presentaron valores significativamente más altos que los controles (p<0,05). A los 7 días y 6 semanas del posparto, los grupos de estudio (A, B y C) presentaron concentraciones plasmáticas promedio de homocisteína más altas y estadísticamente significativas al compararlas con el grupo de embarazadas controles (p<0,05).
ConclusionesLas preeclámpticas y las eclámpticas presentan concentraciones plasmáticas más elevadas de homocisteína y esta elevación se mantiene hasta las 6 semanas del posparto, comparado con embarazadas normotensas sanas.
To compare plasma homocysteine concentrations in preeclamptic, eclamptic and normotensive pregnant patients before and after delivery.
MethodsWe included 30 patients with mild preeclampsia (group A), 30 patients with severe pre-eclampsia (group B), and 30 patients with eclampsia (group C). A control group of 35 normotensive women (group D) was selected with a similar age and body mass index as the study groups. In all groups, blood samples were collected in all patients before delivery, and post-partum follow-up samples were collected at 7 days and 6 weeks.
ResultsStatically significant differences were found between controls and the three study groups in birthweight (P<.05). Before delivery, the highest concentrations were seen in eclamptic patients followed by those with severe preeclampsia. Concentrations were significantly higher in the three study groups than in controls (P<.05). At 7 days and 6 weeks, mean homocysteine concentrations were significantly higher in groups A, B and C than in group D (P<.05).
ConclusionsHomocysteine concentrations were significantly higher in pre-eclamptic and eclamptic patients than in normotensive pregnant women and remained higher at 6 weeks after delivery.
La homocisteína es un aminoácido azufrado originado metabólicamente de la metionina, aminoácido esencial, que desempeña una importante función metabólica al participar en un sistema de transferencia de grupos metilos1-3. La homocisteína es un producto normal del metabolismo de la metionina que no circula en grandes cantidades y puede ser reciclada a través de la vía de recuperación de la metionina o de la vía de formación de cisteína. Este metabolito en la circulación general y en los tejidos por su grupo tiol tiende a formar puentes disulfuro3.
La hiperhomocisteinemia ha sido reconocida como un factor de riesgo independiente de la enfermedad cardiovascular en sujetos no embarazados2. El aumento de las concentraciones de homocisteína produce daño celular endotelial por varios mecanismos (generación de peróxidos de hidrógeno y agotamiento del óxido nítrico mediado por la destoxificación de la homocisteína, aumento de la actividad del factor V de Leiden, aumento de la actividad de la protrombina y alteración de la expresión de la trombomodulina). Los cristales de homocisteína en las células endoteliales pueden actuar como una superficie patológica para la activación de la vía de contacto para la coagulación intrínseca3.
La preeclampsia complica del 5 al 10% de los embarazos alrededor del mundo; sin embargo, no todas las embarazadas tienen el mismo riesgo y la mayoría de los casos (aproximadamente del 75 al 80%), por ejemplo, ocurren durante el primer embarazo. Otros factores de riesgo incluyen hipertensión crónica, enfermedad renal subyacente, diabetes mellitus e historia de preeclampsia previa4.
La disfunción de las células endoteliales se ha identificado como la vía común final en la patogénesis de la preeclampsia. La causa de esta disfunción endotelial es desconocida, pero en años recientes el posible papel de los factores genéticos y los mecanismos inmunitarios han producido un gran interés5,6. Durante el embarazo, ocurren cambios en la fisiología materna para acomodar al nuevo ser en crecimiento y son más evidentes en el sistema cardiovascular. El volumen sanguíneo y el gasto cardiaco se duplican. Estos incrementos ocurren en el segundo trimestre y permanecen elevados hasta después del parto. La presión sanguínea durante todo el embarazo permanece baja, secundaria a una reducción de la resistencia periférica2. Sin embargo, en la preeclampsia, la resistencia periférica total se incrementa, ocasionando que la presión sanguínea se eleve. Se ha postulado que los cambios en la reactividad vascular observados, tanto en embarazos normales como en la preeclampsia, son causados por alteraciones en el endotelio vascular6,7.
Los cambios vasculares mediados por la homocisteína son similares a los asociados con la preeclampsia, por lo que se ha propuesto una hipótesis en la cual se asociaría la hiperhomocisteinemia a esta condición4. Varios estudios han indicado que las concentraciones de homocisteína aumentan en las pacientes con preeclampsia8,9. Pero existen pocos informes con relación a la hiperhomocisteinemia en pacientes con eclampsia.
El objetivo de la investigación fue comparar las concentraciones plasmáticas de homocisteína en preeclámpticas, eclámpticas y normotensas en el pre y posparto.
Materiales y métodosSe seleccionó a un total de 125 pacientes; se incluyó a 30 pacientes con preeclampsia leve (grupo A), 30 pacientes con preeclampsia severa (grupo B) y 30 pacientes con eclampsia (grupo C). El grupo control fue seleccionado por tener edad e índice de masa corporal similares con los grupos en estudio y consistió en 35 embarazadas sanas (grupo D). La investigación fue aprobada por el Comité de Ética e Investigación del hospital y se obtuvo consentimiento por escrito de todas las pacientes.
La preeclampsia leve se definió como la presión arterial sistólica de 140mmHg o más o presión arterial diastólica de 90mmHg o más confirmada por 6 o más horas de diferencia, mientras que la proteinuria se definió como 300mg o más de proteína en una muestra de 24 h o 1-2 cruces de proteinuria en un examen cualitativo después de las 20 semanas de gestación. La preeclampsia severa se definió si la presión arterial diastólica por encima de 110mmHg o presión arterial sistólica de 160mmHg o más, junto con 3 cruces de proteinuria en un examen cualitativo, o por lo menos 3g en una muestra de orina de 24 h, presencia de cefalea, alteraciones visuales, dolor abdominal, oliguria (menos de 500ml/24 horas), hiperbilirrubinemia, elevación de las concentraciones séricas de creatinina (mayor de 1,0mg/dl), trombocitopenia (menos de 150.000 mm3) y elevación de las concentraciones de las transaminasas después de las 20 semanas de gestación. La eclampsia se definió como la aparición de convulsiones o coma en pacientes con signos y síntomas de preeclampsia. La presión sanguínea se midió en posición sentada después de 15 min de descanso.
Los criterios de exclusión fueron antecedentes de enfermedad hipertensiva preexistente, enfermedad cardiaca o renal, diabetes mellitus y embarazo múltiple, tratamiento con medicamentos que alteren el metabolismo del folato (p. ej., antiepilépticos).
Las muestras de sangre se recolectaron en todas las pacientes antes del parto y en los grupos en estudio inmediatamente después del diagnóstico. Las muestras de seguimiento posparto se recolectaron a los 7 días y a las 6 semanas en todos los grupos. Todas fueron centrifugadas por 10 min a 2.500rpm y el plasma fue separado y almacenado a –70° C hasta el momento de la medición. Las concentraciones plasmáticas de homocisteína se midieron por el método de quimioluminiscencia. La sensibilidad analítica del ensayo fue de 0,5μmol/l y los coeficientes de variación intra e interensayo fueron del 3,9 y el 5,8%, respectivamente.
Los datos se presentan como valores promedios±desviación estándar. Los análisis estadísticos entre los grupos se realizaron con la prueba de ANOVA con postest de Dunnett para comparar las características demográficas, el promedio de presión arterial y las concentraciones plasmáticas de homocisteína entre los grupos. Los coeficientes de correlación entre las concentraciones de homocisteína preparto en las preeclámpticas leves, preeclámpticas severas y eclámpticas con los valores promedio de presión arterial sistólica y diastólica se evaluaron usando la prueba de Pearson. Se consideró p<0,05 como estadísticamente significativo.
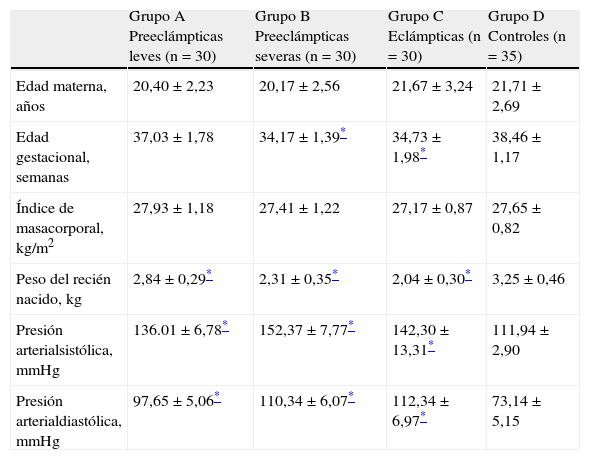
ResultadosLas características generales de las pacientes de los 4 grupos se muestran en la tabla 1. No se encontraron diferencias significativas con relación a la edad materna y el índice de masa corporal entre los controles y los grupos en estudio (p=ns). Se encontraron diferencias estadísticamente significativas en la edad gestacional entre los grupos B y C comparado con el grupo control (p<0,05). También se encontraron diferencias estadísticamente significativas entre los controles y los 3 grupos de estudio con respecto al peso de los recién nacidos (p<0,05). Se observaron diferencias estadísticamente en los valores de los valores promedio de presión arterial sistólica y diastólica de los 3 grupos en estudio comparado con los controles (p<0,05).
Características generales
| Grupo A Preeclámpticas leves (n=30) | Grupo B Preeclámpticas severas (n=30) | Grupo C Eclámpticas (n=30) | Grupo D Controles (n=35) | |
| Edad materna, años | 20,40±2,23 | 20,17±2,56 | 21,67±3,24 | 21,71±2,69 |
| Edad gestacional, semanas | 37,03±1,78 | 34,17±1,39* | 34,73±1,98* | 38,46±1,17 |
| Índice de masacorporal, kg/m2 | 27,93±1,18 | 27,41±1,22 | 27,17±0,87 | 27,65±0,82 |
| Peso del recién nacido, kg | 2,84±0,29* | 2,31±0,35* | 2,04±0,30* | 3,25±0,46 |
| Presión arterialsistólica, mmHg | 136.01±6,78* | 152,37±7,77* | 142,30±13,31* | 111,94±2,90 |
| Presión arterialdiastólica, mmHg | 97,65±5,06* | 110,34±6,07* | 112,34±6,97* | 73,14±5,15 |
Media ± DE.
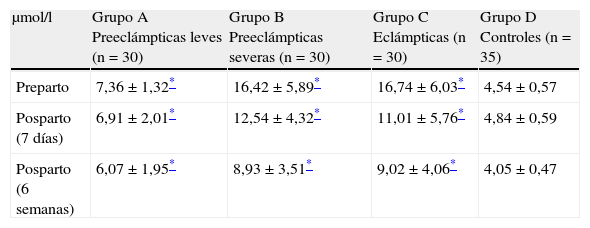
Las concentraciones plasmáticas de homocisteína antes y después del parto en cada uno de los grupos se muestran en la tabla 2. Los valores más altos en el preparto se observaron en el grupo de pacientes eclámpticas (16,74±6,03μmol/l) junto con las preeclámpticas severas (16,42±5,89μmol/l). Se encontraron valores más bajos en las preeclámpticas leves (7,36±1,32μmol/l). Los grupos en estudio presentaron valores significativamente más altos que los controles (4,54±0,57μmol/l; p<0,05). No se encontraron correlaciones significativas entre los valores de homocisteína preparto y los valores promedio de presión arterial sistólica y diastólica en las preeclámpticas leves, preeclámpticas severas y eclámpticas (p=ns).
Concentraciones de homocisteína en el pre y posparto
| μmol/l | Grupo A Preeclámpticas leves (n=30) | Grupo B Preeclámpticas severas (n=30) | Grupo C Eclámpticas (n=30) | Grupo D Controles (n=35) |
| Preparto | 7,36±1,32* | 16,42±5,89* | 16,74±6,03* | 4,54±0,57 |
| Posparto (7 días) | 6,91±2,01* | 12,54±4,32* | 11,01±5,76* | 4,84±0,59 |
| Posparto (6 semanas) | 6,07±1,95* | 8,93±3,51* | 9,02±4,06* | 4,05±0,47 |
Media ± DE.
A los 7 días del posparto, los grupos de estudio presentaron aumentos de las concentraciones plasmáticas promedio de homocisteína (6,91±2,01μmol/l para el grupo A, 12,54±4,32μmol/l para el grupo B y 11,01±5,76μmol/l para el grupo C); estos mostraron tener diferencias estadísticamente significativas al compararlas con el grupo de embarazadas controles (4,84±0,59μmol/l; p<0,05).
Luego de 6 semanas del posparto, las concentraciones plasmáticas de homocisteína en el grupo A (6,07±1,95μmol/l), grupo B (8,93±3,51μmol/l) y grupo C (9,02±4,06μmol/l) permanecían aún significativamente elevadas al compararlas con el grupo D (4,05±0,47μmol/l; p<0,05).
DiscusiónLa presente investigación demuestra que las concentraciones plasmáticas de homocisteína durante el preparto y en el posparto mediato y tardío son significativamente más altas en las pacientes preeclámpticas y eclámpticas que en las normotensas.
Todos los vasos del cuerpo están tapizados por una monocapa de células planas y de forma romboidal conocidas como endotelio. Por muchos años, estas células fueron consideradas como una barrera pasiva entre la sangre y la vasculatura subyacente. Sin embargo, Kang et al.10 demostraron que si los vasos sanguíneos se liberan de su endotelio serían incapaces de relajarse. Estas observaciones y el desarrollo de técnicas para el cultivo de células han llevado a una mayor investigación en el campo de la biología celular del endotelio. Las células endoteliales ofrecen una interfase única entre el ambiente intra y extravascular, y tienen diversas funciones en la fisiología normal y la patología, incluyendo la regulación de la angiogénesis, la respuesta inmunitaria e inflamatoria, al igual que el mantenimiento del tono vascular5.
La hiperhomocisteína está asociada a una variedad de desórdenes, pero no está claro si la asociación es causal o un efecto del proceso de la enfermedad. Un metaanálisis demostró una relación entre la homocisteína y la enfermedad cardiaca coronaria, enfermedad cerebrovascular y enfermedad vascular periférica11. El riesgo de enfermedad cardiaca coronaria parece aumentar en forma proporcional con las concentraciones de homocisteína. Tanne et al.12 indicaron que existe una asociación positiva entre la homocisteína y la enfermedad cardiaca isquémica. Para un incremento de homocisteína de 5μmol/l, la tasa de riesgo de enfermedad isquémica cardiaca aumenta en un 84%. De forma similar, esta investigación demostró una relación entre el aumento de la homocisteína y la severidad de la preeclampsia. Debido a que las concentraciones plasmáticas de homocisteína mostraron diferencias entre las embarazadas normotensas y las preeclámpticas leves, severas y las eclámpticas, se puede considerar que el aumento de las concentraciones plasmáticas de homocisteína se debe a la severidad de la preeclampsia. La homocisteína puede producir estrés oxidativo y disfunción de las células endoteliales13.
La activación o disfunción de las células endoteliales es la hipótesis más comúnmente aceptada para la preeclampsia. Por lo tanto, la hiperhomocisteinemia durante el embarazo puede contribuir a esta condición14. Las concentraciones plasmáticas de homocisteína están disminuidas en el embarazo normal, probablemente debido a un incremento del volumen plasmático y la hemodilución por aumento de la tasa de filtración glomerular, cambios hormonales asociados al embarazo y un aumento de la captación de homocisteína por el feto13.
La asociación entre la preeclampsia y la hiperhomocisteinemia es fuerte, y se ha reportado una asociación similar a la preeclampsia y otros factores, como la hipertensión crónica, el síndrome antifosfolípidos, la obesidad previa al embarazo, la diabetes mellitus y la nuliparidad15. La homocisteína es metabolizada en aminoácidos neurotransmisores excitadores, como el ácido homocisteico y el ácido cisteinsulfínico, los cuales causan convulsiones y muerte neuronal excitotóxica en ratas16. El aumento de las concentraciones de homocisteína en embarazadas susceptibles puede contribuir a las convulsiones eclámpticas.
Además, se piensa que el grupo sulfidrilo de la homocisteína actúa en forma catalítica con los iones del hierro y del cobre en un sistema de oxidación mixta para generar peróxido de hidrogeno, radicales de oxígeno y radicales de homocisteína17. El peróxido de hidrógeno, el cual pasa libremente a través de la membrana de la célula, es reducido y destoxificado por la glutatión peroxidasa, la cual es una enzima antioxidante importante en el sistema biológico. La homocisteína suprime la producción de glutatión peroxidasa celular en las células endoteliales18. Altas concentraciones de homocisteína intracelular alteran la vía de trans-sulfuración y puede reemplazar la cisteína en la síntesis de glutatión. La homocisteína disminuye el glutatión intracelular y el NAD+, y la relación entre la concentración intracelular de glutatión oxidado y reducido. La acumulación de peróxido de hidrógeno, debido a la ineficiencia de la glutatión peroxidasa, es tóxica para los organismos vivos y puede promover la peroxidación lipídica por los radicales libres generados por la homocisteína19.
En sujetos sanos no embarazados, las concentraciones elevadas de homocisteína están asociadas a alteración de la dilatación dependiente del endotelio, una manifestación temprana de la ateroesclerosis. Por el contrario, la disminución de las concentraciones plasmáticas de homocisteína con el uso de vitaminas del complejo B está asociada a mejoría de la función endotelial de los vasos20. Las concentraciones elevadas de homocisteína reducida pero no oxidada promueven el daño tisular y reaccionan con el óxido nítrico en presencia de oxígeno para formar s-nitrohomocisteína, la cual puede disminuir la bioactividad del óxido nítrico debido a la formación de nitrosotiol de novo. Esta forma reducida promueve la generación de derivados de los radicales libres de oxígeno mediante el incremento de la LDL oxidada21. En este estudio, las concentraciones plasmáticas de homocisteína en las preeclámpticas y eclámpticas fueron significativamente mayores que en los controles en todos los periodos de estudio y estos datos apoyarían la teoría previa.
Aunque la preeclampsia está caracterizada clínicamente por hipertensión arterial, proteinuria y edema, las mujeres con este síndrome también tienen más posibilidades de tener alteraciones metabólicas similares a mujeres no embarazadas con enfermedad cardiaca coronaria. Las alteraciones metabólicas incluyen hipertrigliceridemia, excesiva peroxidación lipídica o estrés oxidativo, insulinorresistencia, hiperactividad del sistema nervioso simpático, elevación de las citocinas proinflamatorias plasmáticas y alteración de la relación de tromboxano y prostaciclina, que favorece la vasoconstricción22–24. En las placentas de las preeclámpticas, los cambios patológicos son similares a los observados en la aterosclerosis25. También existen considerables similitudes epidemiológicas entre la preeclampsia y la enfermedad cardiaca coronaria con relación a la obesidad, el estilo de vida sedentaria y los antecedentes de diabetes e hipertensión crónica, los cuales son factores de riesgo para ambos desórdenes. La fuerte asociación entre las concentraciones de homocisteína y la preeclampsia-eclampsia son consistentes con este patrón.
Ya se habían reportado concentraciones plasmáticas de homocisteína más altas en preeclámpticas comparadas con embarazadas normales durante el pre y el posparto9, pero en esta investigación, con un número mayor de pacientes preeclámpticas y un grupo de eclámpticas, se pueden determinar específicamente las concentraciones plasmáticas del aminoácido en cada uno de los grados de severidad. Sin embargo, la información limitada sobre el uso de vitaminas y otros suplementos nutricionales por la madre puede limitar los resultados de esta investigación y modificar los efectos de las concentraciones de homocisteína con la severidad de la preeclampsia.
Las embarazadas seleccionadas para la investigación no tenían un tiempo de ayunas similar al momento de la toma de la muestra. Los resultados de estudios previos en sujetos no embarazados son contradictorios con relación a los efectos de la ingesta de alimentos sobre las concentraciones de homocisteína, demostrando ligeros aumentos, disminuciones o ningún cambio26. Aunque las variaciones en el estado de ayuno pueden inducir incrementos en la variabilidad en las concentraciones de homocisteína plasmática materna, los valores en ayunas pueden ser en la clínica y en la práctica irrelevantes en embarazadas o mujeres lactantes.
En el presente estudio, las pacientes embarazadas normotensas presentaron concentraciones plasmáticas significativamente más bajas de homocisteína comparadas con los grupos de pacientes con diagnóstico de síndrome de hipertensión inducida por el embarazo. Muchos estudios han demostrado la relación entre la hiperhomocisteinemia y la preeclampsia27, mientras que otros han refutado esta asociación28. Esta relación se ha demostrado al principio del embarazo, en el segundo trimestre y en el tercer trimestre29,30. Sin embargo, se ha indicado que la hiperhomocisteinemia en el segundo trimestre en embarazadas asintomáticas no son predictoras del desarrollo del síndrome hipertensivo20,28.
En conclusión, de acuerdo con los hallazgos de esta investigación, las preeclámpticas y las eclámpticas presentan concentraciones plasmáticas más elevadas de homocisteína y esta elevación se mantiene hasta las 6 semanas del posparto, comparadas con embarazadas normotensas sanas.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que los procedimientos seguidos se conformaron a las normas éticas del comité de experimentación humana responsable y de acuerdo con la Asociación Médica Mundial y la Declaración de Helsinki.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores han obtenido el consentimiento informado de los pacientes y/o sujetos referidos en el artículo. Este documento obra en poder del autor de correspondencia.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.