Revisar y actualizar las pautas del aborto farmacológico.
Material y métodoRevisión de la literatura.
ResultadosLa pauta terapéutica más utilizada en gestaciones de menos de 9 semanas (63 días) es la que combina 200mg de mifepristona seguidos, a las 24-48 horas, de 800mcgde misoprostol administrados por vía bucal o vaginal. Con esta pauta las tasas de eficacia oscilan entre el 96,12 y el 97,43% y la tasa de efectos secundarios mayores se sitúa entorno al 0,2%.
ConclusionesEl aborto farmacológico es eficaz y seguro hasta las 9 semanas de gestación y, por ello, debería de ser ofrecido, como una opción válida, a todas las mujeres que consultan para interrumpir una gestación de menos de 9 semanas.
To review and update the different treatment options of pharmacological abortion.
Material and methodsLiterature search and review.
ResultsThe most widely used treatment in pregnancies of less than 9 weeks (63 days) is a combination of 200mg of mifepristone followed by 800 micrograms of misoprostol at 24-48hours administered either vaginally or orally. Efficacy rates vary from 96.12% to 97.43% and the incidence of severe effects is low (0.2%).
ConclusionsMedical abortion is safe and effective and should be offered to all women requesting a termination up to 63 days of gestation.
El aborto farmacológico es una opción segura, efectiva y aceptada por las mujeres. Los sanitarios deberíamos ofrecer también esta opción a las mujeres que solicitan interrumpir su embarazo.
IntroducciónEn el mundo se realizan alrededor de 48 millones de abortos voluntarios cada año1. En España se realizaron en el año 2013 108.690 interrupciones voluntarias del embarazo, de las que 15.407 (14,1%) fueron abortos farmacológicos con mifepristona como medicamento principal y el resto, 93.283, fueron abortos quirúrgicos2.
El aborto quirúrgico, realizado bien mediante aspiración o legrado, ha sido el método de interrupción del embarazo utilizado durante décadas. Posteriormente, se utilizaron diferentes fármacos, fundamentalmente las prostaglandinas y el methotrexate para la interrupción del embarazo pero no fue hasta la aprobación de la mifepristona en Francia, en el año 1988, que se puso a disposición de las mujeres la posibilidad de abortar evitando una intervención quirúrgica.
Mientras que el aborto quirúrgico se caracteriza por la inmediatez de sus resultados el aborto farmacológico conlleva la ventaja de la participación de la mujer, una mayor autonomía e intimidad, la sencillez y la percepción de menor invasión. Debido a estas diferencias, en algunos países europeos el porcentaje de abortos farmacológicos se va incrementando gradualmente, al tiempo que las técnicas más invasivas asociadas al aborto quirúrgico se relegan para edades gestacionales más avanzadas. Para una mayor expansión del uso del aborto farmacológico, resulta necesario que la eficacia del mismo sea equiparable a la del aborto quirúrgico o instrumental3.
En la actualidad, y de acuerdo con la legislación española vigente, una mujer embarazada hasta 7 semanas que desee interrumpir su gestación puede optar entre un tratamiento médico basado en la utilización de 2 fármacos (mifepristona más misoprostol) y un tratamiento quirúrgico o instrumental. No obstante, existe evidencia de buena calidad basada en ensayos clínicos randomizados que ha demostrado la eficacia y seguridad del aborto farmacológico hasta las 9 semanas (63 días) de gestación.
En este artículo nos planteamos realizar una revisión sobre el aborto médico o farmacológico realizado hasta los 63 días de embarazo analizando las pautas más eficaces y seguras así como la aceptabilidad por parte de las mujeres.
Fármacos utilizados en el aborto médicoHasta el momento se han utilizado diferentes fármacos: prostaglandinas, mifepristona y methotrexate, solos o en combinación entre ellos. Inicialmente las dosis, pautas e intervalos entre dosis de estos fármacos se determinaron empíricamente. Cada grupo farmacológico tiene diferentes mecanismos de acción.
MifepristonaLa mifepristona es un derivado de la noretisterona que se fija al receptor de la progesterona con una mayor afinidad que esta última pero sin activar su receptor por lo que realmente actúa como una antiprogesterona4. La mifepristona pertenece al grupo de los moduladores selectivos del receptor de progesterona y tiene la capacidad de bloquear la fijación de la progesterona a su receptor. Es un esteroide con actividad antiprogesterona y antiglucocorticoidea y hasta la fecha ha sido aprobada en diferentes países con las indicaciones de: interrupción voluntaria del embarazo (IVE) temprano, dilatación cervical previa a un aborto instrumental (debida al efecto directo en el colágeno y/o en la escaso fibra muscular lisa que existe en el cérvix), preparación para la IVE inducida por prostaglandinas del segundo trimestre y para la expulsión de un feto muerto durante el tercer trimestre de la gestación5.
Además de bloquear el receptor de progesterona, la mifepristona actúa a nivel miometrial incrementando la sensibilidad del músculo a la acción de las prostaglandinas6. Este efecto potenciador de la actividad de las prostaglandinas se produce a las 24-36 horas de su administración y tiene gran relevancia clínica7.
El efecto antiglucocorticoide de la mifepristona se produce a 2 niveles: a nivel central inhibiendo el efecto feedback del cortisol sobre la hipófisis8 y a nivel periférico compitiendo con el efecto del cortisol a nivel vascular y/o cutáneo9. A pesar de este efecto no se han descrito, a las dosis utilizadas en el aborto farmacológico, signos clínicos o de laboratorio de fallo suprarrenal lo que corrobora su seguridad10.
ProstaglandinasLas prostaglandinas son un conjunto de sustancias de carácter lipídico derivadas de los ácidos grasos de 20 carbonos (eicosanoides) que contienen un anillo ciclopentano y constituyen una familia de mediadores celulares, con efectos diversos, a menudo contrapuestos. Sus acciones son múltiples y algunas tienen utilidad práctica, como la PGE1, que se utiliza en clínica para mantener abierto el ductus arteriosus, en niños con cardiopatías congénitas (alprostadil) y para el tratamiento o prevención de la úlcera gastroduodenal (misoprostol). La PGE2 (dinoprostona) se emplea para la maduración cervical en la inducción del parto, la expulsión del feto muerto y el tratamiento de la mola hidatiforme o el aborto espontáneo.
Las prostaglandinas reblandecen y dilatan el cuello uterino al mismo tiempo que son potentes estimuladoras de las contracciones uterinas, actuando sobre la musculatura lisa del miometrio11.
MethotrexateEl methotrexate es un antagonista del ácido fólico que inhibe la síntesis de purinas y pirimidinas y resulta citotóxico para el trofoblasto12. Su uso está bastante extendido en el tratamiento farmacológico del embarazo ectópico pero no está tan aceptado en el aborto farmacológico, aunque sigue siendo utilizado en aquellos países donde la mifepristona no está comercializada, como por ejemplo en Canadá.
Régimen combinadoA pesar de que algunos autores preconizan el uso de una sola sustancia, especialmente el misoprostol, para el aborto farmacológico13, son muchas las evidencias que recomiendan la utilización de una pauta combinada de mifepristona y misoprostol. El hallazgo de que el efecto de la mifepristona sobre la contractilidad uterina se veía incrementado por el uso concomitante de prostaglandinas6 dio lugar al planteamiento de tratamientos combinados o secuenciales en los que la administración de mifepristona es seguida por la administración, a las 36-48 horas, de una prostaglandina, fundamentalmente misoprostol.
Dosis de mifepristonaLos estudios iniciales utilizando dosis únicas de mifepristona para el aborto farmacológico concluyeron que la dosis única de 600mg era más efectiva que las dosis de 400 o 200mg y obtenía unas tasas de eficacia del 76,9 al 82,1%14. A pesar de la recomendación de utilizar dosis de 600mg de mifepristona, una revisión y metaanálisis de la Cochrane que comparó la eficacia de las dosis de 200mg de mifepristona con la de 600mg, utilizadas en protocolo de administración con prostaglandinas, concluyó que la eficacia de ambas dosis era similar para alcanzar el objetivo de producir un aborto completo15. Posteriormente, Lievre et al., utilizando los mismos estudios incluidos en el metaanálisis de la Cochrane, pero estableciendo diferentes objetivos, concluyeron en su metaanálisis que si bien no existen diferencias entre las dosis de 200 y 600mgpara obtener abortos completos, reducir la dosis de mifepristona, de 600-200mg se asocia a un aumento del número y tasa de embarazos evolutivos16. Este metaanálisis recibió varias críticas argumentando, sobre todo, el amplio rango de los intervalos de confianza y la inclusión de la unidad en los mismos17. Ante las posibles dudas que podían surgir tras este metaanálisis y los cambios asociados en la práctica clínica que podía producirse, una nueva revisión de la Cochrane actualizada al año 2011 concluyó que la efectividad de la pauta mifepristona más misoprostol no se reduce al disminuir la dosis de la primera a 200mg en gestaciones de hasta 63 días de evolución18. En la actualidad la dosis habitual de mifepristona que se utiliza en la mayoría de los protocolos es la de 200mg aunque en países como Francia, Suecia o Austria el protocolo que sigue utilizándose es el de 600mg de mifepristona más 400mcg de misoprostol oral, que, por otra parte, es el protocolo oficialmente aceptado por la Agencia Europea del Medicamento.
Dosis de misoprostolLa dosis de misoprostol habitualmente utilizada es la de 800mcg. La dosis administrada de misoprostol puede, en ocasiones, diferir mucho de la dosis que finalmente alcanza sus receptores para ejercer su efecto. Las condiciones de almacenamiento y manejo de los envases de misoprostol pueden determinar modificaciones en las características farmacológicas del principio activo. Un estudio realizado en diferentes países europeos en el que se compararon diferentes propiedades del misoprostol en una muestra de comprimidos extraídos de su envase y mantenidos al aire libre durante 48 horas frente a otra muestra de comprimidos que se mantuvieron en su envase y, por tanto, sin contacto con el aire ambiente, se observó que los primeros aumentaron su peso y fragilidad, el porcentaje de agua se incrementó un 78% y la dosis de misoprostol había disminuido un 5,1%. Esta disminución de la dosis total de misoprostol puede condicionar la eficacia del tratamiento. La conclusión es que los comprimidos de misoprostol deben de mantenerse almacenados en las condiciones en que son fabricados, hasta el momento de su utilización19.
La introducción de la dosis de 800mcg de misoprostol, combinada con mifepristona, se basó en el análisis de 3 estudios pivotales realizados en el Reino Unido, Francia y Estados Unidos, en los que se reclutaron 5.743 mujeres y se testaron diferentes dosis de misoprostol20–22.
Pauta de tratamientoComo consecuencia, la pauta más extendida de aborto farmacológico, antes de los 63 días de gestación (9 semanas), es la de administrar 200mg de mifepristona por vía oral seguidos por 800mcg de misoprostol administrados por vía vaginal o bucal 36-48 horas después.
Como quiera que en algunas ocasiones esperar 36-48 horas para finalizar el procedimiento puede resultar penoso para las mujeres, se ha intentado acortar este periodo de tiempo. En un ensayo clínico realizado en Escocia, 225 pacientes fueron randomizadas a utilizar el misoprostol a las 6 horas de haber ingerido la mifepristona y otras 225 a utilizarlo a las 36-48 horas. En el primer grupo, el porcentaje de tratamientos efectivos fue del 79 frente al 92% en el segundo grupo, confirmando la conveniencia de retrasar la dosis de misoprostol hasta al menos 36 horas después de la toma de mifepristona23. La explicación de este decalage necesario estriba en que la vida media de la mifepristona es de 24-30 horas.
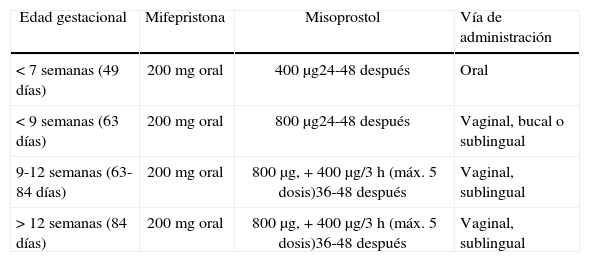
Una revisión sistemática y metaanálisis de 5 ensayos clínicos randomizados en los que se evaluó la eficacia del tratamiento en función del intervalo transcurrido entre la toma de la mifepristona y la del misoprostol, concluyó que, a pesar de no existir diferencias estadísticamente significativas, las tasas de éxito son mayores cuando el misoprostol se administra después de pasadas, al menos, 8 horas24. En la tabla 1 se presentan las diferentes pautas de tratamiento recomendadas por la Organización Mundial de la Salud (OMS).
Diferentes pautas de tratamiento recomendadas por la Organización Mundial de la Salud
| Edad gestacional | Mifepristona | Misoprostol | Vía de administración |
| <7 semanas (49 días) | 200mg oral | 400μg24-48 después | Oral |
| <9 semanas (63 días) | 200mg oral | 800μg24-48 después | Vaginal, bucal o sublingual |
| 9-12 semanas (63-84 días) | 200mg oral | 800μg,+400μg/3h (máx. 5 dosis)36-48 después | Vaginal, sublingual |
| >12 semanas (84 días) | 200mg oral | 800μg,+400μg/3h (máx. 5 dosis)36-48 después | Vaginal, sublingual |
Fuente: Tang et al.71.
La vía de administración de la mifepristona es la oral mientras que el misoprostol puede ser administrado por vías diferentes. A pesar de que las evidencias muestran que misoprostol es más efectivo cuando se administra por vía vaginal, algunos estudios han puesto de manifiesto que administrado de forma sublingual en gestaciones menores de 59 días es igual de efectivo25. También se han descrito otras vías alternativas de administración entre las que la bucal presenta buenos resultados y menos efectos secundarios26. En un ensayo clínico randomizado en el que se reclutaron 1.122 mujeres embarazadas de hasta 9 semanas de gestación y que fueron asignadas a utilizar, tras una dosis de 200mg de mifepristona, bien 400mcg de misoprostol bien 800mcg, en ambos casos por vía bucal, el porcentaje de éxito fue similar entre ambos grupos (96%) pero las mujeres que utilizaron la dosis de 400mcg de misoprostol presentaron menos náuseas, fiebre y escalofríos que las que utilizaron la dosis de 800mcg27. Las evidencias parecen indicar que la vía bucal se asocia a menos efectos secundarios, en especial escalofríos, que la vía sublingual y, por ello debería de ser recomendada28.
No obstante, en un ensayo clínico comparativo entre 2 dosis de misoprostol (400 y 800mcg) y 2 vías de administración (vaginal y sublingual), tras la administración de 200mg de mifepristona, no se pudo demostrar la no inferioridad de la dosis de 400mcg frente a la de 800mcg y esta última, aunque igual de efectiva con independencia de la vía de administración, presentó menos efectos secundarios al ser utilizada por vía vaginal29. En este estudio la dosis de 400mcg de misoprostol se asoció a un mayor riesgo de aborto incompleto (p<0,01). La conclusión fue que cuando se utilicen 200mg de mifepristona deben de administrarse 800mcg de misoprostol, en una sola dosis, preferiblemente por vía vaginal.
En el año 2005 se publicó en el New England una serie de 4 muertes asociadas al aborto farmacológico30 lo que planteó algunas dudas sobre la seguridad de uso del misoprostol por vía vaginal, argumentando que puede deteriorar la inmunidad fisiológica de la vagina y facilitar las infecciones por Clostridium sordelli, que pueden llegar a ocasionar un shock séptico fatal31,32.
Además, el efecto del misoprostol administrado por vía vaginal puede verse condicionado por la capacidad de absorción del epitelio vaginal que, a su vez, está condicionada por la presencia de sangre, infecciones o por la modificación de su pH fisiológico33. De ahí que hayan surgido dudas sobre la conveniencia de administrar el misoprostol por vía vaginal cuando el pH vaginal está aumentado, como en el caso de la vaginosis bacteriana. En un estudio farmacocinético, en el que se compararon los niveles plasmáticos de misoprostol (área bajo la curva [AUC] y concentración máxima [Cmax]) tras ser administrado por vía vaginal a 10 mujeres con vaginosis bacteriana y a otras 10 sin patología vaginal, se observó que la elevación del pH producida por la vaginosis determina una menor AUC y una menor Cmax, lo que puede comprometer la eficacia del tratamiento34. Por todo lo anteriormente expuesto se ha estimado que el cambio en la vía de administración del misoprostol, de vaginal a bucal, junto con la adición de tratamiento antibiótico se puede acompañar de una reducción del riesgo de tener una infección grave del 93%35.
A nivel práctico estos hallazgos sugieren la conveniencia de evitar la vía vaginal cuando exista una infección vaginal. Es importante destacar que en nuestro país disponemos de misoprostol en presentación para ser administrado por vía vaginal autorizada por la Agencia Española del Medicamento con indicación de maduración cervical.
Eficacia del aborto farmacológicoLa eficacia del aborto médico se evalúa de acuerdo a 2 parámetros: por una parte por el porcentaje de mujeres que experimentan una expulsión completa y, por tanto, no requieren un legrado o aspiración posterior y, por la otra, por el porcentaje de gestaciones evolutivas a pesar del uso del tratamiento. En esta revisión hemos encontrado numerosos estudios que consideran diversidad de dosis, pautas y diferentes límites de edad gestacional para el análisis de la efectividad del aborto farmacológico. Atendiendo a las recomendaciones de la OMS, limitamos nuestras conclusiones a la eficacia en gestaciones de ≤63 días, a pesar de que existe evidencia del efecto de la pauta de mifepristona y misoprostol en gestaciones de mayor tiempo36–38.
En general se puede afirmar que la eficacia del tratamiento depende de las dosis de fármaco utilizadas pero no de la vía por la que se administran. Un estudio español en el que se incluyeron 450 pacientes que fueron tratadas con 600mg de mifepristona y 400mcg de misoprostol por vía vaginal, obtuvo tasas de aborto completo del 96,7%, con independencia de la edad gestacional39. La vía de administración puede influir en la frecuencia e intensidad de los efectos secundarios, pero no parece determinar la eficacia del tratamiento. Un estudio prospectivo francés en el que se recogió información de 15.447 abortos farmacológicos realizados en gestaciones de hasta 49 días, la tasa global de eficacia fue del 97,43%40.
Según algunos estudios la eficacia del tratamiento está relacionada con la edad gestacional de forma que en los embarazos muy tempranos, en los que el saco gestacional no es todavía visible, la tasa de fallos del aborto farmacológico es mayor41. Como consecuencia de este estudio, en algunos protocolos se recomienda esperar 1-2 semanas para la administración del tratamiento farmacológico cuando en una ecografía realizada no se visualiza el saco gestacional.
Uno de los problemas que se plantea ante el fallo de eficacia del tratamiento y la subsiguiente gestación evolutiva es la posibilidad de inducir malformaciones fetales. En un estudio prospectivo francés en el que se recogió información de 105 embarazos evolutivos tras tratamiento con mifepristona sola (46 casos) o con mifepristona más misoprostol (59 casos) la tasa general de malformaciones congénitas mayores fue de 4,2% (intervalo de confianza [IC] 95%:1,2-10,4%), superior al 2-3% de la población general42.
También se utilizan mifepristona y misoprostol en el tratamiento del aborto espontáneo, aunque en este caso las series de pacientes son más limitadas y los resultados parecen ser peores. En un estudio retrospectivo publicado en el año 2014, en el que se incluyeron 168 pacientes con aborto espontáneo de menos de 13 semanas, la tasa global de eficacia del tratamiento fue del 61%, o lo que es lo mismo, hubo que realizar evacuación uterina posterior al 39% de las pacientes43. Una de las posibles causas aducidas por los autores para su baja tasa de éxito fue la de realizar la evaluación postratamiento demasiado pronto, en ocasiones a las 24 horas del sangrado, encontrando como hallazgos un endometrio engrosado de más de 30mm de espesor o incluso el saco gestacional. Retrasar la evaluación hasta, al menos 2 semanas después del tratamiento, permite disminuir el número de intervenciones quirúrgicas y elevar, como consecuencia, la tasa de eficacia.
Efectos secundariosLos efectos secundarios más frecuentemente asociados a la pauta de tratamiento con mifepristona más misoprostol son: dolor abdominal (56%), náuseas (54%), cansancio (50%) y mastodinia (28%)44. En general, el principal efecto secundario que refieren hasta el 75% de las mujeres que se someten a un aborto farmacológico es el dolor45. El dolor suele estar asociado al uso de prostaglandinas46. La revisión sistemática de Jackson et al.47 puso de manifiesto que la mejor medida de tratamiento del dolor, para la mayoría de las mujeres que recurren al aborto farmacológico en el primer trimestre de su gestación, es la toma de ibuprofeno antes de que el dolor se establezca. Además se ha podido demostrar que el ibuprofeno es más eficaz que el paracetamol48 y no interfiere en la efectividad del misoprostol49. Un reciente ensayo clínico randomizado en el que 250 mujeres que usaron fármacos para interrumpir su embarazo fueron aleatorizadas a utilizar ibuprofeno de forma profiláctica o de forma terapéutica no encontró diferencias entre ambas estrategias de tratamiento del dolor50. A pesar de estas aparentes contradicciones de los estudios presentados parece razonable, con base en los conocimientos que ya tenemos sobre el efecto de los antinflamatorios no esteroideos en el control del dolor, recomendar el uso de ibuprofeno antes de que el dolor se establezca, o sea de manera profiláctica.
Existe evidencia, soportada por estudios con muestra muy amplia, sobre la seguridad del aborto farmacológico. En un análisis de una base de datos americana en la que se recogieron los eventos producidos durante los años 2009 y 2010 en 233.805 abortos farmacológicos realizados, la tasa de eventos adversos definidos como: ingreso hospitalario posterior, transfusión sanguínea, asistencia en urgencias, administración de antibióticos intravenosos, infección que requirió el uso de antibióticos endovenosos o muerte, fue del 0,16%51. Una revisión del año 2005 en la que se incluyeron datos de 95.163 mujeres tratadas con mifepristona más misoprostol informó de una tasa de complicaciones mayores del 0,2%, siendo la más frecuente el sangrado abundante52. En este mismo estudio la necesidad de realizar una transfusión sanguínea como consecuencia del sangrado abundante se produjo en 0,5 casos/1.000 tratamientos. En el estudio de Gaudu et al.40 únicamente en 4 de los 15.447 abortos farmacológicos recogidos (0,03%) fue necesario realizar una transfusión sanguínea. Los datos disponibles reafirman la seguridad del aborto farmacológico.
Controles posterioresUna de las cuestiones que preocupa a los profesionales que proveen aborto farmacológico es la de comprobar el éxito del tratamiento y descartar abortos incompletos o gestaciones evolutivas. Como se ha comentado con anterioridad, retrasar la evaluación hasta al menos 2 semanas después del tratamiento permite disminuir el número de intervenciones quirúrgicas y elevar, como consecuencia, la tasa de eficacia. Con esta finalidad se han utilizado desde la ecografía hasta los síntomas clínicos pasando por la realización de un test de embarazo.
Puede parecer que la ecografía es el método más adecuado para evaluar el éxito o fracaso del tratamiento pero en un estudio prospectivo realizado en 217 mujeres que utilizaron el aborto médico, la efectividad del test de embarazo para predecir la finalización de la gestación fue del 98,5% frente al 89,8% de la ecografía53. Las limitaciones de la ecografía vienen condicionadas por la subjetividad del explorador así como por la ausencia de consenso sobre el punto de corte del espesor endometrial que hay que considerar para determinar que el tratamiento no ha sido efectivo. Por ello, y para simplificar el procedimiento de evaluación del éxito terapéutico, se ha propuesto la utilización de test de embarazo semicuantitativos realizados en orina. De acuerdo a los resultados del estudio de Grossman et al.54 la sensibilidad del test en orina para detectar embarazos evolutivos es del 88,6% (IC 95%: 74,6-95,7%) y su especificidad del 71,7% (IC 95%: 57,4-82,8%). No obstante hay que tener en cuenta la posibilidad de la no negativización del test de embarazo y, como consecuencia, la existencia de falsos positivos que pueden complicar el manejo. En un ensayo clínico randomizado en el que 1.080 mujeres que se sometieron a aborto farmacológico fueron evaluadas mediante test de embarazo a la semana y a las 2 semanas de la administración de mifepristona, el porcentaje de falsos positivos fue del 91,8% en la primera semana y del 65,8% en la segunda, cuando se utilizó un test de alta sensibilidad55.
Sin embargo, otros estudios han encontrado resultados contrapuestos. La fiabilidad de un test de embarazo semicuantitativo utilizado en casa por las propias mujeres para determinar el éxito o fracaso del aborto farmacológico fue evaluada en un estudio prospectivo realizado en Palo Alto, California, Estados Unidos, en el que se incluyeron 490 mujeres. La sensibilidad y especificidad del test de embarazo para detectar un embarazo evolutivo fueron, respectivamente, del 100 y del 97%56.
En otro estudio de similares características, diseño y protocolo realizado en Vietnam en el que se incluyeron 300 mujeres, el test de embarazo identificó los 11 embarazos evolutivos a pesar del tratamiento farmacológico, mostrando una sensibilidad del 100% y una especificidad del 89,7%57. Como consecuencia de estos estudios se desprende que para facilitar el manejo del aborto medicamentoso, las mujeres pueden utilizar, con elevada efectividad, un test semicuantitativo de embarazo domiciliario.
En el empeño de minimizar las actuaciones relacionadas con el aborto farmacológico se ha propuesto que para evaluar el éxito o fracaso del mismo se puedan utilizar, únicamente, los síntomas asociados a una gestación evolutiva o los síntomas relacionados con un aborto incompleto. Las conclusiones de un estudio caso-control diseñado con el objetivo de responder a la duda de la fiabilidad de los síntomas para concluir la eficacia del tratamiento determinó que es necesaria una prueba objetiva (por ejemplo un test de embarazo) de terminación del embarazo58.
Una de las cuestiones clave durante el proceso de asesoramiento para el aborto farmacológico es el abordaje del uso de un método anticonceptivo efectivo con posterioridad. Una estrategia que ha demostrado ser aceptable en un estudio piloto realizado en 20 mujeres ha sido la inserción de un implante a los 15 minutos de la toma de la dosis de mifepristona. En este estudio la tasa de continuación del método, al año, fue del 87,5%59. A pesar de la baja muestra y de que se trata de un estudio piloto, parece razonable, con la finalidad de evitar un nuevo embarazo no deseado relacionado con el mal uso de un método anticonceptivo, ofrecer a las mujeres que se van a someter a un aborto farmacológico los métodos de larga duración (LARC).
De acuerdo a las últimas recomendaciones del Colegio Americano de Obstetras y Ginecólogos (ACOG), y a pesar de no existir evidencia sobre sensibilización materna en gestaciones de menos de 6 semanas, se recomienda determinar el grupo sanguíneo y Rh de las mujeres que solicitan aborto farmacológico para administrar gammaglobulina anti-D a las mujeres Rh negativas60.
Preferencias de las mujeresSe puede afirmar que, en general, las mujeres están satisfechas con el aborto farmacológico, con tasas de satisfacción que rondan el 94%29.
A pesar de que en países como Estados Unidos el porcentaje de abortos farmacológicos está aumentando progresivamente61, en España, así como en otros países europeos, el uso del aborto farmacológico es bajo, a pesar de la recomendación de la OMS para que el aborto se desmedicalice en la medida de lo posible. Algunas de las barreras aducidas para el bajo uso del aborto farmacológico son la necesidad de evaluaciones periódicas en la consulta y la percepción negativa que del protocolo pueden tener las pacientes.
En un ensayo clínico randomizado, multicéntrico, realizado en 4 países europeos (Noruega, Suecia, Finlandia y Austria) se incluyeron 929 pacientes embarazadas de menos de 64 días62 a las que se trató con el protocolo estándar de mifepristona 200mg seguida de 800mcg de misoprostol. Cuatrocientos sesenta y dos pacientes fueron randomizados para autoadministrarse el misoprostol y realizar una autoevaluación en su domicilio mientras que 467 pacientes fueron randomizados para acudir a la clínica a seguir los controles protocolizados. El porcentaje de mujeres que debió someterse a un aborto instrumental debido al fallo del método farmacológico fue del 6% en ambos grupos (RR 0,5; IC 95%:-2,5-3,6). La conclusión del ensayo fue que el aborto farmacológico puede realizarse en el domicilio eliminando las molestias de las visitas regulares a una consulta de ginecología y con los mismos resultados de efectividad que el aborto farmacológico realizado bajo estricta supervisión médica.
Con el fin de facilitar el acceso al aborto farmacológico se están diseñando diferentes estrategias encaminadas a simplificar los pasos a seguir en el proceso médico que lo acompaña. Un reciente ensayo clínico diseñado para evaluar la eficacia del tratamiento médico del aborto según el profesional sanitario responsable: matrona o ginecólogo y en el que se reclutaron 1.180 mujeres que fueron tratadas con una pauta de 200mg de mifepristona seguidos de 800mcg de misoprostol vaginal a las 24-48 horas, concluyó que los resultados relacionados con la efectividad y efectos secundarios del tratamiento fueron similares en ambos grupos. Sin embargo, las mujeres prefirieron que el proceso fuese dirigido o coordinado por una matrona más que por un ginecólogo63.
En el estudio francés de Gaudu et al.40 no hubo diferencias en las tasas de éxito del aborto farmacológico cuando fue realizado por ginecólogos o por médicos generales (96,48 y 96,44% respectivamente). Algunos datos sugieren que hacer más extensiva la prescripción del aborto farmacológico puede ayudar a su accesibilidad y aceptación por parte de las mujeres. En una encuesta realizada en 90 mujeres de 18-45 años de edad que estaban esperando a ser atendidas en una consulta de medicina interna de Nueva York, un 87,1% de las mismas reconoció que en caso de embarazo no deseado preferiría que el tratamiento le fuese administrado por su médico de cabecera o médico internista64.
Otro de los factores que influye en la expansión del aborto farmacológico es el entrenamiento que tengan los profesionales sanitarios encargados de su provisión. En una encuesta realizada entre los residentes de Ginecología que finalizaron su residencia en el año 2007 en Estados Unidos, solo el 41% de ellos respondió haber sido entrenado en el manejo del aborto farmacológico65. En este escenario de satisfacción de las mujeres con el aborto farmacológico, pueden parecer sorprendentes las conclusiones del estudio presentado por la Asociación de Clínicas Acreditadas para la Interrupción del Embarazo (ACAI), en las que se declara que la mayor parte de las mujeres que han sido correctamente informadas y tienen libertad de elección escogen el método instrumental de aborto frente al método farmacológico (78 vs. 22%)66. Probablemente estos datos necesiten una explicación más detallada y profunda por cuanto resultan paradójicos respecto a otras actuaciones médicas en las que resulta preponderante la opción de tratamiento médico frente al tratamiento quirúrgico. En nuestra especialidad tenemos ejemplos recientes de tratamientos farmacológicos que han desbancado a tratamientos quirúrgicos entre los que destaca, especialmente, el dispositivo liberador de levonorgestrel que ha contribuido al descenso del número de histerectomías realizadas por sangrado menstrual abundante.
Los datos de este estudio español son contradictorios con los de un estudio francés, del año 2011, en el que se realizó una encuesta a una muestra de 4.650 mujeres, representativa del total de mujeres que optan por la finalización de su embarazo en Francia. De acuerdo a los resultados de este estudio, cuando la mujer tiene la capacidad de participar en el proceso de la toma de decisiones sobre la manera de finalizar su embarazo, la mayoría opta por la opción médica antes que por la quirúrgica67.
Para facilitar el acceso al aborto farmacológico se han puesto en marcha experiencias pioneras, como la prescripción y control mediante telemedicina. En un estudio realizado en Iowa, Estados Unidos, tanto las mujeres que fueron atendidas mediante este sistema como los médicos que participaron en el protocolo, consideraron que el acceso telemático permite una mayor accesibilidad a las mujeres y un adecuado control del proceso por parte de los profesionales68. Incluso, un estudio multicéntrico realizado en Estados Unidos, en el que la mifepristona fue tomada por las mujeres en sus domicilios, concluyó que esta estrategia era bien aceptada por las pacientes y los médicos con resultados altamente eficaces69.
ConclusionesEn una revisión sistemática publicada en el año 2013 en la que se identificaron 87 estudios en los que se utilizó una dosis de 200mg mifepristona seguida por misoprostol en gestaciones viables de hasta 63 días, se recogieron datos de 47.283 mujeres tratadas. El porcentaje de fallos del tratamiento fue del 4,8% (tasa de eficacia: 95,2%). En un 1,1% de los casos el embarazo continuó a pesar del tratamiento. El fallo del tratamiento se asoció a gestaciones de más de 8 semanas (56 días), un intervalo entre la mifepristona y el misoprostol menor a 24 horas, dosis de misoprostol de 400mcg y a la administración del misoprostol por vía oral70. Por todo ello se puede concluir que el régimen más efectivo y seguro para obtener el aborto farmacológico sería el de 200mg de mifepristona seguidos a las 36-48 horas por una dosis única de 800mcg de misoprostol por vía bucal o vaginal.
Conflicto de interesesLos autores de este artículo son miembros del Advisory Board nacional de Nordik Pharma, compañía que comercializa en España la mifepristona. Nordic Pharma no ha intervenido ni en la redacción ni revisión de este artículo. Los autores son los únicos responsables del mismo.