La saturación fetal de oxígeno (SpO2), medida mediante oximetría del pulso por reflectancia es del 43%1 y aumenta en los primeros minutos tras el parto hasta el 80-90%2-4. La transición al ambiente extrauterino provoca un estrés oxidativo, como se demuestra tanto en el marco experimental como en el clínico5-7. La moderada tendencia prooxidante asociada con el nacimiento es beneficiosa para el neonato porque contribuye a la activación de una serie de vías metabólicas7,8. Sin embargo, durante la asfixia perinatal y tras la reanimación se genera una oleada de radicales de oxígeno (RO) y de nitrógeno (RN) que supera la capacidad antioxidante del neo-nato y daña a las estructuras celulares, las enzimas, el ARN y el ADN9,10. El empleo de una gran concentración de oxígeno durante la reanimación (reperfusión) favorece el estrés oxidativo11,12, aumenta el daño a los órganos13 e incluso la mortalidad14-16. Estudios anteriores han demostrado que el sistema de defensa antioxidante madura hacia el final de la gestación17,18. Aunque los corticoides prenatales aumentan sustancialmente la actividad de las enzimas antioxidantes y de las enzimas del ciclo redox del glutatión, parece que no son capaces de eliminar por completo el estrés oxidativo, especialmente en los recién nacidos de extremo bajo peso al nacimiento19,20. Además, se ha demostrado que la hiperoxia, incluso durante breves períodos, contribuye al desarrollo de enfermedades relacionadas con el oxígeno, como la retinopatía de la prematuridad (RP) y la displasia bron-copulmonar21,22 (DBP).
Nuestro objetivo fue demostrar que es posible alcanzar una SpO2 prefijada del 85% a los 10 min del nacimiento con la misma eficacia utilizando una FiO2 baja (30%) o una FiO2 alta (90%). Además, el empleo de este abordaje nos permitió disminuir parcialmente la carga de oxígeno administrada en los primeros y posiblemente decisivos minutos de vida postnatal a estos neo-natos, que son especialmente propensos a desarrollar toxicidad por oxígeno.
MÉTODOSPacientesEste fue un ensayo clínico aleatorizado prospectivo integrado en un estudio más exhaustivo sobre la toxicidad del oxígeno en neonatos de edad gestacional extremadamente baja (µ 28 semanas de gestación) realizado en dos centros de referencia de nivel III, el Hospital Universitario La Fe (Valencia) y el Hospital Clínico Universitario San Carlos (Madrid), durante un período de 18 meses (septiembre de 2005 a febrero de 2007). Los comités científicos y éticos de ambos hospitales aprobaron el protocolo de estudio, y los padres firmaron el consentimiento informado de cada uno de los casos incluidos. Los criterios de inclusión fueron edad gestacional µ 28 semanas de gestación, haber nacido en uno de los dos hospitales de maternidad y necesidad de reanimación activa en la sala de partos. Así pues, los niños al nacer estaban bradicárdicos (FC µ 80 lpm), hipotónicos o hiporreactivos y eran incapaces de mantener una respiración activa o eficaz. Los criterios de exclusión fueron la incertidumbre de la edad gestacional, las malformaciones congénitas importantes o las anomalías cromosómicas. El consentimiento informado se obtuvo en cuanto las madres ingresaron al hospital e, inmediatamente antes del nacimiento, los niños fueron asignados aleatoriamente al grupo de concentración de oxígeno elevada (Hox) o baja (Lox) utilizando sobres sellados con números aleatorios ofrecidos por un programa informático automático. Los mezcla-dores de oxígeno se fijaron para administrar una FiO2 del 90% en los niños del grupo Hox y del 30% en los del grupo Lox. Anteriormente habíamos observado que el empleo inicial de aire ambiente a menudo (~ 60%) no pudo estabilizar adecuadamente a los neonatos de bajo peso al nacimiento extremadamente prematuros con una edad gestacional comprendida entre las 24 y 26 semanas. Por lo tanto, optamos por iniciar la ventilación del grupo con oxígeno escaso con una FiO2 del 30%. Los partos múltiples se consideraron como una unidad a efectos de la aleatorización.
ProcedimientosLos niños fueron reanimados por un neonatólogo adjunto, un residente de Pediatría y una enfermera en la mayoría de los partos. El neonatólogo adjunto dirigió el procedimiento de reanimación y se encargó de la vía respiratoria. El residente siguió sus indicaciones, valoró la respuesta clínica y modificó la mezcla de oxígeno según fuera necesario. La enfermera fue responsable de la monitorización de la SpO2 y del registro continuo de los incidentes. Los procedimientos de reanimación siguieron las normas recomendadas por la Sociedad Española de Neonatología, pero incluyeron las modificaciones del manejo de la FiO2 descritas más adelante23,24. Todos los niños fueron reanimados con reanimador en T (Neopuff, Fisher & Paykel, Auckland, Nueva Zelanda), que ofreció la posibilidad de presión positiva continua en las vías respiratorias (CPAP) o de ventilación a presión positiva intermitente con presión final espiratoria (VPPI + PEEP). Raras veces se utilizaron otros medios de ventilación, como la bolsa autohinchable o la de anestesia.
Inmediatamente después del nacimiento, el paciente se colocó bajo un calefactor por radiación y se realizó una breve aspiración mientras la enfermera colocaba una sonda preductal para medir la SpO2 (oxímetro del pulso Radical; Masimo, Irvine, California, Estados Unidos) en la muñeca derecha y la conectaba al oxímetro del pulso25. La frecuencia cardíaca fue evaluada inicialmente mediante auscultación y, tras obtener una SpO2 fiable mediante la oximetría del pulso, se interrumpió la auscultación excepto durante los procedimientos de intubación para la valoración de la correcta colocación del tubo endotraqueal y de la respuesta cardíaca adecuada, o cuando fue evidente la pérdida de la señal por el oxímetro del pulso. Las lecturas de SpO2 se consideraron fiables cuando la frecuencia cardíaca tomada mediante la auscultación directa y la ofrecida por el oxímetro del pulso coincidían. Para conseguir la máxima sensibilidad se utilizaron sensores HiFi® con promedio cada dos segundos, como recomendaban estudios anteriores25. Los niños que mostraron aumento del trabajo respiratorio o dificultades respiratorias pese al CPAP (inicialmente 4 cm H2O) fueron intubados para evitar un mayor deterioro. La decisión de intubar no estuvo normalizada y fue tomada por el neonatólogo adjunto tras evaluar la respuesta del recién nacido a las maniobras de reanimación. Este posible sesgo fue introducido a solicitud de los neonatólogos por la dificultad de normalizar todas las situaciones clínicas comprometidas. Se registró la SpO2, la frecuencia cardíaca y la temperatura, y se documentaron los incidentes como la intubación o la administración de fármacos.
La FiO2 inicial de ambos grupos se ajustó (aumentándola o disminuyéndola) en un 10% cada 60-90 s según la frecuencia cardíaca (FC) y la SpO2. La FC se consideró el principal parámetro clínico que reflejó la eficacia de las maniobras de reanimación. Si la FC disminuyó por debajo de 100 lpm, la FiO2 se incrementó automáticamente en un 10%, y se realizaron nuevos cambios según la respuesta obtenida. Sin embargo, si la FC estuvo en los valores normales (µ 100 lpm), adoptamos una conducta expectante y no modificamos la FiO2 sólo por los valores de SpO2. Por el contrario, con una FC persistentemente µ 100 lpm, confiamos en la SpO2 para disminuir gradualmente la FiO2 intentando mantener una SpO2 del 85%. El mezclador de oxígeno sólo se colocó directamente con el oxígeno al 100% en las situaciones sumamente graves (bradicardia persistente µ 60 lpm durante más de 30 s). Sin embargo, cuando la SpO2 aumentó con mucha rapidez a > 90%, la FiO2 se redujo juiciosamente cada 90 s a intervalos del 10% para evitar los cambios bruscos del tono vascular pulmonar. Se determinó la gasometría en la sangre de cordón y al ingreso en la UCIN.
EstadísticasSe calcularon los estadísticos descriptivos de todos los parámetros del estudio. El análisis estadístico se realizó en dos pasos. Primero se realizó el análisis unilateral de la varianza (ANOVA). Cuando la comparación global de los grupos fue significativa, las diferencias entre los grupos fueron estudiadas con el método de Tukey. Las diferencias se consideraron significativas a un valor de p < 0,05.
Para comparar las variables sin distribución normal se utilizaron los estadísticos no paramétricos. Así, se utilizó la prueba U de Mann Whitney para la comparación de muestras no apareadas, y la de Kruskal Wallis para las comparaciones apareadas. Los datos obtenidos durante el tiempo (% de niños que respiraban aire ambiente) se compararon con la prueba de Mantel-Haens-zel, lo que permitió obtener un valor de p en cada momento y valorar las diferencias entre los dos grupos26. Los análisis estadísticos se realizaron con SPSS 11 (Chicago, IL, Estados Unidos).
RESULTADOSCaracterísticas de la poblaciónLa tabla 1 muestra algunas características clínicas importantes de los grupos Lox y Hox. Los pacientes incluidos constituyeron una población homogénea. Por lo tanto, no se encontraron diferencias relativas a la edad gestacional, el peso al nacimiento, el sexo, los corticoides prenatales, el tipo de parto, el pH de cordón o la puntuación de Apgar al minuto y los cinco minutos entre los dos grupos.
TABLA 1. Características de los neonatos de escasa edad gestacional (≤ 28 semanas de gestación) reanimados inicialmente con una baja (30%; grupo Lox) o alta (90%; grupo Hox) fracción inspiratoria de oxígeno (FiO2) en la sala de parto
Apoyo respiratorio en la sala de partosCuatro recién nacidos del grupo Lox (21,0%) y cinco del grupo Hox (30,4%) necesitaron de intubación endotraqueal inmediata para conseguir una ventilación adecuada (fig. 1). Además, nueve neonatos del grupo Lox y 13 del grupo Hox pasaron, tras la CPAP inicial con mascarilla, a presión positiva intermitente (VPPI + mascarilla). De ellos, cinco recién nacidos del grupo Lox y siete del grupo Hox necesitaron intubación y ventilación mecánica (VM). Así pues, de 19 neonatos del grupo Lox, seis (31,5%) ingresaron en la UCIN con CPAP con mascarilla, cuatro (21,0%) con VPPI + mascarilla y 12 (52,2%) intubados y con ventilación mecánica. No se encontraron diferencias entre los grupos Lox y Hox en relación con el tipo de ventilación administrada al nacer y al ingreso en la UCIN. No se realizó masaje cardíaco ni se administró surfactante ni medicación a ningún niño en la sala de partos. Tampoco hubo diferencias significativas respecto al intervalo hasta alcanzar la estabilización clínica (grupo Lox frente a grupo Hox: 16,5 ± 0,4 min frente a 182 ± 0,7 min) o la temperatura corporal al ingreso en la UCIN (grupo Lox frente a grupo Hox: 36,3 ± 0,7 frente a 36,5 ± 0,4 ºC).
Fig. 1. Diagrama de flujo que muestra el tipo de apoyo respiratorio utilizado en recién nacidos de edad gestacional extremadamente baja (RNEGEB) reanimados inicialmente con una FiO2 del 30% (grupo Lox) o del 90% (grupo Hox). CPAP: presión positiva en las vías respiratorias; VM: ventilación mecánica; VPPI: ventilación a presión positiva intermitente.
Fracción inspiratoria de oxígeno (FiO2)La tabla 2 muestra la cronología de la FiO2 administrada a ambos grupos tras el pinzamiento del cordón. Durante los tres minutos siguientes al nacimiento, la FiO2 del grupo Hox fue significativamente mayor que la del grupo Lox (p < 0,01) y a los cuatro minutos del nacimiento las diferencias de FiO2 entre los grupos seguían siendo estadísticamente significativas. Luego, la FiO2 no fue significativamente distinta entre los grupos durante el resto del ensayo. No hubo diferencias respecto a la FC entre los grupos en ningún momento. El mezclador de oxígeno se fijó directamente con el oxígeno al 100% por una bradicardia persistente en 3 ocasiones en el grupo Lox y en 4 ocasiones en el grupo Hox. Si aceptamos una frecuencia respiratoria media de 60 respiraciones por minuto y una media del volumen corriente de 4 ml/kg, los niños del grupo Hox recibieron 864,0 ml/kg, y los del grupo Lox 465,8 ml/kg, de oxígeno puro, por lo que los primeros recibieron 398,4 ml de oxígeno/kg más al final del período de reanimación/es-tabilización que los segundos.
TABLA 2. Frecuencia cardíaca (FC) y fracción inspiratoria de oxígeno (FiO2) utilizada para conseguir una saturación prefijada del 85% a los diez minutos del pinzamiento del cordón en neonatos de edad gestacional extremadamente baja reanimados inicialmente con una fracción inspiratoria de oxígeno baja (30%) o alta (90%)
Porcentaje de recién nacidos ventilados con aire ambienteLa figura 2 muestra el porcentaje de recién nacidos en cada momento (minutos tras el nacimiento) que respiraron aire ambiente en ambos grupos. Como muestra la figura, el porcentaje de niños del grupo Lox que respiró aire ambiente fue siempre mayor que en el grupo Hox. A los cinco minutos, los niños del grupo Lox que respiraban aire ambiente fueron el 42,0% del total, a los 10 min el 73,7% y a los 15 min el 84,2%. Sin embargo, en el grupo Hox, los expuestos al aire ambiente a los cinco minutos fueron el 26,0%, a los 10 min el 43,5% y a los 15 min el 61,0%. La comparación de ambos grupos con la prueba de Mantel-Haenszel demostró una mayor probabilidad de recibir ventilación con aire ambiente a los 10 y 20 min del nacimiento (p < 0,05) en el grupo Lox, como muestra la figura 2.
Fig. 2. Porcentaje de neonatos ventilados con aire ambiente en cada momento tras el parto en el grupo Lox (FiO2 inicial: 30%) y en el grupo Hox (FiO2 inicial: 90%). La probabilidad de ser ventilado con aire ambiente (prueba de Mantel-Haenszel) fue significativamente mayor en el grupo Lox a los 10 y 20 min del nacimiento (*p < 0,05).
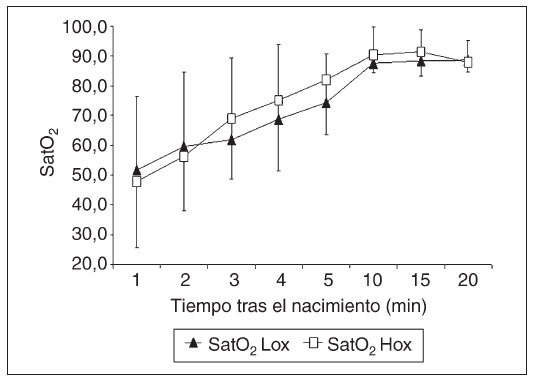
Saturación de oxígeno medida con el oxímetro del pulsoEl tiempo necesario para obtener lecturas fiables del oxímetro del pulso no fue estadísticamente distinto entre los grupos (grupo Lox frente a Hox: 85,6 ± 28,4 frente a 88,2 ± 30,5; n.s.). La figura 3 muestra la evolución de la SpO2 en ambos grupos. La SpO2 inicial en ambos grupos fue muy similar (Lox: 45,7 ± 13,5% frente a Hox: 48,6 ± 4,7%; n.s.). Luego, la SpO2 aumentó en ambos grupos y alcanzó valores del 85,8 ± 5,9% en el grupo Hox a los 5,5 ± 0,7 min y en el grupo Lox del 86,2 ± 8,4% a los 6,5 ± 1,1 min. A los 10 min del pinzamiento del cordón ambos grupos habían alcanzado saturaciones similares (grupo Lox frente a grupo Hox: 86,9 ± 2,5% frente a 88,7 ± 2,5%, n.s.). Tampoco hubo diferencias significativas en la SpO2 entre ambos grupos 20 min después del nacimiento.
Fig. 3. Saturación de oxígeno medida con oximetría del pulso (SpO2) en los primeros 20 min de vida en recién nacidos de edad gestacional extremadamente baja (RNEGEB) asignados aleatoriamente al grupo Lox (FiO2 inicial 30%) y al grupo Hox (FiO2 inicial 90%). SatO2: saturación de oxígeno.
Seguridad del procedimientoAunque el grupo Lox alcanzó la estabilización clínica (definida como una FC > 100 lpm, SpO2 µ 85% y buena respuesta a estímulos) en la sala de partos antes que el grupo Hox, las diferencias encontradas no fueron estadísticamente significativas (grupo Lox frente a grupo Hox: 16,5 ± 0,4 min frente a 18,2 ± 0,7 min). Tampoco se encontraron diferencias significativas en la temperatura corporal (grupo Lox frente a grupo Hox: 36,3 ± 0,7 frente a 36,5 ± 0,4 ºC) y el pH sanguíneo (grupo Lox frente a grupo Hox: 7,18 ± 1,1 frente a 7,14 ± 0,9) entre ambos grupos al ingresar en la UCIN.
Mortalidad y complicaciones a largo plazoNo hubo fallecimientos en ninguno de los grupos en el período neonatal (< 28 días). Sin embargo, 4 recién nacidos del grupo Lox y 3 del grupo Hox murieron por complicaciones respiratorias o neurológicas (hemorragia intracraneal) durante la hospitalización. Además, aunque con el tamaño de la muestra de este estudio no se encontraron diferencias significativas entre los grupos respecto a la incidencia de complicaciones agudas (persistencia del ductus arterial, síndrome de apnea/bradi-cardia, hemorragia intra/periventricular) o a largo plazo (displasia broncopulmonar, retinopatía de la prematuridad, disfunción neurosensorial) al alta entre los supervivientes, hubo una tendencia al aumento de la incidencia de DBP (Hox frente a Lox; p < 0,065) y de RP (Hox frente a Lox; p < 0,069) en el grupo Hox al alta.
ANÁLISISCada año nacen más de 130 millones de niños en todo el mundo, y se estima que tanto en los países en desarrollo como en los industrializados la asfixia provoca el 25% de las muertes neonatales precoces27. El desarrollo tecnológico, la regionalización y el aumento de la competencia del apoyo en cuidados intensivos han conseguido disminuir la mortalidad neonatal precoz y global28. Sin embargo, los neonatólogos han mostrado interés por la revisión crítica de los procedimientos de reanimación no basados en la evidencia y utilizados durante muchos años sólo en los 10 o 15 últimos años16,29-36. Además, ahora sabemos que las intervenciones sobre los recién nacidos extremadamente prematuros en los primeros minutos de vida pueden contribuir no sólo a la supervivencia, sino también a un desarrollo posterior31,37-39.
En este marco, la administración de oxígeno en la sala de partos ha sido tema de debate en la última década. Distintos ensayos clínicos prospectivos han demostrado que la reanimación se puede conseguir con seguridad comenzando con aire ambiente en la mayoría de las circunstancias, y que el empleo de oxígeno puro puede ejercer efectos nocivos y un aumento de la mortalidad10-16. En condiciones normales, los radicales de oxígeno generados por la hipoxia/reoxigenación son neutralizados casi por completo por el sistema defensivo antioxidante. Sin embargo, la maduración de la enzima antioxidante sólo se produce al final del embarazo, por lo que los niños prematuros son propensos al estrés oxidativo20. Aunque la bibliografía contenga pocas pruebas de la administración de oxígeno, es bien sabido que, para la reanimación de los neonatos de edad gestacional extremadamente baja, el oxígeno puede dañar mucho al neonato, y que sólo unos minutos de hiperoxia pueden causar un estrés oxidativo prolongado11. Además, el empleo de mayores concentraciones de oxígeno, incluso durante breves períodos de tiempo, puede contribuir al desarrollo de la displasia broncopulmonar o de la retinopatía de la prematuridad21,22. ILCOR40 ha indicado que, pese a la insuficiente evidencia para cambiar nuestra práctica actual de utilizar oxígeno al 100%, se debe tener cuidado al reanimar a los neonatos prematuros porque (textual): “Un oxígeno tisular excesivo puede causar una lesión oxidativa y se debe evitar, especialmente en el recién nacido prematuro”. Por lo tanto, supusimos que el empleo de una menor FiO2 para la reanimación de recién nacidos de extremo bajo peso al nacimiento podría ser eficaz y contribuir a la disminución de las posibles consecuencias negativas de un exceso de oxígeno. Hace poco se ha estudiado la saturación arterial de oxígeno tras el nacimiento2-4 y se han fijado los valores seguros de oxígeno en los neonatos prematuros alrededor del 85-90%22,41. Por lo tanto, nuestro objetivo fue alcanzar una SpO2 del 85% a los 10 min del nacimiento tratando de evitar la hiperoxemia, que se ha asociado con el empleo de grandes concentraciones de oxígeno durante la reanimación neonatal7,12. Aunque ILCOR no defiende el empleo del oxímetro del pulso como ayuda fiable para ajustar las necesidades de FiO240, hemos demostrado, en estudios previos, que la SpO2 predice claramente la reanimación neonatal eficaz, especialmente si se combina con una adecuada respuesta de la frecuencia cardíaca41. En nuestro estudio no hubo diferencias entre los niños reanimados con concentraciones de oxígeno bajas o elevadas acerca del tiempo necesario para alcanzar la SpO2 deseada. Sin embargo, como muestra la figura 2, la probabilidad de que los niños reanimados con poco oxígeno sean ventilados con aire ambiente para mantener una SpO2 adecuada una vez alcanzada la estabilización clínica fue significativamente mayor (p < 0,05). Además, los niños ventilados inicialmente con una FiO2 del 90% recibieron, por término medio, 398,4 ml de oxígeno puro/kg de más en los cinco primeros minutos de vida respecto a los que recibieron una mezcla de gases inicial con una FiO2 del 30%. Es posible que el aumento del número de neonatos por grupo hubiera hecho significativa esta diferencia. Es importante subrayar que en la actualidad se dispone de poca información fiable en relación con la saturación “normal” de los neonatos muy prematuros. La mayoría de estos neonatos se ventilan inmediatamente tras el nacimiento, generalmente con una FiO2 superior al 21%; por lo que los valores de la saturación no reflejan una situación fisiológica. No obstante, la saturación preductal del 50% en los 2-3 primeros minutos de vida y del 70% a los 5 min del nacimiento se considera normal2-4. Además, algunos neonatos prematuros muestran saturaciones cercanas al 30-40% con una frecuencia cardíaca adecuada durante los 10 primeros minutos de vida31,34,41-43. Nuestros niños, con independencia de la FiO2 utilizada, mostraron valores de SpO2 de este orden, y alcanzaron la saturación prefijada unos 10 min después del pinzamiento del cordón. Sólo intervinimos cuando la baja saturación se acompañó de una marcada hipotonía, la ausencia del esfuerzo respiratorio y, especialmente, de bradicardia persistente. Antes de comenzar este ensayo estuvimos tentados de iniciar la ventilación con aire ambiente en el grupo Lox. Sin embargo, se ha demostra42 que la reanimación inicial de los recién nacidos de edad gestacional extremadamente baja (especialmente con una edad gestacional entre 24 y 26 semanas) con aire ambiente conduce a menudo al fracaso en la consecución de la estabilización clínica (frecuencia cardíaca y oxigenación adecuadas). Estos resultados concuerdan con nuestra experiencia anterior, no publicada. En general se ha creído que la ventilación con una gran concentración de oxígeno provoca vasodilatación pulmonar y mejoría de la función miocárdica; sin embargo, estudios recientes han demostrado la ausencia de esta mejoría, e incluso que la hiperoxemia puede ser nociva y alterar la capacidad de respuesta de la vascularización pulmonar a la NO o a la acetilcolina44-48. En nuestro estudio no encontramos ventajas clínicas en el empleo de mayores concentraciones de oxígeno para iniciar la reanimación.
Ambos grupos mantuvieron una saturación, una frecuencia cardíaca y un estado clínico adecuados. Además, la necesidad de tratamientos respiratorios adicionales fue similar en ambos grupos. En próximos estudios, deberemos monitorizar la SpO2 pre y posductal para evaluar el cortocircuito en estos recién nacidos. Sin embargo, los niños ventilados inicialmente con mayores concentraciones de oxígeno recibieron una cantidad de oxígeno mucho mayor, y presumiblemente están en riesgo de mayor daño inducido por radicales de oxígeno libres, aunque no se detectaron diferencias en la mortalidad neonatal precoz ni en la total.
Este estudio tiene varias limitaciones. En primer lugar, el número de recién nacidos reclutados no nos permite realizar un estudio de cohorte con suficiente potencia estadística. En segundo lugar, pudimos diseñar este estudio para alcanzar la SpO2 objetivo del 85% a los 15 o 20 min del pinzamiento del cordón, especialmente en los neonatos más prematuros, lo que representa un resultado aceptable. Finalmente, el empleo de aparatos que detecten el CO2 espirado (Pedicap, Nellcor Puritan Bennett, Pleasanton, CA), el empleo de técnicas óptimas para la ventilación con mascarilla y la estricta monitorización y la limitación de la presión positiva son importantes para los futuros estudios.
Sin embargo, concluimos que los neonatos de extremo bajo peso al nacimiento pueden reanimarse con seguridad con una FiO2 del 30%. Luego se debe ajustar individualmente la FiO2 según la SpO2 y la FC hasta la estabilización.
AGRADECIMIENTOSEsta investigación fue financiada por la beca #PI05105 del FIS (Fondo de Investigaciones Sanitarias) a M. Vento, y una Ayuda de investigación de la Fundación ONCE 2005 a M. Moro y M. Vento.
Estamos muy agradecidos al Profesor R.J. Martin (Rainbow Babies & Children’s Hospital; Cleveland; Ohio, Estados Unidos) por su revisión y edición del manuscrito.
Registrado en www.clinicaltrials.gov (# NCT00494702).
Correspondencia: Máximo Vento, PhD, MD, Department of Pediatrics, Neonatal Research Unit, Neonatology Service, Hospital Universitario Materno Infantil La Fe, Avenida de Campanar, 21, E4009 Valencia, España.
Correo electrónico: maximo.vento@uv.es