Los anticuerpos contra la enzima carboxilasa del ácido glutámico (GAD) están asociados con una serie de diferentes trastornos neurológicos. Si bien su relación con el síndrome de persona rígida o stiff-person síndrome (SPS), la ataxia cerebelosa y la epilepsia autoinmune es bien conocida, el espectro completo de síntomas se encuentra aún sin definir, y se ha relacionado con otras condiciones como la encefalitis límbica y el deterioro cognitivo.
Se describe la evolución clínica de una paciente con ataxia cerebelosa por anti-GAD que, tras permanecer estable durante años1, desarrolla síntomas de SPS y un rápido deterioro cognitivo.
Mujer de 65 años, diabética, que a la edad de 50 desarrolló una ataxia cerebelosa subaguda. Se realizó un extenso estudio en el que se objetivaron títulos altos de anti-GAD en sangre mediante radioinmunoanálisis (23.000U/ml), que se confirmaron posteriormente por inmunoblot. Habiendo descartado otras potenciales causas de afectación cerebelosa, se diagnosticó de ataxia por anti-GAD, y fue tratada con dosis bajas de prednisona y azatioprina. Con dicho tratamiento se mantuvo clínicamente estable hasta los 61 años, cuando progresó la ataxia y comenzó a presentar síntomas de SPS. Se instauró, entonces, tratamiento con inmunoglobulinas endovenosas (IgIV) 0,4mg/kg/día/durante 5 días, consiguiendo una mejoría parcial del SPS, pero no de la ataxia.
A finales de ese mismo año el marido comenzó a referir episodios puntuales de confusión y desorientación que se fueron haciendo más evidentes en pocos meses. En ese momento el Mini Mental State Examination (MMSE) arrojó una puntuación de 18/29, predominando la alteración en orientación en tiempo y memoria. Los análisis de sangre descartaron otras posibles causas de demencia salvo la presencia repetida de anticuerpos anti-GAD. En un EEG de vigilia se objetivó lentificación cerebral difusa, sin actividad epiléptica.
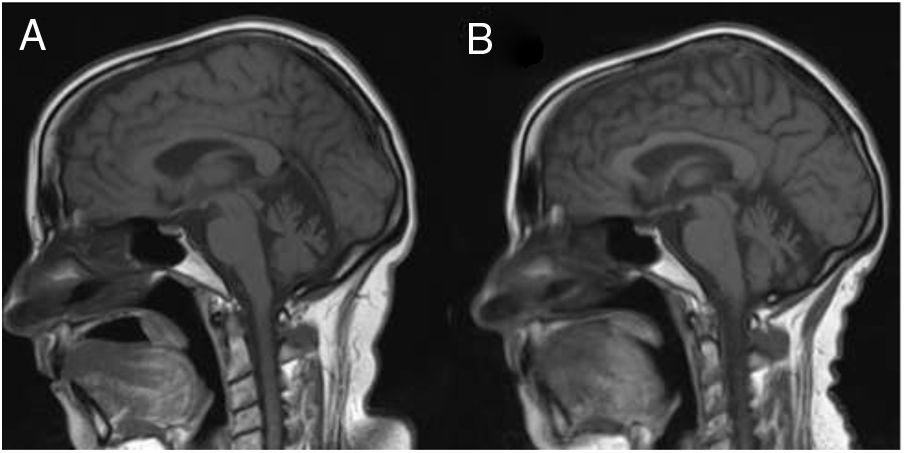
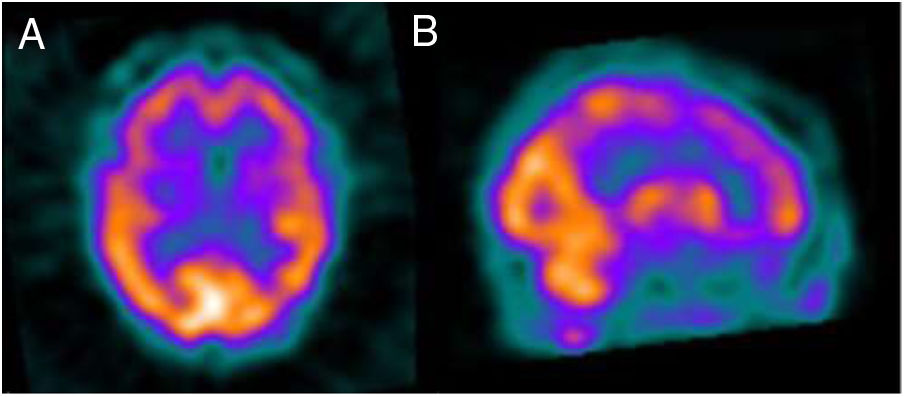
En pocos meses la paciente no recordaba fechas, confundía a los familiares y delegó progresivamente casi todas las actividades instrumentales en su marido. La RM de control mostró una importante atrofia vermiana y, en menor grado, de los hemisferios cerebelosos, sin otras alteraciones (fig. 1). Un SPECT cerebral tras la administración de HMPAO-Tc99m objetivó una hipoperfusión frontal bilateral, así como temporal y parietal izquierdas, compatibles con una demencia frontotemporal (fig. 2). Paciente y familiar rechazaron la realización de una punción lumbar.
RM cerebral, secuencia potenciada en T1, corte sagital, realizada al inicio de la clínica (A) y a los 3 años de evolución (B). A) Se observa una atrofia cerebelosa, predominantemente vermiana. B) Se observa una mayor atrofia cerebelosa, así como una leve prominencia de los surcos cerebrales, de predominio perisilviano.
Se decidió administrar una nueva tanda de IgIV a la misma dosis que se repitió con un intervalo de un mes, sin beneficio clínico. El deterioro cognitivo continuó progresando en meses, constatándose mediante un estudio neuropsicológico más extenso un deterioro de perfil frontotemporal severo. En ese momento, teniendo la paciente 63 años, y año y medio después del inicio del deterioro, el MMSE fue de 9/30. Se desestimaron tratamientos inmunomoduladores más agresivos.
El espectro clínico del síndrome anti-GAD se encuentra aún en continua revisión2,3. Son muy escasas las publicaciones que analizan la presencia de deterioro cognitivo en pacientes con anticuerpos anti-GAD, aunque la evidencia actual parece apoyar la existencia de una asociación entre ambos4,5. Un caso aislado publicado de deterioro cognitivo asociado a anti-GAD describe un perfil clínico similar al de nuestra paciente, sin respuesta a tratamiento con IgIV6. La decisión de iniciar tratamientos inmunomoduladores agresivos en estos pacientes debería tomarse con cautela, teniendo en cuenta la situación individual de cada paciente y la respuesta variable que tienen otros síndromes relacionados con anti-GAD como la ataxia cerebelosa. Por otro lado, la adición secuencial de ataxia cerebelosa, SPS y deterioro cognitivo rápidamente progresivo en una misma paciente, demuestra que los diferentes síntomas pueden coexistir y aparecer de forma asíncrona, superponiéndose. Nuestro caso tiene la limitación de no disponer de la monitorización titulada de anticuerpos a lo largo de la evolución de la enfermedad. Sin embargo, futuros estudios podrían aportar evidencia respecto a si variaciones en la titulación de anticuerpos pudieran relacionarse con la aparición de nuevos síntomas.
Con esta publicación se pretende contribuir a aumentar el conocimiento en torno al espectro clínico anti-GAD. El deterioro cognitivo puede formar parte de las manifestaciones clínicas asociadas, y un bajo índice de sospecha puede retrasar su diagnóstico y la oportunidad de iniciar o intensificar el tratamiento en estadios iniciales de deterioro.