Los ictus de circulación posterior suponen el 15-20% del total de los ictus isquémicos, pero asocian en más del 60% de los casos mal pronóstico funcional y vital. Por sus características clínicas y radiológicas, su diagnóstico y manejo son más complejos que los de los ictus de circulación anterior. El objetivo de nuestro trabajo es analizar a los pacientes con ictus del sistema vertebrobasilar tratados con trombectomía mecánica en nuestra comunidad y definir sus características.
MétodoAnálisis retrospectivo-descriptivo de los pacientes con ictus del sistema vertebrobasilar tratados mediante trombectomía mecánica en nuestro centro (hospital de referencia para la enfermedad cerebrovascular urgente en Aragón). Se definen características basales, factores de riesgo, signos y síntomas de presentación, escalas radiológicas, variables del procedimiento, tiempos de atención y pronóstico funcional a los 3 meses.
ResultadosSe incluyó a 37 pacientes (39,5% mujeres) con una edad media de 68,34 ± 14,1 años. La primera causa etiológica fue la cardioembólica (42,1%), seguida de la aterotrombótica (28,9%). La localización más frecuente de la obstrucción fue el top de la basilar (55,3%). Los síntomas más frecuentes fueron somnolencia (76,3%), déficit motor (71,1%) y náuseas (55,3%). Se logró reperfusión exitosa (mTICIx ≥ 2b) en el 81,1% de pacientes. El pronóstico funcional a 90 días fue desfavorable (mRS < 3) en el 59% de los casos.
ConclusionesLos ictus de circulación posterior se asocian a una importante morbimortalidad. Su presentación clínica subaguda y larvada dilata los tiempos de atención y dificulta una identificación precoz. La trombectomía mecánica es un procedimiento seguro y eficaz, si bien son necesarios más estudios que esclarezcan la selección de pacientes.
Posterior circulation stroke accounts for 15%-20% of ischaemic strokes, but is associated with poor functional and vital prognosis in over 60% of cases. Due to its clinical and radiological peculiarities, diagnosis and management are more complex than in anterior circulation stroke. This study analyses and characterises patients with vertebrobasilar strokes treated with mechanical thrombectomy in our region.
MethodsWe conducted a descriptive, retrospective analysis of patients with vertebrobasilar stroke and treated with mechanical thrombectomy at our centre, a reference centre for cerebrovascular emergencies for the region of Aragon. We recorded baseline characteristics, risk factors, signs and symptoms at onset, radiological assessment scale scores, procedure-related variables, management times, and functional prognosis at 3 months.
ResultsWe selected 37 patients (39.5% women; mean age [standard deviation], 68.34 [14.1] years). Cardioembolic stroke (42.1%) was the most common aetiology, followed by atherothrombosis (28.9%). The top of the basilar artery was the most common site of obstruction (55.3%). The most frequent clinical features were somnolence (76.3%), motor deficits (71.1%), and nausea (55.3%). Successful reperfusion (mTICI ≥ 2b) was achieved in 81.1% of patients. Functional outcome at 90 days was poor (mRS < 3) in 59% of patients.
ConclusionsPosterior circulation stroke is associated with high rates of morbidity and mortality. Its subacute, nonspecific clinical course prolongs management times and hinders early detection. Mechanical thrombectomy is a safe and effective procedure, although further studies are needed to establish the optimal patient profile.
El ictus o enfermedad cerebrovascular aguda es uno de los principales desafíos de salud pública global. Constituye la segunda causa de muerte en el mundo occidental y la primera causa de discapacidad permanente a nivel mundial1. La incidencia estimada en nuestro medio es de 187,4 casos por cada 100.000 habitantes y se prevé que debido al envejecimiento de la población dicha cifra aumente en un 35% entre 2015 y 20352,3.
Los ictus de circulación posterior suponen el 15-20% del total de los ictus isquémicos, pero se asocian en más del 60% de los casos con un mal pronóstico funcional y vital4-7. El caso concreto de la obstrucción de la arteria basilar se considera el más devastador de entre todos los subtipos. Supone menos del 3% de ictus totales y el 5-10% de las oclusiones de gran vaso y, sin embargo, acarrea una importantísima morbimortalidad, con secuelas graves en más del 70% de los pacientes4,7-9.
Estos ictus de circulación posterior o del sistema vertebrobasilar (IVB) presentan varias características diferenciales que influyen en su manejo. Por sus particularidades clínicas y radiológicas existen mayores dificultades a la hora de llegar al diagnóstico. La forma de presentación difiere sustancialmente del cuadro característico de circulación anterior y las escalas y técnicas diagnósticas más utilizadas son menos sensibles a su detección. Además, todavía existen incógnitas sobre el manejo ideal y las indicaciones de terapias endovasculares de reperfusión. Al contrario que en los casos de circulación anterior, hasta este año no había disponibles estudios aleatorizados que demostraran la eficacia y seguridad de la trombectomía mecánica (TM) en el IVB. Las últimas indicaciones son pacientes en las primeras 24 h desde el inicio, con clínica moderada-grave (NIHSS > 10) y en los que exista tejido potencialmente salvable.
El objetivo de nuestro trabajo es analizar a los pacientes con IVB tratados mediante TM en nuestra comunidad, describir sus características basales, su forma clínica de presentación, las características radiológicas, así como los parámetros procedimentales asociados a esta entidad y su pronóstico funcional.
Material y métodosSe hizo un análisis retrospectivo-descriptivo a partir de una base de datos de registro prospectivo de los pacientes con IVB tratados mediante TM en el Hospital Universitario Miguel Servet (hospital de referencia para la enfermedad cerebrovascular aguda en Aragón y único con disponibilidad de TM).
Se seleccionaron los procedimientos realizados entre febrero de 2015 y junio de 2021 y se incluyó en nuestro análisis a aquellos pacientes con diagnóstico de ictus isquémico agudo por oclusión del sistema vertebrobasilar, objetivada mediante angio-TC, resonancia magnética cerebral o arteriografía cerebral con sustracción digital. Se excluyó a aquellos pacientes con ictus transitorio de circulación posterior, oclusión de arterias cerebrales posteriores aisladas y a aquellos con oclusión simultánea de circulación anterior y posterior. La decisión de tratamiento endovascular fue tomada de forma conjunta por el neurólogo de la guardia específica de neurovascular y el neurointervencionista en función de las características clínicas y radiológicas de cada paciente.
Las variables demográficas recogidas fueron: edad, sexo, estado funcional previo (mediante la escala de Rankin modificada, mRS) y factores de riesgo cerebrovascular (hipertensión, dislipidemia, diabetes mellitus, fibrilación auricular, consumo de alcohol, tabaquismo, enfermedad cardiaca previa, enfermedad arterial periférica e ictus previo). Las variables clínicas y asistenciales recogidas fueron el nivel de consciencia a su llegada (mediante la Escala de Coma de Glasgow), cuantificación del déficit neurológico al momento de activación del código ictus (mediante el formulario de National Institute of Health Stroke Scale, NIHSS) y la necesidad de intubación.
De forma retrospectiva se recabaron de los informes de urgencias las manifestaciones clínicas al momento de activación del código ictus, agrupadas en los siguientes signos y síntomas: somnolencia, náuseas/vómitos, síndrome vertiginoso, ataxia, cefalea, déficit motor (y su lateralidad), déficit sensitivo, disartria, alteración del lenguaje, alteración oculomotriz, alteración pupilar, déficit campimétrico visual y parálisis facial con componente superior e inferior. Así mismo, se reflejaron el hospital de referencia, la administración de fibrinólisis, el tiempo de inicio-primera puerta (intervalo desde el inicio de la sintomatología hasta la llegada a centro hospitalario), tiempo puerta-aguja (en aquellos que recibieron fibrinólisis intravenosa), tiempo puerta-ingle y tiempo inicio-reperfusión.
De la TM se registraron la duración del procedimiento, el número de pases, el grado de reperfusión lograda (mediante escala TICI modificada) y la modalidad de anestesia empleada. Se estudió la presencia del signo de la arteria basilar hiperdensa y se valoraron las escalas pc-Posterior circulation Alberta stroke program early CT score (ASPECT), Basilar artery on computed tomography angiography (BATMAN) y Posterior circulation computed tomography angiography vascular score (pc-CTA score). La puntuación de las escalas fue calculada por un único radiólogo especialista, cegado al resto de las variables. La localización de la obstrucción se dividió en 4categorías: tándem vertebral-arteria cerebral posterior (AV-ACP), tándem vertebrobasilar (AVB), troncobasilar y top de la basilar (Top). Las variables resultado evaluadas fueron la cuantificación del déficit neurológico a las 24 h (mediante escala NIHSS), el fallecimiento durante el ingreso, la aparición de hemorragia cerebral sintomática en las primeras 36 h (sICH; Escala ECASS III) y el estado funcional a los 90 días (según puntuación mRS).
En el análisis estadístico descriptivo se estudió el ajuste de las variables cuantitativas a la distribución normal mediante la prueba de Kolmogorov-Smirnov. Las variables dicotómicas se compararon mediante la χ2 de Pearson o la prueba exacta de Fisher y se describieron mediante la distribución porcentual de frecuencias de cada categoría. Las variables cuantitativas continuas con distribución normal se compararon mediante la prueba de la t de Student y se presentan como media ± desviación estándar. La prueba de la U de Mann-Whitney se empleó para la comparación de variables continuas que no se ajustan a la normal, ofreciendo su mediana y rango intercuartílico. La significación estadística se fijó en p < 0,05.
Para el análisis estadístico se empleó R-Studio (versión R: 4.1.2.)10 con el paquete de R tableone11. Las gráficas y tablas se confeccionaron mediante Microsoft Word 365 (Microsoft) y con los paquetes de R Ggplot2, Ggpubr y Waffle12-14.
Este estudio ha sido aprobado por el Comité de Ética de Investigación de la Comunidad de Aragón (CEICA) con número de referencia CI-PI21/089.
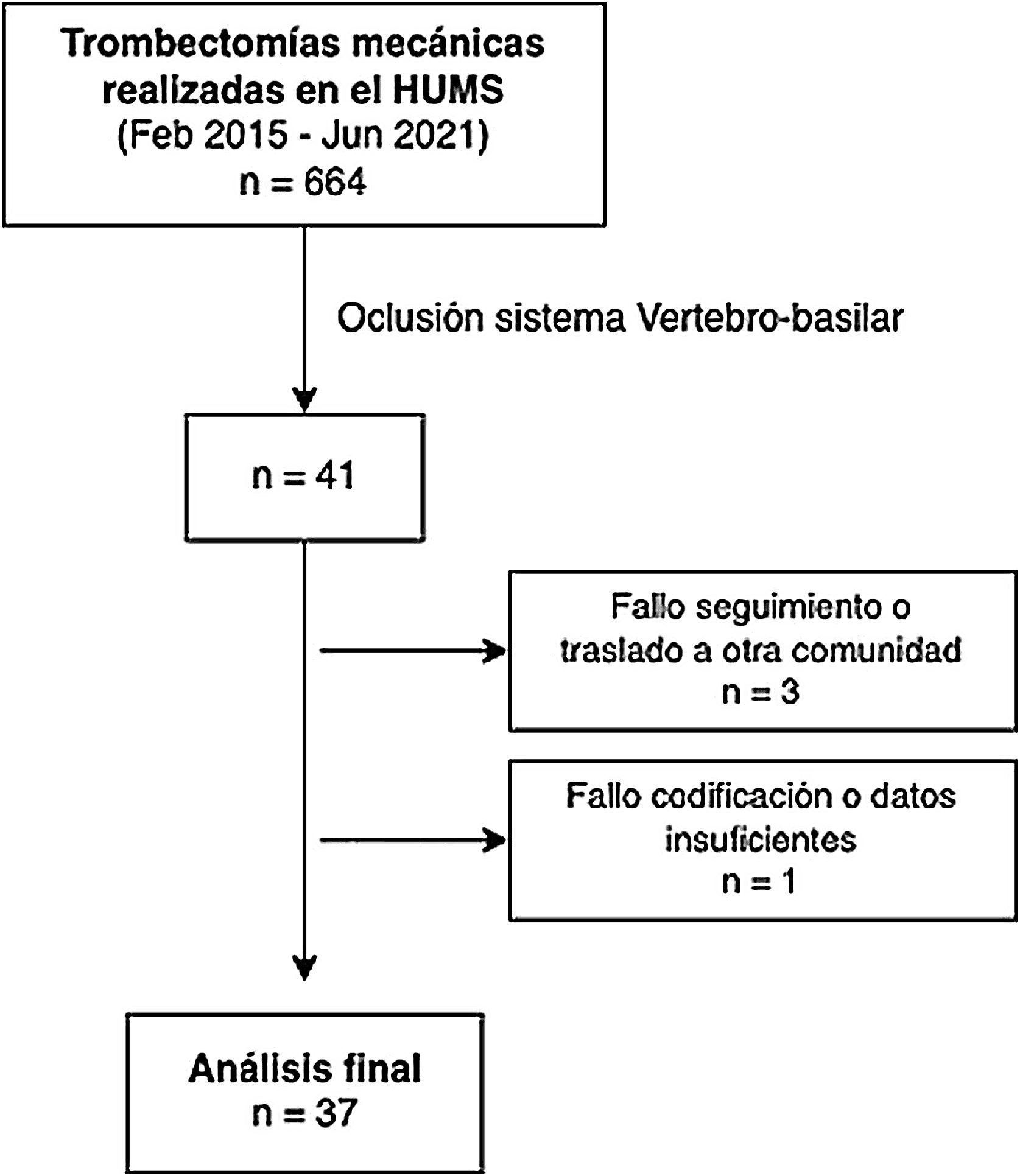
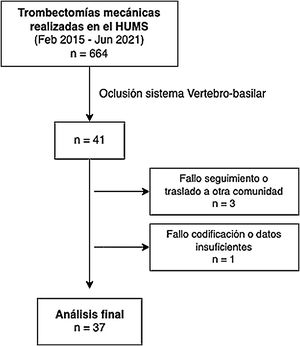
ResultadosSe registró a 664 pacientes tratados con TM entre febrero de 2015 y junio de 2021. De ellos se seleccionó a 41 (6,17%) con oclusión del sistema vertebrobasilar. Se excluyó a 3 pacientes por pérdida de seguimiento debido al traslado a otra comunidad o a centro privado. Otro paciente fue excluido por fallo de codificación y falta de datos (fig. 1).
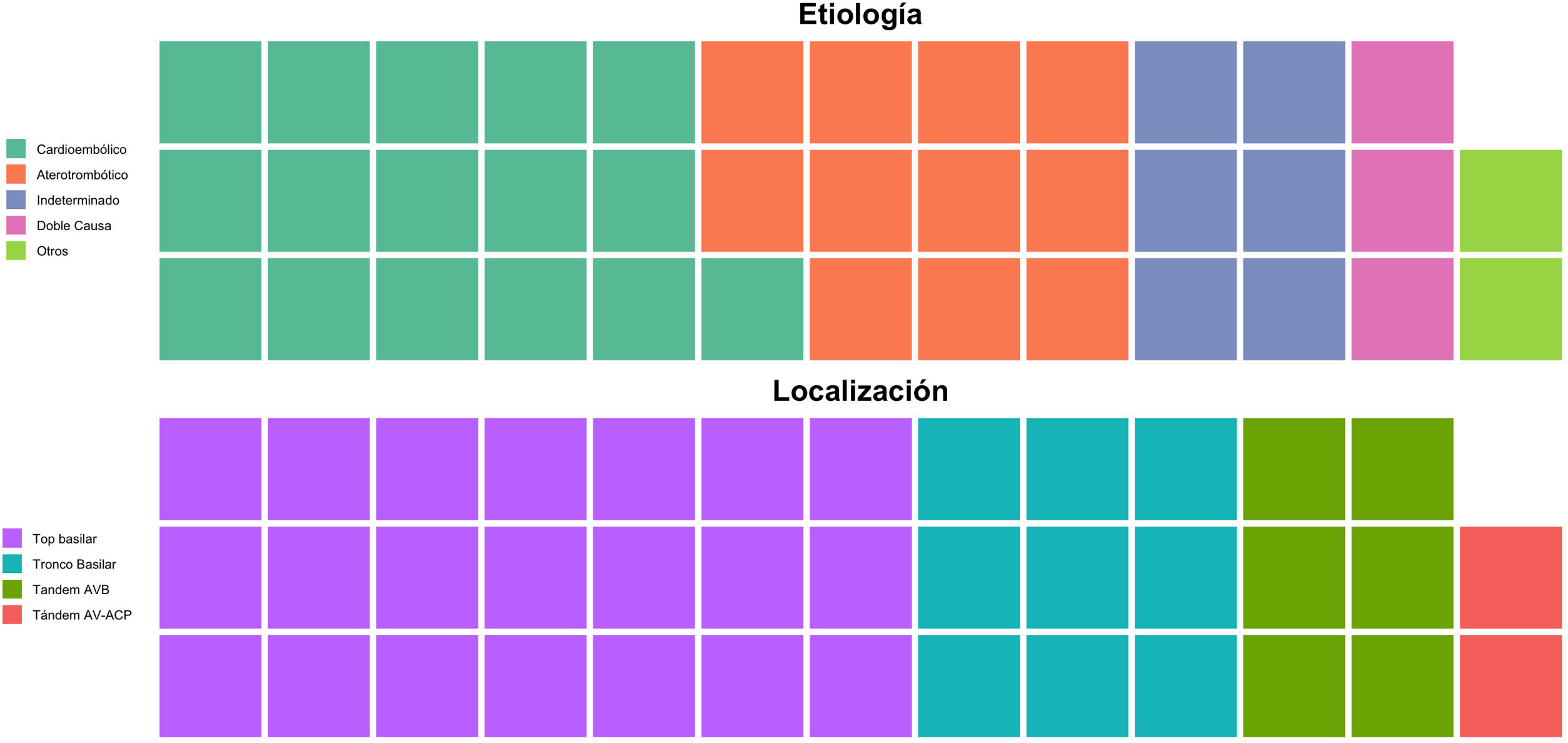
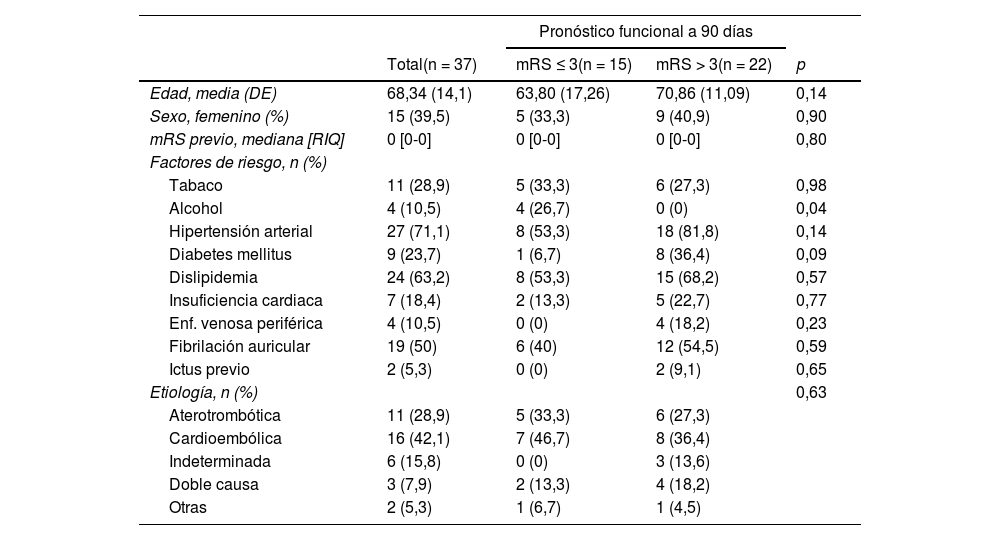
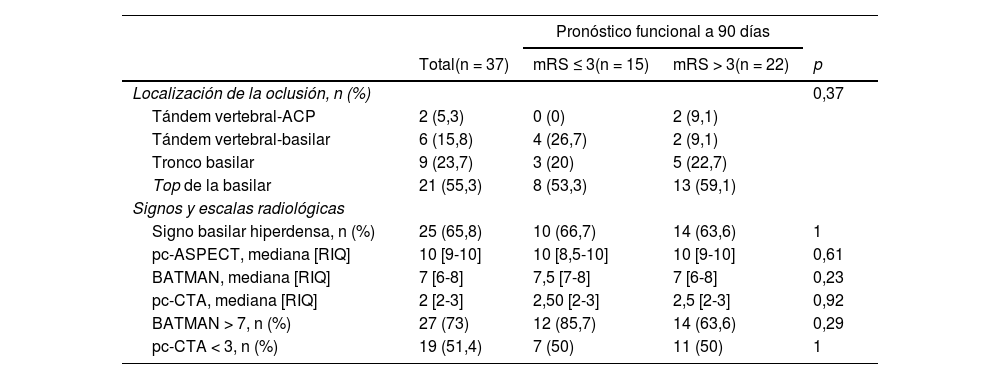
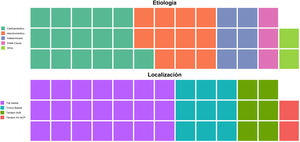
La edad media de los pacientes con oclusión del sistema vertebrobasilar tratados con TM fue de 68,34 ± 14,1 años, de los que el 39,5% (15) eran mujeres. Los factores de riesgo cerebrovascular más frecuentes fueron la hipertensión arterial (27; 71,1%), la dislipidemia (24; 63,2%) y la fibrilación auricular (19; 50%) (tabla 1). Por etiologías (fig. 2) la causa más frecuente de ictus fue la cardioembólica (16; 42,1%), seguida de la aterotrombótica (11; 28,9%). El lugar más frecuente de obstrucción fue el top de la basilar (21; 55,3%), seguido del tronco basilar (9; 23,7%) (tabla 2).
Características basales de los pacientes con sistema vertebrobasilar tratados mediante trombectomía mecánica
| Pronóstico funcional a 90 días | ||||
|---|---|---|---|---|
| Total(n = 37) | mRS ≤ 3(n = 15) | mRS > 3(n = 22) | p | |
| Edad, media (DE) | 68,34 (14,1) | 63,80 (17,26) | 70,86 (11,09) | 0,14 |
| Sexo, femenino (%) | 15 (39,5) | 5 (33,3) | 9 (40,9) | 0,90 |
| mRS previo, mediana [RIQ] | 0 [0-0] | 0 [0-0] | 0 [0-0] | 0,80 |
| Factores de riesgo, n (%) | ||||
| Tabaco | 11 (28,9) | 5 (33,3) | 6 (27,3) | 0,98 |
| Alcohol | 4 (10,5) | 4 (26,7) | 0 (0) | 0,04 |
| Hipertensión arterial | 27 (71,1) | 8 (53,3) | 18 (81,8) | 0,14 |
| Diabetes mellitus | 9 (23,7) | 1 (6,7) | 8 (36,4) | 0,09 |
| Dislipidemia | 24 (63,2) | 8 (53,3) | 15 (68,2) | 0,57 |
| Insuficiencia cardiaca | 7 (18,4) | 2 (13,3) | 5 (22,7) | 0,77 |
| Enf. venosa periférica | 4 (10,5) | 0 (0) | 4 (18,2) | 0,23 |
| Fibrilación auricular | 19 (50) | 6 (40) | 12 (54,5) | 0,59 |
| Ictus previo | 2 (5,3) | 0 (0) | 2 (9,1) | 0,65 |
| Etiología, n (%) | 0,63 | |||
| Aterotrombótica | 11 (28,9) | 5 (33,3) | 6 (27,3) | |
| Cardioembólica | 16 (42,1) | 7 (46,7) | 8 (36,4) | |
| Indeterminada | 6 (15,8) | 0 (0) | 3 (13,6) | |
| Doble causa | 3 (7,9) | 2 (13,3) | 4 (18,2) | |
| Otras | 2 (5,3) | 1 (6,7) | 1 (4,5) | |
DE: desviación estándar; mRS: escala de Rankin modificada; RIQ: rango intercuartílico.
Variables radiológicas
| Pronóstico funcional a 90 días | ||||
|---|---|---|---|---|
| Total(n = 37) | mRS ≤ 3(n = 15) | mRS > 3(n = 22) | p | |
| Localización de la oclusión, n (%) | 0,37 | |||
| Tándem vertebral-ACP | 2 (5,3) | 0 (0) | 2 (9,1) | |
| Tándem vertebral-basilar | 6 (15,8) | 4 (26,7) | 2 (9,1) | |
| Tronco basilar | 9 (23,7) | 3 (20) | 5 (22,7) | |
| Top de la basilar | 21 (55,3) | 8 (53,3) | 13 (59,1) | |
| Signos y escalas radiológicas | ||||
| Signo basilar hiperdensa, n (%) | 25 (65,8) | 10 (66,7) | 14 (63,6) | 1 |
| pc-ASPECT, mediana [RIQ] | 10 [9-10] | 10 [8,5-10] | 10 [9-10] | 0,61 |
| BATMAN, mediana [RIQ] | 7 [6-8] | 7,5 [7-8] | 7 [6-8] | 0,23 |
| pc-CTA, mediana [RIQ] | 2 [2-3] | 2,50 [2-3] | 2,5 [2-3] | 0,92 |
| BATMAN > 7, n (%) | 27 (73) | 12 (85,7) | 14 (63,6) | 0,29 |
| pc-CTA < 3, n (%) | 19 (51,4) | 7 (50) | 11 (50) | 1 |
ACP: arteria cerebral posterior; RIQ: rango intercuartílico.
El signo de la basilar hiperdensa se observó en 25 (65,8%) de los pacientes. No hubo diferencias estadísticamente significativas en su proporción en función del pronóstico funcional a 90 días. Las puntuaciones medianas en las escalas pc-ASPECT, BATMAN y CTA fueron 10 (RIQ: 8,5-10); 7,5 (RIQ: 7-8) y 2,5 (RIQ: 2-3), respectivamente (tabla 2).
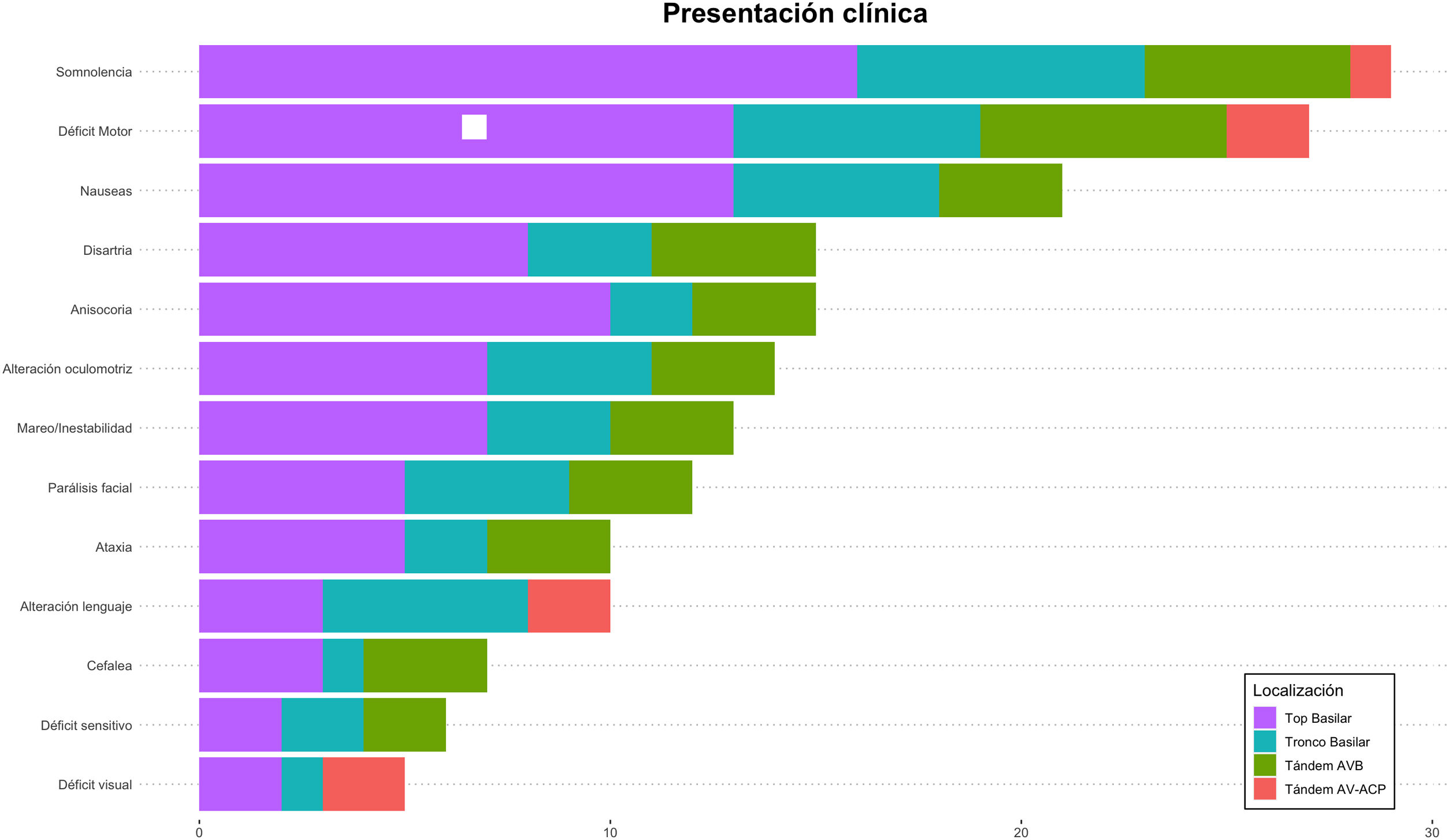
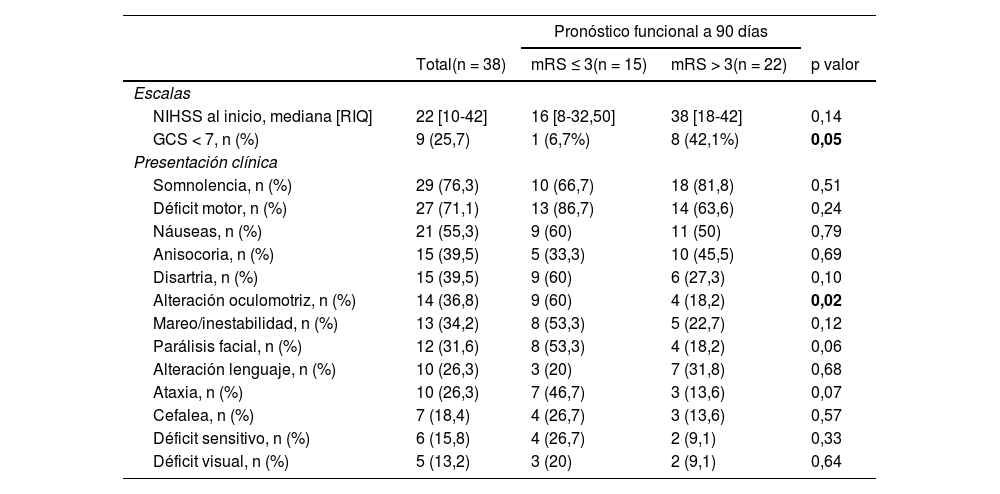
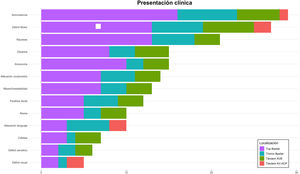
Respecto a la presentación clínica al inicio (tabla 3), la puntuación NIHSS mediana fue 22 (RIQ: 10-42). El síntoma más frecuente fue la somnolencia (29; 76,3%) seguido del déficit motor (27; 71,1%) y las náuseas (21; 55,3%). En relación con la lateralidad del déficit, en 15 pacientes (55,6%) la clínica fue derecha mientras que en 4 casos (14,8%) fue bilateral. Se hallaron diferencias significativas en la proporción de pacientes con nivel de consciencia reducido (Escala de Glasgow < 7) en función del buen pronóstico funcional a 90 días (6,7 vs. 42,1%; p = 0,05). También las hubo en función de la mediana de la puntuación NIHSS a las 24 h (5 vs. 42; p < 0,05) (tabla 4). En la figura 3 observamos la frecuencia de los distintos signos y síntomas en función de la localización de la obstrucción.
Presentación clínica de los sistemas vertebrobasilares tratados con trombectomía mecánica
| Pronóstico funcional a 90 días | ||||
|---|---|---|---|---|
| Total(n = 38) | mRS ≤ 3(n = 15) | mRS > 3(n = 22) | p valor | |
| Escalas | ||||
| NIHSS al inicio, mediana [RIQ] | 22 [10-42] | 16 [8-32,50] | 38 [18-42] | 0,14 |
| GCS < 7, n (%) | 9 (25,7) | 1 (6,7%) | 8 (42,1%) | 0,05 |
| Presentación clínica | ||||
| Somnolencia, n (%) | 29 (76,3) | 10 (66,7) | 18 (81,8) | 0,51 |
| Déficit motor, n (%) | 27 (71,1) | 13 (86,7) | 14 (63,6) | 0,24 |
| Náuseas, n (%) | 21 (55,3) | 9 (60) | 11 (50) | 0,79 |
| Anisocoria, n (%) | 15 (39,5) | 5 (33,3) | 10 (45,5) | 0,69 |
| Disartria, n (%) | 15 (39,5) | 9 (60) | 6 (27,3) | 0,10 |
| Alteración oculomotriz, n (%) | 14 (36,8) | 9 (60) | 4 (18,2) | 0,02 |
| Mareo/inestabilidad, n (%) | 13 (34,2) | 8 (53,3) | 5 (22,7) | 0,12 |
| Parálisis facial, n (%) | 12 (31,6) | 8 (53,3) | 4 (18,2) | 0,06 |
| Alteración lenguaje, n (%) | 10 (26,3) | 3 (20) | 7 (31,8) | 0,68 |
| Ataxia, n (%) | 10 (26,3) | 7 (46,7) | 3 (13,6) | 0,07 |
| Cefalea, n (%) | 7 (18,4) | 4 (26,7) | 3 (13,6) | 0,57 |
| Déficit sensitivo, n (%) | 6 (15,8) | 4 (26,7) | 2 (9,1) | 0,33 |
| Déficit visual, n (%) | 5 (13,2) | 3 (20) | 2 (9,1) | 0,64 |
GCS: Escala del Coma de Glasgow; NIHSS: National Institute of Health Stroke Score.
En negrita se destacan los valores de p estadísticamente significativos (< 0,05).
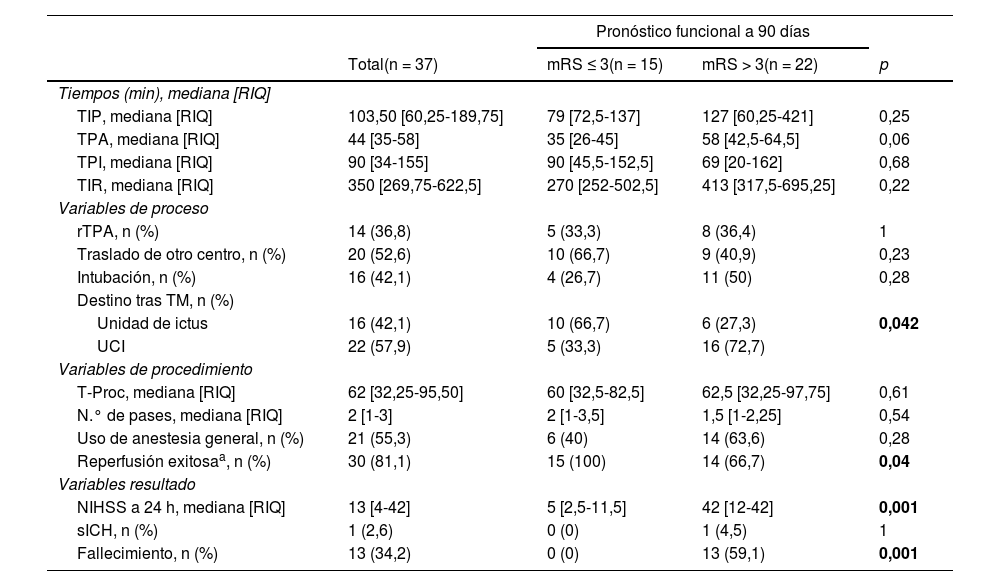
Variables de proceso, variables de procedimiento y variables resultado
| Pronóstico funcional a 90 días | ||||
|---|---|---|---|---|
| Total(n = 37) | mRS ≤ 3(n = 15) | mRS > 3(n = 22) | p | |
| Tiempos (min), mediana [RIQ] | ||||
| TIP, mediana [RIQ] | 103,50 [60,25-189,75] | 79 [72,5-137] | 127 [60,25-421] | 0,25 |
| TPA, mediana [RIQ] | 44 [35-58] | 35 [26-45] | 58 [42,5-64,5] | 0,06 |
| TPI, mediana [RIQ] | 90 [34-155] | 90 [45,5-152,5] | 69 [20-162] | 0,68 |
| TIR, mediana [RIQ] | 350 [269,75-622,5] | 270 [252-502,5] | 413 [317,5-695,25] | 0,22 |
| Variables de proceso | ||||
| rTPA, n (%) | 14 (36,8) | 5 (33,3) | 8 (36,4) | 1 |
| Traslado de otro centro, n (%) | 20 (52,6) | 10 (66,7) | 9 (40,9) | 0,23 |
| Intubación, n (%) | 16 (42,1) | 4 (26,7) | 11 (50) | 0,28 |
| Destino tras TM, n (%) | ||||
| Unidad de ictus | 16 (42,1) | 10 (66,7) | 6 (27,3) | 0,042 |
| UCI | 22 (57,9) | 5 (33,3) | 16 (72,7) | |
| Variables de procedimiento | ||||
| T-Proc, mediana [RIQ] | 62 [32,25-95,50] | 60 [32,5-82,5] | 62,5 [32,25-97,75] | 0,61 |
| N.° de pases, mediana [RIQ] | 2 [1-3] | 2 [1-3,5] | 1,5 [1-2,25] | 0,54 |
| Uso de anestesia general, n (%) | 21 (55,3) | 6 (40) | 14 (63,6) | 0,28 |
| Reperfusión exitosaa, n (%) | 30 (81,1) | 15 (100) | 14 (66,7) | 0,04 |
| Variables resultado | ||||
| NIHSS a 24 h, mediana [RIQ] | 13 [4-42] | 5 [2,5-11,5] | 42 [12-42] | 0,001 |
| sICH, n (%) | 1 (2,6) | 0 (0) | 1 (4,5) | 1 |
| Fallecimiento, n (%) | 13 (34,2) | 0 (0) | 13 (59,1) | 0,001 |
RIQ: rango intercuartílico; rTPA: fibrinólisis; sICH: hemorragia cerebral sintomática; T-Proc: tiempo de procedimiento; TIP: tiempo inicio-puerta; TIR: tiempo inicio-reperfusión; TPA: tiempo puerto-aguja; TPI: tiempo puerta-ingle.
De los 37 procedimientos realizados, 24 (63%) fueron TM primarias y 14 (37%) de rescate. El tiempo mediano de procedimiento fue 62 min (RIQ: 32,25-95,50), con reperfusión exitosa (mTICI≥2b) en 30 de ellos (81,1%). Al analizar los tiempos de proceso se encontró un tiempo mediano de 103,50 min (RIQ: 60,25- 89,75) desde el inicio de la sintomatología hasta el primer contacto con un centro hospitalario, así como un tiempo mediano de 350 min (RIQ: 269,75-622,5) desde el inicio de los síntomas a la reperfusión vascular(tabla 4).
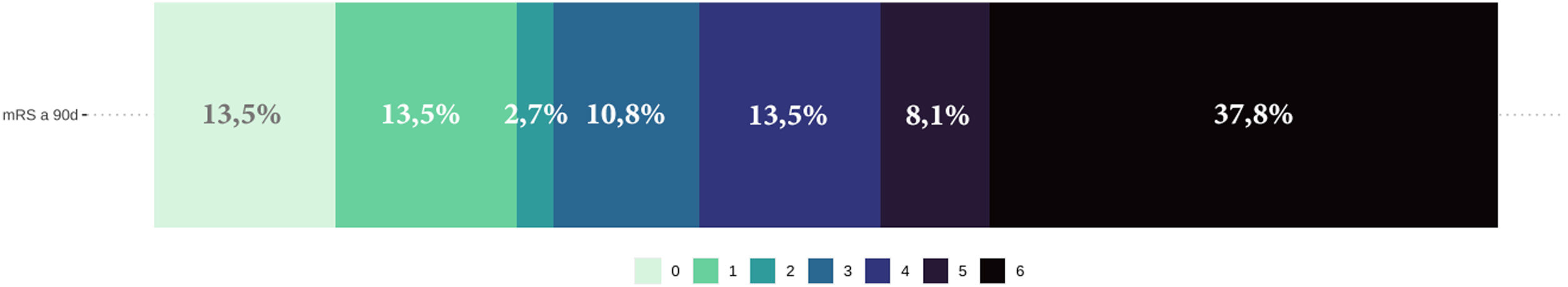
Por último, el pronóstico funcional a los 90 días fue desfavorable (mRS > 3) en 22 de los pacientes (59%) y se registraron 13 exitus letalis (34,2%) durante el ingreso. En la figura 4 se ofrece la distribución de frecuencias de la puntuación mRS a los 90 días.
DiscusiónLos ictus de circulación posterior poseen una serie de características diferenciales de los de circulación anterior, que marcarán su diagnóstico, manejo y estudio. En nuestro trabajo hemos analizado a los pacientes atendidos en nuestra comunidad que recibieron tratamiento endovascular buscando ofrecer una descripción global de sus características, con los aspectos basales, clínicos, radiológicos y, por supuesto, relacionados con el procedimiento y los resultados.
En primer lugar observamos como la localización más habitual de la obstrucción fue el territorio distal y top de la basilar (50%), muy similar a los de otras series publicadas15,16. En cuanto a los factores de riesgo y causa etiológica, clásicamente se había considerado que los IVB poseían un perfil diferente al de los ictus de circulación anterior, atribuyendo la etiología a la cardioembolia hasta en el 40% de los casos16. Sin embargo, estudios más recientes no han encontrado diferencias significativas entre los IVB y los de circulación anterior en cuanto a etiología ni factores de riesgo. La enfermedad ateroesclerótica de gran vaso supone la primera causa de ictus vertebrobasilar (32-37%), seguida de la cardioembólica (18%) y la disección arterial (10%)17-19. Esta última se debe tener siempre presente en los pacientes más jóvenes, cuya localización más frecuente son los segmentos vertebrales V2-V34,6,20. En nuestra serie destaca la alta proporción de dislipidemia (63%) respecto a otros registros, así como el mayor número de pacientes con etiología cardioembólica (50%), posiblemente debido a que solo se analiza a los pacientes tratados con TM.
En segundo lugar, vemos como debido a su forma de presentación los IVB suponen un desafío clínico. A diferencia de los ictus de circulación anterior, en los que la constelación clínica clásica es fácilmente reconocible, los IVB siguen un curso más subagudo y fluctuante. Es habitual que empiecen con síntomas inespecíficos, como cefalea, somnolencia o inestabilidad, lo que puede escaparse de los sistemas de triaje habituales4,6,18,21,22. Del mismo modo, signos exploratorios más sutiles como el síndrome de Horner, alteraciones de la oculomotricidad o la afectación de pares bajos, pueden pasar desapercibidos en una valoración inicial por personal no neurólogo. Todo ello acarrea un retraso diagnóstico y dilata los tiempos de atención21,23,24.
En nuestra serie los síntomas más frecuentes observados fueron la somnolencia, las náuseas y las alteraciones motoras (76, 71 y 55%, respectivamente). Las alteraciones sensitivas o visuales quedan en un segundo plano (13 y 15%), posiblemente al pasar desapercibidas en la valoración inicial, lo mismo que las dificultades exploratorias en aquellos pacientes con bajo nivel de consciencia. Resulta llamativa la presencia de 10 pacientes (26,3%) en quienes se describió una alteración del lenguaje. Al analizarlos en detalle, todos ellos se correspondieron con oclusiones distales en el tronco basilar o top de la basilar. En aquellos a quienes se realizó RMN cerebral (40% de ellos), el territorio afectado sobrepasaba el territorio posterior: en todos ellos estaba afectado el núcleo talámico izquierdo. Lesiones en dicha localización se han relacionado con afectación del lenguaje25-27.
Con relación a los tiempos, en un análisis previo de nuestro registro observamos como los ictus de circulación posterior tenían tiempos puerta-ingle e inicio-reperfusión significativamente superiores a los de circulación anterior28. En el trabajo actual encontramos tendencia a la significación en el tiempo puerta-aguja en función del pronóstico funcional. También encontramos diferencias significativas en los tiempos inicio-puerta, inicio-reperfusión y de procedimiento en virtud del porcentaje de reperfusiones exitosas. Todo ello no hace sino reforzar la importancia de un reconocimiento precoz para instaurar un tratamiento lo más temprano posible.
Otro punto importante que considerar son las limitaciones de la escala NIHSS en los IVB. La escala NIHSS es muy sensible a los ictus de circulación anterior, en especial a los hemisféricos izquierdos. Síntomas típicos de la circulación posterior, como la clínica bulbar, alteración de la marcha, ataxia troncular o parálisis de la mirada vertical no puntúan en la escala NIHSS7,29. Ello provoca que los pacientes con IVB obtengan menores puntuaciones que los pacientes con ictus de circulación anterior. Estudios observacionales mostraron como en el 75% de los pacientes con IVB el NIHSS de presentación se encontraba entre 0 y 530,31, aunque si nos fijamos exclusivamente en aquellos que recibieron terapia endovascular, la mediana de NIHSS fue de 20-22, como en nuestro registro32,33.
El siguiente punto por tratar de los IVB son sus características radiológicas. La TC cerebral constituye la prueba básica en el manejo agudo del ictus isquémico. Lamentablemente debido a los artefactos óseos de la base del cráneo y la mala resolución del parénquima en territorio infratentorial su sensibilidad para detectar cambios isquémicos agudos es muy limitada, inferior al 40% en algunas series6,34,35. La angio-TC posee alta sensibilidad y especificidad para la detección de obstrucciones vasculares, así como buena correlación con la angiografía cerebral36, por lo que es fundamental para la toma de decisiones terapéuticas. Finalmente, la RMN cerebral es considerada la prueba de referencia para la detección de cambios isquémicos agudos en la fosa posterior37; sin embargo, su disponibilidad y duración limitan su utilidad en la urgencia.
Por todo ello se han propuesto diversas escalas y signos que apoyen el diagnóstico y predigan el pronóstico. El primero de ellos es el signo de la arteria basilar hiperdensa en la TC basal. En el contexto clínico adecuado puede indicar trombosis aguda de la arteria basilar, con una sensibilidad de hasta el 71% (65% en nuestra serie)38. Otra herramienta de utilidad es la escala pc-ASPECT, una adaptación de la escala ASPECT a los IVB39. Se ha empleado en los ensayos clínicos para la selección de pacientes y para la caracterización de la extensión de la isquemia. Puede evaluarse en la TC basal, pero se ha visto que si se valora en conjunto con la angio-TC y la TC de perfusión su sensibilidad para detectar cambios isquémicos precoces se duplica40. Así mismo, en varios trabajos ha aportado información sobre la mortalidad y el pronóstico funcional39-42. En nuestra serie la puntuación mediana fue de 10 (RIQ: 8,5-10), superponible a series de pacientes seleccionados para recibir TM. En nuestra muestra no fuimos capaces de encontrar diferencias significativas entre las distintas escalas y el pronóstico funcional o el porcentaje de reperfusiones exitosas, posiblemente debido a nuestro tamaño muestral.
Por último, el tratamiento endovascular en los IVB ha sido un tema muy discutido en los últimos años. A diferencia de los infartos de circulación anterior, en los que la eficacia y seguridad de la TM están avaladas por numerosos estudios43, en los IVB la evidencia es más limitada. Numerosos trabajos han puesto de manifiesto la seguridad y altas tasas de repermeabilización, aunque hasta hace poco carecíamos de estudios aleatorizados9,41,44,45.
Recientemente han sido publicado los resultados de los estudio BAOCHE46 y ATTENTION47, en los que queda demostrada la eficacia de la TEV frente al tratamiento médico. El estudio BAOCHE incluyó a pacientes con hora de inicio entre 6 y 24 h con una mediana de edad de NIHSS de 20. Los pacientes tratados con TEV tuvieron mejor resultado funcional a los 3 meses (mRS 0-3: 46 vs. 24%) y menor mortalidad (31 vs. 42%). Hubo mayor número de hemorragias cerebrales significativas, sin ser esta diferencia estadísticamente significativa. El estudio ATTENTION demostró resultados similares. Incluyó a pacientes atendidos en las primeras 12 h con NIHSS superior o igual a 10 (mediana 22). Los pacientes tratados con TEV tuvieron mejor pronóstico funcional (mRS 0-3: 46 vs. 23%) y menor mortalidad (36,7 vs. 55,3%). Respecto a la selección de pacientes con neuroimagen, se debe destacar que en ambos estudios la mediana de pc-ASPECT fue superior a 8. De forma global, estos resultados apoyan el uso de la TM en pacientes con IVB, síntomas graves y tejido salvable en la neuroimagen, si bien todavía existen incógnitas en relación con la selección de pacientes o la actitud ante NIHSS menores a 1032,33. Otra limitación es el hecho de haberse realizado en población china, en la que existe mayor proporción de estenosis intracraneal, como sucedió en ambos estudios. Son necesarios estudios que incluyan una muestra más diversa48.
La principal limitación de nuestro trabajo es su carácter retrospectivo y observacional. A pesar de incluir la totalidad de los pacientes tratados en nuestra comunidad, el tamaño muestral es pequeño, lo que limita el análisis comparativo. El hecho de analizar un intervalo prolongado de tiempo podría suponer variaciones en la selección de los pacientes y en las técnicas utilizadas. No obstante, los criterios de selección para los ictus de fosa posterior no han sufrido grandes cambios en la última década y todos los pacientes se manejaron de acuerdo con el plan de actuación del ictus vigente en nuestra comunidad, que tampoco ha sufrido modificaciones sustanciales. Por último, la revisión retrospectiva de las historias clínicas y de los fallos de codificación limitan la recuperación de la información.
En conclusión, los IVB a día de hoy suponen un desafío dentro de la neurología neurovascular. Pese a una menor prevalencia, conllevan una importante morbimortalidad. Su presentación clínica es más larvada, con un curso subagudo inespecífico que dilata los tiempos de atención y dificulta una identificación precoz. La TM es un procedimiento seguro, con altas tasas de reperfusión y que ha demostrado mejorar el pronóstico funcional y mortalidad. Sin embargo, son necesarios más estudios que acaben de esclarecer la selección del paciente ideal.
FinanciaciónLa presente investigación no ha recibido ayudas específicas provenientes de agencias del sector público, sector comercial o entidades sin ánimo de lucro.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Al Dr. Tejada. Por su apoyo, guía e insistencia en acabar de dar a luz este trabajo.
Al Dr. de Selby y al Dr. Sancho por guiarme en el laberinto de la vida.