El análisis de biomarcadores bioquímicos de enfermedad de Alzheimer (EA) en líquido cefalorraquídeo (LCR) se recomienda como parte del diagnóstico en los centros en los que está disponible. Ante la ausencia de valores universales validados, se recomienda la determinación de puntos de corte (PdC) específicos para cada centro y su población. El objetivo principal del proyecto CORCOBIA fue determinar los PdC de biomarcadores de EA en LCR para varios centros (Parc de Salut Mar de Barcelona y Hospital General de Granollers) que trabajan con el mismo laboratorio de referencia (Laboratori de Referència de Catalunya).
MétodosEstudio prospectivo que incluyó sujetos cognitivamente sanos (n=42), con deterioro cognitivo ligero amnésico (n=35) y con demencia tipo Alzheimer (n=48), a los que se realizó valoración clínica y neuropsicológica, neuroimagen, genotipado APOE y punción lumbar para analizar los péptidos beta-amiloides (Aβ42, Aβ40) y las proteínas tau total (tTau) y tau fosforilada (pTau181) mediante el autoanalizador Lumipulse® G600II (Fujirebio). Se calcularon los valores de sensibilidad y especificidad, los valores predictivos y el área bajo la curva (ABC), determinando el PdC según el índice de Youden comparando los grupos de sujetos cognitivamente sanos y con demencia tipo Alzheimer.
ResultadosLos PdC y ABC fueron los siguientes: Aβ42 750pg/ml (ABC 0,809); Aβ42/Aβ40 0,062 (ABC 0,78); pTau181 69,85pg/ml (ABC 0,81); tTau 522,0pg/ml (ABC 0,79); Aβ42/tTau 1,76 (ABC 0,86); Aβ42/pTau181 10,25 (ABC 0,86).
ConclusionesLa determinación de PdC para biomarcadores de EA en LCR para los centros participantes permite una mejor precisión diagnóstica, siendo la ratio Aβ42/pTau181 en LCR el parámetro con mayor ABC y mejor balance entre sensibilidad y especificidad.
The analysis of the core biomarkers of Alzheimer's disease (AD) in the cerebrospinal fluid (CSF) is recommended in the clinical units where it is available. Because of the absence of universal validated values, the determination of specific cut-off points (COP) for each center and its population is recommended. The main objective of the CORCOBIA study was to determine the COP of core AD CSF biomarkers for several centers (Parc de Salut Mar, Barcelona, and Hospital General de Granollers), which work with the same reference laboratory (Laboratori de Referència de Catalunya).
MethodsProspective study including cognitively healthy subjects (n=42), subjects with amnestic mild cognitive impairment (n=35) and patients with dementia due to AD (n=48), in whom clinical and neuropsychological assessment, neuroimaging, APOE genotyping and lumbar puncture to analyze amyloid beta peptides (Aβ42, Aβ40), total tau (tTau) and phosphorylated Tau (pTau181) using the Lumipulse® G600II (Fujirebio) was performed. The values of sensitivity, specificity, predictive values and area under the curve (AUC) were calculated, determining the COP according to the Youden index by comparing the groups of cognitively healthy subjects and AD.
ResultsThe resulting COP and their AUC were the following: Aβ42 750pg/ml (AUC 0.809); Aβ42/Aβ40 0.062pg/ml (AUC 0.78); pTau181 69.85pg/ml (AUC 0.81); tTau 522.0pg/ml (AUC 0.79); Aβ42/tTau 1.76pg/ml (AUC 0.86); Aβ42/pTau181 10.25pg/ml (AUC 0.86).
ConclusionsThe determination of COP of core AD CSF biomarkers for the participating centers allows a better diagnostic accuracy. The ratio CSF Aβ42/pTau181 shows the highest AUC and better balance between sensitivity and specificity.
La determinación de biomarcadores bioquímicos de la enfermedad de Alzheimer (EA) en el líquido cefalorraquídeo (LCR) permite una mayor precisión en el diagnóstico de la enfermedad1, siendo recomendada en las guías de diagnóstico actuales para los centros que disponen de ella2,3. Las medidas de los niveles de Aβ42, Aβ42/Aβ40, tau total (tTau) y tau fosforilada en la treonina 181 (pTau181) en LCR fueron incluidas en 2011 en los criterios revisados de diagnóstico de EA de la NIA-AA y posteriormente en las guías de práctica clínica vigentes en nuestro entorno2–5. En el ámbito de la investigación, se ha propuesto un sistema de clasificación de los resultados de dichos biomarcadores que facilita su interpretación (sistema ATN, NIA-AA 2018)6,7. Durante la última década, la determinación de dichos biomarcadores se ha ido incorporando de forma progresiva en el proceso diagnóstico del deterioro cognitivo, en mayor medida en centros con unidades especializadas. La comercialización de autoanalizadores, métodos y reactivos estandarizados durante los últimos años ha favorecido su implantación en los laboratorios. Sin embargo, ante la ausencia de valores universales, debido a diferentes factores tanto poblacionales como metodológicos (factores preanalíticos y analíticos), se sigue recomendando la determinación de los puntos de corte (PdC) específicos para cada centro y su población2.
En este contexto, el estudio CORCOBIA (Correlación de instrumentos cognitivos y biomarcadores de la enfermedad de Alzheimer) tiene como objetivo principal la determinación de los PdC de los biomarcadores principales de la EA en LCR para la población de los centros participantes (Hospital del Mar y Centre Emili Mira, del Parc de Salut Mar, y Hospital General de Granollers), que trabajan con el mismo laboratorio de referencia (Laboratori de Referència de Catalunya). Se llevó a cabo una sistematización de las fases preanalítica y analítica y se analizó la correlación de instrumentos cognitivos estandarizados (batería Neuronorma)8 con los biomarcadores de LCR. En el presente artículo se describen los resultados referentes a la determinación de PdC de los biomarcadores incluidos.
MetodologíaEl estudio CORCOBIA fue aprobado por el Comité Ético del Institut Hospital del Mar d’Investigacions Mèdiques (2014/5638) y siguió las recomendaciones éticas para la investigación recogidas en la Declaración de Helsinki (2013). Se realizó conjuntamente entre el Hospital del Mar (Parc de Salut Mar, Barcelona) y el Laboratori de Referència de Catalunya con 2 centros colaboradores: el CAEM (Parc de Salut Mar, Santa Coloma de Gramenet) y el Hospital General de Granollers.
ParticipantesSe incluyeron sujetos valorados en los distintos centros con los siguientes diagnósticos: cognitivamente sanos (CS), deterioro cognitivo ligero amnésico (DCLa)3 y demencia tipo Alzheimer en grado leve (DTA) según criterios NIA-AA (2011)4,9. Todos los participantes firmaron el consentimiento informado del estudio aprobado previamente por el Comité de Ética; en el caso de los pacientes con diagnóstico de DTA leve, se obtuvo el consentimiento firmado tanto por el participante como por el responsable del mismo.
Los criterios de selección de todos los participantes fueron los siguientes:
- -
Criterios de inclusión: a) edad comprendida entre 60 y 85 años; b) audición, visión y condiciones físicas adecuadas para realizar las evaluaciones; c) escolaridad mínima para realizar la valoración neuropsicológica, y d) estado médico y tratamiento farmacológico estable durante 3 meses antes del comienzo del estudio.
- -
Criterios de exclusión: a) falta de voluntad o incapacidad del sujeto para colaborar adecuadamente en el estudio; b) cualquier enfermedad del sistema nervioso central diferente de las estudiadas que pueda afectar a la cognición; c) trastorno psiquiátrico que, a juicio del investigador, afecte las capacidades cognitivas de los participantes (por ejemplo, episodio depresivo mayor, trastorno bipolar, trastorno distímico descompensado, esquizofrenia o episodio psicótico, según criterios DSM-V); d) hipotiroidismo y/o déficits vitamínicos (B12, ácido fólico), o cualquier otra condición médica que, a juicio del investigador, interfiera en el rendimiento cognitivo de los participantes; e) cualquier condición médica que implique contraindicación para la realización de una punción lumbar (por ejemplo, tratamiento activo con anticoagulantes, trastornos hematológicos que afecten a la coagulación, como trombocitopenia significativa o coagulopatías, insuficiencia hepática grave o enfermedad lumbar que implique alto riesgo para la realización de dicha prueba); i) consumo de alcohol en patrón de abuso o consumo de sustancias tóxicas que, a juicio del investigador, puedan interferir en la valoración cognitiva; j) presencia de hipoacusia grave, ambliopía importante o ceguera, y k) existencia de cualquier situación que pudiera hacer al sujeto, según la opinión del investigador principal, inadecuado para el estudio.
Los participantes fueron asignados a los diferentes grupos según los siguientes criterios: I) «DTA»: pacientes con deterioro cognitivo moderado según la Global Deterioration Scale10 que, a su vez, cumplen criterios diagnósticos de DTA «probable» según criterios NIA-AA de 20114; II) «DCLa»: pacientes con deterioro cognitivo ligero según la Global Deterioration Scale con perfil amnésico primario3, y III) «CS»: sujetos que presentan un estudio neuropsicológico normal ajustado por edad y escolaridad.
ProcedimientosLos pacientes incluidos con diagnóstico clínico de DCLa y de DTA leve fueron valorados en las consultas de Neurología de los 3 centros colaboradores. La muestra de participantes CS estaba compuesta por acompañantes de pacientes (42,9%) y por sujetos con quejas cognitivas subjetivas con rendimientos dentro de la normalidad para la edad y escolaridad en la exploración neuropsicológica (57,1%).
La participación del estudio consistía en la realización de una visita informativa y firma del consentimiento informado, valoración neuropsicológica extensa normalizada (mediante la batería Neuronorma)8, resonancia magnética en los pacientes con evidencia de deterioro cognitivo, determinación del genotipo APOE y realización de una punción lumbar.
Punción lumbar y análisis del LCRSe realizó una punción lumbar (espacios intervertebrales L3-L4 o L4-L5), entre las 8 y las 10 am y en condiciones de ayuno (8h), mediante aguja de 0,7mm y calibre 22G. El procedimiento preanalítico se realizó siguiendo las recomendaciones publicadas por Vanderstichele et al.11 y fue el siguiente: a) dispensación del LCR en un tubo inerte de polipropileno de 10ml (Sarstedt Ref. 62610201) y envío al laboratorio; b) centrifugación del LCR a temperatura ambiente (10min/2.000g); c) alicuotado del sobrenadante en microtubos de polipropileno inerte de 500μL (Starstedt Ref. 72.730.006); d) traslado inmediato al laboratorio de referencia en hielo seco, y e) congelación a −80°C. El tiempo máximo permitido entre la punción lumbar y la congelación en hielo seco inicial y posteriormente en congeladores a −80°C fue de 4 y 12h, respectivamente.
La selección de los participantes se llevó a cabo entre noviembre de 2014 y noviembre de 2019. Las medidas de los biomarcadores se realizaron desde mayo de 2018 hasta diciembre de 2019, siguiendo el siguiente procedimiento: a) descongelación de las alícuotas de LCR durante 30min a temperatura ambiente; b) homogeneización de cada alícuota en un agitador durante 10s cada una, y c) cuantificación en el analizador Lumipulse® G 600 II (Fujirebio, Bélgica), donde se miden los biomarcadores Aβ42, Aβ40, tTau y pTau181 (pg/ml) mediante un método de inmunoanálisis heterogéneo quimioluminiscente automatizado utilizando reactivos IVD de Fujirebio.
Genotipado APOEEl estudio molecular del genotipo APOE se realizó analizando muestras de ADN genómico de los pacientes mediante ensayos PCR de discriminación alélica utilizando reactivos APOE Real Type, de Progenie Molecular, determinando la presencia de los polimorfismos rs7412 (g8041C>T) y rs429358 (g7903T>C) que permiten definir el diplotipo de APOE para los alelos ɛ2, ɛ3 y ɛ4, que a su vez codifican las isoformas APOE-ɛ2, APOE-ɛ3 y APOE-ɛ4, respectivamente.
Análisis estadísticoDeterminación de puntos de corte de biomarcadores de EA en LCRSe obtuvieron los PdC mediante un estudio de capacidad de clasificación de sujetos CS y DTA usando curvas ROC, eligiendo el PdC con el índice de Youden más alto. Se realizó un análisis descriptivo de las características demográficas de estos 2 grupos. Se calcularon pruebas de normalidad (Shapiro-Wilk) y posteriormente se realizó una comparación paramétrica de medias mediante la prueba t de Student o no paramétrica mediante la prueba U de Mann-Whitney de las variables numéricas según correspondiese. Se realizó una comparación de frecuencias de las variables categóricas entre ambos grupos mediante chi-cuadrado. El umbral de significación considerado fue p<0,05. Para la determinación de los PdC de cada uno de los biomarcadores principales de EA en LCR (Aβ42, tTau y pTau181) y de las ratios (Aβ42/Aβ40, Aβ42/tTau y Aβ42/pTau181) se obtuvieron las curvas ROC, las áreas bajo la curva (ABC), los intervalos de confianza al 95% y el conjunto de valores de sensibilidad, especificidad, valor predictivo positivo y valor predictivo negativo asociados a cada PdC. Se seleccionó aquel PdC con el valor del índice de Youden más alto (índice de Youden: sensibilidad+especificidad−1).
Clasificación de los sujetos con DCLa según los criterios A/T/NLos PdC calculados se aplicaron en los sujetos con diagnóstico clínico de DCLa, clasificándolos según la clasificación ATN de la NIA-AA (2018) en las siguientes categorías: A−T−N− (biomarcadores de EA normales); A+T−N− (continuum Alzheimer-cambio patológico tipo Alzheimer); A+T+N± (continuum Alzheimer-EA); A+T−N+ (continuum Alzheimer-cambio patológico tipo Alzheimer con sospecha de enfermedad concomitante); A−T+N+, A−T+N−, A−T−N+ (cambio patológico no tipo EA)7. Dichas variantes fueron determinadas según los PdC de los biomarcadores que ofrece el presente estudio. De esta manera, se consideró A+ cuando el valor de Aβ42 y/o Aβ42/Aβ40 fue inferior al PdC, y T+ y N+ cuando el valor fue superior al PdC de pTau181 y tTau, respectivamente. Se realizó un análisis descriptivo de los datos sociodemográficos expresados en medias y desviaciones estándar de las variables numéricas (edad y años de escolaridad) y porcentajes de la variable categórica dicotómica (sexo) de cada grupo de sujetos correspondientes a cada variante A/T/N.
ResultadosSe incluyeron un total de 125 sujetos valorados en los distintos centros (105 de ellos en el Hospital del Mar, 15 en el Hospital General de Granollers, y 5 en el Centre Emili Mira, con los siguientes diagnósticos: 42 CS, 35 DCLa y 48 DTA en grado leve.
Determinación de puntos de corte de biomarcadores de EA en LCRLa muestra utilizada para calcular los puntos de corte estaba compuesta por 90 sujetos (42 CS, 48 DTA leve). La media de edad fue de 72,5 (5,9) años y el 62,2% eran mujeres. Tal y como muestra la tabla 1, los sujetos con DTA eran ligeramente mayores que los CS, aunque esta diferencia no alcanzó el umbral de significación establecido (71,3 vs. 73,7; p=0,059). Las diferencias sí fueron significativas para la escolaridad y el sexo, mostrando menos años de escolaridad y un porcentaje mayor de mujeres el grupo de sujetos con DTA leve que el grupo CS (8 vs 9,5 y 72,9% vs 50% respectivamente, p<0,001). Por otro lado, se observó un rendimiento significativamente superior en el Mini-Mental StateExamination (MMSE)12 y un porcentaje inferior de portadores de APOE-?4 en el grupo CS respecto al de DTA (28,1 vs. 21,3 y 17,1 vs. 70,5%, respectivamente; p<0,001).
Características de la muestra para la creación de los puntos de corte (n=90)
| CS (n=42) | DTA leve (n=48) | p | |
|---|---|---|---|
| Edad (años), media (DE) | 71,3 (5,45) | 73,7 (6,14) | 0,059a |
| Escolaridad (años), mediana (RIC) | 9,50 (8-15) | 8 (6-10) | 0,012b |
| Sexo femenino, n (%) | 21 (50) | 35 (72,9) | 0,025c |
| MMSE, media (DE) | 28,1 (1,54) | 21,3 (2,84) | <0,001a |
| APOE-?4, n (%)d | 7 (17,1) | 31 (70,5) | <0,001c |
APOE-?4: portadores de alelo APOE-?4 (homo o heterocigotos); CS: cognitivamente sanos; DE: desviación estándar; DTA: demencia tipo Alzheimer; MMSE: Mini-Mental State Examination; RIC: rango intercuartílico.
En cuanto al tiempo entre la obtención de las muestras y su análisis, la mediana fue de 5,5 meses (rango 0-17,3 meses). El 61,1% de las muestras se analizaron conjuntamente en mayo de 2018, realizándose posteriormente series mensualmente hasta completar el 38,9% restante.
En la tabla 2 se presentan los datos descriptivos del conjunto de medidas de los biomarcadores en LCR (Aβ42, Aβ42/Aβ40, tTau, pTau181, Aβ42/tTau y Aβ42/pTau181) y los resultados de la comparación entre los grupos CS y DTA, en los que se observan diferencias estadísticamente significativas en todas ellas (p<0,001).
Medidas de líquido cefalorraquídeo (n=90)
| CS (n=42) | DTA leve (n=48) | pa | |
|---|---|---|---|
| Aβ42 (pg/ml) | 1.061 (679,0-1.526,7) | 611,5 (511,5-716,5) | <0,001 |
| Aβ42/Aβ40 | 0,083 (0,051-0,109) | 0,044 (0,038-0,055) | <0,001 |
| tTau (pg/ml) | 391,0 (283,2-516,0) | 715,5 (468,7-979,0) | <0,001 |
| pTau181 (pg/ml) | 52,7 (41,1-71,8) | 120,0 (79,0-170,9) | <0,001 |
| Aβ42/tTau | 2,86 (1,55-5,09) | 0,81 (0,54-1,37) | <0,001 |
| Aβ42/pTau181 | 24,7 (10,9-38,0) | 4,76 (3,12-9,04) | <0,001 |
Las variables están expresadas en mediana (rango intercuartílico).
Aβ: proteína beta-amiloide; CS: cognitivamente sanos; DTA: demencia tipo Alzheimer; pTau181: proteína tau fosforilada en la treonina 181; tTau: proteína tau total.
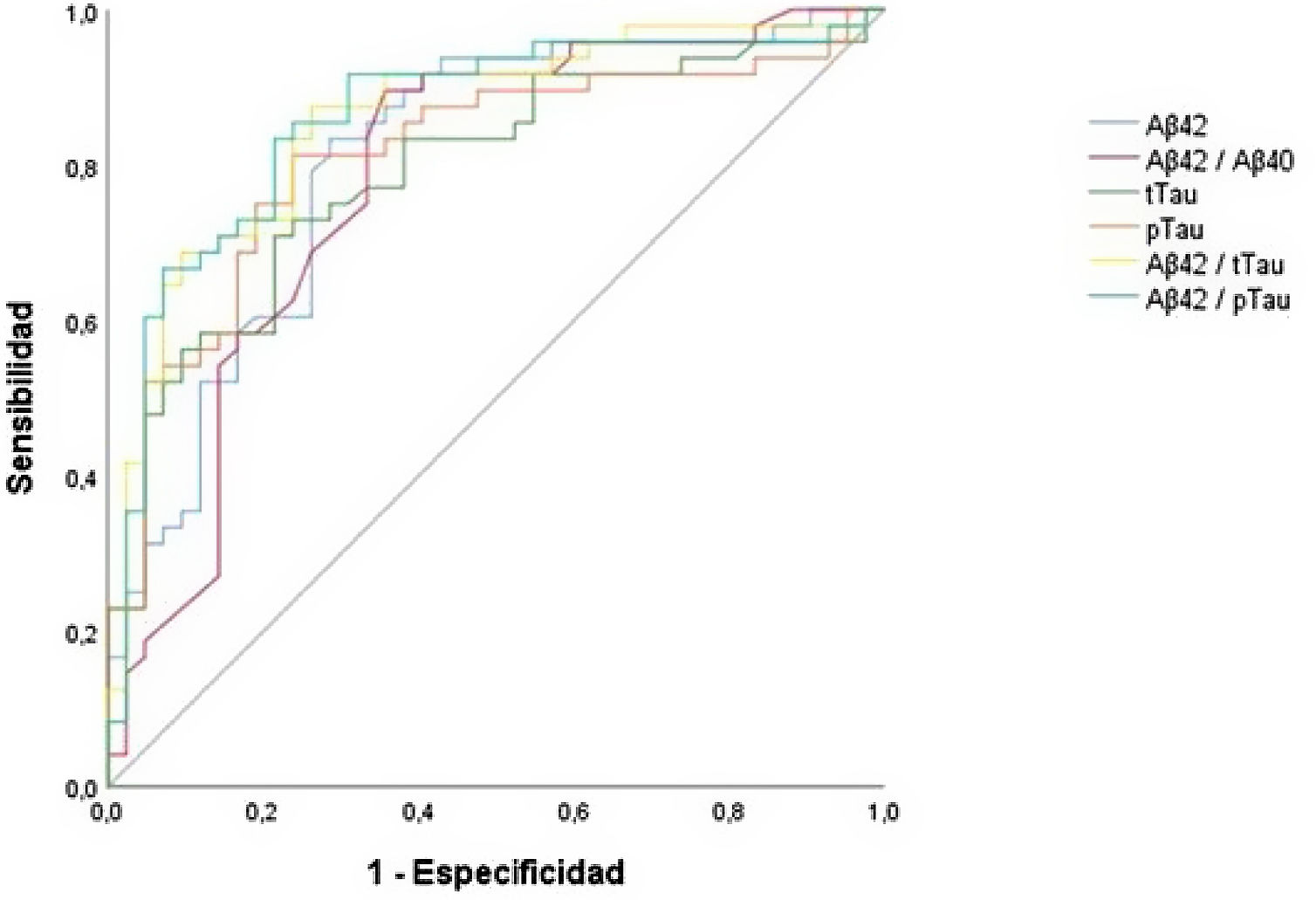
La figura 1 muestra las curvas ROC del conjunto de los biomarcadores analizados, los cuales obtuvieron una ABC con valores que oscilan entre el 0,78 y 0,86. Los valores seleccionados para determinar los puntos de corte óptimos para los biomarcadores principales de la EA en LCR fueron los siguientes: Aβ42=750pg/ml, tTau=522pg/ml, pTau181=69,9pg/ml y de las ratios: Aβ42/Aβ40=0,062, Aβ42/tTau=1,755 y Aβ42/pTau181=10,3. Los valores de sensibilidad, especificidad, valores predictivos e índices de Youden se ofrecen en la tabla 3. El índice de sensibilidad fue superior al 80% para todos los biomarcadores y ratios, excepto para tTau (70,8%). El índice de especificidad fue superior al 70% en todos los casos excepto para la ratio Aβ42/Aβ40 (64,3%). La combinación de biomarcadores mediante la ratio Aβ42/pTau181 obtuvo el índice de Youden más alto (0,62) con una ABC de 0,86.
Puntos de corte del conjunto de biomarcadores de líquido cefalorraquídeo
| Punto de corte | Sensibilidad, % | Especificidad, % | VPP, % | VPN, % | Youden | ABC [IC 95%] | p | |
|---|---|---|---|---|---|---|---|---|
| Aβ42 (pg/ml) | 750,0 | 83,3 | 71,4 | 76,9 | 78,9 | 0,548 | 0,81 [0,72-0,90] | <0,001 |
| Aβ42/Aβ40 | 0,062 | 89,6 | 64,3 | 74,1 | 84,4 | 0,539 | 0,78 [0,68-0,88] | <0,001 |
| tTau (pg/ml) | 522,0 | 70,8 | 78,6 | 79,1 | 70,2 | 0,494 | 0,79 [0,70-0,89] | <0,001 |
| pTau (pg/ml) | 69,9 | 81,3 | 76,2 | 79,6 | 78,0 | 0,574 | 0,81 [0,72-0,90] | <0,001 |
| Aβ42/tTau | 1,75 | 87,5 | 73,8 | 79,2 | 83,8 | 0,613 | 0,86 [0,78-0,94] | <0,001 |
| Aβ42/pTau181 | 10,25 | 83,3 | 78,6 | 81,6 | 80,5 | 0,619 | 0,86 [0,78-0,94] | <0,001 |
ABC: área bajo la curva; Aβ: proteína beta-amiloide; IC 95%: intervalo de confianza al 95%; LCR: líquido cefalorraquídeo; pTau181: tau fosforilada en la treonina 181; tTau: tau total; VPN: valor predictivo negativo; VPP: valor predictivo positivo.
De la muestra de sujetos con DCLa (n=35), 25 sujetos (71,4%) se clasificaron dentro del continuum Alzheimer: 5 sujetos (14,3%) como «cambio patológico tipo Alzheimer» (A+T−N−) y 20 (57,1%) como «EA» (A+T+N±). Por otro lado, 9 sujetos (25,7%) presentaron biomarcadores de EA normales (A−T−N−) y un sujeto (2,86%) se categorizó como «cambio patológico no tipo EA», puesto que presentaba un perfil A−T+N+. En la tabla 4 se muestran la frecuencia y los porcentajes de sujetos de cada perfil A/T/N y sus características sociodemográficas.
Características sociodemográficas y perfiles A/T/N en sujetos con DCLa (n=35)
| Perfil A/T/N | N (%) | Edad, media (DE) | Escolaridad, media (DE) | Sexo (% mujeres) |
|---|---|---|---|---|
| Continuum de la EA | ||||
| A+T−N− | 5 (14,9) | 71,6 (4,93) | 10,6 (4,56) | 40 |
| A+T+N− | 2 (5,7) | 78,5 (3,54) | 7,00 (1,41) | 0 |
| A+T+N+ | 18 (51,4) | 74,1 (4,42) | 9,33 (4,10) | 77,8 |
| Cambio patológico no tipo EA | ||||
| A−T+N+ | 1 (2,9) | 75,0 | 8 | 100 |
| Biomarcadores de la EA normales | ||||
| A−T−N− | 9 (25,7) | 76,2 (3,15) | 7,78 (2,59) | 22,2 |
DCLa: deterioro cognitivo ligero amnésico; DE: desviación estándar; EA: enfermedad de Alzheimer.
Seis de los participantes en el estudio (4,8%) sufrieron algún evento adverso relacionado con la punción lumbar, 5 de ellos cefalea pospunción y un caso de mareo, todos ellos recuperados ad integrum. No se registraron eventos adversos graves. No se registraron eventos adversos en relación con el resto de los procedimientos del estudio.
DiscusiónA pesar del desarrollo de sistemas de análisis semiautomatizados para la determinación de biomarcadores de la EA en LCR, no se dispone de valores de referencia universales para la interpretación de los mismos. El presente trabajo describe los valores de PdC obtenidos mediante un estudio prospectivo multicéntrico con el propósito de aplicarlos en la práctica clínica en nuestra población de una forma fiable.
Determinación de puntos de corte de biomarcadores de EA en LCRSe obtuvieron los PdC mediante un estudio de capacidad de clasificación de sujetos CS y DTA usando curvas ROC, eligiendo el PdC con el índice de Youden más alto. La elección de PdC para un biomarcador particular puede realizarse mediante diferentes aproximaciones estadísticas (por ejemplo, valores de normalidad en población sana, controlando la sensibilidad o especificidad deseada, maximizando la precisión o mediante curvas ROC ?representación gráfica de sensibilidad vs. 1?especificidad de los posibles PdC), siendo esta última aproximación práctica habitual en investigación clínica. La elección de los PdC tras el estudio de capacidad mediante curvas ROC según el índice de Youden más alto permite un óptimo balance entre sensibilidad y especificidad13,14, que consideramos adecuado en el ámbito de la práctica clínica en el diagnóstico de la EA, siendo esta determinación una prueba más en el proceso diagnóstico.
La obtención de PdC mediante una aproximación caso-control ha sido utilizada en numerosos trabajos previos15–21, algunos de ellos mediante la misma plataforma de análisis18–21. Con el objetivo de optimizar la fiabilidad del diagnóstico clínico, el presente trabajo dispone de unos criterios de inclusión y exclusión que cumplen con las recomendaciones de práctica clínica habitual para el diagnóstico de EA3,4,8, así como una extensa batería neuropsicológica para la correcta caracterización de los sujetos. Así mismo, se han utilizado criterios restrictivos en cuanto al grado de enfermedad cerebrovascular (resonancia magnética cerebral con leucoaraiosis en grado menor o igual a 1 en la escala de Fazekas, más allá de otros criterios habituales como la ausencia de infartos estratégicos o de gran vaso). De entre los trabajos que proponen PdC para la plataforma Lumipulse® siguiendo un diseño de estudio caso-control, destacan los publicados por Bayart et al. (44 DTA vs. 42 controles sanos, incluyendo tan solo medidas para Aβ42 y tTau), Leitão et al. (80 DTA vs. 40 controles), así como un importante estudio multicéntrico publicado recientemente por Gobom et al. (321 AD vs. 342 controles)18,20,21. En cuanto a los PdC que se referían en ficha técnica de Lumipulse® G por el fabricante (Fujirebio) en el momento de realizar los análisis del presente trabajo, se obtuvieron comparando 60 DTA vs. 40 controles. Estos PdC son discretamente inferiores respecto a los del presente estudio excepto para la ratio Aβ42/Aβ40, que obtiene un resultado similar (Aβ42<526pg/ml, tTau>409pg/ml, pTau>50,2pg/ml en el caso del estudio de Gobom et al.; Aβ42<599pg/dl, tTau>404pg/dl, pTau>56,5pg/dl, Aβ42/tTau<1,275, Aβ42/pTau<8,10, Aβ42/Aβ40<0,069 respecto los referidos en ficha técnica)21. Estas diferencias pueden deberse a cierta variabilidad en cuanto a las características demográficas de la muestra, como una edad más joven respecto a nuestra cohorte (por ejemplo, 62,2 y 66,8 años de media en los grupos control y DTA en el estudio de Gobom et al.)21, así como a diferencias en cuanto a los criterios de selección del grupo control. En el caso del presente estudio, los criterios de selección del grupo control incluían una extensa valoración psicométrica y no se incluyeron otras condiciones neurológicas como cefalea crónica o polineuropatías como en alguno de los estudios18,20,21, o enfermedades como epilepsia, esclerosis múltiple o trastornos psiquiátricos mayores, como sucede en el grupo control referido en ficha técnica. Además, en nuestro caso se siguieron los mismos criterios de inclusión para todos los sujetos, minimizando la variabilidad del grupo control, a diferencia de los criterios del estudio multicéntrico referido21.
Otros estudios han optado por definir los PdC de biomarcadores bioquímicos de EA en LCR basándose en la concordancia con el estudio con tomografía por emisión de positrones cerebral con radiotrazadores de amiloide o por patrón de hipometabolismo indicativo de EA con fluorodesoxiglucosa22–29, algunos de ellos realizados por centros de nuestro ámbito23,24. De ellos, consideramos de especial interés el publicado por Alcolea et al., en el que se incluyeron 94 sujetos (35 DCL, 12 DTA, 41 otras demencias o enfermedades neurodegenerativas y 6 controles sanos), derivando los PdC de los biomarcadores de EA en LCR utilizando la misma plataforma de análisis que en el presente trabajo según la concordancia con estudio de tomografía por emisión de positrones amiloide (18F-florbetapir)23. Los PdC que se obtuvieron (Aβ42 916pg/dl, tTau>456pg/dl, pTau>63pg/dl, Aβ42/Aβ40<0,062) son discretamente diferentes en cuanto a Aβ42 y tTau y muy similares en cuanto a pTau. De forma interesante, la ratio Aβ42/Aβ40 coincide en los 2 estudios. En este caso, las diferencias observadas, aunque menores, podrían deberse a una aproximación diferente (se incluye una muestra clínicamente heterogénea).
Respecto al tiempo transcurrido entre la obtención y el análisis de las muestras, aunque la recogida de estas se inició el año 2014 y las recomendaciones citadas indican estabilidad de las muestras durante 2 años11, una publicación posterior de Willemse et al. muestra que los niveles de Aβ42, tTau y pTau181 se mantendrían estables durante 12 años a una temperatura de −80°C30.
Aunque el estudio incluyó también un grupo de sujetos con DCLa, los datos de estos no se utilizaron para el cálculo de los puntos de corte debido a que el diagnóstico de DCL es relativamente inestable y en algunos casos los sujetos clasificados como tal no progresan a demencia o incluso revierten a normalidad psicométrica31. Sin embargo, la inclusión de este grupo con DCL ha permitido aplicar los resultados obtenidos y explorar la capacidad de clasificación de los mismos de acuerdo con el esquema A/T/N.
Las diferencias en cuanto a las características demográficas entre los grupos a partir de los que se obtienen los PdC (CS y DTA) concuerdan con los factores de riesgo conocidos de la enfermedad. El grupo con demencia fue ligeramente mayor que el de referencia, aunque la diferencia en las medias de edad fue inferior a 3 años y no alcanzó significación estadística. Sí se observaron diferencias estadísticamente significativas en cuanto al sexo y el nivel de escolaridad. Estas diferencias concuerdan con el mayor riesgo de DTA observado en mujeres y en sujetos con menor escolaridad reportado en la literatura32–34. Respecto al genotipado del gen APOE, se observan diferencias en cuanto al porcentaje de portadores de la variante APOE-?4, siendo este más alto en el grupo de DTA, un resultado esperable debido al aumento de riesgo de EA en los portadores de esta variante alélica35,36.
En cuanto a los valores obtenidos de los diferentes biomarcadores estudiados, así como la combinación de los mismos mediante ratios, se observan diferencias estadísticamente significativas entre los 2 grupos para todos ellos, hecho que concuerda con el diagnóstico clínico. Todos los biomarcadores y ratios obtienen ABC superiores al 0,78, destacando las obtenidas mediante la combinación de biomarcadores indicadores de amiloidosis y depósito de proteína tau (Aβ42/pTau181 y Aβ42/tTau, ABC 0,86), en consonancia con estudios previos37,38. Se observan globalmente niveles de sensibilidad y especificidad superiores al 70%, alcanzando en su mayoría valores superiores al 75% en ambos estadísticos. Los biomarcadores aislados con valores de sensibilidad más altos fueron aquellos indicativos de amiloidosis (Aβ42 y Aβ42/Aβ40), especialmente la ratio Aβ42/Aβ40 (sensibilidad del 89%), aunque con unos valores de especificidad más modestos (71 y 64%, respectivamente). Este hecho podría deberse al diferente patrón temporal de alteración de dichos biomarcadores, disminuyendo los de amiloidosis tempranamente respecto a la elevación de tTau y pTau18139 en fases preclínicas de la enfermedad, así como a la inclusión de sujetos con niveles bajos de péptidos amiloide en LCR por amiloidosis cerebral no directamente relacionada con la EA. Se observó una mejor especificidad de los 2 biomarcadores indicativos de depósito de proteína tau, a favor de tTau respecto a pTau181 (78,6 y 76,26%, respectivamente). La combinación de biomarcadores indicativos de amiloidosis y taupatía mediante la ratio Aβ42/pTau181 obtiene los valores con mayor ABC y mejor balance entre sensibilidad y especificidad, aconsejable en el diagnóstico de una enfermedad con carácter irreversible, sin perder de vista la necesidad de detección de pacientes en fases tempranas. Tal y como han demostrado varios estudios anteriores, la ratio Aβ42/pTau181 se considera un biomarcador en LCR con una elevada precisión40–42. En conjunto, los resultados obtenidos apoyan el uso de los PdC obtenidos en la práctica clínica, preferiblemente mediante la combinación de los mismos.
Variantes A/T/N en sujetos con DCLaLa mayoría de los sujetos del grupo DCLa presentan un perfil de biomarcadores de EA alterado, cumpliendo criterios diagnósticos de DCLa debido a EA3. Este elevado porcentaje podría relacionarse con la realización de un estudio neuropsicológico formal y extenso en el estudio, que conlleva una óptima clasificación clínica de los sujetos, reforzando el papel de la valoración neuropsicológica en la práctica clínica habitual. Los resultados obtenidos nos han permitido un diagnóstico etiológico más preciso en pacientes con diagnóstico clínico de DCLa, siendo similares a los reportados en distintos trabajos sobre la aplicabilidad del sistema de clasificación A/T/N en otras cohortes43–48.
LimitacionesRespecto a las limitaciones del estudio, se considera que una mayor muestra de sujetos en cada uno de los grupos podría haber aumentado la potencia estadística del mismo. Por otro lado, a pesar de que se asumen unos niveles de los biomarcadores dentro de la normalidad en el grupo control, no es descartable la inclusión de sujetos en fases preclínicas de EA. Este posible sesgo de selección es inherente a la clasificación estrictamente clínica y psicométrica, si bien el uso de una extensa batería neuropsicológica puede minimizarlo. Otra limitación del estudio es no disponer de datos longitudinales, especialmente en cuanto al grupo control. Asimismo, a pesar de la optimización del estudio diagnóstico mediante un adecuado protocolo y la experiencia en los centros participantes, no se dispone de un estudio anatomopatológico de los pacientes con diagnóstico de DTA que confirme la etiología. Por otro lado, la inclusión de algunos sujetos con quejas cognitivas subjetivas implica un mayor riesgo de inclusión de sujetos en fases preclínicas de la EA49, si bien la evidencia en este sentido ha aumentado en los años posteriores al diseño del estudio y no se tuvo en cuenta en aquel momento. A pesar del riesgo de inclusión de sujetos en fases preclínicas de EA en el grupo control, la comparación entre los grupos más alejados a nivel psicométrico podría disminuir su efecto, ante niveles de biomarcadores presumiblemente más alejados de la normalidad en los sujetos con EA en fase de demencia. Por último, las dificultades en cuanto a la selección de los sujetos, especialmente en referencia al grupo control, así como de aspectos logísticos en cuanto a la creación de circuitos de envío de muestras de forma sistematizada y fiable, conllevó un retraso considerable respecto el calendario de ejecución del proyecto previsto inicialmente.
Por otro lado, el diseño del presente estudio conlleva un detallado protocolo de valoración clínica, neuropsicológica y de neuroimagen que permite una adecuada caracterización de los sujetos. Además, se ha realizado en un marco de práctica clínica habitual, donde se observa una mayor heterogeneidad en cuanto a características demográficas, clínicas, comorbilidades o tratamientos farmacológicos respecto a estudios en cohortes de investigación. Esta aproximación proporciona una mayor validez externa para la aplicación de los PdC descritos en otras unidades especializadas.
ConclusionesEn el presente estudio se han determinado PdC para los biomarcadores de EA en LCR mediante una aproximación clínica, obteniendo valores estadísticos que apoyan su aplicación de forma fiable en los centros participantes y con bajo riesgo de eventos adversos. La combinación de biomarcadores indicativos de amiloidosis y taupatía mediante la ratio Aβ42/pTau181 es la que proporciona un mejor balance entre sensibilidad y especificidad.
FinanciaciónLa presente investigación no ha recibido ayudas específicas provenientes de agencias del sector público, sector comercial o entidades sin ánimo de lucro.
MSC percibe financiación por parte del Consejo Europeo de Investigación (European Research Council) en el marco del programa de investigación e innovación europeo Horizonte 2020 (European Union's Horizon, Grant agreement No. 948677) y beca Marie Skłodowska-Curie (No 847648 (LCF/BQ/PR21/11840004), así como del Instituto de Salud Carlos III (PI19/00155), y la Fundació La Caixa (ID 100010434).
ING y JRG perciben financiación por parte del Instituto de Salud Carlos III (ISCIII-FEDER, PI21/00194).
Conflicto de interesesMSC ha trabajado como consultor y en consejos asesores para Roche Diagnostics International Ltd. y ha ofrecido sesiones en simposios esponsorizados por Roche Diagnostics, S. L. U. y Roche Farma, S. A. El resto de los autores declaran no tener ningún conflicto de intereses.
Los autores agradecen la colaboración de los participantes en el estudio y de sus familiares, así como la de todos los profesionales de los distintos centros que han participado en el mismo (enfermería y auxiliares de enfermería de hospitales de día y equipo técnico de laboratorio).