La endometriosis es una enfermedad muy prevalente, polimorfa y capaz afectar seriamente a la fertilidad con una grave afectación de su reserva ovárica en algunos casos.
El diagnóstico precoz y el correcto seguimiento son fundamentales para evitar las consecuencias de la endometriosis sobre la fertilidad y sobre la calidad de vida. Para ello, profesionales de distintos ámbitos han de coordinarse. Para preservación integral de la fertilidad se considerarán medidas de prevención de las recurrencias (básicamente con anticonceptivos orales), la individualización de las indicaciones de cirugía, técnicas quirúrgicas conservadoras de tejido ovárico y en casos seleccionados, la vitrificación de ovocitos.
Las pacientes deben ser informadas del beneficio de intentar la gestación en edades tempranas. La vitrificación ovocitaria sería una alternativa eficaz para posponer la maternidad, pero su efectividad depende de la edad de la mujer y de la cantidad y calidad de ovocitos obtenidos. La literatura relativa a la preservación en endometriosis es prácticamente inexistente, y la extrapolación de los datos de otro tipo de pacientes, aunque inexacta, es la única referencia disponible.
Las vitrificación ovocitaria en los centros públicos debe reunir una serie de condiciones coste-utilidad: en casos de riesgo real de pérdida de reserva ovárica, pero que puedan responder a una estimulación ovárica con un número suficiente de ovocitos. Serán candidatas a vitrificación las pacientes con endometriosis cuando se den 2 condiciones: 1) endometrioma bilateral de más de 4cm o recurrencia posquirúrgica de la endometriosis; 2) edad≤35 años y marcadores de reserva ovárica no indicativos de baja reserva ovárica (AMH>1ng/ml; recuento de folículos antrales>5; FSH>10mg/ml). Dado que se considera que 10 ovocitos vitrificados sería un número adecuado, se realizarán un máximo de 2 ciclos para alcanzar esta cifra.
Endometriosis is a prevalent and polymorphic disease in which fertility may be impaired. Some patients may have an ovarian reverse loss, compromising their reproductive future, even with assisted reproduction techniques.
Early diagnosis and accurate follow-up are essential to avoid endometriosis consequences, not only on fertility, but also on quality of life. Professionals from different fields need an adequate training and collaboration with other specialists. For integrated fertility preservation, measures for preventing recurrence (mainly oral contraception), individualised surgery indications, ovarian tissue conservative surgical techniques and, in selected cases, oocyte vitrification should be considered.
Although patients must be informed of the benefits of pregnancy at a young age, this is often a non-realistic option. Oocyte vitrification is an effective alternative to postpone maternity, but its efficacy is related to the age of the woman and to the quantity and quality of the oocytes obtained. Publications related to preservation in endometriosis are scarce, and extrapolating data from other kinds of patients, although inexact, is the only available reference.
Oocyte vitrification in public health systems should have some cost-benefit conditions. It should be offered in cases with a real risk of ovarian reserve loss, but when there are adequate conditions to achieve an ovarian stimulation response to be able to obtain a sufficient number of oocytes. Patients with endometriosis will be candidates for vitrification if they fulfil two conditions: 1) bilateral endometrioma of more than 4cm, or post-surgical recurrence of endometriosis, and 2)- age ≤35 years and ovarian reserve markers excluding low ovarian reserve (AMH>1ng/ml; antral follicle count>5; FSH>10mg/ml). As 10 vitrified oocytes should be considered a sufficient number, a maximum of 2 cycles will be offered to reach this number. Follow-up of these cases will allow an evaluation of the efficacy and efficiency of this policy to be made in the future.
La endometriosis es una enfermedad con una alta prevalencia que afecta hasta un 5-10% de las mujeres en edad fértil. Se estima que 176 millones de mujeres en el mundo sufren endometriosis (Ministerio de Sanidad, Servicios Sociales e Igualdad, 2013; Carrillo et al. 2016; Ozcan et al., 2008).
Se trata de una enfermedad muy pleomorfa que puede presentarse en estadios diferentes y cursar con una clínica variable. Si bien algunas pacientes están asintomáticas, otras consultarán por dismenorrea, dolor abdominal, dispareunia, alteraciones del ciclo u afectación de otros órganos (Barlow y Glynn, 1993). Otras consultan inicialmente por esterilidad (Practice Comittee ASRM, 2012) y su pronóstico reproductivo a menudo resulta peor que el de otro tipo de parejas (Carrillo et al., 2016). Al margen de la forma de comienzo clínico la endometriosis es una enfermedad crónica, que se mantiene activa y puede exacerbarse mientras dura el ciclo genital de la mujer. Por lo tanto, la función reproductiva de la mujer con endometriosis puede verse afectada a lo largo del tiempo.
Esta variabilidad clínica hace que médicos generales, ginecólogos e incluso otros especialistas puedan estar implicados en el manejo de estas pacientes. Desde las unidades especializadas en el tratamiento de la endometriosis se trata de concienciar a otros colegas para lograr un diagnóstico precoz de la enfermedad, para poder actuar con celeridad en el tratamiento del dolor y prevenir las consecuencias de complicaciones de estadios avanzados de la endometriosis. Es importante que todos ellos tengan conocimiento de la existencia de un riesgo de pérdida de la función reproductiva, y de las opciones de preservar la fertilidad en aquellas mujeres jóvenes con endometriosis cuyo objetivo inmediato no es la maternidad.
Por este motivo, desde el Grupo de interés de asistencia en reproducción de los centros públicos de la SEF considera importante realizar una actualización sobre los conocimientos actuales relativos a la preservación de la fertilidad en la endometriosis, y proponer una serie de recomendaciones para el cuidado de su función reproductiva. La articulación de una red de seguimiento de la paciente con endometriosis que interactúe con las unidades de reproducción en el sistema público de salud es la base para una atención integral de la endometriosis.
Endometriosis y esterilidadLa endometriosis cursa con esterilidad entre un 30-50% de los casos. Los mecanismos por los que la reproducción se ve afectada son múltiples. En los casos más graves se produce una franca alteración de la anatomía genital, obstrucción tubárica, hidrosalpinx… Sin embargo, incluso en estadios leves se han descrito en el líquido peritoneal y folicular la presencia de citocinas, factores inflamatorios y un ambiente de estrés oxidativo. Estos elementos condicionan cambios a nivel del espermatozoide, de la foliculogénesis y del ambiente folicular. Numerosos estudios han confirmado alteraciones en la función de las células de la granulosa y en la calidad ovocitaria (Garrido et al., 2000; Lachapelle et al., 1996; Pellicer et al., 1998; Pellicer et al., 2000; Wunder y Mueller, 2006; Cahill et al., 2003; Sanchez et al., 2016).
Estas anomalías en la calidad de los gametos se traducen en embriones de peor calidad. La implantación también podría estar afectada negativamente por la disfunción endometrial inherente a la enfermedad, siendo especialmente notoria en las mujeres con adenomiosis (Gilabert-Estellés et al., 2003, Gilabert-Estellés et al., 2007; Brosens et al., 2010; Lebovic et al., 2001; Brosens et al., 2010).
Sin embargo, el factor que más afecta al potencial reproductivo de las mujeres con endometriosis que consultan por esterilidad es a menudo una reducción de la reserva ovárica (Lemos et al., 2008). La presencia de endometriomas ováricos o la necesidad de quistectomías ováricas son, como veremos en el apartado siguiente, factores determinantes responsables de la pérdida de reserva ovárica. No es infrecuente que nos encontremos con la sensación de haber llegado tarde y de tener que tratar a mujeres con baja reserva ovárica que responderán con menor número de ovocitos y peor calidad de los mismos.
Por estos motivos, la respuesta de las mujeres con endometriosis a las técnicas de reproducción asistida es peor que en otro tipo de pacientes. Estas pacientes a menudo tienen marcadores de reserva ovárica más desfavorables, siendo este el factor más determinante junto con la edad del éxito de los tratamientos (Practice Comittee ASRM, 2012; Carrillo et al., 2016; Somigliana et al., 2015).
Pérdida de la reserva ovárica en la paciente con endometriosisLa pérdida de reserva ovárica en la endometriosis se debe al efecto de los endometriomas y a las cirugías al nivel del ovario (Gizzo et al., 2015; Oral et al., 2015; Streuli et al., 2012).
El endometrioma podría actuar por un efecto de masa mecánico que causa destrucción tisular. Se describen alteraciones morfológicas en torno al quiste: pérdida de estroma cortical y de folículos, fibrosis… Sin embargo, parece que el efecto principal se debe a la acción de factores paracrinos, inflamatorios y estrés oxidativo que pueden aparecer incluso en endometriosis leves (Carrillo et al., 2016).
La quistectomía ovárica laparoscópica, pese a ser la técnica quirúrgica de elección (Hart et al., 2008) y la más conservadora, puede dañar seriamente la reserva ovárica. La decapsulación, incluso en manos expertas, arrastra junto con la cápsula del quiste folículos primordiales (Donnez et al., 2010). Este fenómeno es incluso más marcado en pacientes jóvenes, donde la densidad folicular es mayor debida no solo a su edad, sino también a una tipología más proinflamatoria que induce una activación del reclutamiento folicular que justificaría el mayor índice de recidivas observado en estos casos (Carrillo et al., 2016). La coagulación para lograr hemostasia adecuada también tiene un efecto de destrucción tisular, razón por la cual el láser podría ser más adecuado que otros tipos de sistemas de coagulación. En torno al lecho quirúrgico se dan fenómenos de inflamación que extienden el daño tisular, a los que hay que añadir factores como el compromiso vascular o la fibrosis secundaria.
Los factores más determinantes del grado de afectación de la reserva ovárica tras la quistectomía serían (Carrillo et al., 2016):
- -
El carácter bilateral.
- -
La edad de la paciente.
- -
La situación prequirúrgica de reserva ovárica.
- -
El tipo de cápsula del quiste (fibroblástico o fibroquístico).
- -
La habilidad del cirujano para limitar la lesión del tejido sano y la extensión de la coagulación.
- -
Las recurrencias quirúrgicas, la necesidad de una cirugía repetida.
Las determinaciones posquirúrgicas de hormona anti-mulleriana revelan una reducción de la reserva ovárica, como quedó demostrado en el metaanálisis de Raffi en 2012, con una disminución de hasta un 40% con respecto a los niveles prequirúrgicos (Raffi et al., 2012). Por este motivo, la Sociedad Europea de reproducción Humana y Embriología (ESHRE) recomienda prudencia e información adecuada a las mujeres infértiles antes de una quistectomía por endometriosis (Dunselman y Vermeullen Becker, 2014).
Preservación de la fertilidad mediante vitrificación ovocitariaAnte esta posible afectación de la reserva ovárica en el momento del diagnóstico o en la evolución de la enfermedad, se plantea que determinadas pacientes podrían beneficiarse de una preservación de ovocitos. Esta técnica, realizada en condiciones adecuadas, permitiría adelantarse a esta situación y ofrecer una opción de fertilidad futura.
La vitrificación ovocitaria es eficaz y seguraLa vitrificación ovocitaria ha demostrado ser una técnica eficaz y segura. Series amplias como la de Cobo et al. (2014) con 1.027 recién nacidos han confirmado que los resultados obstétricos y neonatales no difieren en los ciclos con ovocitos vitrificados con respecto a los ovocitos en fresco. Los datos del registro SEF 2013 recogen en ciclos con ovocitos propios tasas de supervivencia ovocitaria del 83,1%, con tasas de gestación por desvitrificación del 35,1%; con ovocitos de donante estas cifras ascendieron a 87,2% y 47,9% respectivamente.
En cuanto a los protocolos se recomiendan los ciclos con antagonistas GnRH que permiten desencadenar la ovulación con análogos de la GnRH. Esta medida consigue que la hiperestimulación ovárica sea prácticamente inexistente. Otro tipo de complicaciones de la FIV como sangrado, torsión ovárica o infección tienen una prevalencia menor de un 0,5% (Registro SEF 2013).
Factores determinantes del éxito de la preservación ovocitariaLa vitrificación ovocitaria es la técnica de elección para la congelación de ovocitos (Oktay et al., 2006; Cobo y Diaz, 2011; Jlujoysky et al., 2014). Sin embargo, el éxito de la preservación ovocitaria depende de la calidad y cantidad de ovocitos. La edad, principal marcador de calidad, es el factor que mayor influencia tiene en el resultado del ciclo de desvitrificación (Cil et al., 2013; Stoop et al., 2014; Cobo et al., 2016). La edad se asocia a una pérdida progresiva de reserva ovárica en cantidad y calidad (Nelson, 2013). Independientemente de la edad, la situación de la reserva ovárica es determinante; de ella dependerá el número de ovocitos que se conseguirán tras la estimulación ovárica (La Marca et al., 2014; Somigliana et al., 2015). La realización de varios ciclos de estimulación puede ser efectiva y segura para permitir la acumulación de un número suficiente de ovocitos (Elizur et al., 2009).
Los estudios (Cil et al., 2013; Cobo et al., 2016) que presentan resultados de ciclos de desvitrificación revelan que la tasa de recién nacido vivo está condicionada por el número de ovocitos disponibles. La mayor serie disponible en preservación electiva de ovocitos (Cobo et al., 2016) reúne 137 casos de mujeres que habían recurrido a esta técnica para retrasar voluntariamente la maternidad o por causa médica (17 casos). La tasa acumulada de recién nacido vivo implica el consumo de un número de ovocitos que será mayor en las mujeres de más de 36 años que en el grupo de mujeres más jóvenes. Para las mujeres de más de 36 años se alcanzó una tasa estable de recién nacido vivo a partir de los 10 metafase ii consumidos. Esta cifra de 10 ovocitos coincide con los resultados del clásico estudio de Sunkara (Sunkara et al., 2011) que determina, a partir del análisis de 400.135 ciclos del registro nacional británico, que la tasa de recién nacido alcanza un nivel óptimo a partir de los 10-15 ovocitos.
Efecto del ciclo de fecundación in vitro sobre la endometriosisEn la etiopatogenia de la endometriosis intervienen los estrógenos y la ovulación. Por todo ello, existe el temor de que las técnicas de reproducción asistida pudieran condicionar una progresión de la enfermedad.
La estimulación para ciclos de inseminación sí parece incrementar el riesgo de recurrencia, no así las mujeres sometidas a FIV (D’Hooghe et al., 2006). Benaglia, en un estudio retrospectivo de 189 mujeres con endometriosis y un ciclo FIV fallido, recoge una tasa de recurrencia a los 36 meses del 20%. Esta fue independiente del número de ciclos FIV realizados y de la reserva ovárica o respuesta a la estimulación (Benaglia et al., 2011).
Coccia publica un estudio retrospectivo con 117 mujeres infértiles intervenidas de endometriosis. Con un seguimiento de entre uno y 15 años observaron que la recurrencia de la lesión ecográfica era similar en el grupo sometido a técnicas de reproducción asistida y en el grupo control, independientemente del estadio de la enfermedad (Coccia et al., 2011).
Experiencia en vitrificación ovocitaria en endometriosisLa gran experiencia acumulada en vitrificación ovocitaria se refiere básicamente a casos de donantes, preservación en pacientes oncológicas que van a ser sometidas a tratamientos gonadotóxicos o preservación electiva que a menudo se realiza en mujeres de más de 36 años (Cobo et al., 2016). En mujeres con endometriosis existen pocos casos publicados de pacientes que hayan reutilizado sus ovocitos. En la serie de Cobo tan solo 12 mujeres con endometriosis desvitrificaron sus ovocitos.
La endometriosis afecta a la calidad ovocitaria como vimos anteriormente, y dependiendo de los casos, en mayor o menor medida a la reserva ovárica. Por esta razón, los resultados han de ser más desfavorables que en las donantes y que en mujeres de edades similares que hicieron preservación electiva para retrasar la maternidad.
Selección de pacientes con endometriosis candidatas a vitrificación ovocitariaDada la alta prevalencia de la endometriosis, y su variedad de formas de presentación y evolución, es preciso seleccionar a las pacientes que realmente podrán beneficiarse de una vitrificación ovocitaria. Ofrecer esta opción de forma indiscriminada a todas las mujeres con endometriosis sería inasumible económicamente para un sistema público, y probablemente tendría un valor coste-utilidad limitado.
Para establecer unos criterios de selección adecuados es preciso considerar:
Tasa de afectación ováricaLa endometriosis se presenta con endometriomas hasta en un 20-40% de los casos y estos son bilaterales hasta en un 19-28% de las ocasiones (Vercellini et al., 1998).
Tasa de recurrenciasLa evolución natural de la enfermedad es variable; sin tratamiento se han descrito, en controles laparoscópicos realizados a los 6-12 meses, progresión de la enfermedad hasta en un 45%, regresión hasta en el 29% y estabilización hasta en un 42% de las pacientes. Guo en una revisión de la literatura estima tasas de recurrencia entre un 2,5% a los 2 años y hasta un 40-50% a los 5 años (Guo, 2009).
En un estudio retrospectivo de 401 pacientes con seguimiento medio de 6 años estableció, en un estudio multivariante, que la edad de la menarquia, la severidad del dolor pélvico crónico y la dismenorrea previas a la cirugía eran factores de riesgo de recurrencia del dolor. Mientras que en lo relativo a la recurrencia de lesiones los que resultaron significativos fueron la edad en el momento de la cirugía inicial, el estadio de la enfermedad, la severidad del dolor pélvico crónico previamente a la cirugía y la ausencia de gestación (Coccia et al., 2011).
Previsión de que la mujer necesite recurrir a sus ovocitos vitrificados en un futuroEl recurso de vitrificar ovocitos ha de ser útil para la paciente; es decir, que debe proponerse en pacientes que vayan a presentar deseos de fertilidad en un futuro y problemas de esterilidad. La endometriosis cursa con esterilidad en un 30-50% de los casos, por lo que muchas de estas pacientes no necesitarán estas medidas. Por otra parte, en series en las que se describen pacientes que reutilizan sus ovocitos vitrificados por otro tipo de indicaciones, se han establecido tasas de reutilización entre un 9,7% y un 12% (Cobo et al., 2016; Devine y Mumford, 2015). Estas eran básicamente mujeres que recurrieron a una preservación electiva mayoritariamente en edades superiores a los 36 años, y por lo tanto con un perfil totalmente distinto al del caso de la endometriosis.
Realización del procedimiento cuando exista una reserva ovárica adecuadaIdealmente, la vitrificación debe proponerse antes de que exista una afectación relevante de la reserva ovárica con el fin de lograr un número suficiente de ovocitos de calidad. Para ello, disponemos de marcadores de reserva ovárica como el recuento de folículos antrales o la hormona anti-mulleriana, cuyo valor predictivo de respuesta a la estimulación ovárica es elevado (La Marca y Sunkara, 2014). Sin embargo, su papel en población no estéril a priori no esta aún claramente establecido. La edad se considera como un marcador determinante que además de relacionarse con la reserva ovárica (Seifer et al., 2011) es indicativo de calidad ovocitaria. Las aneuploidías aumentan exponencialmente a partir de los 36 años (Franasiak et al., 2014; Demko et al., 2016), aunque otros factores de orden metabólico y energético también podrían estar implicados en los fallos reproductivos asociados a la edad (Moreno et al., 2015).
Ante estas circunstancias hemos de buscar el equilibrio para que la preservación ovocitaria en mujeres con endometriosis sea una medida con una relación coste-utilidad razonable, para lo cual hemos de seleccionar a las pacientes con amenaza de pérdida de reserva ovárica que, al mismo tiempo, tengan aún una dotación suficiente para poder así acumular un número aceptable de ovocitos de calidad (Somigliana et al., 2015).
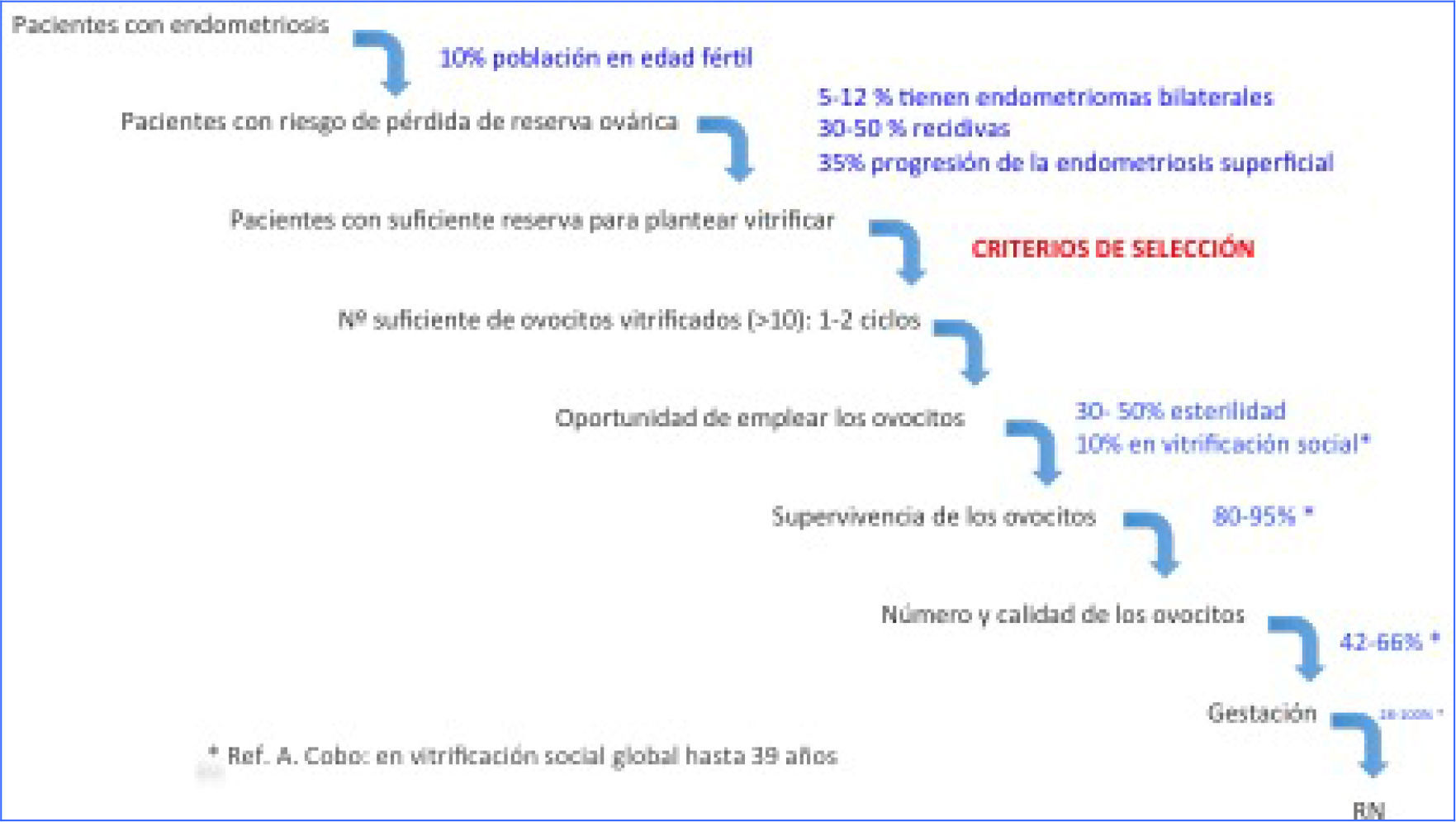
Actualmente disponemos únicamente de los datos referentes a otro tipo de pacientes que han sido sometidas a preservación ovocitaria por motivos muy diferentes (oncológicas, social…). La extrapolación de estos datos a las pacientes con endometriosis (fig. 1) es compleja: por una parte la calidad y cantidad de ovocitos obtenidos no será equivalente y, además, es más probable que presenten problemas de esterilidad relacionados no solo con una reserva ovárica insuficiente.
Considerando estas limitaciones, desde el Grupo de Interés de Asistencia en Reproducción de los Centros Públicos de la SEF se han propuesto unos criterios de selección en las pacientes con endometriosis para que sean candidatas a una vitrificación de ovocitos en el sistema público de salud (fig. 2).
Las condiciones necesarias son una edad ≤35 años y una previsión de respuesta suficiente a la estimulación ovárica. Para ello se considera que si bien pacientes que tuvieran marcadores de reserva ovárica en los rangos marcados por los criterios de Bolonia (Ferraretti et al., 2011) podrían ser excluidas, no así las que tuvieran una respuesta subóptima. Este último grupo de pacientes descrito por autores como Polyzos (Polyzos y Sunkara, 2015), incluye pacientes que respondieron con entre 4 y 9 ovocitos; en estos casos un par de ciclos pueden ser necesarios para obtener más de 10 ovocitos. Si se cumplen estas condiciones, el procedimiento debería ofrecerse a mujeres con afectación relevante de los ovarios: quistes endometriósicos de tamaño importante o recurrencia de la enfermedad a nivel del ovario en mujeres que han tenido una cirugía ovárica previa (Dunselman y Vermeullen Becker, 2014; Somigliana et al., 2015; Carrillo et al., 2016). Estas, en principio, serán las pacientes que realmente podrían ver peligrar su reserva ovárica.
La limitación de recursos en el sistema público y la necesidad de lograr un número mayor de 10 ovocitos ha determinado que, en principio, se fije el número máximo de ciclos de vitrificación en 2. Se estima que pacientes que no logran una cifra adecuada de ovocitos tras 2 ciclos de estimulación probablemente tendrán ya una afectación de la reserva ovárica que hace que esta medida no resulte coste-efectiva. Si tras un primer ciclo hubiera una respuesta inesperadamente baja (≤3 ovocitos) se valorará individualmente si un cambio de protocolo de estimulación podría lograr una respuesta adecuada en un segundo ciclo.
Preservación integral de la fertilidad en la endometriosis, papel del sistema público de saludAnte el carácter crónico y polimorfo de la endometriosis el sistema público debería organizar un plan de asistencia que garantice el diagnóstico precoz y el correcto seguimiento de la endometriosis. De esta forma se podría mejorar el pronóstico reproductivo de estas mujeres, y además se mejoraría en muchos casos su calidad de vida.
Este plan de asistencia ya se contempla en la Guía de atención a las mujeres con endometriosis en el Sistema Nacional de Salud (2013), donde se recalca la necesidad de una colaboración entre atención primaria y especializada, se definen estrategias de atención y vías de abordaje. A estas recomendaciones habría que añadir la necesidad de una interacción entre los diferentes especialistas que siguen a estas mujeres con los siguientes objetivos:
Diagnóstico precoz de la enfermedadNo es infrecuente que el diagnóstico de la endometriosis se retrase años, ya que hasta un 30% de los casos no presentan clínica o se trata de síntomas relacionados con la esfera extragenital que hacen que no sean valorados por ginecólogos. Por otra parte, se tiende a considerar la dismenorrea como algo prácticamente fisiológico, cuando es el síntoma más relevante de la endometriosis, en especial cuando es severo y progresivo. Las asociaciones de afectados están ejerciendo un importante papel de concienciación difundiendo el mensaje de que la dismenorrea no es algo «normal» y que se debe consultar por ello. La guía del ministerio de sanidad insiste en la necesidad de derivar a los pacientes a unidades especializadas en los casos de dismenorreas rebeldes al tratamiento con anticonceptivos orales o antiinflamatorios.
Seguimiento adecuado de la endometriosisDiagnóstico precoz de la progresión de la enfermedad y prevención de recurrenciasComo ya se señaló previamente, la evolución natural de la enfermedad es variable y se observan tanto casos de progresión como de regresión espontánea de la enfermedad. Dado que se trata de una enfermedad crónica debería asegurarse el seguimiento adecuado para evitar situaciones en las que la afectación ovárica bilateral se detecta cuando ya hay un compromiso importante de la reserva folicular.
Los factores de riesgo y los marcadores de recurrencia no están claramente identificados, ya que se basan en estudios retrospectivos e incluyen diversos grados de la enfermedad y diferentes métodos de detección de la recurrencia.
Existen tratamientos médicos eficaces para la prevención de las recurrencias: los anticonceptivos (ACO), los gestágenos, el DIU liberador de levonorgestrel y los análogos GnRH.
Los ACO inhiben la ovulación, mantienen unos niveles de estrógenos estables y producen atrofia endometrial; con el empleo continuo de ACO se puede incluso suprimir totalmente la hemorragia por privación. Para lograr una reducción de la recurrencia del dolor es necesario prolongar el uso de ACO más de 6 meses. Un metaanálisis (Muzii y Di Tucci, 2016) demostró que las mujeres con ACO en pauta continua durante 12 meses, después de la quistectomía, tenían menos recurrencias de dismenorrea o endometrioma ovárico que los ACO en pauta cíclica (Hughes et al., 2007; Koga et al., 2015).
Un ensayo prospectivo aleatorizado no logró demostrar diferencias entre distintos tipos de gestágenos. El dienogest, que tiene un fuerte efecto progestagénico en el endometrio y una acción antiandrogénica es tan efectivo como el tratamiento con análogos GnRH en la prevención de recurrencias con muchos menos efectos secundarios (Strowitzi y Marr, 2010). Los gestágenos tienen una efectividad similar en la prevención de la recurrencia del dolor, pero su uso está limitado por su peor tolerancia. La opción del DIU de levonorgestrel, pese a no inhibir la ovulación, permite un tratamiento eficaz a largo plazo con muy buena tolerancia.
Los análogos de la GnRH son altamente eficaces en la prevención de recurrencias (nivel de evidencia Ia), pero la aparición de efectos secundarios debidos al hipoestronismo, especialmente a nivel óseo, obliga a realizar tratamientos cortos o a completarse con terapia hormonal sustitutiva con dosis bajas de estrógenos (Koga et al., 2015).
Cirugía conservadora en endometriosisEs importante que ante cualquier cirugía por endometriosis se considere el posible efecto sobre la fertilidad y la reserva ovárica, por lo que sería recomendable una valoración de la función reproductiva futura antes de la intervención. En ocasiones puede ser recomendable posponer la quistectomía y priorizar la fertilidad (preservación o gestación) si es que la sintomatología de la paciente lo permite. Esta recomendación es especialmente relevante ante una segunda cirugía. La ESHRE, en sus guías clínicas, es muy restrictiva en las indicaciones de cirugía ovárica ante mujeres que no han cumplido sus deseos genésicos (Duselman 2014). Por ello una valoración conjunta de los casos entre unidades de reproducción y equipos quirúrgicos es imprescindible para establecer una estrategia individualizada.
En los casos en que sea necesario realizar una quistectomía la técnica de elección es la escisión de la cápsula frente al drenaje y electrocoagulación de la pared del endometrioma (Dunselman y Vermeullen Becker, 2014). Otras alternativas parecen tener un efecto menos nocivo en la reserva ovárica: la hemostasia con láser de CO2 tras la decapsulación (Donnez et al., 2010) o el drenaje del quiste con inyección de etanol (Lee et al., 2014).
A menudo las cirugías por endometriosis graves son intervenciones complejas, en las que se resecan complejos focos de endometriosis infiltrantes, y no debe olvidarse que el momento en que se aborda el ovario, a menudo al final, es cuando más en peligro está el futuro reproductivo de la mujer.
Recomendaciones desde el punto de vista de la reproducciónLas recomendaciones para la prevención de la afectación de la fertilidad en mujeres con endometriosis que no han cumplido deseos genésicos serían las siguientes:
- -
La toma de anticonceptivos orales previene la recurrencia de la endometriosis. Se trata de un tratamiento sencillo, económico y eficaz (nivel de evidencia Ia).
- -
Ha de fomentarse la gestación en edades tempranas.
- -
La vitrificación ovocitaria debe ofrecerse siguiendo unos criterios que intenten maximizar su eficacia y coste-utilidad.
- -
Las pacientes candidatas a vitrificación ovocitaria en el sistema público de salud serán aquellas que vayan a tener un riesgo real de pérdida de su reserva ovárica, pero que cumplan con unas condiciones adecuadas para responder a una estimulación ovárica con un número suficiente de ovocitos.
La consideración de la fertilidad futura ha de ser una constante en la mujer joven con endometriosis. Han de proponerse medidas de vigilancia y prevención de las recurrencias. La vitrificación de ovocitos se dibuja como una opción prometedora. La experiencia disponible hasta la fecha es escasa y los resultados no pueden ser comparados con la vitrificación por otro tipo de causas. Sin embargo, puede ser una opción adecuada para determinadas pacientes con riesgo de pérdida de su reserva ovárica. Se necesita un tiempo de seguimiento futuro y una evaluación de los resultados en términos de reutilización de los ovocitos vitrificados y tasa de recién nacidos vivos. Un estudio de coste-efectividad en el sistema público de salud, considerando las diferentes opciones para conseguir un recién nacido vivo, ayudará a acotar el perfil de pacientes con endometriosis que realmente pudieran beneficiarse de estas medidas.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.