el endometrio es un tejido dinámico que sufre cambios a lo largo del ciclo menstrual, incluidos los morfológicos, bioquímicos y moleculares, necesarios para un proceso de implantación embrionario exitoso. Cuando existe un grosor endometrial insuficiente, la implantación embrionaria se da lugar cerca de las arterias espirales de la capa basal, donde existe un elevado flujo sanguíneo y una alta tensión de oxígeno. Dicha situación da lugar a un exceso de producción de radicales libres de oxígeno, hecho que puede interferir en la implantación y el desarrollo embrionarios (Catt y Henman, 2000). Así pues, una adecuada valoración de dicha situación es fundamental para conseguir una gestación evolutiva.
Pacientesen este artículo presentamos los casos clínicos de 2 pacientes con endometrio insuficiente y la forma en que hemos manejado su situación mediante tratamiento histeroscópico y farmacológico.
Resultadosen ambos casos clínicos se ha conseguido la gestación evolutiva. Una de las pacientes tuvo un parto eutócico en la semana 32 y nació un niño sano de 2.100 gramos, y la otra paciente sigue con el curso de su embarazo.
Conclusionesla prevalencia de endometrio fino según los estudios publicados se encuentra entre el 2,4 y el 8,5% de las mujeres (Ribeiro et al., 2018; Kasius et al., 2014). Múltiples estudios han demostrado que existe correlación entre el endometrio fino, las bajas tasas de implantación y los bajos porcentajes de gestación evolutiva; se sugiere un grosor endometrial mínimo de 7 mm para incrementar dichos porcentajes.
The endometrium is a dynamic tissue that undergoes changes throughout the menstrual cycle, including morphological, biochemical and molecular changes, necessary for a successful embryo implantation process. When insufficient endometrial thickness occurs embryo implantation takes place near the spiral arteries in the endometrial basal layer with high blood flow and high oxygen tension which leads to excess production of oxygen free radicals, a fact that can interfere with embryo implantation and development (Catt and Henman, 2000). Thus, an adequate assessment of this situation is essential to achieve an ongoing pregnancy.
PatientsIn this article, we present the clinical cases of 2 patients with insufficient endometrium and how we have managed their situation through hysteroscopic and pharmacological treatment.
ResultsPregnancies have been achieved in both clinical cases. One of the patients had an eutocic delivery at 32nd week of pregnancy and a healthy child of 2,100 grams was born. The other patient is still pregnant.
ConclusionsThe prevalence of thin endometrium according to published studies is between 2.4% and 8.5% of women (Ribeiro et al., 2018; Kasius et al., 2014). Multiple studies have shown a correlation between thin endometrium, low implantation rates and lower percentages of ongoing pregnancy. A minimum endometrial thickness of 7 mm is suggested to increase these percentages.
Los pasos iniciales en el proceso de la implantación embrionaria son la aposición, la adhesión del blastocisto a la capa epitelial del endometrio y finalmente la invasión del trofoblasto entre sus células epiteliales. Son múltiples los factores que contribuyen a la regulación del ciclo menstrual, incluyendo las hormonas, los factores autocrinos y los paracrinos. La función del endometrio uterino es la preparación para la implantación y el mantenimiento del embarazo en el caso de que ocurra la implantación; pues en caso contrario, aparecería el sangrado menstrual. De ahí que el endometrio sea un tejido dinámico y juegue un papel primordial en la reproducción. La comprensión actual de la fisiopatología endometrial se ha visto facilitada por las herramientas de descubrimiento celular y molecular (Critchley et al., 2020). Si bien no hay consenso sobre el valor exacto que define el concepto de endometrio fino o insuficiente, múltiples estudios han demostrado correlación entre el endometrio fino y las bajas tasas de implantación.
Aproximadamente, el 50% de todos los procesos de implantación de nuestra especie dan como resultado un embarazo que no es evolutivo debido a una receptividad uterina inadecuada. Si bien las técnicas de reproducción asistida nos permiten superar la mayoría de los problemas de infertilidad, la implantación sigue siendo el paso limitante para el éxito de la fecundación in vitro (FIV) (Lebovitz y Orvieto, 2014).
Presentamos 2 casos clínicos con el objetivo de revisar las diferentes estrategias terapéuticas en las pacientes con endometrio insuficiente, fino o refractario al manejo habitual.
Material y métodosCasos clínicosCaso clínico 1Mujer de 42 años de edad, nulípara, con esterilidad primaria de pareja de 4 años de evolución.
Entre sus antecedentes personales destacan: hipotiroidismo subclínico, linfoma hodgkiano diagnosticado a los 17 años, por el cual recibió tratamiento con quimioterapia y radioterapia en el área cervical y la mediastínica.
Fue sometida a una miomectomía vía laparotómica de mioma, localizado en la cara posterior con apertura de cavidad endometrial en el año 2017. En el año 2018, se le practicó miomectomía y polipectomía múltiple mediante histeroscopia con uso de tijera de corte. Cinco meses después se realizó una nueva miomectomía laparotómica con entrada en la cavidad uterina. La paciente explica oligomenorrea desde dicha cirugía.
En el año 2019, inició con el estudio de esterilidad y durante la realización de una histeroscopia se evidenció un canal endocervical normal, pero la cavidad uterina parecía tubular identificándose el orificio tubárico derecho, pero no el izquierdo; mediante el corte con tijera y la disección roma, con histeroscopio ampliamos la cavidad uterina hacia el lado izquierdo aunque sin conseguir visualizar correctamente el orificio tubárico de ese lado. Tras dicho procedimiento pautamos tratamiento hormonal sustitutivo (THS) con estrógenos orales y solicitamos resonancia magnética nuclear para completar el estudio, que informó de la presencia de un mioma uterino de 2 cm, intramural, sin afectación de la cavidad uterina. Seis meses más tarde realizamos una nueva histeroscopia bajo sedación en la cual de nuevo no se visualizó en su totalidad la cavidad del útero por presencia de adherencias firmes y parcialmente vascularizadas que ocupaban la mitad del total de la cavidad uterina. Se seccionaron las adherencias hasta conseguir visualizar correctamente las paredes del útero, el fundus y ambos orificios tubáricos para conseguir un tamaño normal de la cavidad. Al tratarse de una recidiva, al finalizar la histeroscopia se introdujo un dispositivo intrauterino (DIU) con carga de 375 picogramos de cobre que se mantuvo durante 3 meses junto con toma de THS. Realizamos estímulo hormonal para practicar fecundación in vitro y el estudio genético preimplantacional de aneuploidías consiguiendo 2 embriones euploides que se vitrificaron.
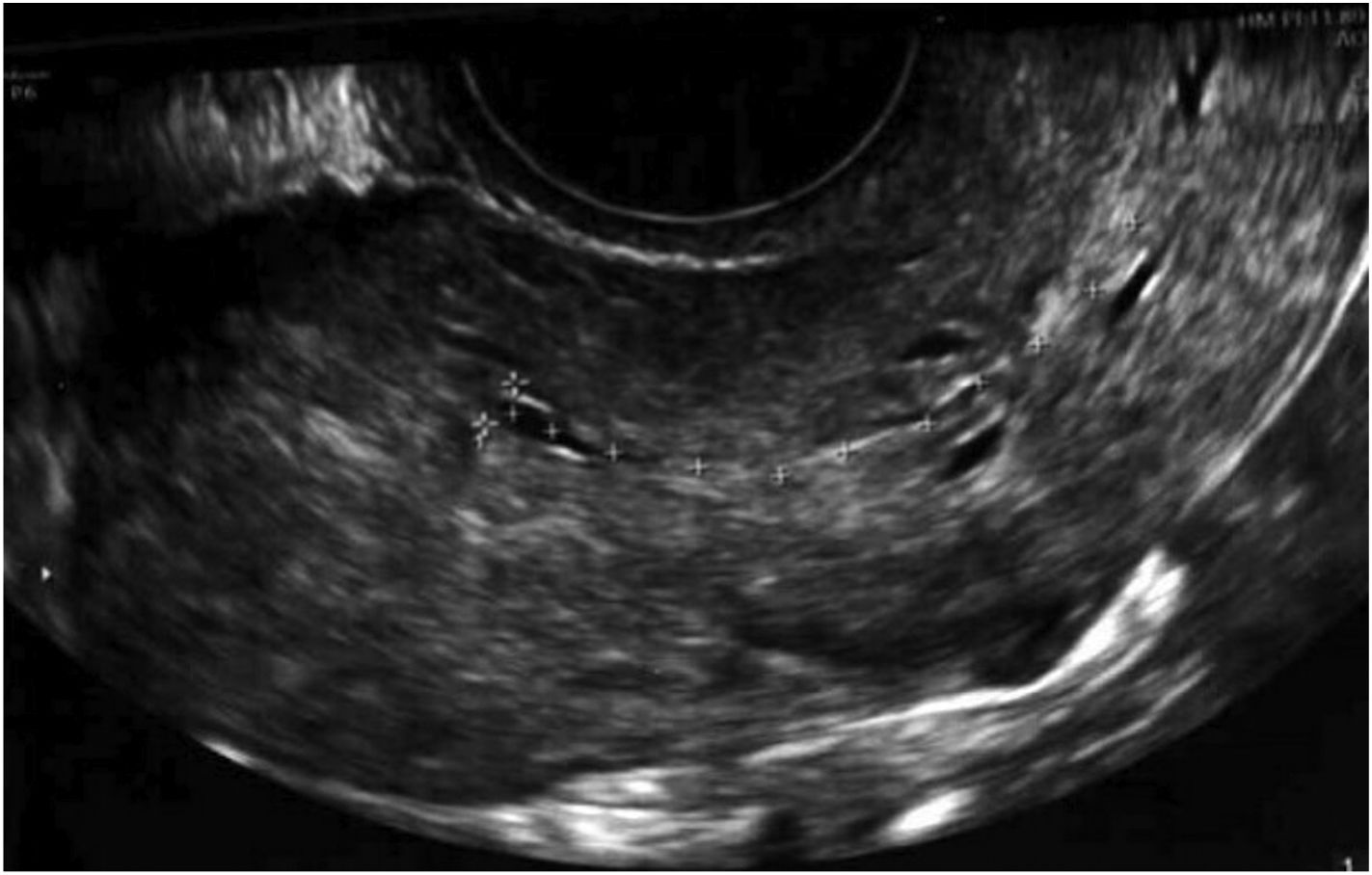
Unos meses después, en diciembre del año 2019, fue diagnosticada de aneurisma cerebral, por lo que recibió una microcirugía con craneotomía y temporalmente abandonó el estudio de reproducción. Al retomar las visitas, dados sus antecedentes, y ante la sospecha ecográfica de adherencias uterinas, repetimos la histeroscopia con la ayuda de una guía ecográfica abdominal. En dicho procedimiento, evidenciamos de nuevo adherencias firmes en el hemiútero izquierdo, algunas de ellas vascularizadas, que seccionamos. Además, practicamos metroplastia lateral izquierda y fúndica, dejando al mismo nivel ambos orificios tubáricos, hasta identificar una cavidad uterina normal en tamaño y morfología, capaz de albergar gestación. Tras la adhesiolisis y la metroplastia, se indicó THS con toma de estradiol 6 mg diarios durante 2 meses. A los 5 días de ciclo sustituido, los niveles plasmáticos de estrógenos eran adecuados, pero resultaba muy difícil identificar el grosor endometrial tanto por ecografía transvaginal (fig. 1) como abdominal, al igual que con la visión tridimensional.
Se indicó la siguiente pauta de preparación endometrial: a los 6 mg diarios de valerato de estradiol le añadimos pauta transdérmica, pentoxifilina 400 mg cada 12 h vía oral, sildenafilo 25 mg cada 6 h vía vaginal durante 7 días, vitamina E 400 mg cada 12 h, L-Arginina 6 g al día, ácido acetilsalicílico 100 mg al día y triptorelina 0,1 el primer día de progesterona, el día de la transferencia y 3 días después de la transferencia.
El día 21 de tratamiento identificamos un endometrio de 6 mm de grosor, homogéneo y se programó la transferencia de un blastocisto euploide. La determinación de beta-hCG fue de 300 mUI/mL.
Durante la gestación a la paciente se le aplicó un cerclaje terciario por incompetencia cervical diagnosticada en la semana 23. Finalmente, tuvo un parto eutócico en la semana 32 y nació un niño sano de 2.100 gramos.
Caso clínico 2Mujer de 44 años que consultó por esterilidad primaria de pareja de 2 años de evolución, sin antecedentes personales ni familiares de interés. Como método anticonceptivo, durante 10 años fue usuaria de DIU liberador de 52 mg de levonorgestrel; desde su retirada refiere oligomenorrea con sangrados menstruales escasos y de 2 días de duración. Sus antecedentes obstétricos son un parto eutócico hace 14 años con otra pareja y con la pareja actual tuvo una gestación espontánea que finalizó en aborto diferido en la sexta semana.
Entre otras pruebas realizamos una histeroscopia, en marzo de 2019, en la cual evidenciamos un canal endocervical normal y una cavidad uterina arcuata con endometrio polipoide y eritematoso; en fundus se biopsió una formación blanca amarillenta.
La histología fue informada como endometrio con marcada decidualización estromal y el cultivo de endometrio fue positivo para Streptococcus epidermidis, por lo cual tomó el tratamiento de antibiótico oral según antibiograma. A los 4 meses, realizamos una segunda histeroscopia evidenciando cavidad uterina de tamaño y morfología normales con endometrio de aspecto normal cuyo cultivo fue negativo.
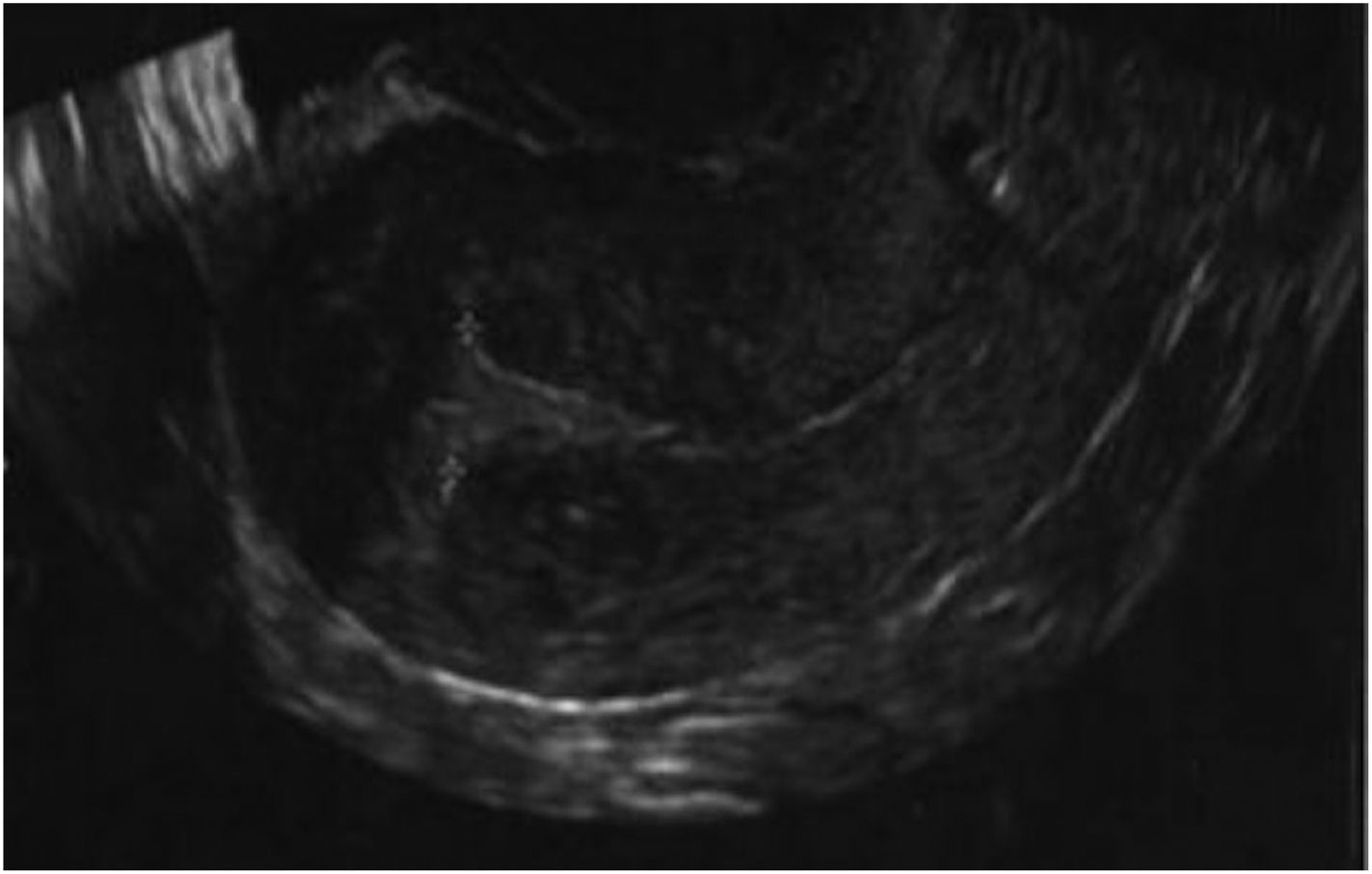
En el ciclo siguiente, sustituido en contexto de ovorrecepción, tras más de 15 días de tratamiento con estradiol oral, 6 mg al día y posteriormente parches en la ecografía, el endometrio tenía 3 mm de grosor; añadimos ácido acetilsalicílico y entonces el endometrio pasó a ser de 5 mm, trilaminar únicamente en fundus por lo que se canceló el ciclo por endometrio insuficiente. Acordamos en el siguiente ciclo realizar otra histeroscopia y posterior preparación endometrial. Durante la histeroscopia visualizamos adherencias anteroposteriores laxas y avasculares que se seccionaron con tijera de corte. El cultivo de endometrio fue negativo y se repitió la revisión histeroscópica a los 2 meses, la cual fue normal. Durante el ciclo de preparación endometrial se realizó el tratamiento hormonal y de endometrio refractario igual que con la paciente anterior. Al identificar el endometrio trilaminar de 7 mm de grosor (fig. 2) indicamos la transferencia de un blastocisto. Actualmente, la paciente está embarazada de 21 semanas.
DiscusiónEl ciclo menstrual normal es un ciclo estrechamente coordinado de efectos estimulantes e inhibidores que da como resultado la liberación de un solo ovocito maduro de un grupo de cientos de miles de ovocitos primordiales. A los 7 días del inicio del sangrado menstrual, los folículos de 9-10 mm son visibles por ecografía. A su vez, el incremento de las concentraciones de estradiol provocan la proliferación del endometrio, el cual se hace más grueso, aumenta su número de glándulas y entonces se identifica como un patrón trilaminar en la ecografía (Fleischer et al., 1986).
Desde un punto de vista hormonal, tras la ovulación aumenta la concentración de progesterona sérica, lo cual tiene un profundo impacto en el endometrio, provocando el cese de las mitosis, reorganización glandular, cambios secretores, decidualización, edema y aumento del engrosamiento endometrial. Juntas, estas 2 hormonas generan un crecimiento adecuado del endometrio e inducen la diferenciación de las células del estroma a la decidua, lo que proporciona un sitio de implantación receptivo al blastocisto. Este cambio puede detectarse a través de ecografía y relativamente pronto tras la ovulación, pues la triple línea desaparece y el endometrio pasa a ser uniformemente brillante.
A nivel histológico, el endometrio se compone de 2 capas, la funcional y la basal. Así como la basal no se modifica a lo largo del ciclo menstrual y en ella encontramos largas arterias espirales, la funcional sí sufre cambios y es la que se descama durante el sangrado menstrual. Se trata de un tejido dinámico que sufre cambios, incluidos los morfológicos, los bioquímicos y los moleculares, necesarios para un proceso de implantación embrionario exitoso. Por otra parte, desde un punto de vista funcional, tras la ovulación la constricción de las arterias espirales da lugar a la reducción del flujo sanguíneo de la capa funcional, disminuyendo así su oxigenación. Cuando existe un grosor endometrial insuficiente, la implantación se da lugar cerca de las arterias espirales de la capa basal con alto flujo sanguíneo y elevada tensión de oxígeno, lo cual da lugar a un exceso de producción de radicales libres de oxígeno, hecho que puede interferir en el desarrollo embrionario y la implantación (Catt y Henman, 2000).
Con la introducción de la ecografía en la práctica clínica, el desarrollo y el grosor del endometrio se evalúan fácilmente durante la estimulación hormonal mediante el uso de la vía transvaginal. La evaluación del endometrio incluye la medición del grosor, el patrón y el flujo sanguíneo endometrial, subendometrial y uterino, así como la evaluación ecográfica tri- y tetradimensional del volumen endometrial (Alcázar, 2006).
Algunos autores han sugerido que el endometrio fino o insuficiente debería definirse como aquel endometrio que no puede alcanzar un grosor suficiente para la implantación del embrión (El-Toukhy et al., 2008), aunque se han descrito gestaciones evolutivas con endometrios de < 5 mm de grosor (Kasius et al., 2014). Si bien no hay acuerdo sobre cuál es el grosor adecuado que debe tener el endometrio para una receptividad embrionaria adecuada, de forma empírica se reconoce que el valor mínimo sería de 7 mm en presencia de concentraciones séricas adecuadas de estrógenos (Grupo de Trabajo de Fracaso Reproductivo, 2020).
El endometrio refractario incluye aquel endometrio fino o insuficiente y también el endometrio que presenta adherencias intrauterinas o síndrome de Asherman. El síndrome de Asherman es un grado severo de presencia de adherencias intrauterinas y suele cursar con clínica de hipoamenorrea, abortos de repetición, fallo de implantación y, en ocasiones, dismenorrea. El endometrio refractario tiene una prevalencia global en las mujeres infértiles del 0,6 al 0,8%, alcanzando hasta el 22% en las pacientes con adherencias intrauterinas (Kasius et al., 2014). La prevalencia de endometrio fino, según los estudios publicados se encuentra entre el 2,4 y el 8,5% de las mujeres (Ribeiro et al., 2018; Kasius et al., 2014). La relevancia clínica del endometrio fino o refractario radica en que las tasas de embarazos clínicos y de recién nacidos vivos disminuyen significativamente con endometrios de menos de 8 mm (Liu et al., 2018) y es del 8,5% si el endometrio < 6 mm en ciclos sustituidos de ovorrecepción.
La implantación natural del embrión humano es un proceso sucesivo de 3 etapas: aposición, adhesión e invasión con la participación sincrónica de un endometrio receptivo y de un embrión. La implantación supone una compleja secuencia de eventos de señalización en los cuales participan mediadores moleculares del proceso de receptividad endometrial, incluyendo las moléculas de adhesión, las citoquinas, los factores de crecimiento, los lípidos y otros; y solo puede tener lugar con éxito durante la «ventana de implantación» (Sociedad Española de Ginecología y Obstetricia [SEGO], 2018).
Fisiopatología del endometrio fino: puede ser el resultado de un endometrio lesionado o bien idiopático. Cualquier procedimiento o terapia que lesione o atrofie el endometrio puede dar lugar a la aparición de las adherencias entre las paredes opuestas del miometrio.
El origen de esta enfermedad se expone en la tabla 1 (factores etiopatogénicos del endometrio fino o insuficiente). Puede ser 1) secundario a una cirugía intrauterina (en especial el legrado de causa obstétrica o puerperal, la ablación endometrial, la miomectomía o septoplastia, tras sufrir de Strassman), 2) yatrogenia (radioterapia pélvica, exposición a dietilestilbestrol), 3) consecuencia de una endometritis tras algún proceso infeccioso o inflamatorio, 4) congénito (con las anomalías Müllerianas como primera causa), 5) idiopático, ocasionando una lesión de la capa basal endometrial disminuyendo así la capacidad de regeneración endometrial (Santana Suárez et al., 2017).
Manejo: dada su etiología múltiple, el manejo debe ir dirigido a la causa en concreto con el objetivo de incrementar la receptividad endometrial y facilitar la implantación (tabla 2).
Opciones terapéuticas en el endometrio refractario
| Opciones terapéuticas en endometrio refractario | |
|---|---|
| Quirúrgico | |
| Histeroscopia | |
| Trasplante de útero | |
| Hormonal | |
| Estrógenos | |
| Análogo agonista GnRH* | |
| Gonadotropina coriónica humana | |
| AAS, vitaminas y suplementos | |
| Ácido acetilsalicílico | |
| L-arginina | |
| Pentoxifilina | |
| Vitamina E / alfa-tocoferol | |
| Sildenafilo | |
| Otras | |
| Plasma rico en plaquetas | |
| Medicina regenerativa | |
| Acupuntura, bioautorregulación, estimulación neuromuscular | |
*GnRH: hormona liberadora de gonadotrofinas
1) Se recomienda como primer paso realizar una histeroscopia para una eventual corrección de un problema anatómico asociado. Si este no existiera o ante la falta de corrección exitosa del mismo, se han descrito muchas terapias experimentales para su mejora pero sin clara eficacia demostrada (Grupo de Trabajo de Fracaso Reproductivo, 2020). En el caso de confirmar la presencia de adherencias intrauterinas, se deberían seccionar preferiblemente con tijera fría histeroscópica para evitar el daño térmico. La liberación de las mismas en casos complejos puede practicarse de forma ecoguiada y suele ir seguida de THS con estrógenos durante 6 a 8 semanas, con el objetivo de regenerar el grosor endometrial. En ocasiones, en casos de recidiva, se puede valorar aplicar un balón intrauterino, gel antiadherente o un DIU de cobre durante 3 a 4 meses. Se debe valorar la complementación del estudio endometrial con la toma de muestra para cultivo.
Otras pruebas de imagen para evaluar la cavidad uterina (histerosalpingografía, histerosonografía) pueden ser útiles pero no tan resolutivas como la histeroscopia.
Otra opción quirúrgica, innovadora y diferente a la histeroscopia es el trasplante de útero en casos muy seleccionados.
2) Tratamiento hormonal: el endometrio es un tejido hormonodependiente que prolifera en respuesta a los estrógenos, los cuales después inducirán la producción de receptores de progesterona.
* Los estrógenos ayudan a la proliferación endometrial al provocar contracción en las arterias espirales y reduciendo la liberación de radicales libres oxidativos en la capa funcional. No hay consenso claro en cuanto a cuál es la mejor vía de administración, la dosis y la duración de su administración. Cuando las pacientes infértiles tienen un endometrio inadecuado en su grosor, la primera acción que llevamos a cabo es incrementar la dosis estándar de estradiol, además de la duración del tratamiento, pues esto parece incrementar de forma significativa la tasa de embarazos cuando se compara con la de un grupo control (Chen et al., 2006). El incremento progresivo de la dosis (step-up) no ofrece beneficios, así que desde el primer día de ciclo se pueden iniciar con elevadas dosis diarias (entre 6 y 16 mg) de forma continua.
La vía oral suele ser la más utilizada por su biodisponibilidad y la tolerancia, aunque con las vías parenterales pueden verse incrementados los niveles plasmáticos de estradiol al evitar el paso hepático, lo que no ha demostrado incrementar tasas de implantación.
* Agonista. La aplicación de análogos agonistas de la hormona liberadora de gonadotropoina (GnRH) durante la fase lútea mejoran los niveles de estrógenos y progesterona, aunque con resultados dispares en cuanto a su utilidad en el grosor endometrial. Qublah et al., en un estudio prospectivo randomizado que incluía pacientes infértiles con endometrio fino (< = 7 mm) observaron que en aquellas que recibieron triptorelina 0,1 mg el día del pico ovulatorio (teórico día de punción folicular), el día de la transferencia embrionaria (TE) y 3 días después de TE tuvieron mayores tasas de implantación, de gestación y de grosor endometrial. Estos efectos podrían ser resultado del efecto directo del agonista de GnRH en el endometrio y en el cuerpo lúteo. Además, provoca un incremento de LH, lo que da lugar a la secreción de factores de crecimiento, citoquinas y otras moléculas angiogénicas involucradas en el proceso de implantación (Qublan et al., 2008).
* Gonadotropina coriónica humana (hCG) en fase folicular: la hCG, un glucopéptido segregado por el sincitiotrofoblasto, es responsable del mantenimiento del cuerpo lúteo y de la producción de progesterona durante las primeras semanas de embarazo y cumple con múltiples funciones locales y sistémicas; parece desempeñar un papel fundamental en la interacción entre el endometrio y el embrión durante la ventana de implantación (Gil Arribas y Robles Corchado, 2020). Se han identificado receptores de hormona luteinizante y hCG en el epitelio endometrial que podrían modular la diferenciación endometrial y la angiogénesis; además, parece ser que también se produce en las células epiteliales endometriales durante la fase secretora, por lo que podría actuar como agente paracrino local en la diferenciación y receptividad del endometrio al regular determinadas citoquinas y factores de crecimiento (Garcia-Velasco et al., 2016). En casos de endometrio fino se aplican 150 UI de hCG subcutánea diarias a partir del octavo día de preparación endometrial durante 7 días o hasta conseguir el incremento del grosor endometrial (Papanikolaou et al., 2013).
3) Dado que el crecimiento endometrial es un proceso hormonodependiente que requiere del flujo uterino apropiado que modula sobre todo el crecimiento del endometrio glandular, incrementar el flujo vascular subendometrial a la vez que aumenta la expresión de VEGF (factor de crecimiento endotelial vascular) representa otra posibilidad terapéutica farmacológica en aquellos casos en los que el fallo repetido de implantación se asocie con endometrios poco desarrollados (SEGO, 2018; Takasaki et al., 2010). El objetivo de esta terapia sería mejorar la vascularización a nivel endometrial, disminuyendo la resistencia y la impedancia de las arterias radiales uterinas (Gil Arribas y Robles Corchado, 2020). Con respecto a fármacos como la L-arginina, el tocoferol y la pentoxifilina, no hay una evidencia científica contundente que avale su uso, pero sí del uso combinado de tocoferol y pentoxifilina, ya que podría mejorar la condición endometrial especialmente en las mujeres que han sido tratadas con radioterapia. Aunque se ha ensayado con múltiples procedimientos y diferentes agentes, incluidos los parches de nitroglicerina, ninguno de ellos de forma aislada ha demostrado evidencia suficiente (SEGO, 2018; Garcia-Velasco et al., 2016).
* Ácido acetilsalicílico: aunque existen estudios publicados a favor, su utilidad en casos de endometrio refractario es empírico. En realidad, el mecanismo beneficioso del ácido acetilsalicílico podría ser triple: disminuyendo la contractilidad endometrial, como antiinflamatorio, al inhibir la cicloxigenasa y la síntesis de prostaglandinas y al aumentar el flujo sanguíneo endometrial.
Su efecto a bajas dosis ha sido evaluado por diferentes autores con resultados dispares. Aunque en un grupo de ovorreceptoras (Weckstein et al., 1997) no se evidenció aumento del grosor endometrial, sí se demostró incremento en la tasa de implantación y de gestación respecto a las que no lo tomaron; en una revisión de Cochrane (Glujovsky et al., 2010) no se demostró dicho beneficio.
* L-arginina: es un aminoácido esencial fundamental en múltiples funciones del organismo tales como regular la vasodilatación y el flujo vascular, activar el sistema inmune y los procesos inflamatorios. Su utilidad en las pacientes con endometrio fino radicaría en el hecho de que puede aumentar el flujo vascular en condiciones en las cuales existe disfunción endotelial con baja producción de óxido nítrico (NO). Entre las pacientes con endometrio refractario, la posología a valorar sería 6 g diarios repartidos en 4 tomas vía oral desde el primer día de ciclo de preparación endometrial hasta teórico día de hCG para inducción de ovulación (Takasaki et al., 2010).
* Vitamina E o alfa-tocoferol: es una molécula liposoluble con propiedades antioxidantes, antiinflamatorias y vasodilatadoras que puede mejorar el flujo sanguíneo capilar en diferentes órganos (Takasaki et al., 2010; Acharya et al., 2009; Letur-Konirsch y Delanian, 2003). En las pacientes expuestas a la vitamina E, la histología del endometrio mejora el crecimiento del epitelio glandular, el desarrollo de vasos sanguíneos y la expresión de la proteína VEGF. Se recomienda suspender la medicación el día antes de la TE.
* Pentoxifilina: es un inhibidor no específico de la fosfodiesterasa, por lo que incrementa el cAMP (adenosín monofosfato cíclico) intracelular provocando vasodilatación, inhibiendo las reacciones inflamatorias y la liberación de factores de necrosis tumoral. Su efecto se refuerza si se asocia a vitamina E; con dicha combinación a dosis de 800 mg de pentoxifilina y 600-1000 UI diarias de vitamina E durante 6 u 8 meses antes del ciclo de transferencia, se demostró un incremento en el grosor endometrial en un 73% de las pacientes con un porcentaje de gestación del 40% (Acharya et al., 2009).
La combinación de estos fármacos ha demostrado su utilidad sobre todo en las pacientes que han recibido radioterapia (Lédée-Bataille et al., 2002).
* Sildenafilo es un inhibidor de la 5-fosfodiesterasa y su potencial efectividad radica en la posibilidad de aumentar el efecto vasodilatador del NO, pues actúa relajando la musculatura lisa del endotelio vascular, principalmente mediante la activación del cGMP (guanosina monofosfato cíclico). En casos de endometrio fino o insuficiente, su posología es de 25 mg cada 6 horas vía vaginal en la fase proliferativa durante 7 días; o bien, hasta el día de la transferencia embrionaria (Takasaki et al., 2010).
4) Otras modalidades terapéuticas están orientadas a la regeneración del tejido endometrial como las perfusiones o infusiones transvaginales de factores estimuladores de colonias de granulocitos (G-FSC), medicina regenerativa (células madre mesenquimales de médula ósea, células madre endometriales, células madre humanas embrionarias) o plasma autógeno rico en plaquetas. Y otras técnicas destinadas a mejorar la vascularización a nivel endometrial como la acupuntura, técnicas de estimulación neuromuscular y bioautorregulación (Santana Suárez et al., 2017).
ConclusionesEl endometrio es uno de los factores que intervienen en la obtención de los resultados óptimos tras un tratamiento de reproducción asistida. Una adecuada preparación del endometrio resulta imprescindible para alcanzar una implantación exitosa, lo cual incluye la expresión, la modulación y la secreción de varios factores de crecimiento y citoquinas proinflamatorias, incluyendo un aumento de la interleuquina-11 y el factor inhibidor de leucemia (LIF) en la fase medio-lútea (Lebovitz y Orvieto, 2014).
La sincronización entre el ciclo ovárico y el endometrial, modulados por hormonas y múltiples sustancias, no siempre es la adecuada para facilitar la implantación embrionaria. Solo cuando el grosor o el patrón ecográfico del endometrio parecen inadecuados se han evaluado diferentes estrategias para intentar mejorarlo; especialmente, en aquellos casos en los que parece difícil o imposible hacerlo crecer (Garcia-Velasco et al., 2016). El desarrollo endometrial y su grosor son unos de los factores que más influencia tienen en la receptividad endometrial, de ahí el interés por conseguir un tratamiento adecuado para el endometrio fino o refractario, y que sea un reto para la especialidad en reproducción humana. Un grosor endometrial menor a 8 mm podría afectar negativamente los resultados y en estos casos debería ofrecerse la opción de vitrificar y diferir la transferencia embrionaria (Liu et al., 2018; Liu et al., 2019). De hecho, la mayoría de literatura médica especializada establece en 7 mm el grosor endometrial mínimo, pero se han comunicado embarazos con grosores mucho menores (Kasius et al., 2014). Aunque es difícil establecer un punto de corte objetivo por debajo del cual un endometrio se considere como insuficiente y tampoco existe un límite por debajo del cual el embarazo sea imposible.
El tratamiento del endometrio delgado sigue siendo un desafío y se requieren grandes investigaciones futuras, incluyendo tecnología celular y molecular, para dilucidar aún más el manejo óptimo de estas pacientes. A lo largo de los años, han surgido diferentes modalidades para su manejo: desde la adhesiolisis histeroscópica, el tratamiento hormonal, los tratamientos vasoactivos, la infusión intrauterina y la medicina regenerativa. La diversidad de tratamientos no hace más que demostrar que ninguno de estos tratamientos tiene la eficacia suficiente como para ser el definitivo. El tratamiento del endometrio fino es un reto para el clínico y son necesarios más estudios para determinar cuál es su manejo óptimo. El avance de la tecnología ha permitido que en la actualidad la infusión de plasma autógeno rico en plaquetas, la regeneración endometrial con células madre (células clonogénicas residentes en epitelio y estroma, células madre de médula ósea y células madre humanas embrionarias) y el trasplante uterino sean una posibilidad en estas pacientes (Santana Suárez et al., 2017).
Conflicto de interesesLas autoras declaran no tener ningún conflicto de intereses.
FinanciaciónNinguna.