El dolor relacionado con cáncer es experimentado por el 90% de los pacientes oncológicos. La base del tratamiento son los opioides y la escalera analgésica, de la Organización Mundial de la Salud. El dolor irruptivo oncológico es una forma de dolor relacionado con el cáncer particularmente difícil de gestionar con los opioides clásicos. En esta revisión se cubre la titulación y la rotación de opioides, tanto para dolor basal como irruptivo. También se revisa la contribución de los preparados de fentanilo de acción rápida para el tratamiento del dolor irruptivo oncológico, su indicación y titulación. El citrato de fentanilo oral transmucoso y los comprimidos bucales de fentanilo fueron los primeros fármacos desarrollados específicamente para el tratamiento del dolor irruptivo oncológico. Dado que la administración oral de fentanilo no es una opción en muchos pacientes oncológicos, el desarrollo de un espray intranasal de fentanilo con pectina surgió como un método más eficaz de administración.
Cancer-related pain is experienced by 90% of patients with cancer. The mainstays of treatment are opioids and the World Health Organization's analgesic ladder. Breakthrough cancer pain (BCP) is a form of cancer-related pain that is particularly difficult to manage with classical opioids. In this review, we discuss titration and opioid rotation in both background and breakthrough pain. We also review the contribution of fast-acting fentanyl preparations for the treatment of BCP and its indications and dose titration. The first drugs developed specifically for the treatment of BCP were oral transmucosal fentanyl citrate (CFOT) and fentanyl buccal tablets. Because oral fentanyl administration is not an option in many cancer patients, the development of a fentanyl nasal spray (FNS) has emerged as a more effective method of administration.
El dolor oncológico puede tener un origen multifactorial y puede ser secundario al propio tumor o a complicaciones de los tratamientos aplicados. Hasta el 70% de los pacientes con cáncer presentará dolor en algún momento de su enfermedad, dolor que es intenso en el 25-30% de los casos1. Según lo avanzado de la enfermedad, estas cifras son más prevalentes y es uno de los factores que más afecta a la calidad de vida del paciente. En estos pacientes, la prevalencia del dolor irruptivo oncológico (DIO) es alta y variable (del 33-95%), según las series, y es más prevalente con la progresión de la enfermedad y cuando hay afectación de huesos de carga y plexos nerviosos2.
Con los analgésicos convencionales, en ocasiones es difícil lograr un alivio eficaz del dolor oncológico severo. Si el origen del dolor es exclusivamente tumoral, una forma es intentar combatirlo a medio plazo con tratamientos dirigidos a la neoplasia, pero no siempre estos tratamientos son eficaces o el paciente está en condiciones de tolerarlos y, en cualquier caso, su control analgésico nunca es inmediato. Los analgésicos opioides siguen siendo, por tanto, la base del tratamiento del dolor oncológico severo y del DIO. Son la base de esta indicación debido a su eficacia, seguridad, múltiples vías de administración y facilidad de ajuste, entre otras características.
El objetivo de esta revisión es conocer el adecuado manejo y titulación de los opioides utilizados en el control del dolor oncológico basal, así como la indicación y titulación de los opioides indicados en el control del DIO y sus posibles combinaciones.
Uso de opioides en el dolor basalElección del opioide. El inicio de la prescripciónLos opioides siguen siendo los medicamentos de elección para el tratamiento del dolor moderado o intenso, con independencia de la causa. El dolor oncológico, en particular, se suele tratar con fármacos del tercer escalón, es decir, con los opioides mayores disponibles. El estándar fue la morfina, pero hay numerosos medicamentos en este grupo (morfina, fentanilo, hidromorfona, oxicodona, oxicodona/naloxona y tapentadol). La vía más utilizada es la administración oral, dejándose las alternativas subcutánea o intravenosa para crisis emergentes de dolor en pacientes con apoyo hospitalario, sabiendo que la dosis equivalente es de entre 1:2 y 1:3 de la dosis oral.
La hidromorfona y la oxicodona son alternativas eficaces a la morfina oral; la combinación de oxicodona con dosis bajas de naloxona reduce el problema de los efectos secundarios, como el estreñimiento, sin afectar a la potencia analgésica.
Tapentadol, que tiene un doble mecanismo de acción en la misma molécula MOR-NRI (mu-opioide agonista del receptor y del inhibidor de la recaptación de noradrenalina), parece jugar un papel importante en el tratamiento del dolor complejo y tiene un buen perfil de tolerancia gastrointestinal.
El uso de fentanilo transdérmico y buprenorfina está especialmente recomendado en pacientes con dificultades para tragar, en caso de intolerancia oral o pacientes polimedicados por vía oral3. La buprenorfina, además, se puede utilizar en pacientes con problemas renales o en hemodiálisis, ya que no es necesario ajuste de dosis en estos casos4.
La metadona es una alternativa válida, pero su manejo puede ser complicado debido a las marcadas diferencias entre los sujetos en su vida media plasmática y a la duración variable de su efecto.
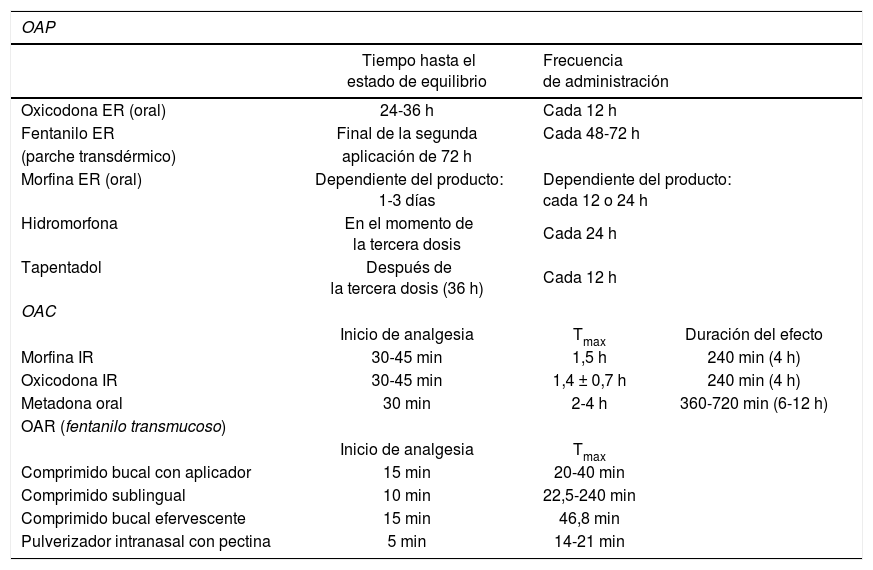
Hay muchas clasificaciones de los opioides, pero según las características temporales que definen el inicio y la duración de su acción se dividen en opioides de acción retardada o prolongada (OAP), opioides de acción normal o corta y opioides de acción rápida (OAR, basados en fentanilo transmucoso). Los OAR están diseñados e indicados específicamente para el DIO, porque empiezan actuar a los 3-15 min y su efecto analgésico dura 1-2 h (tabla 1).
Opioides de acción prolongada (OAP), opioides de acción corta (OAC) y opioides de acción rápida (OAR).
| OAP | |||
|---|---|---|---|
| Tiempo hasta el estado de equilibrio | Frecuencia de administración | ||
| Oxicodona ER (oral) | 24-36 h | Cada 12 h | |
| Fentanilo ER | Final de la segunda | Cada 48-72 h | |
| (parche transdérmico) | aplicación de 72 h | ||
| Morfina ER (oral) | Dependiente del producto: 1-3 días | Dependiente del producto: cada 12 o 24 h | |
| Hidromorfona | En el momento de la tercera dosis | Cada 24 h | |
| Tapentadol | Después de la tercera dosis (36 h) | Cada 12 h | |
| OAC | |||
| Inicio de analgesia | Tmax | Duración del efecto | |
| Morfina IR | 30-45 min | 1,5 h | 240 min (4 h) |
| Oxicodona IR | 30-45 min | 1,4 ± 0,7 h | 240 min (4 h) |
| Metadona oral | 30 min | 2-4 h | 360-720 min (6-12 h) |
| OAR (fentanilo transmucoso) | |||
| Inicio de analgesia | Tmax | ||
| Comprimido bucal con aplicador | 15 min | 20-40 min | |
| Comprimido sublingual | 10 min | 22,5-240 min | |
| Comprimido bucal efervescente | 15 min | 46,8 min | |
| Pulverizador intranasal con pectina | 5 min | 14-21 min | |
Tmax: tiempo hasta la concentración sérica máxima.
Independientemente del opioide que vayamos a utilizar, hay que informar y adiestrar al paciente en el manejo de los efectos adversos esperados. La estrategia terapéutica debe incluir siempre el uso temporal (3-4 días) de antieméticos y el uso continuado de laxantes de forma profiláctica y como tratamiento mantenido, ya que no se desarrolla tolerancia al estreñimiento.
Una revisión sistemática realizada por la Asociación Europea de Cuidados Paliativos (EAPC), con estudios de revisión y metaanálisis sobre morfina oral, oxicodona e hidromorfona, no encuentra diferencias consistentes en cuanto a eficacia o toxicidad y recomienda cualquiera de la 3 formulaciones para el manejo del dolor basal oncológico moderado-severo5, y su elección se debe realizar por su facilidad y comodidad de uso, por el conocimiento del fármaco por parte del facultativo prescriptor, por las pequeñas diferencias de efectos adversos, así como por las preferencias del paciente.
Generalidades de la titulación y peculiaridades según formulacionesLa titulación es el proceso por el cual la dosis de un opioide se incrementa para obtener una cantidad suficiente de analgesia con un número aceptable de efectos secundarios. Este debe ser un proceso rápido y controlado, administrando tratamiento para el control del dolor crónico basal y dosis de rescate de la misma formulación para control de las exacerbaciones de dolor que acontecen durante el proceso de titulación (exacerbaciones que no debemos confundir con episodios de DIO) hasta alcanzar la dosis eficaz6.
La extendida práctica de utilización de morfina de liberación inmediata por vía oral cada 4 h para comenzar la administración de morfina no se basa en ensayos clínicos controlados, sino en el perfil de farmacocinética de esta formulación (Tmax < 1 h; Tmedioβ 2-3 h; duración del efecto, aproximadamente 4 h)7. En el uso de cualquiera de las formulaciones de morfina de liberación retardada se incluye una dosificación mínima de la que partir; para pacientes en tratamiento previo con mórficos o en aquellos sin tratamiento previo, no se incluye una titulación con morfina de liberación rápida. Sin embargo, del mismo modo, en todas las fichas técnicas se recomienda una dosis individualizada. La forma más segura y práctica de llegar a esa dosis individualizada es mediante titulación con morfina de liberación rápida y posterior conversión a la formulación que deseemos de morfina de liberación retardada.
Se recomienda iniciar con morfina de acción corta a dosis de 5 mg cada 4 h para pacientes en los que se ha omitido el paso por el segundo escalón de la escala analgésica, ancianos y pacientes con insuficiencia renal. En pacientes con exposición previa a opioides se pautará 10 mg cada 4 h. Durante la fase de titulación debe dejarse una dosis de rescate a demanda del paciente, cada 1-2 h, igual a la pautada cada 4 h, para prevenir episodios de dolor no controlado. Es importante insistir al paciente en la recogida del número de dosis de rescate que precisa durante el proceso de titulación. Transcurridas al menos 24 h se debe revaluar al paciente, sumar las dosis totales administradas, dividir la dosis entre 6 y pautarla cada 4 h. Se dejará nuevamente la dosis de rescate.
Cuando el dolor está controlado con dosis estables, se puede transformar la dosis total diaria administrada de morfina de liberación corta en la dosis del OAP que deseemos (cada 12 h, cada 24 h o parches de liberación transdérmica cada 72 h)8.
Entre otras alternativas a escoger para la titulación están aceptadas las que se citan a continuación, iniciando la titulación con la formulación de acción corta del mismo OAR con el que se hará el ajuste final. Sin embargo, el ajuste más recomendado y práctico es comentado previamente con morfina oral de liberación corta:
- •
Oxicodona 5 mg cada 4 h vía oral y dosis de rescate.
- •
Hidromorfona 2 mg vía oral cada 4 h y dosis de rescate.
- •
Metadona 2,5-5 mg cada 8-12 h8.
La metadona tiene un perfil farmacocinético complejo y una vida media larga impredecible. Los datos de estudios de los que se dispone la equipara en eficacia al resto de presentaciones de morfina oral o presentaciones transdérmicas, con una mayor tendencia a la somnolencia, por lo que no se recomienda de primera elección en el inicio de tratamiento de tercer escalón, y siempre se debe utilizar por profesionales experimentados5.
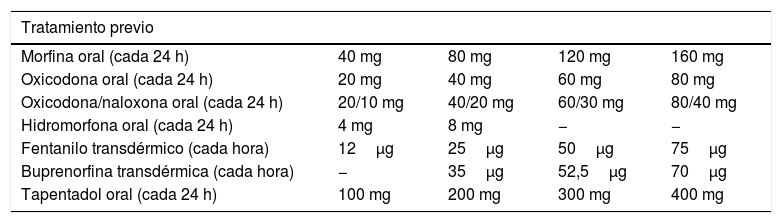
Cabe hacer mención especial a la rotación, que es el término dado a la práctica clínica de sustituir un opioide en uso de tercer escalón por otro, cuando no se alcanza la analgesia deseada y presenta efectos adversos intolerables pese a la correcta titulación. Precisa de una correcta familiaridad con la dosis equianalgésica de opioides diferentes (tabla 2).
Tabla de conversión de opioides.
| Tratamiento previo | ||||
|---|---|---|---|---|
| Morfina oral (cada 24 h) | 40 mg | 80 mg | 120 mg | 160 mg |
| Oxicodona oral (cada 24 h) | 20 mg | 40 mg | 60 mg | 80 mg |
| Oxicodona/naloxona oral (cada 24 h) | 20/10 mg | 40/20 mg | 60/30 mg | 80/40 mg |
| Hidromorfona oral (cada 24 h) | 4 mg | 8 mg | − | − |
| Fentanilo transdérmico (cada hora) | 12μg | 25μg | 50μg | 75μg |
| Buprenorfina transdérmica (cada hora) | − | 35μg | 52,5μg | 70μg |
| Tapentadol oral (cada 24 h) | 100 mg | 200 mg | 300 mg | 400 mg |
En una revisión sistemática sobre fentanilo transdérmico (FTD) y buprenorfina, que incluye un metaanálisis de 4 en-sayos clínicos aleatorizados que comparan morfina oral con FTD o buprenorfina9, y un ensayo clínico aleatorizado de 3 brazos que compara morfina oral con metadona y con FTD en dolor moderado-severo oncológico7, no se encontraron diferencias significativas entre las formulaciones transdérmicas y otras presentaciones, con discreta ventaja en el caso de los opioides transdérmicos, por una menor tendencia al estreñimiento y una mayor preferencia por parte del paciente, lo que los hace apropiados para el manejo del dolor moderado-severo oncológico en el tercer escalón7.
En el caso de inicio de tratamiento con FTD en pacientes que reciben tratamiento con opioides por primera vez, como dosis inicial se deben usar los parches con una velocidad de liberación de 12μg/h. En pacientes muy ancianos o pacientes delicados, no se recomienda iniciar un tratamiento con opioides con un parche de FTD, debido a su sensibilidad conocida a los tratamientos con opioides. En estos casos sería preferible iniciar un tratamiento con dosis bajas de morfina de liberación inmediata y prescribir un parche de FTD tras la determinación de la dosis óptima. Según la intensidad del dolor y si el paciente ha estado en contacto con otros opioides menores, podría iniciarse con la dosis de 25μg/h, con importante hincapié en la prevención y manejo de efectos adversos. Dado que el período hasta alcanzar el nivel de analgesia es de 10 a 15 h, debe dejarse pautado morfina de liberación rápida cada 4 h hasta alcanzar dicho nivel de analgesia, que también servirá para hacer el ajuste de dosis si persiste la necesidad de uso de morfina de liberación retardada a los 3 días. Si la analgesia es inadecuada pasados los 3 días, deben realizarse incrementos de dosis no menores a 12,5μg/h ni mayores a 25μg/h adicionales, debiendo estar guiados por la necesidad de morfina de liberación corta en los días previos10. La dosis de rescate de morfina de acción corta que debe dejarse para el proceso de titulación debe ser del 10% o un sexto del equivalente de la dosis total diaria de FTD, es decir, 5-10 mg de morfina oral por cada parche de 25μg/h8.
En pacientes previamente en tratamiento con otros opioides deberá cuantificarse el total de opioide precisado en 24 h en equivalente a morfina de 24 h, y realizar una segunda conversión de la dosis de morfina oral de 24 h a FTD.
En el caso de la buprenorfina, independientemente de la exposición previa a opioides menores, se recomienda empezar por el parche de 35μg/h cada 72 h, dejando las primeras 12 h la analgesia previa y rescate de morfina de liberación corta o buprenorfina sublingual. Al igual que con el FTD, la evaluación inicial del dolor no debe hacerse antes de las 24 h y la final pasadas las 72 h, con el cómputo de dosis de rescate para cuantificar si se precisa aumento de dosis. Al igual que para el FTD, hay tablas de conversión para los pacientes que lleven tratamiento previo con opioides11.
Titulación de opioides para el dolor irruptivo oncológicoElección del fármaco ideal para el manejo del dolor irruptivo oncológicoEl tratamiento del dolor oncológico basal con las formulaciones convencionales de opioides, prescritas y administradas como tratamiento continuo, consigue resultados bastante satisfactorios, que no se obtienen con el tratamiento del DIO, para el que ha sido necesario desarrollar nuevas formulaciones de opioides mejor adaptadas a sus características singulares.
El tiempo necesario hasta que la morfina de liberación retardada y todos los demás OAP alcanzan el estado de equilibrio varía entre 24 y 72 h, lo que los descarta como posible tratamiento del DIO. En cuanto a la morfina de acción rápida, su efecto se inicia a los 30-45 min, cuando gran parte de los episodios de DIO ya se han resuelto. Por vía parenteral (intravenosa o subcutánea), la morfina podría ser una alternativa para el tratamiento del DIO, pero al ser invasiva tiene el inconveniente de que su administración precisa instrumentación y adiestramiento de los pacientes o sus familias.
Por lo tanto, las formulaciones de acción corta de morfina y oxicodona, indicadas para la titulación inicial de dosis de opioide basal, pueden ser útiles únicamente si se administran con suficiente antelación (30-45 min), como es el caso del DIO incidental, aunque estos son infrecuentes e imprevisibles. Sin embargo, en los casos de DIO idiopático o involuntario se requieren OAR con un inicio muy rápido de acción (3-15 min), lo que actualmente solo es posible con las formulaciones transmucosas de fentanilo.
La búsqueda de nuevos analgésicos se ha centrado en el fentanilo debido a su potencia analgésica, de 50 a 100 veces mayor que la morfina, y a la rapidez de absorción e inicio del efecto analgésico12.
El citrato de fentanilo transmucoso oral con aplicador fue la primera formulación diseñada específicamente para el tratamiento del DIO. Sin embargo, no todo el fentanilo se absorbe a través de la mucosa oral, sino que el 25% se suele absorber con rapidez y el 75% se deglute. Un tercio del producto deglutido se absorbe lentamente (en 2 h) en el intestino delgado13.
La actualización de la revisión Cochrane de Zeppetella y Ribeiro incluyó ensayos clínicos aleatorizados con las nuevas formulaciones de fentanilo transmucoso oral y fentanilo intranasal. Estos estudios mostraron que ambas formulaciones son mejores para el control del DIO que el placebo y que la morfina oral de acción corta14,15.
Hay que señalar que si se considera el uso de OAR o fentanilo transmucoso para el DIO, los pacientes deben tolerar los opioides, ya que todos los datos publicados al respecto se refieren a pacientes que son tratados con dosis equivalente a 60 mg de morfina en 24 h.
Combinaciones posibles y titulación de fentanilo para el dolor irruptivo oncológicoLa Sociedad Española de Oncología, en su documento de consenso, indica que la morfina de liberación rápida o corta, que ha sido el tratamiento tradicional para el DIO, tiene un mecanismo de acción que no coincide con las características del DIO16, además de facilitar la suma de secundarismos. La guía de la EAPC indica que el fentanilo transmucoso es más eficaz que la morfina de liberación rápida, y que el fentanilo intranasal es el que ofrece una mayor rapidez analgésica, mayor que las formulaciones transmucosas orales de fentanilo5.
Por lo tanto, queda claro que el fentanilo es el principio activo que más se ajusta a la necesidad analgésica del DIO, con independencia del opioide mayor utilizado para el control basal2.
La dosis de fentanilo no está relacionada con la dosis de opioide basal. Es necesario realizar una titulación del opioide usado para el DIO con el objetivo de optimizar el tratamiento minimizando los efectos adversos. Se recomienda empezar por la menor dosis disponible del fármaco e ir aumentándola hasta encontrar la dosis eficaz16, siguiendo, en todo caso, las indicaciones específicas para cada tipo de fentanilo transmucoso (oral o intranasal).
Además, tal y como se indica en el documento de consenso sobre el DIO, elaborado por expertos de 4 sociedades científicas (Sociedad Española de Oncología Médica, Sociedad Española de Oncología Radioterápica, Sociedad Española del Dolor y Sociedad Española de Cuidados Paliativos), el fentanilo utilizado para el control del DIO es independiente del opioide utilizado para el dolor basal, pudiéndose realizar todas las combinaciones deseadas entre opioide basal y fentanilo para DIO, siempre y cuando se tomen las medidas de titulación correspondientes para cada uno de ellos16. De esta manera se puede asociar, por ejemplo, FTD o MST Continus® para dolor basal con cualquiera de los fentanilos transmucosos orales e intranasales, sin que exista miedo a la suma de secundarismos si se realiza una adecuada titulación de ambos.
Al igual que el resto de fentanilos transmucosos, las características especiales de la vía intranasal hacen que la dosis inicial no pueda estimarse de una proporción del opioide usado de base, sino que ha de realizarse una titulación en cada paciente, adaptándola a su respuesta al dolor irruptivo.
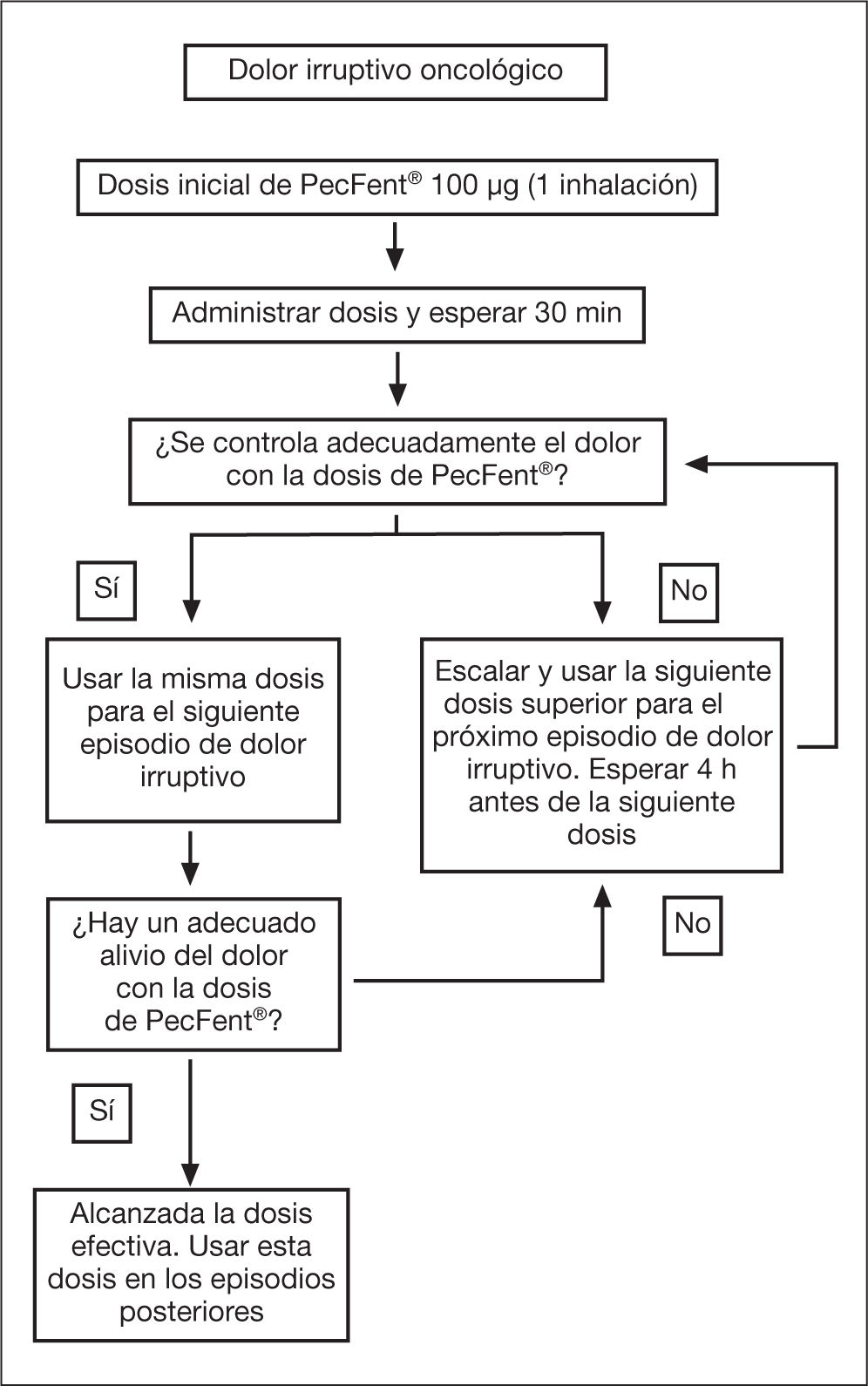
La dosis óptima del fentanilo intranasal con pectina se determina tras un ajuste de dosis progresivo partiendo de 100μg en una fosa nasal. Se debe prescribir inicialmente un frasco de 100μg/pulverización, iniciando la titulación con una única administración. La eficacia se evaluará durante los siguientes 30 min y de ser necesario se aplica una nueva pulverización de 100μg en la otra fosa nasal. De haber sido eficaz, en el siguiente episodio irruptivo se utilizarán 2 dosis de 100μg, una en cada fosa nasal.
Si es insuficiente se prescribirá un frasco de 400μg, iniciando con una dosis de una única inhalación en el siguiente episodio irruptivo, repitiendo el proceso previo. La dosis será efectiva si consigue el control del dolor en 2 episodios irruptivos consecutivos sin efectos secundarios17. No debe administrase más de 4 dosis al día, y se deben espaciar las tomas al menos 4 h. Si persisten los episodios irruptivos en número de 4 o más al cabo de 24 h deberá reajustarse el tratamiento mórfico de base del paciente (fig. 1).
Algunas notas sobre mi práctica clínica en el ajuste de dosis del fentanilo intranasal con pectinaUtilizo la educación sanitaria para ayudar al paciente a encontrar la dosis eficaz con el fentanilo intranasal con pectina. Dicho en otras palabras, que el paciente sepa cómo aumentar de forma autónoma la dosis hasta encontrar la que le sea eficaz, asegurando así la adherencia al tratamiento. No hacer este seguimiento podría conllevar una ausencia de dosis eficaz y pérdida de confianza en el fármaco por parte del paciente18.
El esquema de educación sanitaria que utilizo en mi práctica clínica es el siguiente:
- •
Indico al paciente que empiece por la administración de 100μg en una fosa nasal. Si con los 100μg se encuentra «bien» le digo que continúe con dicha dosis para los siguientes episodios.
- •
Le indico también que si a los 20 min siguiera con «dolor», se administre otros 100μg en la otra fosa nasal. De nuevo, le digo que si con los 200μg se encuentra «bien» continúe con dicha dosis para los siguientes episodios.
- •
La dosis eficaz más frecuente del fentanilo intranasal es la de 100 y 200μg. La mayoría de los pacientes (85%) utiliza una dosis eficaz relativamente baja, 100 y 200μg18. En consecuencia, explicar cómo utilizar los 100 y 200μg suele ser suficiente para el 85% de mis pacientes.
- •
A determinados pacientes les explico cómo, con la presentación de 100μg, aumentar la dosis hasta los 400μg (hasta que vuelven a consulta y pueda prescribir la presentación de 400μg). Para dicha práctica me apoyo en el estudio de Perelman y Knight de 2013, que demostró una exposición similar de fentanilo administrando 4 esprays de la presentación de 100μg o 1 solo espray de la presentación de 400μg19.
El manejo del dolor oncológico severo y del DIO todavía es un reto, ya que están infradiagnosticados e infratratados en muchas ocasiones. Para conseguir un adecuado control de ambos se precisa, además de su correcto conocimiento y completa evaluación, el uso de fármacos eficaces, y se deben considerar como 2 manifestaciones muy diferentes del mismo síntoma. En el manejo del dolor basal, los OAP siguen siendo la principal herramienta, pero en el manejo del DIO es el fentanilo transmucoso, en concreto el fentanilo intranasal con pectina, el que mejor mimetiza la cinética del DIO y, por tanto, obtendrá mayor eficacia. En esta revisión hemos visto cómo las guías actualizadas desmitifican que se tenga que pautar el mismo principio activo para el dolor basal y para el irruptivo, ya que las nuevas formulaciones nos ofrecen mejor eficacia y menos secundarismos.
Para conseguir una adecuada balanza control analgésico/efectos adversos, y con la menor dosis eficaz, es indispensable una correcta titulación del opioide utilizado en el dolor basal y del fentanilo para el DIO.
Una parte del éxito del tratamiento del DIO se basa en la educación sanitaria que se logre transmitir al paciente y su entorno acerca del dolor y su manejo, puesto que mejora el adecuado cumplimiento terapéutico y minimiza o previene los posibles efectos adversos. Es función del especialista destacar la importancia de la administración precoz, de la detección de desencadenantes y de la evaluación dinámica del dolor basal y del DIO, ya que el dolor, en cualquiera de sus facetas, es un síntoma cambiante y evolutivo, y su tratamiento debe ser dinámico.
Conflicto de interesesLa autora declara no tener ningún conflicto de intereses.