El avance en el conocimiento de los mecanismos fisiopatológicos implicados y de la historia natural del cáncer colorrectal ha propiciado la implementación de programas de cribado y vigilancia. Estos programas, dirigidos al diagnóstico precoz de esta neoplasia, incluyen diversos procedimientos, entre los que destacan las pruebas de detección de sangre oculta en heces, las exploraciones endoscópicas o radiológicas y, más recientemente, determinados análisis genéticos.
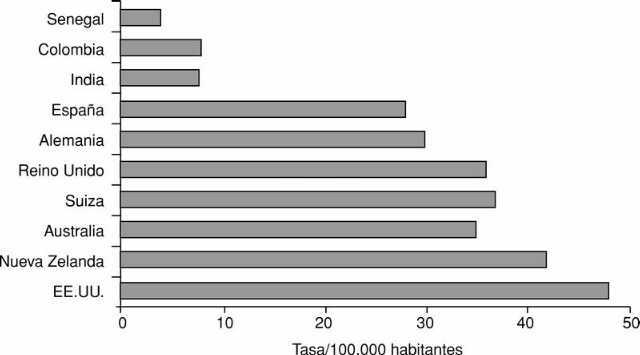
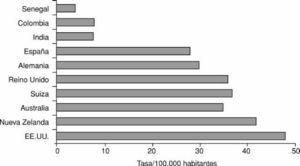
El cáncer colorrectal (CCR) es una de las neoplasias más frecuentes de los países occidentales. En España, su incidencia se sitúa alrededor de los 30 casos por 100.000 habitantes (fig. 1), siendo la segunda neoplasia más frecuente en ambos sexos, después del cáncer de pulmón en varones y del cáncer de mama en mujeres1. Esta elevada incidencia y los resultados aún poco satisfactorios de su tratamiento hacen que el CCR sea la segunda causa más frecuente de muerte por cáncer en nuestro medio1. La mortalidad global asociada a esta neoplasia es del 50-60%, aunque ésta depende de varios factores, entre los que sobresale el estadio evolutivo del tumor. Así, la probabilidad de supervivencia a los 5 años es del 85% en el CCR localizado, del 55% si existe afección adenopática y del 6% en aquellos con metástasis a distancia2.
Fig. 1. Incidencia del cáncer colorrectal en diferentes áreas geográficas.
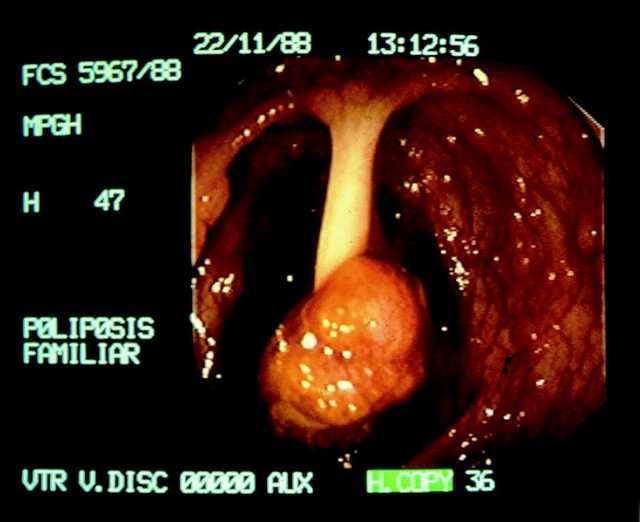
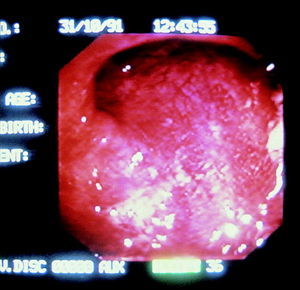
Estudios epidemiológicos y de intervención han caracterizado la historia natural del CCR, estableciéndose que el adenoma o pólipo adenomatoso es una lesión premaligna que precede en la mayoría de los casos a la aparición del cáncer (fig. 2). La extirpación del pólipo adenomatoso, que puede realizarse en más de un 90% de los casos mediante procedimientos no quirúrgicos, reduciría o incluso anularía el riesgo de desarrollar un CCR3. Ello comporta que el CCR sea una de las neoplasias que más podría beneficiarse de la aplicación de programas de prevención.
Fig. 2. Imagen endoscópica de un pólipo pediculado.
En general, se considera que un programa de cribado es adecuado cuando: a) la enfermedad objeto de estudio constituye un problema sanitario grave y frecuente; b) las pruebas empleadas son lo suficientemente precisas para detectar la enfermedad en estadios iniciales, son aceptadas por los pacientes y son factibles en la práctica clínica diaria; c) el tratamiento al que se somete un paciente cuyo diagnóstico se ha realizado en el contexto de un programa de cribado ha demostrado mejorar su pronóstico, y d) existen evidencias de que el beneficio sobrepasa los potenciales daños y costes del programa4. En relación con el CCR, los programas de cribado satisfacen estos criterios. En primer lugar, como ya se ha comentado inicialmente, el CCR es una enfermedad con una elevada prevalencia y mortalidad asociada cuando el diagnóstico se efectúa en estadios avanzados. En segundo lugar, varias exploraciones han demostrado que son capaces de detectar lesiones en fases iniciales de su desarrollo. En tercer lugar, estudios caso-control y de intervención han aportado suficientes evidencias de que la extirpación de pólipos adenomatosos disminuye la incidencia de CCR, y que la detección de tumores en estadios iniciales reduce la mortalidad asociada a esta enfermedad. Finalmente, los beneficios que aportan los programas de cribado son superiores a los riesgos derivados y su relación coste-efectividad es comparable a la de otros programas de cribado de otras enfermedades universalmente aceptados4.
La profilaxis primaria persigue la disminución del riesgo de desarrollar un CCR, y se basa en la adopción de hábitos higiénico-dietéticos aplicables a toda la población, como dietas ricas en folatos y calcio y pobres en carnes rojas, la práctica de ejercicio, el control del peso y el abandono del hábito tabáquico. Por otra parte, la quimioprevención, o utilización de fármacos para prevenir el desarrollo de pólipos adenomatosos y su consiguiente progresión a CCR, está adquiriendo gran relevancia5. En varios estudios clínicos, sulindac, un antiinflamatorio no esteroide, ha demostrado ser capaz de reducir el tamaño y el número de adenomas en pacientes con poliposis colónica familiar. A raíz de estos resultados, actualmente se están llevando a cabo estudios con inhibidores selectivos de la ciclooxigenasa 2 (COX-2) que, a diferencia de los no selectivos como la aspirina y los antiinflamatorios no esteroides, no poseen efectos secundarios en el tracto gastrointestinal y en la función plaquetaria. Esta enzima se halla elevada en un 90% de los CCR esporádicos y en un 40% de los pólipos adenomatosos, siendo su expresión normal en tejido sano. Los mecanismos a través de los cuales la inhibición de la COX-2 disminuye la carcinogénesis colónica no son del todo conocidos, pero podrían implicar un incremento de la apoptosis y la regulación de la angiogénesis. Así, recientemente se ha demostrado un efecto beneficioso de la administración de celecoxib, un inhibidor de la COX-2, con relación al número de pólipos en pacientes con poliposis cólica familiar5.
La prevención secundariacontempla las estrategias de cribado y tiene como objetivo identificar individuos asintomáticos con lesiones precancerosas o en una fase inicial de la progresión tumoral4,6,7. Con el fin de aumentar la rentabilidad de las estrategias de cribado es fundamental la identificación y caracterización de las subpoblaciones con una mayor incidencia de lesiones colónicas mediante historia clínica personal y familiar, así como con diversas técnicas moleculares. Estos grupos de riesgo incluyen familias que cumplen criterios de poliposis colónica familiar, cáncer colorrectal hereditario no poliposis, y pacientes con familiares de primer grado afectados de CCR o adenomas colónicos. Además, las estrategias de cribado también van dirigidas a una población de riesgo medio constituida por aquellos individuos de edad superior a 50 años sin otros factores de riesgo adicionales4,6,7.
Finalmente, la prevención terciariacomprende estrategias de vigilancia dirigidas a monitorizar individuos con enfermedad colorrectal previa, como aquellos con historia personal de adenoma, CCR o enfermedad inflamatoria intestinal4, a fin de detectar precozmente la aparición de nuevas lesiones.
En la presente revisión se describirán, en primer lugar, las características de los diferentes procedimientos empleados en la detección precoz del CCR. Posteriormente, se expondrán las estrategias aceptadas de cribado y vigilancia tanto en la población general como en los diferentes grupos de riesgo.
Procedimientos para la detección precoz del cáncer colorrectal
Examen digital rectal
Es uno de los procedimientos más sencillos, baratos e inocuos, y puede formar parte de la exploración física convencional y rutinaria. Sin embargo, el tacto rectal permite la detección de menos del 10% de las neoplasias colorrectales, es decir, sólo de aquellas situadas a menos de 7-10 cm del margen anal.
Detección de sangre oculta en heces
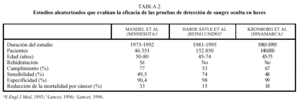
Es una de las pruebas de cribado más utilizadas. El intestino elimina habitualmente 0,6-1,2 ml de sangre al día, lo que supone una concentración de hemoglobina fecal inferior a 2 mg/g de heces. En presencia de una lesión colorrectal las pérdidas suelen aumentar aunque no de manera constante, existiendo importantes variaciones a lo largo del tiempo. Así, en un estudio realizado en pacientes con CCR, la sensibilidad de la prueba oscilaba del 72 al 90% cuando ésta se realizaba durante 3 o 6 días, respectivamente. Por ello, en la actualidad, se recomienda la obtención de dos muestras en 3 días diferentes, lo que supone un total de 6 muestras, y se considera que la prueba es positiva cuando una de ellas lo es8.
Existen diversos métodos para la detección de sangre oculta en heces. De todos ellos, el más común es el el test del guayaco (Hemocult II®). Se trata de una prueba cualitativa basada en la actividad seudoperoxidasa de la hemoglobina. Esta actividad no se halla limitada a la hemoglobina humana, sino que también se encuentra en la fruta fresca, los vegetales y en la carne roja, por lo que su ingesta puede comportar resultados falsos positivos. A su vez, agentes reductores como el ácido ascórbico pueden interferir la oxidación del guayaco, induciendo una reacción falsamente negativa (tabla 1). Por todo ello, se aconseja seguir una dieta evitando estos productos y otras recomendaciones específicas, aunque ello comporta una disminución del grado de cumplimiento estimada en un 45-90%. Por último, a fin de mejorar la sensibilidad del procedimiento se ha aconsejado la rehidratación de la tarjeta. Sin embargo, aunque ello aumenta la sensibilidad de la prueba del 50-70% hasta valores superiores al 90%, comporta una disminución de la especificidad con aumento de los resultados falsos positivos del 1-2% hasta el 6-10%8.
Para mejorar los resultados obtenidos con Hemocult® se han desarrollado otras pruebas de detección. Hemoquant test® es un método cuantitativo que determina la hemoglobina fecal y la fracción de ésta convertida a porfirina por las bacterias intestinales. Se trata de un procedimiento complejo, caro y, aunque inicialmente parecía incrementar la sensibilidad y especificidad de los métodos previos, estudios posteriores no lo han confirmado. Por otra parte, existen pruebas basadas en reacciones inmunológicas que utilizan suero contra la hemoglobina humana (Hemoselect®). Recientemente, se ha comparado la utilidad de tres técnicas de detección de sangre oculta en heces: Hemocult II®, Hemocult II Sensa®, una prueba de guayaco más sensible, y Hemoselect®, así como la combinación de Hemoselect® empleado como método de confirmación de los resultados obtenidos con Hemocult II Sensa®. En este estudio, Hemoselect® y la prueba combinada superaban los resultados obtenidos con Hemocult II® en el cribado del CCR9.
La efectividad de las pruebas de detección de sangre oculta en heces en el cribado del CCR en la población de riesgo medio ha sido evaluada en diversos estudios controlados y aleatorizados. La mayoría de ellos demuestran un incremento de la proporción de tumores diagnosticados en una fase inicial de su desarrollo (estadio A o B de la clasificación de Dukes), así como una reducción de la mortalidad relacionada con esta neoplasia (tabla 2).
Sigmoidoscopia flexible
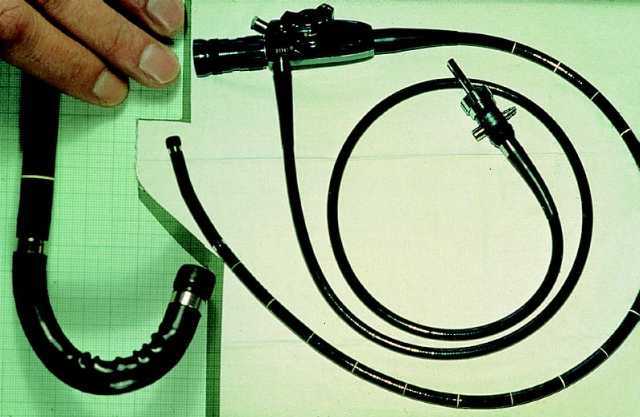
En manos experimentadas, la sigmoidoscopia flexible puede alcanzar el colon descendente, lo que comporta una rentabilidad diagnóstica 2 o 3 veces superior a la de la sigmoidoscopia rígida (fig. 3). Así, diversos estudios establecen que el 60-70% de las lesiones colorrecta-
les pueden detectarse mediante el sigmoidoscopio de 60 cm, mientras que esta cifra se reduce a la mitad cuando se utiliza el endoscopio de 35 cm. Además, el coste de esta exploración es bajo, ya que puede realizarse sin sedación.
Fig. 3. Sigmoidoscopia flexible.
La utilidad de la sigmoidoscopia para la detección precoz del CCR ha sido evaluada únicamente en estudios caso-control o prospectivos no controlados. Uno de los más citados es el Kaiser Multiphasic Evaluation Study, el cual incluye 261 pacientes que fallecieron por CCR y los compara con 868 individuos controles en relación con la práctica de exploraciones sigmoidoscópicas en los 10 años previos10. Los resultados de este estudio demostraron que mientras sólo el 8,8% de los pacien tes afectados de CCR habían sido sometidos a esta ex ploración, este porcentaje alcanzaba el 24,2% en los individuos control. Así, estos autores estimaron que la práctica de una sigmoidoscopia permitía disminuir la mortalidad asociada a CCR en un 30%. Por otra parte, el estudio del Memorial Sloan-Kettering Cancer Center demostró que el 80% de los tumores detectados con este procedimiento se hallaban en estadio A o B de la clasificación de Dukes, y que la probabilidad de supervivencia a los 5 años era del 88%4,6.
Fibrocolonoscopia
La fibrocolonoscopia es la única técnica que permite explorar y biopsiar/resecar las lesiones de todo el colon y recto. Por ello, algunos autores han preconizado la utilización de la fibrocolonoscopia como técnica de cri bado en grupos de riesgo medio y alto, ya que el porcentaje de lesiones situadas en una localización proximal al ángulo esplénico oscila entre el 22 y el 50% del total11. Además, estos estudios sugieren que únicamente se identificarían un 80% de las lesiones colorrectales si la práctica de la colonoscopia se limitara a aquellos casos en los que se detecta un adenoma en el trayecto explorado mediante sigmoidoscopia. Esta aproximación había sido propuesta por algunos grupos, dado que los pacientes con adenomas distales al ángulo esplénico tienen una mayor probabilidad de presentar lesiones proximales.
Otras exploraciones
Enema opaco
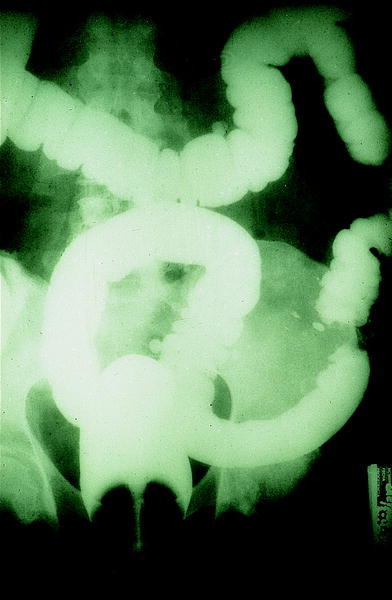
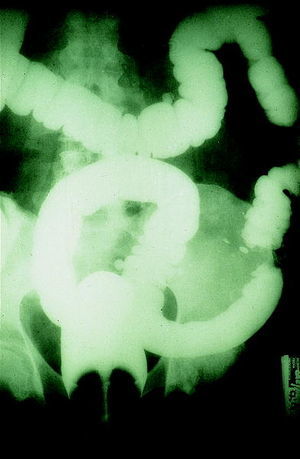
El uso del enema opaco con doble contraste en el cribado del CCR ha disminuido considerablemente en los últimos años en favor de las exploraciones endoscópicas (fig. 4). Ello se debe fundamentalmente a la baja sensibilidad que posee en el diagnóstico de los pólipos
menores de 1 cm, así como a la posibilidad de tomar biopsias y de extraer pólipos que tienen las técnicas endoscópicas13. Sin embargo, cuando se combina con la sigmoidoscopia puede convertirse en una alternativa a la colonoscopia completa en aquellos casos en que esta última no consigue la visualización completa del colon.
Fig. 4. Enema opaco: imagen en «corazón de manzana» en el colon descendente, sugestivo de carcinoma de colon.
La ultrasonografía hidrocolónica
Es una combinación de la ultrasonografía abdominal convencional con la instilación retrógrada de agua; también ha sido evaluada como alternativa a la colonoscopia. A pesar de presentar una elevada sensibilidad en el diagnóstico de lesiones de gran tamaño, la mayoría de estudios demuestran que posee una baja rentabilidad en la detección de pólipos pequeños, por lo que su utilidad en los programas de cribado es cuestionable.
La colonoscopia virtual o colonografía mediante tomografía computarizada
Sus principales ventajas son la inocuidad, la mayor comodidad para el paciente y la ausencia de los «puntos ciegos« detrás de pliegues colónicos. Entre sus inconvenientes destaca la dificultad para detectar lesiones menores de 1 cm y/o sésiles, el tiempo excesivamente largo requerido para interpretar las imágenes y, obviamente, la incapacidad para obtener muestras de tejido14.
Estrategias de cribado del cáncer colorrectal
Población de riesgo medio
Es la constituida por individuos con una edad superior a 50 años que no presentan otros factores de riesgo para el desarrollo de CCR, dado que a partir de esta edad la incidencia de CCR aumenta exponencialmente. Las medidas de cribado recomendadas se basan en la realización de una prueba de detección de sangre oculta en heces con periodicidad anual o bianual, y/o la práctica de una sigmoidoscopia cada 5 años4,7. Ambas estrategias han demostrado una gran efectividad, consiguiendo reducir la mortalidad por CCR. Hasta la actualidad, no se ha demostrado un mayor beneficio al combinar ambas aproximaciones, aunque ello podría solventar las limitaciones que poseen por separado4,7.
En el supuesto de que una de estas técnicas exploratorias fuera positiva, se debería realizar una colonoscopia completa. Esta actitud es cuestionable cuando el pólipo detectado en la sigmoidoscopia es tubular y menor de 0,5 cm.
Individuos con historia familiar de poliposis colónica familiar
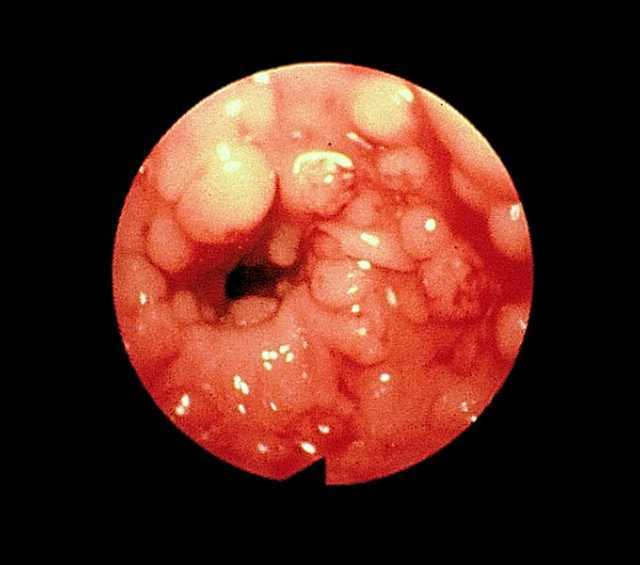
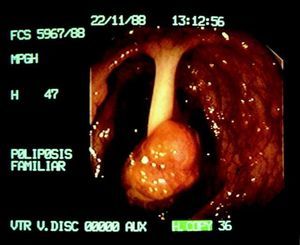
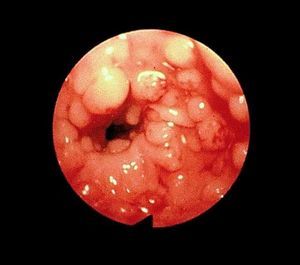
La poliposis colónica familiar (PCF) es una enfermedad hereditaria de transmisión autosómica dominante, con una incidencia de un caso por 10.000 habitantes. Se caracteriza por el desarrollo de un gran número de pólipos adenomatosos, en general más de 100, en el colon y el recto que progresan invariablemente a adenocarcinoma antes de la quinta década de la vida (fig. 5). El gen responsable de la PCF es el APC, localizado en el brazo largo del cromosoma 5. Son variantes de la PCF el síndrome de Turcot (asociación de neoplasias colónicas y tumores de SNC) y el síndrome de Gardner (asociación de adenomas gastrointestinales, osteomas y tumores de tejidos blandos)2.
Fig. 5. Imagen endoscópica de una poliposis colónica
La instauración de programas de cribado en familias afectadas de PCF ha conseguido disminuir la incidencia de CCR y mejorar la expectativa de vida de estos pacientes. Estos programas contemplan la realización de medidas de consejo genético con detección de mutaciones germinales en el gen APC, habitualmente mediante la prueba de la proteína truncada o genotipificación. A los portadores de mutaciones, la realización de una sigmoidoscopia anual será suficiente para determinar si expresan la enfermedad, dado que los pólipos afectan a todo el colon, y en tal caso, es recomendable someterse a una colectomía4,7.
Los pacientes con PCF pueden también presentar diversas manifestaciones extracolónicas: adenomas duodenales y gástricos, tumores desmoides, hipertrofia pigmentaria de la retina, y anomalías óseas y dentales. Alguna de estas lesiones tienen riesgo de malignización, siendo el carcinoma de tracto gastrointestinal alto la neoplasia fatal más frecuente en los pacientes so metidos a colectomía profiláctica, con una latencia de 22 años tras la misma. Por todo ello, es conveniente realizar una endoscopia digestiva alta en todos los individuos afectados de PCF2.
Individuos con historia familiar de cáncer colorrectal hereditario no poliposis
El cáncer colorrectal hereditario no poliposis (CCHNP) o síndrome de Lynch es una enfermedad con herencia autosómica dominante, que representa el 2-5% del total de CCR. Su definición se basa en los criterios de Amsterdam: 3 o más individuos afectados de CCR, uno de ellos familiar de primer grado de los otros dos, afectar a 2 generaciones sucesivas y al menos un caso diagnosticado antes de los 50 años.
El mecanismo implicado en el CCRHNP consiste en la acumulación de errores durante la replicación del ADN como consecuencia de la presencia de mutaciones germinales en los genes responsables de su reparación (hMSH2 y hMLH1, entre otros). Estos errores se acumulan de manera predominante en fragmentos repetitivos de ADN denominados microsatélites. Clínicamente, se caracteriza por el desarrollo precoz de CCR, a menudo antes de los 40 años, afectar al colon proximal, y tener una tendencia a desarrollar tumores sincrónicos y metacrónicos. Algunos de estos pacientes presentan neoplasias en otros órganos, como endometrio, ovario, uréter, pelvis renal, estómago, laringe, intestino delgado o páncreas, lo que constituye el síndrome de Lynch tipo II.
Para ayudar a los pacientes a asumir el riesgo vital de desarrollar CCR y otras neoplasias, y la necesidad de un programa de cribado intensivo, es importante ofrecerles medidas de consejo genético. Al tratarse mayoritariamente de lesiones proximales, la colonoscopia es la técnica de elección. El intervalo entre exploraciones debe ser menor que el propuesto para la población general, ya que la progresión de adenoma a carcinoma parece ser más rápida que en el CCR esporádico. Por ello se recomienda realizar una colonoscopia cada uno o dos años, empezando a los 20-30 años de edad15. La práctica de estudios genéticos para la identificación de portadores de mutaciones génicas podría modificar las estrategias de cribado y hacerlas parecidas a las aplicadas a la PCF.
Familiares de primer grado con historia de cáncer colorrectal o adenoma
Estudios de cohortes y caso-control aportan evidencias de que los individuos con familiares de primer grado afectados de adenoma o CCR tienen un mayor riesgo de desarrollar un CCR, así como de padecerlo a edades más tempranas que los individuos sin historia familiar. Por tanto, la incidencia de CCR a los 40 años en personas con un familiar de primer grado afectado de esta enfermedad es comparable a la de la población general a los 50 años, y en ambos grupos la incidencia aumenta si el CCR se diagnosticó en edades más tempranas de la vida. Ante estas evidencias, se recomiendan las mismas estrategias que a la población general pero iniciándolas a los 40 años, en especial en aquellos individuos con familiares a los que se les diagnosticó un adenoma o CCR antes de los 55-60 años de edad16,17.
Estrategias de vigilancia del cáncer colorrectal
Individuos con antecedente personal de adenoma
En la actualidad, está universalmente aceptado que la mayoría de CCR se originan en un pólipo adenomatoso, por lo que su detección y exéresis es fundamental para reducir la incidencia de esta neoplasia3.
El National Polyp Study, que incluye un total de 2.362 pacientes con adenomas colónicos, ha permitido la obtención de importantes conclusiones. Así, ha sido posible establecer que la presencia de áreas con displasia de alto grado aumenta significativamente con el tamaño del pólipo, la presencia de componente velloso, la multiplicidad de las lesiones y la edad del paciente. Por otro lado, se sabe que los pacientes que han presentado un adenoma colónico tienen una elevada probabilidad de presentar nuevas lesiones a lo largo del seguimiento, siendo el riesgo mayor cuando la lesión inicial es múltiple, mayor de un cm o posee un componente velloso3.
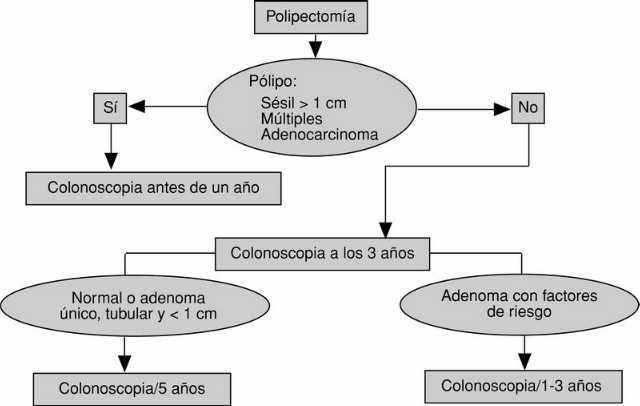
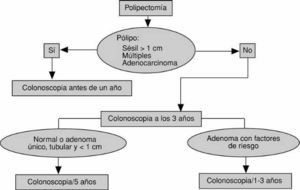
Estudios del mismo grupo cooperativo han permitido definir la estrategia de vigilancia tras la polipectomía endoscópica (fig. 6). Una vez asegurada la extirpación completa del pólipo, hecho especialmente importante en lesiones sésiles de gran tamaño, múltiples o con focos de adenocarcinoma, los pacientes deben ser incluidos en un programa de vigilancia. En este sentido, es aconsejable realizar una nueva colonoscopia completa a los 3 años de la resección del pólipo. Si esta exploración fuera normal o sólo detectara un adenoma tubular único y de pequeño tamaño, el siguiente control podría demorarse hasta los 5 años. En otra situación cualquiera, el intervalo debería ser menor4.
Fig. 6. Estrategia de vigilancia tras la polipectomía endoscópica de adenomas colónicos.
Pacientes con historia personal de cáncer colorrectal
Los pacientes que han presentado un CCR poseen un mayor riesgo de desarrollar una segunda neoplasia en el colon o recto, ya sea un carcinoma o un adenoma sincrónico (el 4 y el 15-30%, respectivamente),o a lo largo del seguimiento (5-10%). Además, un 30-40% de los pacientes con CCR intervenido con pretensión curativa desarrollarán recurrencia de la enfermedad neoplásica, siendo el estadio de la lesión inicial el factor predictivo más determinante. Las recidivas pueden ser locorregionales (30%) o a distancia (80%). Por todo ello, se ha sugerido que estos pacientes podrían beneficiarse de programas de vigilancia dirigidos a detectar precozmente la presencia de recidivas curables y/o lesiones metacrónicas.
Diversos estudios caso-control y de cohortes, así como un reciente metaanálisis, indican que la realización de un programa de vigilancia puede mejorar el pronóstico de estos pacientes18,19, ya que un mayor porcentaje de recurrencias son detectadas en fase asintomática (45%). Además, la tasa de recidivas resecadas con finalidad curativa es superior (20%), al igual que el número de tumores metacrónicos detectados (1,7%). Por último, se ha observado un incremento en la supervivencia de los pacientes incluidos en programas de seguimiento que empleaban la determinación de los valores séricos de CEA.
Las estrategias de vigilancia postoperatoria más comúnmente empleadas contemplan la realización de anamnesis y exploración física, detección de sangre oculta en heces, determinaciones analíticas, pruebas de imagen como la tomografía computarizada, la ultrasonografía abdominal, el enema opaco y la radiografía simple de tórax, y técnicas endoscópicas como la fibrocolonoscopia y la sigmoidoscopia flexible. Dado que la recurrencia de la enfermedad neoplásica puede tener lugar en diversas localizaciones, y que ninguna de estas exploraciones por separado posee la suficiente rentabilidad diagnóstica, los programas de seguimiento post operatorio deberían basarse en la combinación de varias de ellas. Sin embargo, recientemente un estudio prospectivo y aleatorizado ha demostrado que la realización de colonoscopia, tomografía computarizada y radiografía de tórax con periodicidad anual no aumenta la probabilidad de supervivencia de los pacientes con CCR en relación con una vigilancia simple que incluya seguimiento clínico y determinación de los valores séricos de CEA de manera periódica20.
Pacientes con enfermedad inflamatoria intestinal
La probabilidad de desarrollar un CCR a los 35 años del diagnóstico de una enfermedad inflamatoria intestinal de localización colónica es del 30%, estando el riesgo relacionado con la extensión y el tiempo de evolución de la misma (fig. 7). Estos tumores se caracterizan por aparecer a una edad más precoz, tener una mayor tendencia a localizarse en el colon proximal y presentar un patrón plano e infiltrante. En estos pacientes existe una importante asociación entre la presencia de áreas de displasia y el desarrollo de CCR. Así, cuando las biopsias obtenidas en el curso de una colonoscopia de vigilancia demuestran focos de displasia grave, un 40-50% de los pacientes presentan simultáneamente un CCR, mientras que si la displasia es leve, la frecuencia es del 3-20%4.
Fig. 7. Imagen endoscópica de una colitis ulcerosa.
En la actualidad, se recomienda efectuar una colonoscopia anual en las pancolitis de más de 8-10 años de evolución y en los casos con afección izquierda con una evolución superior a los 15 años. La finalidad del programa de vigilancia es el cribado de displasia grave, situación en la que se deberá indicar una colectomía. Dado que los focos de displasia pueden asentar en mucosa de aspecto normal, es necesario obtener biopsias de manera sistemática cada 10-12 cm4.